糖尿病大鼠肾组织中PTEN/AKT/mTOR通路对自噬的调控作用*
2016-12-26吴德佩张莹莹曾令萍石明隽王圆圆
吴德佩, 肖 瑛, 张莹莹, 曾令萍, 石明隽, 王圆圆, 郭 兵
(贵州医科大学病理生理学教研室, 贵州 贵阳 550025)
糖尿病大鼠肾组织中PTEN/AKT/mTOR通路对自噬的调控作用*
吴德佩, 肖 瑛△, 张莹莹, 曾令萍, 石明隽, 王圆圆, 郭 兵
(贵州医科大学病理生理学教研室, 贵州 贵阳 550025)
目的: 观察糖尿病大鼠肾组织中PTEN和自噬水平的变化,探讨糖尿病肾病中PTEN/AKT/mTOR通路对自噬的调控机制。方法:将SD大鼠随机分为正常对照组(NC组)和糖尿病组(DM组),每组各8只。用链脲佐菌素复制DM大鼠模型。于成模后10周处死大鼠后测定相应生化指标和肾脏指数,免疫组化观察肾小管上皮细胞PTEN蛋白的表达部位;Western blotting法检测肾组织LC3、PTEN及PTEN/AKT/mTOR通路的变化;real-time PCR检测肾组织PTEN的mRNA表达水平。结果:DM组的血糖、24 h尿蛋白量和肾脏指数均显著高于NC组(P<0.05)。与NC组相比,DM组大鼠肾组织的LC3I和LC3II水平明显降低(P<0.05)。PTEN主要分布于肾小管上皮细胞中,DM组PTEN蛋白的表达水平明显低于NC组(P<0.05)。DM大鼠肾组织中,PTEN/AKT/mTOR通路的活性增高。结论:糖尿病大鼠肾脏组织中细胞自噬水平下降,而参与自噬调控的PTEN/AKT/mTOR通路活性升高,提示其自噬水平的变化可能受到PTEN/AKT/mTOR通路的调节。
自噬; 糖尿病肾病; PTEN/AKT/mTOR信号通路
糖尿病肾病(diabetic nephrapathy,DN)是糖尿病(diabetes mellitus,DM)严重的并发症,也是导致终末期肾衰竭的常见原因[1],其发病机制目前尚不清楚。自噬是细胞的自我吞噬过程,即细胞利用溶酶体降解自身受损的细胞器和生物大分子物质,它可参与细胞的分化和发育,是一种高度保守的维持自身稳态的重要调节机制[2-3]。DN发生时肾组织中存在蛋白质损伤,而自噬途径是细胞内损伤蛋白质清除的主要途径之一。已有文献报道,DN发生时自噬水平明显降低[4]。第10号染色体上缺失的磷酸酶和张力蛋白同源基因(phosphatase and tensin homology deleted on chromosome ten,PTEN)编码具有脂质磷酸酶活性和蛋白磷酸酶活性的双重磷酸酶,它可以负性调控磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/AKT通路。本课题组前期研究结果显示,在糖尿病大鼠肾脏中PTEN表达明显减少,促进了肾纤维化的发生发展[5-6]。另有文献报道PTEN可以调控自噬的变化水平[7],但在DN中,PTEN的表达与自噬形成关系尚不明确,因此本研究拟采用链脲佐菌素(streptozotocin,STZ)复制Ⅰ型糖尿病大鼠模型,通过多种分子生物学实验方法检测PTEN/AKT/mTOR通路对DM大鼠肾脏组织自噬水平的调控,以期为糖尿病肾病的防治提供新的理论与实验依据。
材 料 和 方 法
1 动物
健康清洁级雄性Sprague-Dawley(SD)大鼠,体重(160±20) g,购于北京华阜康生物科技有限公司,许可证号为[SCXK(京)2009-0004]。
2 主要试剂
STZ(购自Sigma);兔抗大鼠PTEN单克隆抗体(Abcam);兔抗大鼠LC3A/B抗体和兔抗大鼠p-mTOR(Ser2448)多克隆抗体(CST);兔抗大鼠mTOR多克隆抗体(Proteintech);兔抗大鼠AKT多克隆抗体和兔抗大鼠p-AKT(Thr308)多克隆抗体(北京博奥森生物技术有限公司);小鼠抗大鼠β-actin单克隆抗体、辣根过氧化物酶标记羊抗鼠IgG和辣根过氧化物酶标记羊抗兔IgG(武汉普美克生物技术有限公司);DAB显色剂和免疫组织化学SP两步法检测试剂(北京中杉金桥生物技术有限公司);聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜和Whatman 3MM滤纸(Millipore);超敏ECL化学发光试剂盒(碧云天生物研究所);柠檬酸、柠檬酸三钠、总RNA提取试剂盒以及PTEN和β-actin引物(上海生工生物技术工程服务有限公司);RevertAidTMFirst Strand cDNA Synthesis Kit(Thermo);2×SuperReal PreMix Plus(天根生化科技有限公司)。
3 主要方法
3.1 动物模型的制备及分组 适应性喂养大鼠1周,造模前称重,禁食6~8 h,采用乙醚麻醉,16只大鼠随机分为正常对照组(normal control,NC组)和DM组,每组8只。DM组大鼠一次性尾静脉注射溶于pH 4.5、0.01 mol/L无菌柠檬酸-柠檬酸钠缓冲液的链脲佐菌素,剂量为55 mg/kg; NC组大鼠予以尾静脉注射等体积STZ溶媒枸橼酸钠缓冲液。注射后72 h,尾静脉采血测空腹血糖,以血糖值大于或等于16.7 mmol/L为造模成功。
3.2 血、尿及肾组织采集 于实验10周处死各组大鼠,处死前1 d用代谢笼收集24 h尿液并记录尿量,收集的尿液取部分离心后,取上清,于-20 ℃保存;处死前禁食6~8 h,麻醉后称重,股动脉取血,分离血清,-20 ℃保存;开腹取双侧肾脏,去掉包膜及周围脂肪组织,称重后一部分用4%中性甲醛固定,其余放于-80 ℃保存。以肾重(mg)与体重(kg)的比值为肾脏指数(kidney index,KI)。
3.3 生化指标检测 用氧化酶法测血糖(blood glucose,BG),双缩脲法测尿总蛋白(urine protein,UP),以24 h尿量与尿蛋白浓度的乘积为24 h尿总蛋白量。
3.4 肾组织形态学观察 用4%中性甲醛固定肾组织,经包埋、固定,然后行石蜡切片,HE染色后光镜下观察肾组织形态学变化。
The sun goes down without twilight, rain or snow will come next.
3.5 免疫组织化学染色 3 μm厚肾组织石蜡切片经微波修复抗原,采用SP法检测PTEN(1∶100)在各组大鼠肾组织中的表达, I 抗4 ℃孵育过夜,同时以PBS作为阴性对照,取出室温10 min,PBS冲洗,II 抗室温孵育40 min,DAB染色,苏木素复染,固定封片,脱水透明,晾干后中性树胶封片,显微镜下观察并摄取图像。
3.6 Western blotting法检测PTEN、AKT、p-AKT(Thr308)、mTOR、p-mTOR(Ser2448)和LC3的蛋白水平 取大鼠肾皮质每 0.2 g用蛋白裂解液(按RIPA∶PMSF=100∶1的比例制备)1 mL,匀浆器研磨成液体,离心取上清测得蛋白含量,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyaerylamide gel electrophoresis,SDS-PAGE)分离,然后以300 mA电转移至PVDF膜上。5% 脱脂奶粉室温封闭1 h,TBST洗膜后分别加 I 抗β-actin(1∶4 000)、PTEN(1∶1 000)、AKT(1∶300)、p-AKT(Thr308)(1∶400)、mTOR(1∶500)、p-mTOR(Ser2448)(1∶600)和LC3(1∶1 000),4 ℃孵育过夜;加II抗室温孵育1 h,TBST洗膜,ECL试剂显影曝光。LC3和PTEN以β-actin蛋白条带作内参照;磷酸化p-AKT(Thr308)和p-mTOR(Ser2448)分别以总AKT及mTOR蛋白条带作内参照,Bio-Rad凝胶成像系统扫描,Image Lab图像分析软件对每个条带灰度进行定量分析。
3.7 Real-time PCR检测PTEN的mRNA表达 TRIzol法提取总RNA;核酸蛋白分析仪测浓度及纯度后,按Thermo逆转录试剂盒说明书操作合成cDNA,通过Bio-Rad CFX96荧光定量PCR分析系统进行检测,以β-actin为内参照,目的基因的相对含量以2-ΔΔCt表示,引物序列和退火温度见表1。
表1 PCR引物序列及扩增条件
Table 1. The sequences and conditions of the primers used in real-time PCR
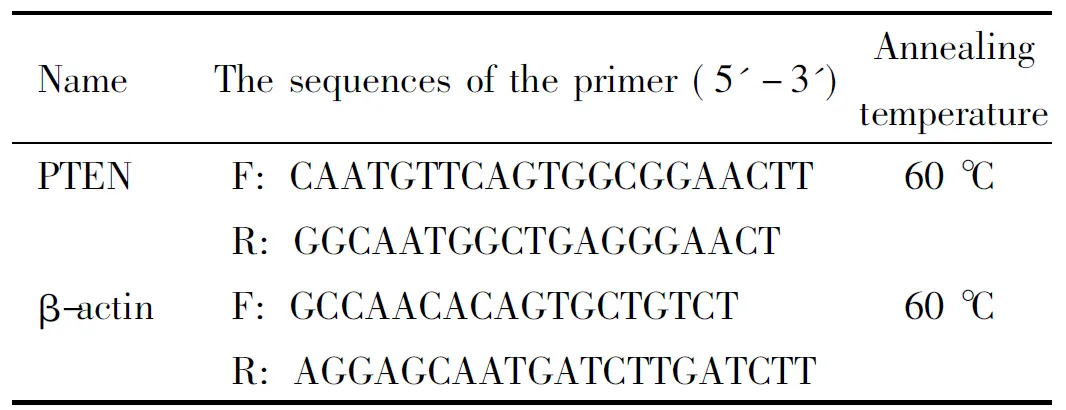
NameThesequencesoftheprimer(5'-3')AnnealingtemperaturePTENF:CAATGTTCAGTGGCG-GAACTT60℃R:GGCAATGGCTGAGG-GAACTβ-actinF:GCCAACACAGTGCTGTCT60℃R:AGGAGCAATGATCTT-GATCTT
F: forward; R: reverse.
4 统计学处理
采用SPSS 21.0软件进行统计学分析,所有实验数据以均数±标准差(mean±SD)表示,两组间比较先进行正态性检验,再采用独立样本t检验,以P<0.05为差异有统计学意义。
结 果
1 两组大鼠的肾脏指数、血糖和尿蛋白的变化
糖尿病组大鼠肾脏指数、血糖及24 h尿蛋白均显著高于正常对照组(P<0.05),结果见表2。
表2 正常组和糖尿病组大鼠血糖、肾脏指数和24 h尿蛋白量的变化
Table 2.The levels of kidney index (KI), blood glucose (BG), 24 h urine protein (24 h UP) in normal control (NC) group and diabetic (DM) group (Mean±SD.n=8)

*P<0.05 vs NC.
2 两组大鼠肾脏组织的病理变化
HE染色可见正常大鼠肾小管结构清晰,肾小管上皮细胞排列整齐,基底膜完整,间质中未见炎细胞浸润。糖尿病组可见部分肾小管上皮细胞空泡变性,部分肾小管管腔扩张,间质有炎细胞浸润,见图1。

Figure 1. The histological changes of the renal tissues in the control and diabetic rats (HE staining, ×200).
图1 正常组和糖尿病组大鼠肾组织的形态学观察
3 糖尿病大鼠肾组织中自噬水平明显下调
与正常对照组相比,糖尿病组LC3I蛋白的表达明显降低(P<0.05);与正常对照组相比,糖尿病组LC3II蛋白的表达也明显降低(P<0.05),见图2。
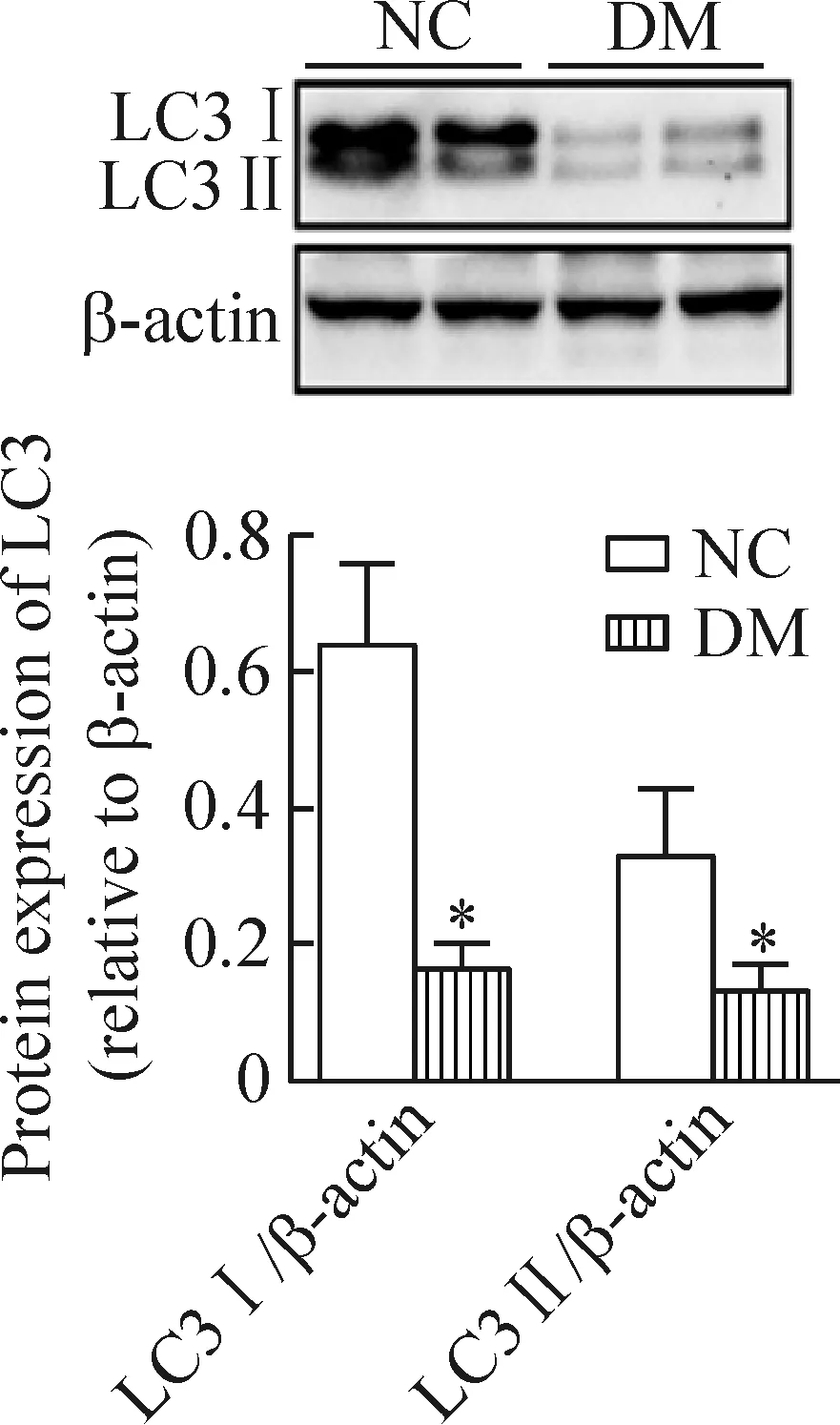
Figure 2. The protein expression of LC3 in the control and diabetic rats. Mean±SD.n=6.*P<0.05vsNC.
图2 LC3在正常组和糖尿病组大鼠肾组织中的表达
4 糖尿病大鼠肾组织中PTEN表达明显下调
免疫组化结果显示正常对照组PTEN蛋白高表达于集合管和肾小管,肾间质及肾血管外膜也有少量表达,但糖尿病组大鼠肾组织PTEN的表达明显减少,见图3;通过Western blotting实验检测发现,糖尿病组大鼠肾皮质中的PTEN蛋白表达明显降低(P<0.05),real-time PCR结果显示糖尿病组大鼠肾皮质PTEN的mRNA水平明显低于正常对照组(P<0.05),见图4。
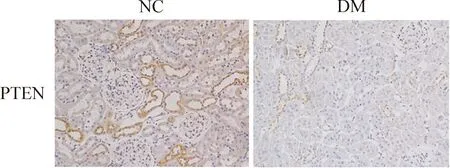
Figure 3. The expression of PTEN in the renal tissues of the control and diabetic rats detected by immunohistochemical staining (×200).
图3 PTEN在正常组和糖尿病组大鼠肾组织中的表达
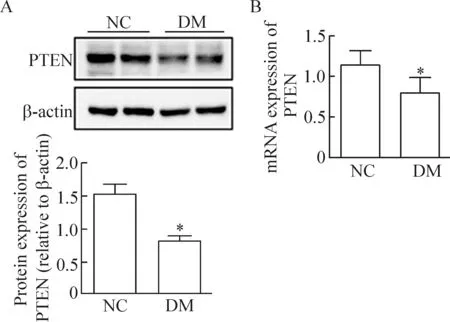
Figure 4.The expression of PTEN at mRNA and protein levels in the renal tissues of control group and diabetic group. A: Western blotting analysis for renal PTEN. The representative images of Western blotting shows 2 samples per group. β-actin was used for normalization to calculate the relative abundance of PTEN in control group and diabetic group. B: the graphical presentations show the relative abundance of PTEN mRNA in control group and diabetic group after normalization with β-actin. Mean±SD.n=6.*P<0.05vsNC.
图4 PTEN的蛋白和mRNA在正常组和糖尿病组大鼠肾组织中的表达
5 糖尿病大鼠肾组织中PTEN/AKT/mTOR通路相关蛋白水平的变化
与正常对照组相比,糖尿病组AKT蛋白的水平无明显变化,而p-AKT(Thr308)蛋白明显增多(P<0.01);与正常对照组相比,糖尿病组的mTOR蛋白水平无显著变化,而p-mTOR的蛋白水平显著增高(P<0.01),见图5。
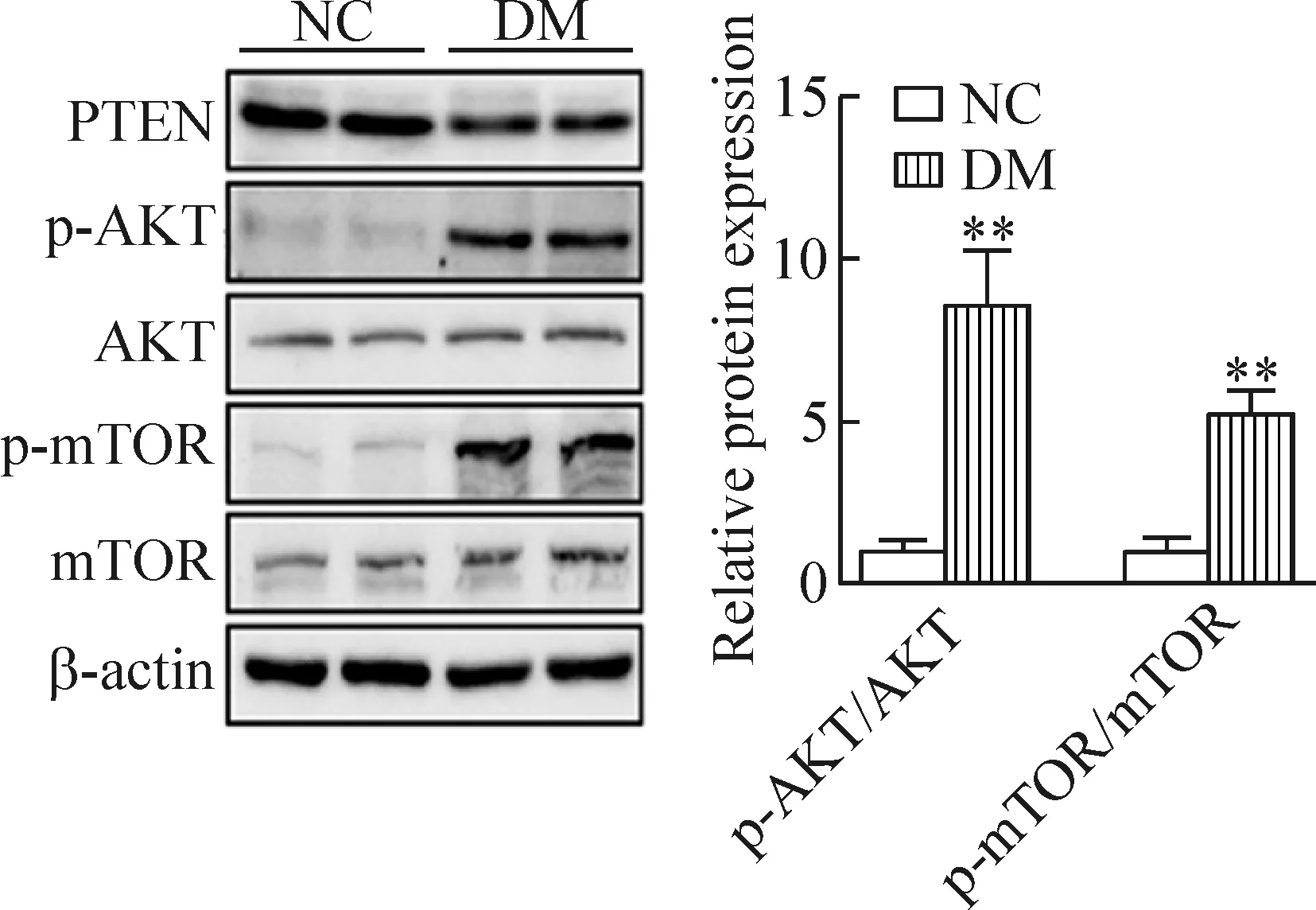
Figure 5. The protein levels of p-AKT, AKT, p-mTOR, mTOR in the renal tissues of control group and diabetic group. Mean±SD.n=6.**P<0.01vsNC.
图5 正常组和糖尿病组大鼠肾组织中p-AKT、AKT、p-mTOR和mTOR的蛋白水平
讨 论
自噬是一种溶酶体参与的、降解细胞内老化及受损的细胞器和蛋白质的细胞代谢过程,是应激状态下细胞自我保护的适应性表现。自噬具有一定的细胞保护作用,在糖尿病肾病中,肾小管受损加重,会引起慢性肾功能衰竭的形成,而且自噬水平减弱;另有研究表明,高糖可诱导足细胞自噬的增强[8],因此不同类型的自噬对细胞有着不同的病理生理意义。
mTOR信号通路是参与自噬的主要信号通路之一。近年研究发现,在结直肠癌中,自噬标志蛋白LC3的表达与mTOR的表达呈负相关,mTOR的失活诱导了自噬的激活[9]。目前在DN中,关于mTOR通路的研究甚少,且DN中自噬水平的高低与PTEN/AKT/mTOR通路之间的关系尚不明确。因此,本研究旨在观察糖尿病大鼠肾脏组织中自噬相关蛋白LC3及PTEN/AKT/mTOR通路的变化,探讨DN中自噬水平降低的可能机制。本课题组的前期研究发现,PTEN在糖尿病大鼠肾脏组织中表达下调[10],在高糖培养的肾小管上皮细胞中,PTEN表达减少,而p-Akt蛋白水平上调[11]。但在DN中AKT与mTOR通路的关系尚不清楚。已有研究表明,抑癌基因PTEN可以负性调控PI3K/AKT通路,在此通路中,PI3K激活后使质膜上产生第二信使PIP3,PIP3与细胞内含有PH结构域的信号蛋白AKT和磷酸肌醇依赖性蛋白激酶1(phosphoinositide-dependent kinase 1,PDK1)结合,促使PDK1磷酸化AKT蛋白的Thr308位点导致AKT活化[12]。PTEN是一个PIP3磷酸酶,与PI3K的功能相反,它可以通过去磷酸化使PIP3转变为PIP2,减少AKT的活化,进而阻止由AKT调控的下游信号传导事件的发生。AKT又称蛋白激酶B,是PI3K下游的主要效应物,它通过与下游多条信号通路相互作用进而调控细胞增殖、分化、凋亡、迁移等。mTOR信号通路是与AKT相互作用的信号转导通路之一,活化的mTOR可以调控细胞生长、增殖、分化等过程,起着中心调控点的作用,该通路的失调与多种人类疾病相关,包括癌症、糖尿病与心血管疾病[13-15]。mTORC2可磷酸化激活AKT,活化的AKT又可以激活mTORC1[16],进而抑制自噬的变化水平,但在DN中,AKT与mTOR之间的相互关系还不是很清楚,所以有待深入研究。
本实验采用免疫蛋白印迹检测糖尿病组大鼠肾组织中自噬标志性蛋白LC3的表达明显降低;免疫组织化学显示PTEN主要分布于肾小管上皮细胞中;糖尿病大鼠肾组织中PTEN的蛋白和mRNA的表达水平均显著降低;p-AKT和p-mTOR在糖尿病组大鼠肾组织中的蛋白水平均明显高于正常对照组。因此推测DN中,PTEN/AKT/mTOR通路的过度激活可能介导了自噬的变化水平。但在本实验中未做药物干预研究,所以在后期实验中可以给予药物治疗,检测给予药物干预前后糖尿病大鼠肾脏自噬水平的变化情况,以期为改善糖尿病肾病寻找新的靶点。
[1] Wolf G, Ziyadeh FN. Cellular and molecular mechanisms of proteinuria in diabetic nephropathy[J]. Nephron Phy-siol, 2007, 106(2):p26-p31.
[2] Cui J, Bai XY, Shis S, et al. Age-related changes in the function of autophagy in rat kidneys[J]. Age (Dordr), 2012, 34(2):329-339.
[3] 颜晓勇, 张茂平, 吴蔚桦. LC3在早期糖尿病大鼠肾脏中的表达及意义[J]. 重庆医学, 2012, 41(21):2128-2130.
[4] Wu WH, Zhang MP, Liu F, et al. The role of programmed cell death instreptozotocin-induced early diabetic nephropathy[J]. J Endocrinol Invest, 2011, 34(9):e296-e301.
[5] 李 霜, 王圆圆, 文箐颖, 等. 控制血糖对糖尿病大鼠肾PTEN表达及纤维化病变的影响[J]. 贵阳医学院学报, 2012, 37(1):14-19.
[6] 刘瑞霞, 郭 兵, 肖 瑛, 等. 糖尿病大鼠肾组织Smurf2表达及其与SnoN蛋白降解的关系[J]. 中国病理生理杂志, 2010, 26(9):1743-1748.
[7] Chen KW, Mo JQ, Zhou M, et al. Expression of PTEN and mTOR in saccral chordoma and association with poor prognosis[J]. Med Oncol, 2014, 31(4):886.
[8] 朱吉莉, 马特安, 陈星华, 等. 高糖通过PI3K-AKT-mTOR信号通路增加足细胞自噬[J]. 中华肾脏病杂志, 2013, 29(7): 515-519.
[9] Wu SH, Sun CB, Tian D, et al. Expression and clinical significance of beclin 1, LC3 and mTOR in colorectal cancer[J]. Int J Clin Exp Pathol, 2015, 8(4):3882-3891.
[10]王圆圆, 刘瑞霞, 郭 兵, 等. 大鼠肾组织PTEN表达下调在糖尿病肾病发展中的作用[J]. 生理学报, 2011, 63(4):325-332.
[11]张昌志,石明隽,李 霜,等. 高糖对肾小管上皮细胞PTEN蛋白表达影响[J]. 中国公共卫生, 2015, 31(5): 609-611.
[12]Lina YX, Linb K, Kanga DZ, et al. Similar PDK1-AKT-mTOR pathway activation in balloon cells and dysplasia with refractory epilepsy[J]. Epilepsy Res, 2015, 112: 137-149.
[13]胡浩然, 宣佳利, 杨解人. 芝麻素改善自发性高血压大鼠肾损伤作用及与PI3K/AKT/mTOR信号通路的关系[J]. 中国病理生理杂志, 2016, 32(4):719-725.
[14]Ali G, Boldrini L, Capodanno A, et al. Expression of p-AKT and p-mTOR in a large series of bronchopulmonary neuroendocrine tumors[J]. Exp Ther Med, 2011, 2(5):787-792.
[15]Ciureda L, Di Sanza C, Incani UC, et al. The mTOR pathway: a new target in cancer therapy[J]. Curr Cancer Drug Targets, 2010, 10(5): 484-495.
[16]Zeng M, Chen BF, Qing YF, et al. Estrogen receptor β signaling induces autophagy and downregulates Glut9 expression[J]. Nucleasides: Nucleatides Nucleic Acids, 2014, 33(7):455-465.
(责任编辑: 卢 萍, 罗 森)
Effects of PTEN/AKT/mTOR signalling pathway on regulation of autophagy in renal tissues of diabetic rats
WU De-pei, XIAO Ying, ZHANG Ying-ying, ZENG Ling-ping, SHI Ming-jun,WANG Yuan-yuan, GUO Bing
(DepartmentofPathophysiology,GuizhouMedicalUniversity,Guiyang550025,China.E-mail:yxhx20060725@126.com)
AIM: To observe the expression change of PTEN and autophagy in the renal tissues of diabetic rats, and to explore the regulatory mechanism of PTEN/AKT/mTOR pathway to autophagy in diabetic nephropathy. METHODS: The Sprague-Dawley rats were randomly divided into normal control group and diabetic group (8 in each group). The diabetic rat model was established by injection of streptozotocin. The biochemical and kidney indexes were measured after the model of diabetic nephropathy was successfully established. The expression location of PTEN in the renal tubular epithelial cells was observed by the method of immunohistochemistry. The protein levels of autophagy-related protein LC3, PTEN and PTEN/AKT/mTOR signalling molecules were determined by Western blotting. The mRNA expression of PTEN was detected by real-time PCR. RESULTS: The blood glucose, 24 h urine protein and kidney index in diabetic group were all obviously higher than those in control group. Compared with control group, the protein levels of LC3I and LC3II in diabetic group were obviously decreased. PTEN was mainly located in the renal tubular epithelial cells. Compared with control group, the protein expression of PTEN was significantly down-regulated in diabetic group. Furthermore, the activity of PTEN/AKT/mTOR pathway increased in diabetic nephropathy rats. CONCLUSION: The level of autophagy in renal tissues of diabetic rats is decreased, whereas the activity of PTEN/AKT/mTOR pathway is increased. The level of autophagy may be mediated by PTEN/AKT/mTOR pathway.
Autophagy; Diabetic nephropathy; PTEN/AKT/mTOR signalling pathway
1000- 4718(2016)11- 2015- 05
2016- 05- 30
2016- 08- 06
国家自然科学基金资助项目(No.81360116);贵州省科技厅基金资助项目(黔科合SY字[2013]3175号);贵阳市科技局攻关项目(No. GY2015-31)
R587.1; R363
A
10.3969/j.issn.1000- 4718.2016.11.016
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0851-8174011; E-mail: yxhx20060725@126.com
