晚期糖基化终末产物通过氧化应激诱导大鼠软骨细胞损伤*
2016-12-26黄文舟王丽丽殷嫦嫦程细高
黄文舟, 王丽丽, 殷嫦嫦, 李 健, 敖 鹏, 程细高△
(1南昌大学第二附属医院骨科,江西 南昌330006; 2九江学院/九江市转化医学重点实验室,江西 九江 332000)
晚期糖基化终末产物通过氧化应激诱导大鼠软骨细胞损伤*
黄文舟1, 王丽丽2, 殷嫦嫦2, 李 健1, 敖 鹏1, 程细高1△
(1南昌大学第二附属医院骨科,江西 南昌330006;2九江学院/九江市转化医学重点实验室,江西 九江 332000)
目的:探讨晚期糖基化终末产物(advanced glycation end products,AGEs)能否通过氧化应激引起大鼠软骨细胞损伤。方法:原代培养SD大鼠软骨细胞,对细胞表型进行鉴定;应用CCK-8法检测软骨细胞生存率;DCFH-DA染色荧光显微镜下检测胞内活性氧簇(reactive oxygen species,ROS)的水平;Hoechst 33342 核染色法及Annexin V-FITC/PI流式细胞法测定软骨细胞的凋亡率;RT-PCR法检测软骨细胞中Bax、Bcl-2、caspase-3、MMP3、MMP13和COL2的mRNA水平;Western blotting法检测软骨细胞中cleaved caspase-3、MMP3、MMP13和COL2的蛋白水平。结果:与对照组相比,AGEs可显著上调胞内ROS水平(P<0.05),但经抗氧化剂N-乙酰半胱氨酸(NAC)抑制后ROS的生成明显减少(P<0.05);另外,NAC可抑制AGEs引起的软骨细胞凋亡相关分子Bax/Bcl-2和caspase-3水平的上调,并减少MMP3和MMP13表达及COL2的丢失(P<0.05)。结论:AGEs可通过氧化应激诱导大鼠软骨细胞损伤。
晚期糖基化终末产物; 骨性关节炎; 氧化应激; 基质金属蛋白酶; 细胞凋亡
骨性关节炎(osteoarthritis,OA)是一种以关节软骨退行性变为主要病理特征的退行性疾病。关节软骨主要由软骨细胞(chondrocyte)和软骨基质(extracellular matrix,ECM)组成,其中软骨细胞对维持细胞外基质的完整性具有重要作用[1]。正常情况下,软骨细胞对细胞外基质的合成和降解一直处于动态平衡。OA中,软骨细胞凋亡是导致OA的直接原因。此外,软骨细胞分泌蛋白水解酶增加,通过对Ⅱ型胶原、蛋白聚糖等细胞外基质的降解作用,打破了这种动态平衡,引起关节软骨完整性的破坏,最终促进骨性关节炎的形成[2]。 OA是一个多因素、多环节共同作用的结果,其主要与衰老、肥胖程度、机械因素及基因表达遗传因素等有关,其中衰老是导致OA的主要原因[3]。 氧化应激与衰老所致的骨性关节炎密切相关[4]。然而,衰老引起氧化应激所导致OA发病的原因尚不明确。近来,晚期糖基化终末产物(advanced glycation end products,AGEs)被认为是衰老致OA患病的分子学基础[5]。AGEs主要通过引起软骨基质降解与软骨细胞凋亡[6-7]、促进软骨组织的炎症反应等[8]方式在OA发病中发挥重要作用。本研究通过研究AGEs 促进氧化应激对大鼠关节软骨细胞损伤的作用,探讨AGEs在骨性关节炎发病过程中的作用,对早期预防及治疗OA提供实验依据。
材 料 和 方 法
1 动物及材料
SPF级雄性SD大鼠,4周龄,体重约40 g,购自湖南斯莱克景达实验动物有限公司,许可证号为SCXK(湘)2014-0004。AGE-BSA(Calbiochem);胰蛋白酶、胎牛血清及DMEM/F12培养基(Gibco);Ⅱ型胶原酶、苏木素染液、甲苯胺蓝染液和Alcian Blue 8GX(Solarbio);Hoechst 33342染色液、活性氧检测试剂盒和N-乙酰半胱氨酸(N-acetyl-L-cysteine,NAC)购自Beyotime;小鼠IgG免疫组化试剂盒和DAB显色液(Boster);Annexin V-FITC/PI凋亡检测试剂盒(MultiSciences Biotech);蛋白提取试剂盒(Applygen);CCK-8试剂盒和GREENspin细胞RNA 快速提取试剂盒(Zomanbio);HiFiScript 快速去基因组cDNA 第1链合成试剂盒、DNA Ladder2000及高灵敏度化学发光检测试剂盒(Cwbio);2× Taq Master Mix(Sinobio);抗cleaved caspase-3抗体(CST);抗MMP3和抗MMP13抗体(Novus);抗Ⅱ型胶原和抗GAPDH抗体(Abcam);山羊抗兔IgG和山羊抗小鼠IgG(Proteintech);所用引物由上海生工合成,见表1。
2 方法
2.1 大鼠关节软骨细胞的分离培养及形态学鉴定 取4周龄SPF级大鼠,颈椎脱臼法处死,75%乙醇浸泡30 min,消毒后无菌操作分离股骨颈、股骨踝和胫骨平台,取关节软骨并剪碎收集于离心管中,加入0.25%胰蛋白酶37 ℃水浴消化30 min,离心去除液体,加入0.2% II型胶原酶37 ℃水浴振荡消化3 h,离心收集细胞,含10% 胎牛血清的DMEM培养液吹打重悬混匀后移入25 cm2培养瓶中,置于37 ℃、5% CO2、饱和湿度的培养箱内培养,以后每3~4 d更换培养基,待细胞铺满瓶底80% 以上,使用0.25%胰酶消化细胞,按1∶2培养传代。取第3代细胞接种于24孔板中,待细胞贴壁以后进行Ⅱ型胶原免疫细胞化学染色、甲苯胺蓝染色和阿尔新蓝染色。
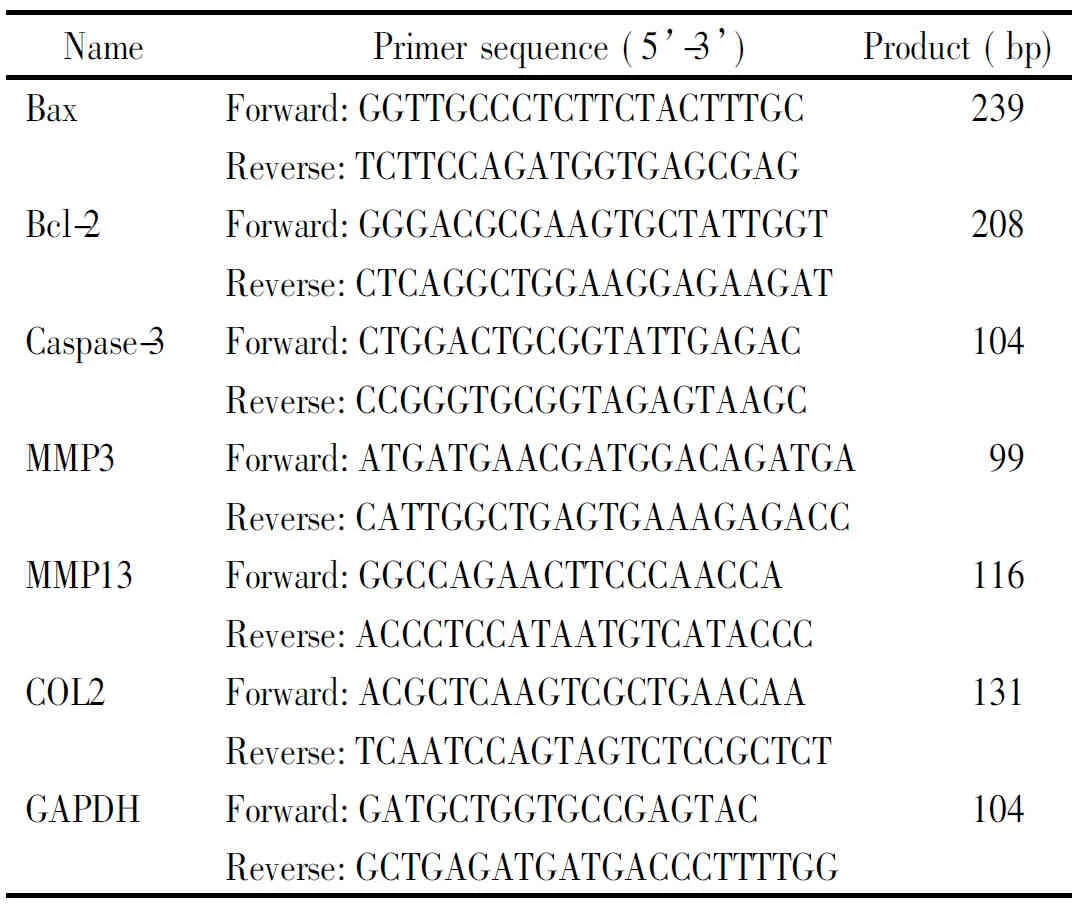
表1 引物序列
2.2 AGEs对大鼠软骨细胞生存率的影响 取第3代软骨细胞,以每孔5×103接种于96孔培养板,将培养板置于培养箱培养24 h;吸除培养基,分别加入含不同浓度AGEs的DMEM培养基(不含胎牛血清)100 μL,药物浓度分别为0、10、25、50、100、200 mg/L。每组设5个复孔,分别培养24 h及48 h后,每孔加入CCK-8溶液10 μL,在细胞培养箱中继续孵育2 h后,用酶标仪测定在450 nm处的吸光度。计算每组药物浓度组吸光值的平均值,分别与空白对照组比较。
2.3 细胞分组及处理 取第3代软骨细胞进行实验,分组如下:空白对照(control)组:只加DMEM培养基培养软骨细胞24 h;AGEs组:含AGEs的DMEM培养基培养细胞24 h;AGEs+NAC组:先用含5 mmol/L NAC的DMEM培养基预处理软骨细胞2 h,再换用含5 mmol/L NAC的AGEs的DMEM培养基培养细胞24 h;NAC组:用含5 mmol/L NAC的DMEM培养基处理软骨细胞24 h。
2.4 DCFH-DA染色测定细胞内活性氧簇(reactive oxygen species,ROS)的水平 将软骨细胞接种于24孔板,按不同浓度(0、25、50、100、200 mg/L)AGEs、AGEs+NAC和NAC分组,去培养基,用PBS冲洗3次,再用10 μmol /L DCFH-DA染液于37 ℃培养箱中避光孵育20 min,然后用PBS冲洗3次。在荧光显微镜下观察,并随机选取5个不重复区摄片。
2.5 Hoechst 33342染色检测细胞凋亡 将软骨细胞接种于24孔板,按上述分组进行处理后,去培养基,用PBS冲洗3次,加入Hoechst 33342试剂,于37 ℃培养箱中避光孵育10 min,后用PBS洗3次,在荧光显微镜下观察细胞,鉴别正常与凋亡的软骨细胞并摄片,随机取不同视野计算细胞凋亡率,重复5次。
2.6 流式细胞术检测软骨细胞凋亡率 将软骨细胞接种于6孔板中,按上述分组进行处理后,常规消化离心收集各组细胞;调整细胞浓度为5×105个细胞,PBS漂洗后将细胞重悬于500 μL 1×binding buffer中; 加入5 μL Annexin V-FITC和10 μL 碘化丙啶(propidium iodide,PI);轻柔混匀后,室温避光孵育5 min;应用BD 流式细胞仪上机检测。
2.7 RT-PCR检测Bax、Bcl-2、caspase-3、基质金属蛋白酶3(matrix metalloproteinase 3, MMP3)、MMP13和COL2的mRNA表达量 将软骨细胞接种于6孔板中,按上述分组进行处理后,使用GREENspin细胞RNA快速提取试剂盒提取细胞总RNA。按照逆转录试剂盒说明将RNA 逆转录成 cDNA。按2×Taq Master Mix说明进行扩增。PCR扩增反应体系为2×Master Mix 12.5 μL,ddH2O 8.5 μL,上游引物1 μL,下游引物 1 μL,模板cDNA 2 μL。PCR反应条件为:94 ℃ 90 s; 94 ℃ 30 s, 60 ℃ 30 s, 72 ℃ 1 min,32个循环; 72 ℃ 5 min。扩增产物在1%琼脂糖凝胶电泳15 min左右,SIM凝胶成像系统拍照并用ImageJ软件分析条带灰度值。以GAPDH作内参照。
2.8 Western blotting法检测cleaved caspase-3、MMP3、MMP13及COL2的蛋白水平 将软骨细胞接种于6孔板中,按上述分组进行处理后,按总蛋白提取试剂盒说明提取细胞蛋白。BCA 法检测蛋白浓度。加入4×蛋白质上样缓冲液95 ℃水浴5 min 变性。每组蛋白上样量为30 μg,在SDS-聚丙烯酰胺凝胶中电泳;然后用湿转法将凝胶中的蛋白转至PVDF 膜上;将PVDF 膜置于含5%脱脂奶粉的TBST 中室温封闭2 h;分别加入GAPDH(1∶5 000)、cleaved caspase-3(1∶1 000)、MMP3(1∶1 000)、MMP13(1∶4 000)和COL2(1∶1 000)的I抗工作液室温孵育2 h,1×TBST漂洗 5 min 3次;用辣根过氧化物酶标记的II 抗(1∶5 000) 室温孵育2 h;漂洗后ECL发光液显色。试剂盒进行曝光、显影。以GAPDH为内参照,用ImageJ软件进行灰度分析。
3 统计学处理
采用SPSS 19.0软件进行实验数据分析,数据均采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用Bonferroni校正t检验,以P<0.05为差异有统计学意义。
结 果
1 软骨细胞的鉴定
分离培养的SD大鼠软骨细胞贴壁生长,外观呈三角形或多角形。甲苯胺蓝染色使正常软骨细胞胞浆呈蓝色,细胞核呈紫蓝色。软骨细胞经阿尔新蓝染色后,可见细胞质染成淡蓝色。Ⅱ型胶原免疫细胞化学染色可见细胞质呈黄色,细胞核周围散在棕黄色的颗粒,见图1。

Figure 1. The morphological presentation of rat chondrocytes (×100). A: under phase-contrast microscope; B: toluidine blue staining; C: Alcian blue staining; D: immunocytochemical staining for type II collagen.
图1 软骨细胞的形态学表现
2 CCK-8法测定软骨细胞的存活率
AGEs(0、10、25 mg/L)处理软骨细胞24 h及48 h后均不影响细胞存活率,但AGEs(50、100、200 mg/L)处理软骨细胞24 h或48 h后均能显著降低软骨细胞存活率(P<0.05)。根据上述结果,后续采用100 mg/L AGEs处理软骨细胞24 h进行研究,见图2。
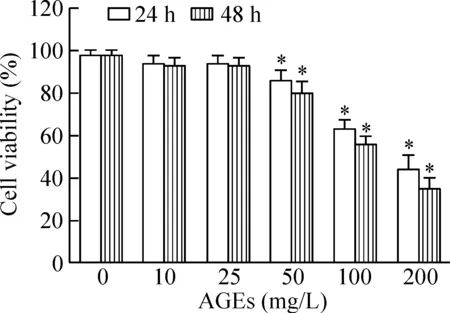
Figure 2. Dose- and time-dependent effects of AGEs on the cell viability of rat chondrocytes detected by CCK-8 assay. Mean±SD.n=5.*P<0.05vs0 mg/L group.
图2 AGEs引起软骨细胞毒性
3 AGEs引起的软骨细胞的氧化应激
不同浓度AGEs处理软骨细胞24 h,可见25、50、100、200 mg/L浓度的AGEs均能使细胞内DCF的平均荧光强度(mean fluorescence intensity,MFI)明显增强,与对照组相比,差异有统计学显著性(P<0.05)。此外,NAC与100 mg/L AGEs 共培养的软骨细胞与100 mg/L AGEs组相比,MFI明显降低(P<0.05),见图3。
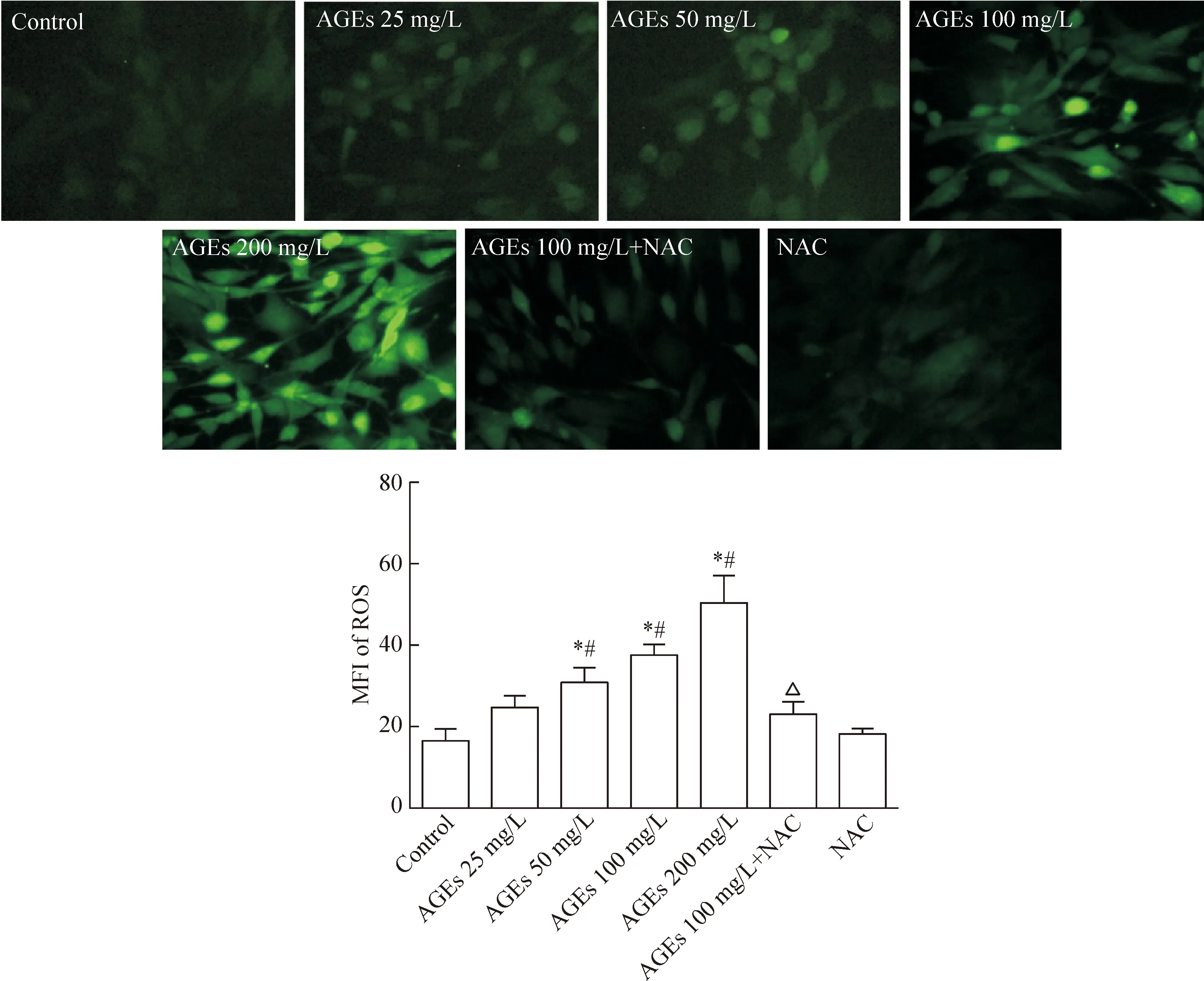
Figure 3. AGEs induced accumulation of intracellular reactive oxygen species (ROS) in the chondrocytes (×200). MFI: mean fluorescence intensity.Mean±SD.n=5.*P<0.05vscontrol group;#P<0.05vsNAC group;△P<0.05vsAGEs 100 mg/L group.
图3 AGEs引起软骨细胞的氧化应激反应
4 AGEs通过氧化应激引起软骨细胞凋亡
荧光显微镜下可见Hoechst染色空白对照组、NAC组中软骨细胞核染色分布均匀,呈弥散均匀的低密度荧光。AGEs组中细胞核呈致密浓染的凋亡特征的软骨细胞数量增多,与control、NAC组比较,差异有统计学显著性(P<0.05)。而AGEs+NAC组中,抗氧化剂NAC与AGEs共培养24 h的软骨细胞凋亡较AGEs组明显减少(P<0.05),见图4A。
此外,通过Annexin V-FITC/PI流式细胞术检测结果显示,AGEs处理软骨细胞24 h后凋亡率增至(18.90±2.82)%,差异有统计学显著性(P<0.01)。而NAC与AGEs共培养软骨细胞24 h时,软骨细胞凋亡率下降至(8.23±1.66)%,与单独AGEs处理软骨细胞组相比,差异有统计学显著性(P<0.05),见图4B。
AGEs处理软骨细胞24 h 可显著增加Bax/Bcl-2 及caspase-3的mRNA表达量(P<0.05),而NAC与AGEs共培养软骨细胞24 h 能抑制AGEs引起的Bax/Bcl-2及caspase-3的mRNA表达量上调(P<0.05),见图4C。
Western blotting实验检测cleaved caspase-3的蛋白表达量, AGEs可促进凋亡相关蛋白cleaved caspase-3的增加(P<0.05),而NAC可抑制AGEs引起的cleaved caspase-3的蛋白水平上调(P<0.05),见图4D。
5 AGEs通过氧化应激对软骨细胞基质金属蛋白酶及Ⅱ型胶原的影响
AGEs作用下,与对照组相比,MMP3及MMP13的mRNA表达显著增加(P<0.05),而COL2的mRNA表达显著下降(P<0.05)。NAC预处理后与AGEs共培养软骨细胞,能显著抑制MMP3和MMP13的mRNA表达量并提高COL2的mRNA表达量(P<0.05),见图5A。Western blotting实验结果可见,AGEs可促进软骨细胞表达MMP3及MMP13,并降低COL2的蛋白水平(P<0.05),而NAC可抑制MMP3、MMP13的蛋白水平并提高COL2的蛋白水平(P<0.05),见图5B。
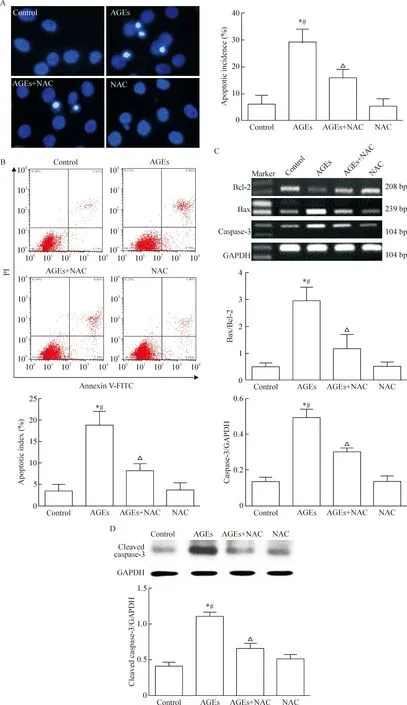
Figure 4.NAC reduced AGEs-induced apoptosis of chondrocytes. A: the changes of apoptotic cells detected by Hoechst 33342 nuclear staining (×400); B: flow cytometry analysis of the apoptosis in chondrocytes; C: the mRNA levels of Bax, Bcl-2 and caspase-3 measured by RT-PCR; D: the protein level of cleaved caspase-3 measured by Western blotting. Mean±SD.n=5.*P<0.05vscontrol group;#P<0.05vsNAC group;△P<0.05vsAGEs group.
图4 AGEs通过氧化应激引起软骨细胞凋亡

Figure 5.The effects of NAC on the expression of MMP3, MMP13 and COL2 in the chondrocytes induced by AGEs. A: the mRNA levels of MMP3, MMP13 and COL2 measured by RT-PCR; B: the protein levels of MMP3, MMP13 and COL2 measured by Western blotting. Mean±SD.n=5.*P<0.05vscontrol group;#P<0.05vsNAC group;△P<0.05vsAGEs group.
图5 AGEs通过氧化应激上调软骨细胞中MMP3和MMP13表达,下调COL-2表达
讨 论
AGEs是还原糖(葡萄糖)与蛋白、脂质经过一系列非酶糖基化反应(即Maillard 反应)形成的不可逆性终末期产物[5],常沉积于关节软骨、皮肤胶原组织及心包液中[9]。正常情况下,体内AGEs的水平维持在一个较为平衡的状态,糖尿病、衰老或饮食摄入高温处理的食物都将引起体内AGEs水平明显升高,后产生一系列病理生理改变。软骨细胞外基质主要由Ⅱ型胶原及蛋白聚糖组成,其生物半衰期较长,更易发生非酶糖基化。AGEs形成使得胶原分子间相互交联增多,导致胶原弹性下降,引起软骨结构及功能的改变[10]。研究表明,关节软骨退变病人的正常软骨中AGEs含量明显升高[11]。动物实验研究同样发现,15个月小鼠膝关节软骨中的AGEs含量明显高于2个月的小鼠[12]。
软骨细胞在维持软骨形态和功能方面发挥重要作用,软骨基质的合成与更新主要依靠软骨细胞[13]。软骨细胞凋亡引起的细胞数量进行性减少,使细胞外基质合成减少、破坏增加是导致OA的重要原因。因此,软骨细胞凋亡数量与OA的程度密切相关。衰老引起的线粒体功能损害导致软骨细胞凋亡在OA发病中起关键作用[14]。 而线粒体功能障碍与氧化应激密切相关。氧化应激可诱导细胞内ROS及活性氮簇(reactive nitrogen species,RNS)大量产生[15]。线粒体功能损害时,线粒体Ca2+内流增加一方面可促进ROS的形成,另一方面可降低线粒体膜电位引起 ATP合成的功能障碍,这样又导致Ca2+内流及ROS的进一步增加。线粒体途径引起的细胞凋亡可引起线粒体膜上多种凋亡相关蛋白因子表达。Bcl-2 是抗细胞凋亡因子,Bax 是促细胞凋亡因子,Bax/Bcl-2这对作用相反的细胞凋亡因子共同激活其下游的一系列凋亡因子,引发细胞凋亡[16]。此外,caspase-3是引起细胞凋亡过程的核心效应器,无活性前体的procaspase-3被激活生成活性片段cleaved caspase-3被看作是细胞发生凋亡的标志之一[17]。在本项研究中,我们发现AGEs可通过氧化应激导致软骨细胞凋亡,这与Yang等[7]研究结果一致。
正常软骨基质合成及降解处于动态平衡,当软骨受损后,基质金属蛋白酶的增多对Ⅱ型胶原、蛋白聚糖等细胞外基质的降解作用,打破了这种平衡,细胞外基质大量降解可引起关节软骨完整性的破坏。研究显示,髋关节退变患者血清MMP3的浓度比正常人升高[18]。此外, MMP13被认为是骨性关节炎发展中最重要的胶原蛋白酶。因为,MMP13对Ⅱ型胶原蛋白的水解能力是其他MMPs的5~10倍,并且在OA发病时,MMP13可表达于更深层的软骨中[19]。研究发现,线粒体功能损害时可通过ROS上调引起MMPs增加[20],尤其可导致软骨细胞MMP3和MMP13的表达上调[21]。 此前,已有学者对AGEs引起软骨细胞MMPs表达上调作出研究发现,AGEs可显著提高软骨细胞中MMP-1、-3、-13的表达量[22]。本次研究通过RT-PCR及Western blotting技术检测发现AGEs可引起MMP3和MMP13表达上调,继而影响Ⅱ型胶原的表达下降。而将抗氧化剂NAC作用于AGEs诱导的软骨细胞时可逆转上述现象,证明AGEs诱导软骨细胞MMP3和MMP13上调与氧化应激有关。
[1] Caramés B, Kiosses WB, Akasaki Y, et al. Glucosamine activates autophagyinvitroandinvivo[J]. Arthritis Rheum, 2013, 65(7):1843-1852.
[2] Billinghurst RC, Dahlberg L, Ionescu M, et al. Enhanced cleavage of type II collagen by collagenases in osteoarthri-tic articular cartilage [J]. J Clin Invest, 1997, 99(7): 1534-1545.
[3] Shane Anderson A, Loeser RF. Why is osteoarthritis an age-related disease? [J]. Best Pract Res Clin Rheumatol, 2010, 24(1):15-26.
[4] Yin W, Park JI, Loeser RF. Oxidative stress inhibits insulin-like growth factor-I induction of chondrocyte proteoglycan synthesis through differential regulation of phosphatidylinositol 3-kinase-Akt and MEK-ERK MAPK signaling pathways [J]. J Biol Chem, 2009, 284(46): 31972-31981.
[5] Prasad C, Imrhan V, Marotta F, et al. Lifestyle and advanced glycation end products (AGEs) burden: its relevance to healthy aging [J]. Aging Dis, 2014, 5(3): 212-217.
[6] Huang CY, Lai KY, Hung LF, et al. Advanced glycation end products cause collagen II reduction by activating Janus kinase/signal transducer and activator of transcription 3 pathway in porcine chondrocytes [J]. Rheumatology (Oxford), 2011, 50(8): 1379-1389.
[7] Yang Q, Guo S, Wang S, et al. Advanced glycation end products-induced chondrocyte apoptosis through mitochondrial dysfunction in cultured rabbit chondrocyte [J]. Fundam Clin Pharmacol, 2015, 29(1): 54-61.
[8] Nah SS, Choi IY, Lee CK, et al. Effects of advanced glycation end products on the expression of COX-2, PGE2 and NO in human osteoarthritic chondrocytes [J]. Rheumatology, 2008, 47(4): 425-431.
[9] Singh VP, Bali A, Singh N, et al. Advanced glycation end products and diabetic complications [J]. Korean J Physiol Pharmacol, 2014, 18(1): 1-14.
[10]Bonet ML, Granados N, Palou A. Molecular players at the intersection of obesity and osteoarthritis [J]. Curr Drug Targets, 2011, 12(14): 2103-2128.
[11]Steenvoorden MM, Huizinga TW, Verzijl N, et al. Activation of receptor for advanced glycation end products in osteoarthritis leads to increased stimulation of chondrocytes and synoviocytes[J]. Arthritis Rheum, 2006, 54(1):253-263.
[12]Kim JH, Lee G, Won Y, et al. Matrix cross-linking-mediated mechanotransduction promotes posttraumatic osteoarthritis [J]. Proc Natl Acad Sci U S A, 2015, 112(30): 9424-9429.
[13]Tian J, Zhang FJ, Lei GH. Role of integrins and their ligands in osteoarthritic cartilage [J]. Rheumatol Int, 2015, 35(5):787-798.
[14]Blanco FJ, Rego I, Ruiz-Romero C. The role of mitochondria in osteoarthritis [J]. Nat Rev Rheumatol, 2011, 7(3): 161-169.
[15]Di Meo S, Reed TT, Venditti P, et al. Role of ROS and RNS sources in physiological and pathological conditions [J]. Oxid Med Cell Longev, 2016, 2016:1245049.
[16]赵泓翔, 郭 可, 崔亚迪, 等. 半枝莲黄酮对复合Aβ25-35引起线粒体膜Bcl-2、Bax、Bcl-xL及Bak异常的干预作用[J]. 中国病理生理杂志, 2014, 30(12): 2262-2266.
[17]刘关羽, 何卫阳, 朱 鑫, 等. 氧化应激诱导自噬对骨髓间充质干细胞增殖与凋亡的影响[J]. 中国病理生理杂志, 2015, 31(12):2176-2182.
[18]Kensaku M, Tsuyoshi N, Katsuyuki Y, et al. Significant increases in serum and plasma concentrations of matrix metalloproteinases 3 and 9 in patients with rapidly destructive osteoarthritis of the hip [J]. Arthritis Rheumatol, 2002, 46(10):2625-2631.
[19]Fernandes JC, Martel-Pelletier J, Lascau-Coman V, et al. Collagenase-1 and collagenase-3 synthesis in normal and early experimental osteoarthritic canine cartilage: an immunohistochemical study [J]. J Rheumatol, 1998, 25(8):1585-1594.
[20]Reed KN, Wilson G, Pearsall A, et al. The role of mitochondrial reactive oxygen species in cartilage matrix destruction [J]. Mol Cell Biochem, 2014, 397(1-2):195-201.
[21]Ye W, Zhong Z, Zhu S, et al. Advanced oxidation protein products induce catabolic effect through oxidant-dependent activation of NF-κB pathway in human chondrocyte [J]. Int Immunopharmacol, 2016, 39: 149-157.
[22]Nah SS, Choi IY, Yoo B, et al. Advanced glycation end products increases matrix metalloproteinase-1, -3, and -13, and TNF-alpha in human osteoarthritic chondrocytes [J]. FEBS Lett, 2007, 581(9):1928-1932.
(责任编辑: 卢 萍, 罗 森)
Advanced glycation end products induce rat chondrocyte injury by modulating oxidative stress
HUANG Wen-zhou1, WANG Li-li2, YIN Chang-chang2, LI Jian1, AO Peng1, CHENG Xi-gao1
(1DepartmentofOrthopedics,TheSecondAffiliatedHospitalofNanchangUniversity,Nanchang330006,China;2JiujiangUniversity,KeyLaboratoryofMedicalTransformationofJiujiang,Jiujiang332000,China.E-mail: 228206846@qq.com)
AIM: To explore the possibility that advanced glycation end products (AGEs) induces rat chondrocyte injury by modulating oxidative stress. METHODS: Primarily cultured rat chondrocytes were identified. The viability of the chondrocytes was measured by CCK-8 assay. The intracellular levels of reactive oxygen species (ROS) were detected by DCFH-DA staining. The number of apoptotic cells was determined by Hoechst 33342 nuclear staining and flow cytometry. RT-PCR was performed to measure the mRNA levels of Bax, Bcl-2, caspase-3, MMP3, MMP13 and COL2 in the chondrocytes. Western blotting was used to evaluate the protein levels of cleaved caspase-3, MMP3, MMP13 and COL2. RESULTS: Compared with control group, the intracellular levels of ROS in the chondrocytes treated with AGEs were significantly increased (P<0.05), and pretreatment withN-acetyl-L-cysteine (NAC) suppressed the formation of ROS (P<0.05). Besides, NAC inhibited AGEs-induced apoptosis of the chondrocytes, as indicated by reduceing the levels of Bax/Bcl-2 and caspase-3, decreased the expression of MMP3 and MMP13, and reduced the loss of COL2. CONCLUSION: AGEs induce chondrocyte injury by activating oxidative stress.
Advanced glycation end products; Osteoarthritis; Oxidative stress; Matrix metalloproteinases; Apoptosis
1000- 4718(2016)11- 2036- 07
2016- 05- 26
2016- 09- 13
国家自然科学基金资助项目(No. 81060147)
R363.2
A
10.3969/j.issn.1000- 4718.2016.11.020
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 13870615428; E-mail: 228206846@qq.com
