氧化苦参碱改善高脂诱导ApoE-/-小鼠的胰岛素抵抗*
2016-12-26张会欣邢邯英
王 超, 张会欣, 邢邯英, 王 杏, 张 哲
(1河北省人民医院老年医学重点实验室,河北 石家庄 050051; 2河北以岭医药研究院药理室, 河北 石家庄 050035)
氧化苦参碱改善高脂诱导ApoE-/-小鼠的胰岛素抵抗*
王 超1, 张会欣2△, 邢邯英1, 王 杏1, 张 哲1
(1河北省人民医院老年医学重点实验室,河北 石家庄 050051;2河北以岭医药研究院药理室, 河北 石家庄 050035)
目的:观察氧化苦参碱对高脂诱导胰岛素抵抗小鼠的作用并初步探讨可能机制。方法:ApoE-/-小鼠高脂喂养16周,分为胰岛素抵抗组以及氧化苦参碱25、50、100 mg/kg组,C57BL/6J小鼠设为对照组,每组10只。灌胃给药8周后,进行小鼠葡萄糖耐量实验;测定血清空腹血糖(FBG)、甘油三酯(TG)、胆固醇(TC)、游离脂肪酸(FFA)和空腹胰岛素(FINS)的含量;实时荧光定量PCR测定肝组织胰岛素受体(INSR)、胰岛素受体底物-2(IRS-2)和葡萄糖转运子2(GLUT2)的mRNA表达;Western blot法测定肝组织GLUT2、INSR、IRS-2、p-INSR、p-IRS-2、磷脂酰肌醇3-激酶(PI3K)、p-PI3K、丝氨酸/苏氨酸蛋白激酶(AKT)和p-AKT的蛋白水平。结果:氧化苦参碱能不同程度降低FBG、TG、TC、FFA和FINS水平,改善胰岛素抵抗;氧化苦参碱组INSR、IRS-2和GLUT2的mRNA表达比胰岛素抵抗组升高(P<0.05),p-INSR/INSR、p-IRS-2/IRS-2、p-PI3K/PI3K、p-AKT/AKT和GLUT2的蛋白水平也升高(P<0.05)。结论:氧化苦参碱能通过PI3K/AKT通路,改善高脂诱导小鼠的胰岛素抵抗。
氧化苦参碱; 高脂饮食; 胰岛素抵抗; 胰岛素; PI3K/AKT信号通路
研究显示,慢性肝病患者中约有50%~80%病人存在糖耐量异常,慢性病毒性肝炎患者继发糖尿病的发生率可达17.5%以上[1]。大量临床研究资料表明病毒性肝炎、肝炎后肝硬化、脂肪肝等肝脏疾病与胰岛素抵抗(insulin resistance,IR)关系密切,胰岛素抵抗可能是肝源性糖尿病发病的重要因素之一[2]。氧化苦参碱(oxymatrine,OXY)是豆科植物苦参的主要生物碱之一,具有抗病原体、抗氧化、调血脂等作用[3-4],临床上用于乙肝、脂肪肝的治疗。任路平等[5]报道了氧化苦参碱能够改善高果糖诱导胰岛素抵抗大鼠,我们采用高脂喂养ApoE-/-小鼠建立胰岛素抵抗模型,观察氧化苦参碱对胰岛素抵抗功能的作用及可能作用机制。
材 料 和 方 法
1 材料和仪器
雄性ApoE-/-小鼠40只,雄性C57BL/6J小鼠10只,体质量18~22 g,均购自北京大学医学部实验动物中心[动物许可证号SCXK(京)2011-0012]。氧化苦参碱购自正大天晴药业股份有限公司;胰岛素放免试剂盒购自上海研晶生物;抗胰岛素受体(insulin receptor,INSR)和p-INSR抗体、胰岛素受体底物-2(insulin receptor substrate-2,IRS-2)和p-IRS-2抗体、葡萄糖转运子2(glucose transporter 2,GLUT2)抗体、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)和p-PI3K抗体、丝氨酸/苏氨酸蛋白激酶(serine/threonine protein kinase,AKT)和p-AKT抗体均购自Abcam;引物均委托上海生工生物公司合成。7080型全自动生化分析仪(HITACHI);DFM-96 型放射免疫γ计数器(合肥众成机电技术公司);7300荧光定量PCR仪(ABI)。
2 方法
2.1 实验分组与给药ApoE-/-小鼠给予高脂饲料(脂肪59.8%)喂养,C57BL/6J小鼠给予普通饲料(脂肪10.3%)喂养,16周后将ApoE-/-小鼠按照随机数字表法分为胰岛素抵抗(insulin resistance,IR)组、氧化苦参碱25、50、100 mg·kg-1·d-1干预组(25 OXY、50 OXY、100 OXY组),每组10只小鼠。氧化苦参碱干预组每天灌胃给予8周的氧化苦参碱,胰岛素抵抗组小鼠给予等体积的纯净水。C57BL/6J小鼠设为正常对照组(normal control, NC)。实验结束后处死小鼠,留取血清和肝脏,-80 ℃保存备用。
2.2 生化指标检测 采用全自动生化分析仪测定小鼠血清空腹血糖(fasting plasma glucose,FBG)、甘油三酯(triglycerides,TG)、总胆固醇(total choleste-rol,TC)和游离脂肪酸(free fatty acid,FFA)的含量。放射免疫法测定空腹血清空腹胰岛素(fasting insulin,FINS)含量,计算胰岛素敏感指数(insulin sensitivity index,ISI)=1/(空腹血糖×胰岛素)和稳态模型评估法计算胰岛素抵抗指数(homeostasis model of assessment for insulin resistance index,HOMA-IR)=空腹血糖×空腹胰岛素/22.5。
2.3 小鼠静脉葡萄糖耐量实验(intravenous glucose tolerance test,IGTT) 给药结束,小鼠禁食不禁水14~16 h,尾部采血,用微量血糖仪测定空腹血糖,记为0 min的血糖值,每只小鼠随后口服30%的葡萄糖溶液,测定30、60、120 min血糖值。
2.4 实时荧光定量PCR(RT-qPCR)检测小鼠肝脏INSR、IRS-2和GLUT2的mRNA表达 小鼠肝脏冰浴中按比例加入TRIzol试剂,匀浆,获得总RNA,紫外吸收法测定RNA纯度和浓度,用RNA试剂盒反应体系将总RNA逆转录成cDNA,按照荧光定量扩增试剂盒反应体系依次加样上机检测,2-ΔΔCt方法进行数据分析,将GAPDH设为内参照,NC组设为1,以目的基因RQ值反映INSR、IRS-2和GLUT2的mRNA表达水平。引物序列见表1。

表1 引物序列
F: forward; R: reverse.
2.5 Western blot法检测小鼠肝脏INSR、p-INSR、IRS-2、p-IRS-2、GLUT2、PI3K、p-PI3K、AKT及p-AKT的蛋白水平 小鼠肝脏,加入组织裂解液,冰浴中匀浆,充分裂解后离心,取上清,提取肝组织总蛋白,BCA方法测定蛋白浓度,变性后转移至PVDF膜,脱脂奶粉封闭,加入合适浓度稀释的 I 抗孵育过夜,加入合适浓度稀释的II抗孵育反应,洗膜后胶片曝光显影。以目的蛋白与内参照积分吸光度(integrated absorbance,IA)比值反映相应的蛋白表达水平。
3 统计学处理
最后,希望大家可以进一步夯实基础、破解难题。当前,西江辖区还存在不少困扰水上安全的难题和瓶颈,与社会的期待有差距,对比陆域的发展有所滞后。我们希望和共建单位一道,正视问题,真抓实干,敢啃硬骨头,发挥新作为,着力在防治船舶污染、处置闲置船舶、“三无船舶”,提升西江航运企业安全管理水平等问题上取得更大的成效
用SPSS 13.0统计软件分析,各组数据以均数±标准差(mean±SD)表示,各组间数据比较用单因素方差分析结合SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 氧化苦参碱对胰岛素抵抗小鼠生化指标的影响
与NC组比较,IR组小鼠的体重、血清FBG、TC、TG和FFA含量均明显升高(P<0.05)。氧化苦参碱干预后,与IR组相比,25 OXY组的TC、TG和FFA含量降低(P<0.05),50 OXY组血清的FBG、TC和TG、FFA含量降低(P<0.05),100 OXY组的体重及血清FBG、TC、TG和FFA水平均降低(P<0.05),见表2。
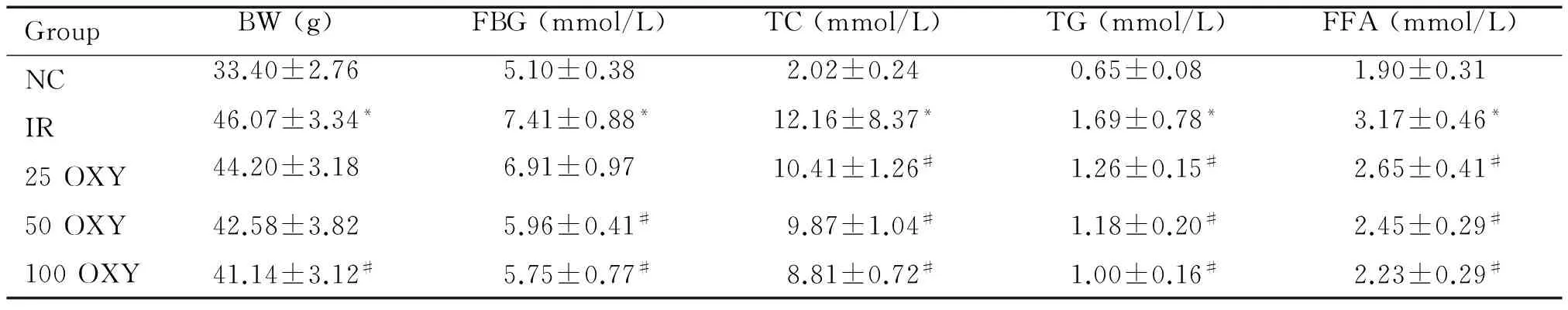
表2 氧化苦参碱对小鼠体重及血清生化指标的影响
2 氧化苦参碱对胰岛素抵抗小鼠胰岛素敏感性的影响
与NC组比较,IR组小鼠的FINS水平和HOMA-IR值升高,ISI值降低(P<0.05)。氧化苦参碱干预后,与IR组相比,25 OXY组和50 OXY组FINS水平和HOMA-IR值降低(P<0.05),100 OXY组的FINS水平和HOMA-IR值降低,ISI值升高(P<0.05),见表3。
表3 氧化苦参碱对胰岛素抵抗小鼠胰岛素敏感性的影响
Table 3.The effect of OXY on insulin sensitivity in IR mice (Mean±SD.n=10)
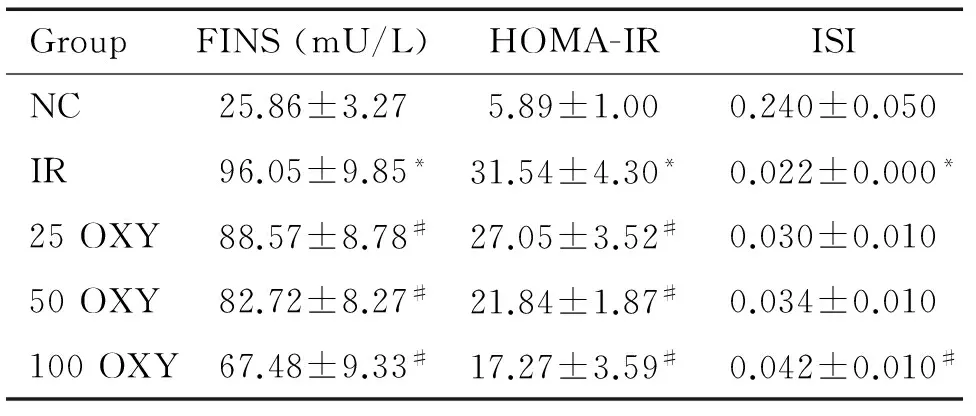
*P<0.05 vs NC group; #P<0.05 vs IR group.
3 氧化苦参碱对胰岛素抵抗小鼠IGTT的影响
4 氧化苦参碱对胰岛素抵抗小鼠肝组织INSR、IRS-2和GLUT2的mRNA和蛋白表达的影响
与NC组比较,IR组小鼠肝脏INSR、IRS-2和GLUT2的mRNA表达降低(P<0.05);与IR组相比,50 OXY组和100 OXY组INSR、IRS-2和GLUT2的mRNA表达均升高(P<0.05),见图2。
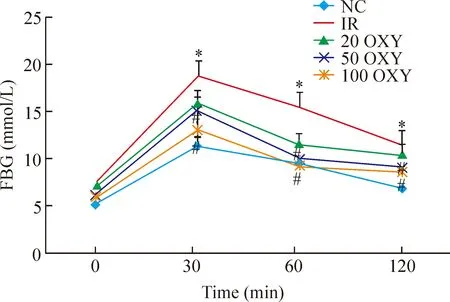
Figure 1.The effect of OXY on IGTT in IR mice. Mean±SD.n=10.*P<0.05vsNC group;#P<0.05vsIR group.
图1 氧化苦参碱对胰岛素抵抗小鼠IGTT的影响
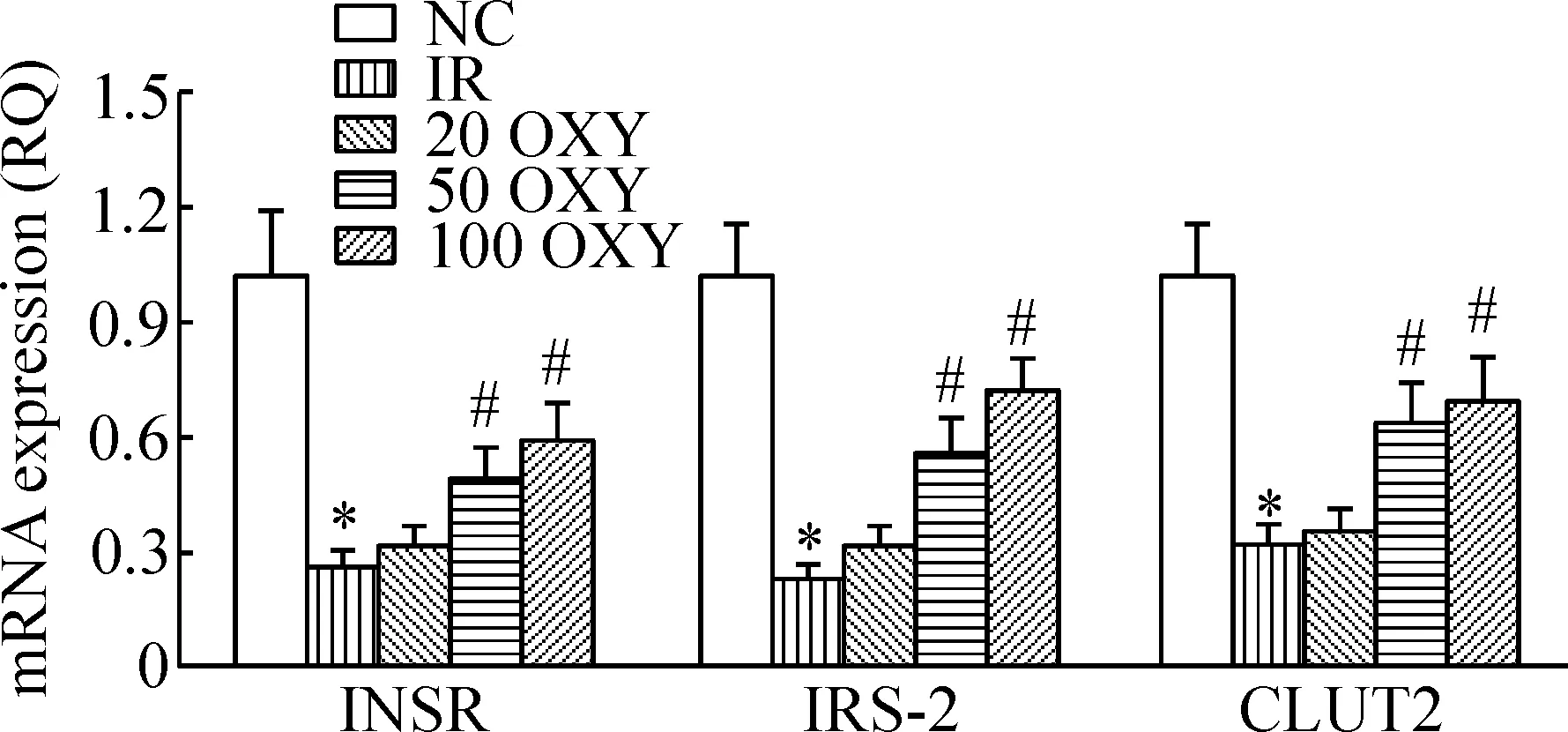
Figure 2.The mRNA expression of INSR, IRS-2 and GLUT2 in the liver tissues. Mean±SD.n=3.*P<0.05vsNC group;#P<0.05vsIR group.
图2 小鼠肝组织INSR、IRS-2和GLUT4的mRNA表达变化
与NC组比较,IR组小鼠肝脏p-INSR、p-IRS-2和GLUT2 的蛋白水平降低(P<0.05);与IR组相比,25 OXY组p-IRS-2的蛋白水平升高(P<0.05),50 OXY组和100 OXY组p-INSR、p-IRS-2和GLUT2的蛋白水平均升高(P<0.05),各组INSR和IRS-2蛋白表达的差异无统计学显著性,见图3。

Figure 3.The protein levels of INSR, IRS-2 and GLUT2 in the liver tissues. Mean±SD.n=3.*P<0.05vsNC group;#P<0.05vsIR group.
图3 小鼠肝组织INSR、IRS-2和GLUT2的蛋白水平的变化
5 氧化苦参碱对胰岛素抵抗小鼠肝组织PI3K/AKT通路的影响
与NC组比较,IR组小鼠肝脏p-PI3K/PI3K和p-AKT/AKT的比值降低(P<0.05);与IR组相比,50 OXY组和100 OXY组p-PI3K/PI3K和p-AKT/AKT的比值均升高(P<0.05),见图4。
讨 论
本研究表明高脂诱导的ApoE-/-小鼠血糖、血脂和胰岛素水平升高,HOMA-IR值降低,ISI值升高,说明高脂诱导ApoE-/-小鼠出现血脂紊乱和胰岛素抵抗。糖耐量实验也证实了高脂诱导ApoE-/-小鼠是理想的胰岛素抵抗动物模型[6-7]。氧化苦参碱能够降低胰岛素抵抗小鼠血糖、血脂、胰岛素及升高胰岛素指数,上调肝组织胰岛素受体及底物表达,提示了氧化苦参碱可通过提高小鼠肝组织胰岛素活性及受体功能,改善ApoE-/-小鼠的胰岛素抵抗。
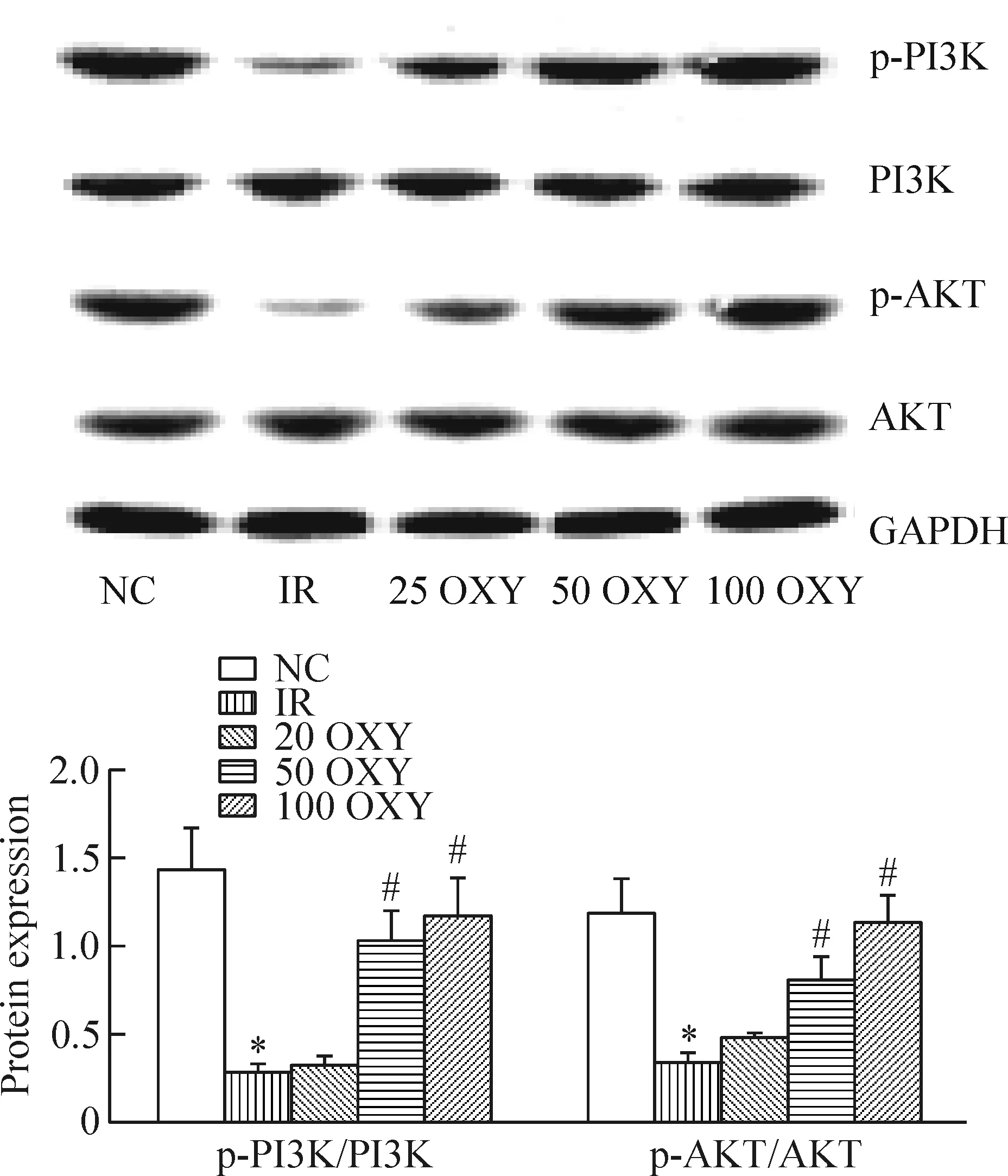
Figure 4.The levels of p-PI3K/PI3K and p-AKT/AKT in the liver tissue. Mean±SD.n=3.*P<0.05vsNC group;#P<0.05vsIR group.
图4 小鼠肝组织PI3K/AKT通路的变化
胰岛素抵抗是机体对胰岛素的反应减退,主要是肝脏、骨骼肌、脂肪的糖代谢缺陷。研究表明,胰岛素抵抗分子水平机制包括受体前缺陷、受体缺陷和受体后缺陷[8]。其中,受体缺陷指的是胰岛素受体数目及亲和力降低;受体后缺陷指胰岛素与受体结合后信号传导到细胞过程受到阻碍,也是多数胰岛素抵抗的分子发生机制。IRS是胰岛素受体底物,主要包括IRS-1和IRS-2,在胰岛素信号转导过程中,IRS-2的作用更为重要[9],因此我们观察了IRS-2在胰岛素抵抗小鼠肝脏的变化。结果表明,胰岛素抵抗小鼠胰岛素受体和其底物及磷酸化水平降低,显示了肝脏胰岛素受体缺陷,胰岛素信号通路转导受阻。氧化苦参碱能同时提高p-INSR/INSR和p-IRS-2/IRS-2比值,使大鼠胰岛素敏感性得以恢复。
肝细胞胰岛素信号传导途径包括PI3K、MAPK等多种途径,PI3K通路是肝脏胰岛素信号传导中的主要通路[10],PI3K与IRS相结合而被激活。我们观察到高脂诱导的ApoE-/-小鼠肝脏p-PI3K的蛋白水平降低,同时位于PI3K下游AKT磷酸化水平也下调,氧化苦参碱干预后,p-PI3K/PI3K和p-AKT/AKT比值上调,提示了氧化苦参碱改善胰岛素抵抗与激活PI3K/AKT磷酸化、提高胰岛素及受体功能、提高肝组织胰岛素敏感性有关。但PI3K是否是唯一途径,是否有其他作用机制尚待进一步研究。
PI3K/AKT磷酸化激活后可引发一系列糖原合成、蛋白合成、葡萄糖转运等生理效应,因此我们进一步观察了GLUT2的表达变化。GLUT2属于葡萄糖转运蛋白家族,在肝细胞中,GLUT2占全部葡萄糖转运的97%以上,胰岛素抵抗发生时,肝脏GLUT2功能受损,葡萄糖转运减少,引起糖代谢紊乱[11]。我们结果显示氧化苦参碱能提高高脂诱导的ApoE-/-小鼠肝脏GLUT2表达,推测氧化苦参碱是通过INSR -IRS2-PI3K-AKT-GLUT2等一系列信号转导过程完成其改善胰岛素抵抗的作用。
我们还观察到氧化苦参碱能够降低胰岛素抵抗小鼠的体重。研究认为肥胖是高血压、糖尿病、动脉粥样硬化等疾病的重要危险因素,是代谢综合征的病理特征之一[12],因此我们推测氧化苦参碱能够通过降低脂肪细胞的分化和增殖、增加脂肪动员,减少脂肪形成等来抑制脂肪沉积和抑制体重增加。但是氧化苦参碱是否通过对脂肪细胞的作用改善胰岛素抵抗及机制尚需进一步研究。
[1] Kuriyama S, Miwa Y, Fukushima H, et al. Prevalence of diabetes and incidence of angiopathy in patients with chronic viral liver disease[J]. J Clin Biochem Nutr, 2007, 40(2):116-122.
[2] Samuel VT, Shulman GI. The pathogenesis of insulin resistance: integrating signaling pathways and substrate flux[J]. J Clin Invest, 2016, 126(1):12-22.
[3] Huang LH, Zhong YM, Xiong XH, et al. The disposition of oxymatrine in the vascularly perfused rat intestine-liver preparation and its metabolism in rat liver microsomes[J]. J Pharm Sci, 2016, 105(2):897-903.
[4] 刘丽荣, 李 霜, 王圆圆, 等. 氧化苦参碱抑制高糖诱导的大鼠肾小管上皮-间充质转化及其机制研究[J]. 中国病理生理杂志, 2013, 29(12): 2152-2159.
[5] 任路平, 胡志娟, 宋光耀, 等. 氧化苦参碱对高果糖饮食诱导大鼠脂肪肝的改善作用及机制研究[J]. 中华内分泌代谢杂志, 2012, 28(11): 935-937.
[6] Yang M, Li S, Liu H, et al. Response to a long-term high-fat diet in the signature of genes involved in lipid metabolism in ApoE-/-mice[J]. Am J Med Sci, 2013, 346(3):211-215.
[7] 金 鑫, 张会欣, 崔雯雯, 等. 津力达对高脂诱导的胰岛素抵抗ApoE-/-小鼠MAPK信号通路的影响[J]. 中国新药杂志, 2015, 24(14):1648-1653.
[8] Morino K, Petersen KF, Shulman GI. Molecular mechanisms of insulin resistance in humans and their potential links with mitochondrial dysfunction[J]. Diabetes, 2006, 55(2):S9-S15.
[9] Hashimoto H. Study on establishment of congenic strains and screening of characteristics in IRS-2 deficient mice to support translational research on type 2 diabetes[J]. Exp Anim, 2011, 60(1):21-32.
[10]Alliouachene S, Bilanges B, Chicanne G, et al. Inactivation of the class II PI3K-C2β potentiates insulin signaling and sensitivity[J]. Cell Rep, 2015, 13(9):1881-1894.
[11]Thorens B. GLUT2, glucose sensing and glucose homeostasis[J]. Diabetologia, 2015, 58(2):221-232.
[12]Kim SH, Plutzky J. Brown fat and browning for the treatment of obesity and related metabolic disorders[J]. Diabetes Metab J, 2016, 40(1):12-21.
(责任编辑: 林白霜, 罗 森)
Oxymatrine ameliorates high fat-induced insulin resistance in ApoE-/-mice
WANG Chao1, ZHANG Hui-xin2, XING Han-ying1, WANG Xing1, ZHANG Zhe1
(1KeyLaboratoryofGeriatricsofHebeiGeneralHospital,Shijiazhuang050051,China;2PharmacologyDepartmentofHebeiYilingMedicineInstitute,Shijiazhuang050035,China.E-mail:hxzhang76@sohu.com)
AIM: To investigate the effect of oxymatrine (OXY) on high fat-induced insulin resistance in mice, and to investigate the mechanism. METHODS:ApoE-/-mice with high-fat diet for 16 weeks were divided into insulin resistance group, and OXY groups at concentrations of 25, 50 and 100 mg/kg. C57BL/6J mice served as normal control group. The mice in OXY groups were gavaged with OXY for 8 weeks. Glucose tolerance test in the mice was performed. Fasting blood glucose (FBG), total cholesterol (TC), triglyceride (TG), fatty acid (FFA) and fasting insulin (FINS) in the plasma were measured. The mRNA expression of insulin receptor (INSR), insulin receptor substrate-2 (IRS-2), glucose transporter 2 (GLUT2) in the liver tissues was examined by RT-qPCR. The protein levels of GLUT2, INSR, IRS-2, p-INSR, p-IRS-2, PI3K, p-PI3K, serine/threonine protein kinase (AKT) and p-AKT were examined by Western blot.RESULTS: OXY reduced the levels of FBG, TC, TG, FFA and FINS, and attenuated insulin resistance. Compared with insulin resistance group, the mRNA expression of INSR, IRS-2 and GLUT2 significantly increased in OXY groups (P<0.05). The protein levels of p-INSR/INSR, p-IRS-2/IRS-2, p-PI3K/PI3K, p-AKT/AKT and GLUT2 also increased in OXY groups (P<0.05). CONCLUSION: OXY ameliorates high fat-induced insulin resistance in mice via PI3K/AKT pathway.
Oxymatrine; High-fat diet; Insulin resistance; Insulin; PI3K/AKT signaling pathway
1000- 4718(2016)11- 2010- 05
2016- 05- 30
2016- 09- 06
国家重点基础研究发展计划(973计划)项目(No. 2012CB518606);河北省重大医学科研项目(No. zd2013002; No. zd2013004)
R587.1; R363
A
10.3969/j.issn.1000- 4718.2016.11.015
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0311-85901715; E-mail: hxzhang76@sohu.com
