HIE大脑中动脉血流动力学变化与血清S100B水平的相关性研究
2016-12-25,,,,
,,, ,
(1.深圳市宝安区松岗人民医院功能科,广东 深圳 518105;2.深圳市龙岗区第二人民医院)
·临床医学·
HIE大脑中动脉血流动力学变化与血清S100B水平的相关性研究
张燕辉1*,黄嘉成1,陈淑媛2,梁燕1,赖梅平1
(1.深圳市宝安区松岗人民医院功能科,广东 深圳 518105;2.深圳市龙岗区第二人民医院)
目的探讨足月新生儿缺氧缺血性脑病(HIE)大脑中动脉变化与血清S100B水平的相关性研究。
方法选取本院85例生后24 h即收入院的足月新生儿HIE患者为研究对象,另选30例正常足月新生儿为对照组。应用SIEMENS ACUSON X300彩色超声多普勒诊断仪及ELISA法测定两组脑血流参数及血清S100B水平。结果对照组新生儿脑实质回声均匀,脑室系统无扩张或狭窄,且随出生时间延长新生儿侧脑室前角面积、收缩期峰值流速(Vs)、舒张末期流速(Vd)不断增大,而HIE患儿侧脑室前角面积、Vs、Vd随着出生时间延长而增加,但增加幅度小于对照组,且病情越重增加幅度越小。HIE血清S100B浓度逐日下降,HIE轻度组于生后第120 h接近对照组水平,HIE中、重度组与对照组仍存在差异(P<0.05)。经Pearson相关分析可知,S100B与Vs、Vd呈负相关(P<0.05),与阻力指数(RI)、搏动指数(PI)呈正相关(P<0.05)。结论外周血S100B蛋白及脑血流动力学紊乱是HIE患儿脑损伤的重要原因,两者相互作用,相互影响。
足月新生儿; 缺氧缺血性脑病; 大脑中动脉; 血流动力学指标; 血清S100B
新生儿缺氧缺血性脑病(hypoxie-ischemic encephalopathy,HIE)是指患儿出生时由于窒息缺氧而导致脑损伤,是引起新生儿残疾及死亡的主要因素之一[1]。尽早诊断、治疗及评估对HIE患儿预后具有重要的意义。既往临床上对HIE患儿常采用肌酸激酶(Creatine Kinase,CK)、肌酸激酶脑型同工酶(creatine kinase isoenzymes,CK-BB)作为患儿早期诊断指标,但CK、CK-BB诊断灵敏性较低[2]。血清S100B蛋白与急性脑损伤有密切的关系,且在早期脑损伤时,大脑普遍存在脑血流指标的变化[3]。本文探讨足月HIE患儿大脑中动脉(Middle cerebral artery,MCA)血流动力学指标与血清S100B水平的变化。
1 资料与方法
1.1临床资料2013年1月~2015年7月选取本院新生儿科收治的85例生后24 h即收入院的足月新生儿缺氧缺血性脑病(HIE)患儿为研究对象,纳入标准:(1)均符合中华医学会儿科分学会对新生儿HIE诊断标准及分度标准;(2)均经彩色超声多普勒诊断仪或CT确诊;(3)患儿家属均签署知情同意书,且通过本院医学伦理委员会批准;(4)入院后均给予积极治疗。同时均有产程缺氧、宫内窘迫或出生时窒息史的患儿。其中男45例,女40例,轻度38例,中度27例,重度20例,出生孕周38~42周,平均40.2±2.2周,出生体重3 246±373 g;另选取30例正常足月新生儿为对照组,均无围产期窒息及心肺疾病史,其中男16例,女14例,出生孕周38~42周,平均41.2±1.8周,出生体重3 420±368 g,两组患儿性别、孕周、出生体重比较差异无统计学意义(P>0.05),具有可比性。
1.2检查方法
1.2.1 颅脑超声检查 采用SIEMENS ACUSON X300彩色超声多普勒诊断仪,该仪器具有CDFI、CDE及PW功能,电子相控阵心脏探头频率为2.5~3.5 MHz,高频线阵探头频率为5.0~7.0 MHz。受检儿取仰卧位在安静状态下进行床边扫查。首先采用心脏探头,经前囟及侧囟作颅脑冠状面、矢状面及横切面扫查,仔细观察脑组织形态结构;然后选用高频线阵探头,经前囟获取侧脑室前角冠状切面,测量双侧侧脑室前角面积;最后采用高频线阵探头经侧囟清晰显示Willis环,先用彩色能量多普勒(color Doppler echocardiography,CDE)显示,观察双侧大脑中动脉分布并测量水平段血流直径(D),再用彩色多普勒血流成像(color Doppler flow imaging,CDFI)显示,引导脉冲多普勒(PW)测量双侧大脑中动脉血流参数,包括收缩期峰值流速(Velocity Peak systolic,Vs)、舒张末期流速(Velocity diastolic,Vd)、阻力指数(Resistance index,RI)及搏动指数(Pulsatility index,PI)。受检儿生后第1、2、3、4、5天连续进行观察测量5次。每次超声检查的仪器设置条件相同,操作者为同一医生,检查时间为20 min左右。各测量指标均取3个心动周期平均值,并以左、右两侧的平均值进行统计分析。
1.2.2 S100 B测定 受检儿于生后24 h及第2、3、4、5天采集空腹静脉血,分离血清,采用罗氏cobas e 601全自动电化学发光检测仪检测S100B,所有操作严格按说明书进行。试剂盒为罗氏原装配套产品。
1.3统计学方法采用SPSS19.0数据包进行分析,组间计量资料采用t检验,进一步两两分析采用LSD-t法,HIE患儿脑血流动力学指标与血清S100B、CK、CK-BB的关系采用Pearson相关分析,P<0.05为差异具有统计学意义。
2 结 果
2.1各组新生儿颅脑二维声像图及侧脑室前角面积的动态变化对照组新生儿脑实质回声均匀,脑室系统无扩张或狭窄;轻度组仅8例出生24 h内见脑实质呈小片状回声增强,至48 h脑实质回声恢复正常;中度组患儿出生24 h内脑实质回声呈散在或广泛增粗增强,侧脑室变窄,至120 h 20例脑实质回声接近正常,7例仍呈散在点片状回声增强;重度组脑实质回声广泛增粗增强,脑结构模糊,侧脑室明显变窄或消失(图1),至120 h仅6例脑实质回声接近正常。中、重度组侧脑室前角面积测得均值与对照组比较差异均有显著性(P<0.05),见表1。
2.2 HIE患儿MCA血流动力学变化患儿出生后24 h内,HIE各组MCA血流直径缩小,以中重度组为著,Vs,Vd均减低,RI及PI均升高,HIE各组与对照组、中重度组与轻度组比较差异均有显著性(P均<0.05)。24 h后脑血流逐渐恢复,轻度组至48 h血流直径及血流参数多恢复正常,与对照组比较差异无显著性(P>0.05)。中、重度组至72 h,血流直径仍小于对照组(P<0.05),至96 h,与对照组无差异。中度组Vs,Vd至96 h多接近正常,重度组Vs,Vd至120 h尚有6例未恢复正常水平,与对照组、轻度组比较差异有显著性( 均P<0.05)。而中度组、重度组RI、PI至120 h测得均值间与对照组比较差异无统计学意义(P>0.05),见表2,表3。
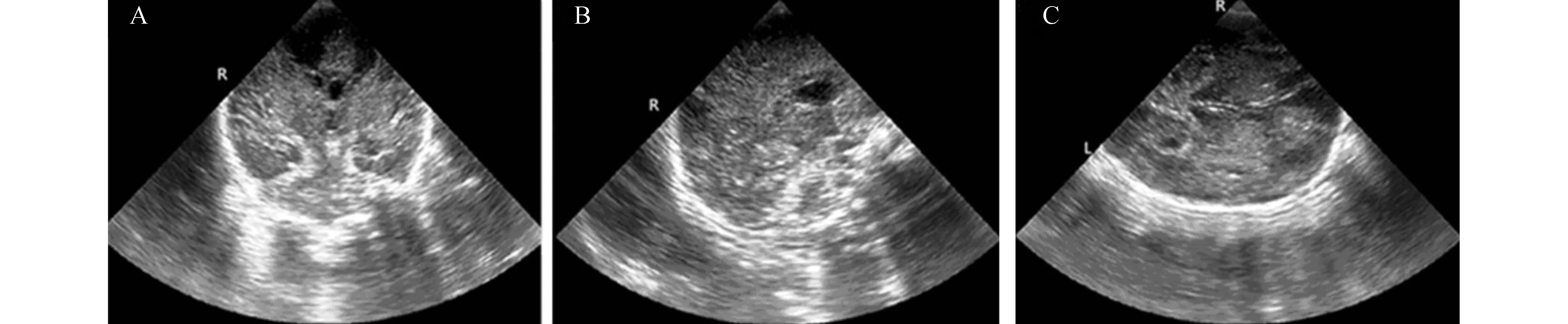
图1 重度缺氧缺血性脑病 A.冠状面;B.矢状面;C.横切面:示缺氧后脑水肿,双侧脑半球弥漫性回声增强,侧脑室变窄,边界模糊
表1HIE轻、中、重度组与对照组侧脑室前角面积的动态变化(mm2)
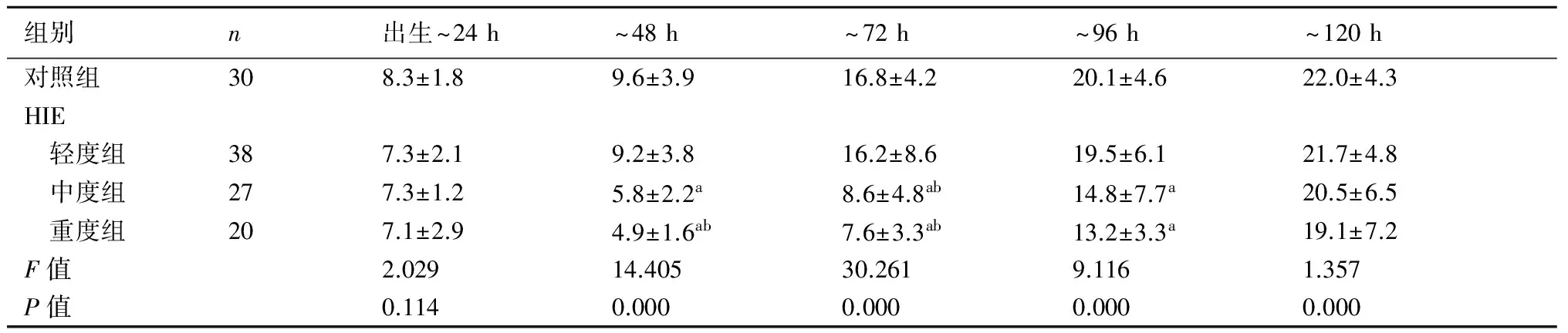
组别n出生~24h~48h~72h~96h~120h对照组308.3±1.89.6±3.916.8±4.220.1±4.622.0±4.3HIE 轻度组387.3±2.19.2±3.816.2±8.619.5±6.121.7±4.8 中度组277.3±1.25.8±2.2a8.6±4.8ab14.8±7.7a20.5±6.5 重度组207.1±2.94.9±1.6ab7.6±3.3ab13.2±3.3a19.1±7.2F值2.02914.40530.2619.1161.357P值0.1140.0000.0000.0000.000
与对照组比较,a:P<0.05,b:P<0.01
表2HIE各组与对照组Vs、Vd的动态变化
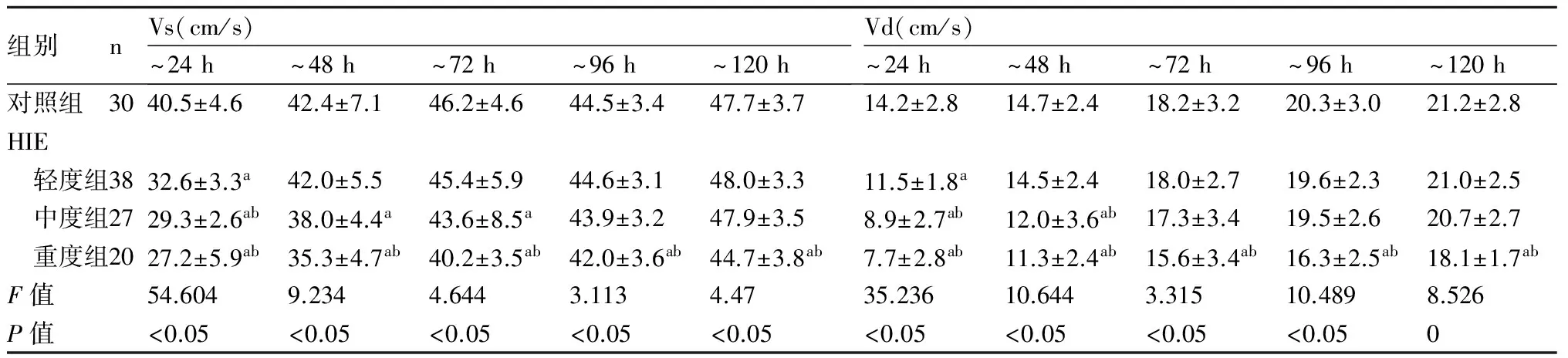
组别nVs(cm/s)~24h~48h~72h~96h~120hVd(cm/s)~24h~48h~72h~96h~120h对照组3040.5±4.642.4±7.146.2±4.644.5±3.447.7±3.714.2±2.814.7±2.418.2±3.220.3±3.021.2±2.8HIE 轻度组3832.6±3.3a42.0±5.545.4±5.944.6±3.148.0±3.311.5±1.8a14.5±2.418.0±2.719.6±2.321.0±2.5 中度组2729.3±2.6ab38.0±4.4a43.6±8.5a43.9±3.247.9±3.58.9±2.7ab12.0±3.6ab17.3±3.419.5±2.620.7±2.7 重度组2027.2±5.9ab35.3±4.7ab40.2±3.5ab42.0±3.6ab44.7±3.8ab7.7±2.8ab11.3±2.4ab15.6±3.4ab16.3±2.5ab18.1±1.7abF值54.6049.2344.6443.1134.4735.23610.6443.31510.4898.526P值<0.05<0.05<0.05<0.05<0.05<0.05<0.05<0.05<0.050
与对照组比较,a:P<0.05;与轻度HIE组比较,b:P<0.05
表3HIE各组与对照组RI,PI的动态变化
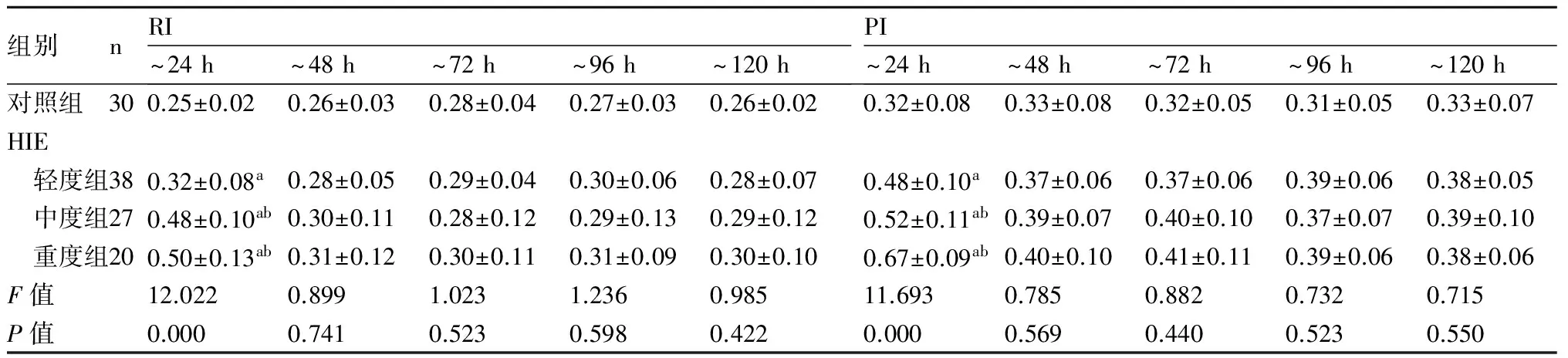
组别nRI~24h~48h~72h~96h~120hPI~24h~48h~72h~96h~120h对照组300.25±0.020.26±0.030.28±0.040.27±0.030.26±0.020.32±0.080.33±0.080.32±0.050.31±0.050.33±0.07HIE 轻度组380.32±0.08a0.28±0.050.29±0.040.30±0.060.28±0.070.48±0.10a0.37±0.060.37±0.060.39±0.060.38±0.05 中度组270.48±0.10ab0.30±0.110.28±0.120.29±0.130.29±0.120.52±0.11ab0.39±0.070.40±0.100.37±0.070.39±0.10 重度组200.50±0.13ab0.31±0.120.30±0.110.31±0.090.30±0.100.67±0.09ab0.40±0.100.41±0.110.39±0.060.38±0.06F值12.0220.8991.0231.2360.98511.6930.7850.8820.7320.715P值0.0000.7410.5230.5980.4220.0000.5690.4400.5230.550
与对照组比较,a:P<0.05;与轻度HIE组比较,b:P<0.05
2.3 HIE患儿与对照组血清S100B水平的动态变化生后24 h内,HIE患儿血清S100B水平均高于对照组(P<0.05)并达峰值浓度,其中HIE组间两两比较差异有显著性(P<0.05)。24 h后,血清S100B浓度逐日下降,HIE轻度组于生后120 h接近对照组水平,HIE中、重度组与对照组仍存在差异(P<0.05)。见表4。
表4HIE各组与对照组血清S100B水平的动态变化(μg/L)
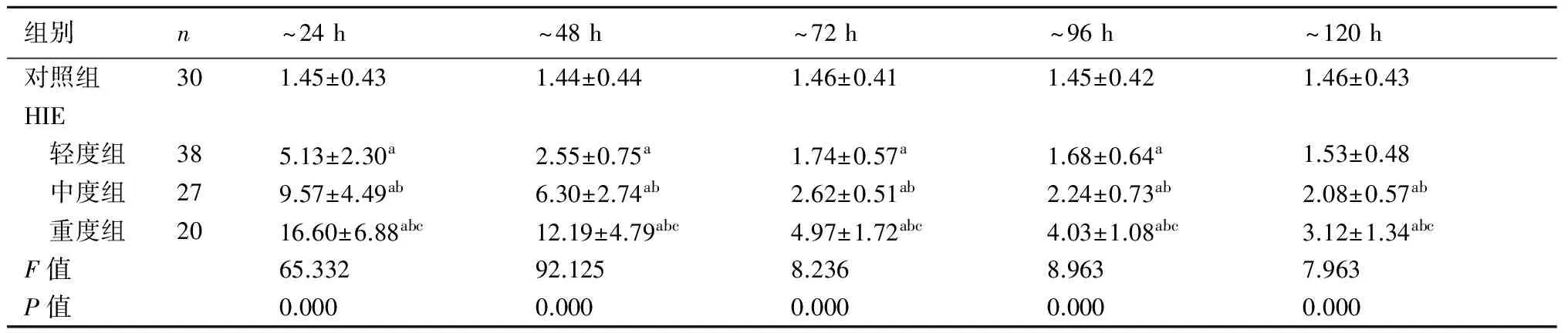
组别n~24h~48h~72h~96h~120h对照组301.45±0.431.44±0.441.46±0.411.45±0.421.46±0.43HIE 轻度组385.13±2.30a2.55±0.75a1.74±0.57a1.68±0.64a1.53±0.48 中度组279.57±4.49ab6.30±2.74ab2.62±0.51ab2.24±0.73ab2.08±0.57ab 重度组2016.60±6.88abc12.19±4.79abc4.97±1.72abc4.03±1.08abc3.12±1.34abcF值65.33292.1258.2368.9637.963P值0.0000.0000.0000.0000.000
与对照组比较,a:P<0.05;与轻度HIE组相比,b:P<0.05;与中度HIE组相比,c:P<0.05
2.4 HIE患儿脑血流动力学指标与血清S100B的关系经Pearson相关分析可知,S100B与Vs呈负相关(P<0.05),与RI、PI呈正相关(P<0.05)。见表5。
表5HIE患儿脑血流动力学指标与血清S100B的关系
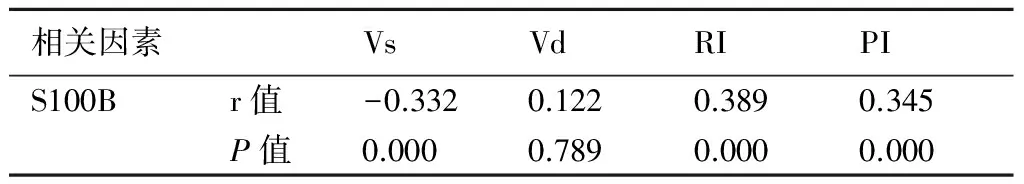
相关因素VsVdRIPIS100Br值-0.3320.1220.3890.345P值0.0000.7890.0000.000
3 讨 论
新生儿HIE是指围产儿出生时缺氧性窒息,导致患儿脑部缺血缺氧性损伤,患儿临床表现为生理病理及神经病理改变,并出现一系列脑损伤表现[4],多见于足月新生儿,其发生多与胎儿宫内窘迫、产程缺氧、出生时窒息、胎粪吸入、反复呼吸暂停、心跳骤停及高碳酸血症等密切相关。HIE患儿如未及时诊断与治疗,预后效果并不理想,临床上大部分患儿可留下不同程度的神经系统后遗症,严重影响患儿生命健康[5]。目前对HIE的诊断主要依靠临床表现、病史及影像学检查,缺乏可客观反映患儿病情进展及预后的血液生化诊断指标[6],寻找灵敏性及特异性较高的生化指标对HIE患儿进行诊断对尽早评估患儿病情发展及预后具有重要的意义。
S100B蛋白属于酸性结合蛋白,是S100家族中的最具有活性的成员,占脑蛋白总量0.1%~0.2%,是脑内特异性蛋白[7-8]。S100B蛋白以高浓度特异性存在于中枢神经系统前部垂体细胞、神经胶质细胞中,并小量存储在小脑小脑核及感觉神经中[9]。生理状态下其在脑脊液及血清中表达水平很低,但当脑部发生损伤后其水平将大幅升高[7]。本文结果显示,HIE患儿血清S100B水平显著高于对照组,且随着HIE患儿病情加重,血清S100B水平显著升高,从而表明,血清S100B升高与新生儿HIE病情发生及进展有密切的关系,其可能作用机制为脑细胞损伤后,脑脊液中S100B蛋白可通过损伤的血管屏障进入血液中,导致血液S100B水平升高有关。因此,血清S100B可作为HIE诊断和预后判断的辅助生化指标,但由于脑部损伤的发生时刻不同,即使损伤程度相同,不同患儿在同时刻的血清S100B含量衰减程度不同,损伤程度严重的窒息新生儿的血清S100B含量完全可能不高于损伤程度不严重的窒息新生儿,所以准确的诊断和预后判断需要综合考虑临床状态、影像学检查和其他生物化学检测指标[10]。
大脑缺血缺氧时脑组织中酸性代谢产物将增加,导致钙泵及钠泵功能失衡,使得氨基酸及自由基兴奋性增加,从而加重脑损伤[11],引发脑水肿。脑水肿是HIE患儿早期特征性的病理改变,其超声表现为脑实质回声增强,侧脑室变窄,一般在1周左右恢复正常,未能改善者渐成后遗症改变。 缺氧时脑血管自动调节功能将丧失,脑血流将随着脉压下降而减少[12-13]。MCA是颈内动脉的直接延伸,其供应大脑半球约80%血流,且变异较少,易于探及,缺氧时MCA血流变化最为敏感,故选择其为动态观察的血管[14-15]。本文结果显示,生后24 h内,中、重度HIE患儿均有脑实质回声增粗增强,侧脑室变窄,而轻度HIE患儿仅有8例脑实质呈小片状回声增强并于48 h内恢复正常。至120 h,20例中度组HIE脑实质回声恢复正常,重度组HIE仅6例脑实质回声接近正常。HIE患儿生后24 h内Vs、Vd均减少,RI、PI均增高。至48 h,轻度组血流参数多恢复正常。至96 h,中度组Vs、Vd多接近正常。至120 h,重度组Vs,Vd尚有6例未恢复正常水平,与对照组、轻度组比较差异有显著性(P均<0.05)。而中度、重度组RI、PI至(72±8 h)测得均值间与对照组比较差异无统计学意义(P>0.05)。由此表明,二维声像图及脑血流指标可作为HIE病情发展及预后的评价指标。生后早期进行床旁彩色多普勒超声检查并予连续性动态观察,可为脑损伤的早期诊断、临床治疗及预后评估提供重要依据。
经Pearson相关分析可知,S100B与Vs、Vd呈负相关(P<0.05),与RI、PI呈正相关(P<0.05),从而表明HIE脑损伤的发生与脑血流指标改变有密切的关系。HIE患儿生后同时段做颅脑彩超检查及检测血清S100B水平并进行动态观察,可更好地评估脑损伤程度,为临床针对性治疗和评估预后提供重要参考信息。
综上所述,外周血S100B蛋白及脑血流动力学紊乱是HIE患儿脑损伤的重要原因,两者相互作用,相互影响。通过测定HIE患儿外周血S100B蛋白及脑血流动力学对患儿病情进展及预后具有一定的评估价值。
[1] 陈丽娟,尹国燕,赵俊丽,等.早期综合干预对缺氧缺血性脑病新生儿神经行为发育及血清S100B水平的影响[J].中华行为医学与脑科学杂志,2011,20(7):608-610.
[2] 姜东林,孙钧铭,李成万,等.血浆S100B蛋白在缺氧缺血性脑病新生儿的诊断评估[J].中国实验诊断学,2010,14(3):426-428.
[3] 朱阿瑾,余增渊,李天慧,等.血清S100B蛋白在缺氧缺血性脑病新生儿脑损伤中的诊断价值[J].实用儿科临床杂志,2010,25(11):853-855.
[4] Mutlu M,SarIaydIn M,Aslan Y,et al.Status of vitamin D,antioxidant enzymes,and antioxidant substances in neonates with neonatal hypoxic-ischemic encephalopathy[J].J Matern Fetal Neonatal Med,2015,8(2):96-98.
[5] 陈桃英,王晓蕾,李雅雯,等.全身亚低温治疗对缺氧缺血性脑病新生儿血清NSE、S100B浓度及神经系统预后的影响[J].现代中西医结合杂志,2013,22(32):3556-3557.
[6] 田恬,周宏艳,李改莲,等.尿S100B蛋白和乳酸/肌酐比值对新生儿缺氧缺血性脑病预后判断的价值[J].中国新生儿科杂志,2008,23(3):141-144.
[7] Faingold R,Cassia G,Prempunpong C,et al.Intestinal ultrasonography in infants with moderate or severe hypoxic-ischemic encephalopathy receiving hypothermia[J].Pediatr Radiol,2015,12(2):78-80.
[8] 吕静娟.S100B对于新生儿HIE诊断和窒息预后判断的临床价值[J].医学研究杂志,2007,36(5):66-68.
[9] Massaro AN,Govindan RB,Vezina G,et al.Impaired cerebral autoregulation and brain injury in newborns with hypoxic-ischemic encephalopathy treated with hypothermia[J].J Neurophysiol,2015,114(2):818-824.
[10] Zayachkivsky A,Lehmkuhle MJ,Ekstrand JJ,et al.Ischemic injury suppresses hypoxia-induced electrographic seizures and the background EEG in a rat model of perinatal hypoxic-ischemic encephalopathy[J].J Neurophysiol,2015,10(4):18-22.
[11] 杨新军,田培超.彩色多普勒在新生儿缺氧缺血性脑病早期诊断中的应用[J].中国实用神经疾病杂志,2014,17(15):44-46.
[12] 王石,李智超.血清S1OOB蛋白和神经元特异性烯醇化酶在缺氧缺血性脑病诊断与预后判断中的价值[J].中国儿童保健杂志,2015,23(1):90-92.
[13] 张艳.血清中sICAM-1、TNF-α和S100B检测在新生儿缺氧缺血性脑病中的临床意义[J].中国妇幼保健,2014,29(24):3931-3932.
[14] Liu L,Zheng CX,Peng SF,et al.Evaluation of urinary S100B protein level and lactate/creatinine ratio for early diagnosis and prognostic prediction of neonatal hypoxic-ischemic encephalopathy[J].Neonatology,2010,97(1):41-44.
[15] Aridas JD,Yawno T,Sutherland AE,et al.Detecting brain injury in neonatal hypoxic ischemic encephalopathy:closing the gap between experimental and clinical research[J].Exp Neurol,2014,261(4):281-290.
TheCorrelationoftheLevelsofFullSerumS100BofTermNeonateswithHypoxic-ischemicEncephalopathyBrainHemodynamic
ZHANG Yanhui,HUANG Jiacheng,CHEN Shuyuan,etal
(SonggangPepole’sHospital,Shenzhen,Guangdong518105,China)
ObjectiveObjective To explore the correlation between changes in middle cerebral artery of the full-term neonates with hypoxic-ischemic encephalopathy (HIE) and the levels of serum S100B .Methods85 patients of full-term neonates with hypoxic ischemic encephalopathy 24 h after born were selected as the research object,the cerebral blood flow parameters and the serum levels of S100B in two groups were applicated with SIEMENS ACUSON X300 color Doppler diagnostic apparatus and ELISA.Another 30 normal infants were selected as control group.ResultsThe neonatal brain parenchyma of control group in echo uniform,with no expansion of the ventricular system or stenosis,and with prolonged time newborn ventricle horn area,peak systolic velocity (Vs),diastolic velocity (Vd) increased,and those of HIE children increased too,but the increase was less than the control group,and the more severe the disease the smaller the increase was. The serum S100B concentrations of HIE decreased day by day,mild HIE group approached the level of the control group 120 h after birth,and there were still differences (P<0.05) in the moderate or severe group and control group. By Pearson correlation analysis,S100B and Vs,Vd were negatively correlated (P<0.05),and the resistance index (RI) and pulsatility index (PI) were positively correlated (P<0.05).ConclusionsPeripheral blood S100B protein and cerebral hemodynamics dynamics disorder play important role in neonates with HIE brain injury,and the two influence each other.
full-term newborns; hypoxic-ischemic encephalopathy; middle cerebral artery; hemodynamics; serum S100B
10.15972/j.cnki.43-1509/r.2016.02.013
2015-11-10;
2016-02-20
深圳市宝安区科技创新计划项目科研课题(2015257).
*通讯作者,E-mail:ws2199827@126.com.
R722
A
蒋湘莲)
