β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂临床应用专家共识
2016-12-24内酰胺类抗生素内酰胺酶抑制剂合剂临床应用专家共识编写委员会
β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂临床应用专家共识编写委员会
●述 评
β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂临床应用专家共识
β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂临床应用专家共识编写委员会
1 概述
革兰阴性菌是我国细菌感染性疾病最常见的病原体。近年来,革兰阴性菌对β-内酰胺类抗生素的耐药性不断增加,最重要的耐药机制是细菌产生各种β-内酰胺酶。β-内酰胺酶抑制剂能够抑制大部分β-内酰胺酶,恢复β-内酰胺类抗生素的抗菌活性。因此,β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂在临床抗感染中的地位不断提升,已成为临床治疗多种耐药细菌感染的重要选择。目前我国临床使用的β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂的种类和规格繁多,临床医师对该类合剂的特点了解不够,临床不合理使用问题较突出。为规范β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂的临床应用,延缓其耐药性的发生和发展,特制定本共识。
2 主要β-内酰胺酶及β-内酰胺酶抑制剂
β-内酰胺酶是由细菌产生的能水解β-内酰胺类抗生素的一大类酶。β-内酰胺酶种类繁多,有多种分类方法,最主要的分类方法有根据β-内酰胺酶的底物、生化特性及是否被酶抑制剂所抑制的功能分类法(Bush分类法),将β-内酰胺酶分为青霉素酶、广谱酶、超广谱β-内酰胺酶、头孢菌素酶和碳青霉烯酶等;根据β-内酰胺酶末端的氨基酸序列特征的分子生物学分类法(Ambler分类法),将β-内酰胺酶分为丝氨酸酶和金属酶。目前引用较多的是基于上述2种方法建立的分类方法。见表1。
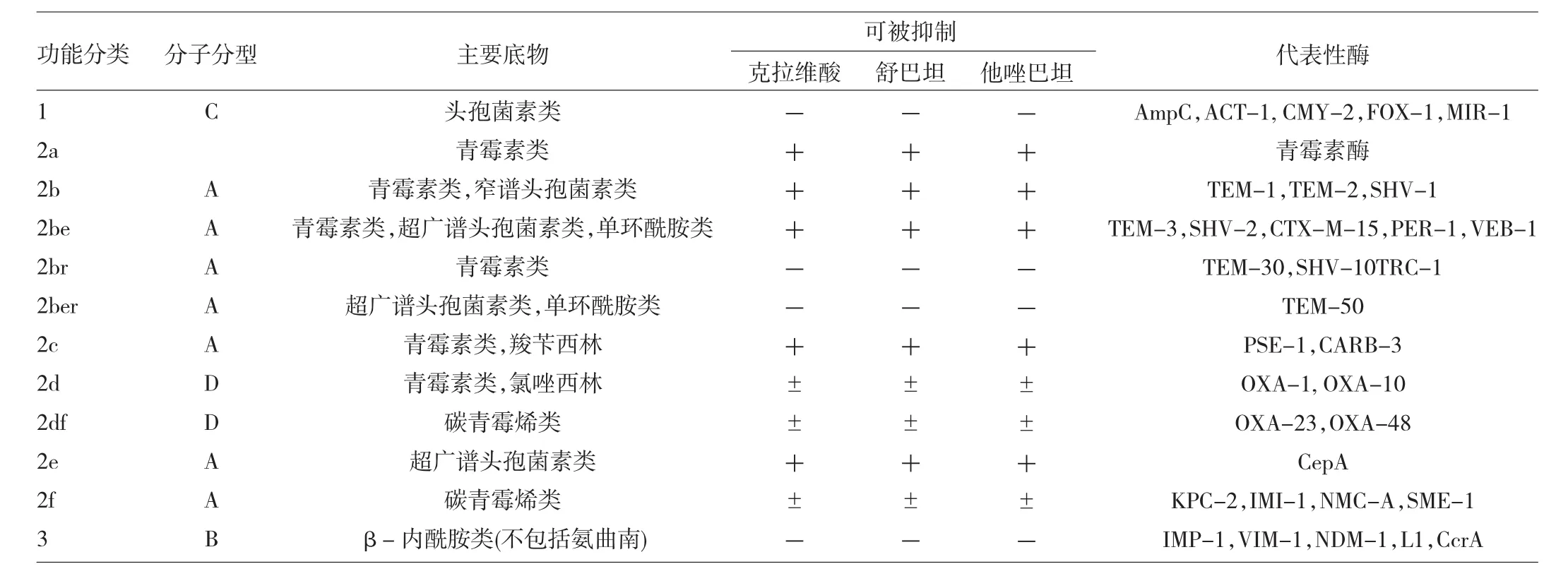
表1 β-内酰胺酶的分类和3种主要酶抑制剂的作用
超广谱β-内酰胺酶(ESBLs)是由质粒介导的能水解青霉素类、头孢菌素及单环酰胺类等β-内酰胺类抗生素的β-内酰胺酶,其对碳青霉烯类和头霉素类水解能力弱。这类酶可被β-内酰胺酶抑制剂如克拉维酸、舒巴坦及他唑巴坦等抑制。ESBLs主要由肠杆菌科细菌产生,以肺炎克雷伯菌、大肠埃希菌、变形杆菌最为常见。到目前为止,全世界共发现了200余种ESBLs。根据编码基因的同源性,ESBLs可分为TEM型、SHV型、CTX-M型、OXA型和其他型共5大类型[1]。
头孢菌素酶(AmpC酶)通常是由染色体介导,对第一、二、三代头孢菌素水解能力强,但其对碳青霉烯类抗生素和第四代头孢菌素的水解能力弱,克拉维酸不能抑制其活性,他唑巴坦和舒巴坦有部分抑酶作用,氯唑西林抑制头孢菌素酶作用强。该酶主要存在于肠杆菌属、柠檬酸杆菌属、普鲁菲登菌属、粘质沙雷菌属和摩根菌属等细菌。染色体介导的头孢菌素酶可以被β-内酰胺类抗生素诱导和选择。近年来,质粒介导的头孢菌素酶陆续被报道,主要出现于肺炎克雷伯菌、大肠埃希菌及沙门菌属细菌中,常呈持续高水平表达,可通过质粒广泛传播。根据其与染色体介导的头孢菌素酶的同源性,可分为CMY-2组、CMY-1组、MIR-1/ACT-1组、DHA-1组和ACC-1组等[2]。
碳青霉烯酶是指能水解碳青霉烯类抗生素的一大类β-内酰胺酶,分别属于Ambler分子分类中的A类、B类和D类酶。A类、D类为丝氨酸酶,B类为金属酶,以锌离子为活性中心[3-4]。
A类碳青霉烯酶可以由染色体介导,也可由质粒介导,前者包括SME、NMC和IMI酶等,后者包括KPC和GES酶等。KPC酶是近年来肠杆菌科细菌尤其是肺炎克雷伯菌对包括碳青霉烯类抗生素在内的几乎所有β-内酰胺类抗生素耐药的最主要机制,我国最常见的是KPC-2,其对头孢吡肟和头孢他啶的水解能力较弱[5-6]。A类碳青霉烯酶可部分被克拉维酸所抑制,但不被乙二胺四乙酸(EDTA)所抑制[2]。
D类碳青霉烯酶(OXA酶)对苯唑西林水解活性强,主要见于不动杆菌属细菌。包括OXA-23、OXA-24/ OXA-40、OXA-48、OXA-58和OXA-51酶等。目前临床应用的酶抑制剂对其没有很好的抑制作用,且不同OXA酶对碳青霉烯类抗生素水解活性不相同,β-内酰胺酶抑制剂的抑酶活性也不同[7]。
B类碳青霉烯酶(金属酶)能灭活青霉素类、头孢菌素类、碳青霉烯类抗生素,但对氨曲南水解活性弱,不能被β-内酰胺酶抑制剂所抑制,可被EDTA或巯基类化合物抑制。常见于铜绿假单胞菌、不动杆菌属细菌和肠杆菌科细菌,包括IMP、VIM、GIM、SPM、SIM、NDM酶等[4,8]。
β-内酰胺酶抑制剂能抑制细菌产生的大部分β-内酰胺酶,常与β-内酰胺类抗生素联合使用,能使抗生素中的β-内酰胺环免遭水解,保护β-内酰胺抗生素的抗菌作用。临床上常用的β-内酰胺酶抑制剂主要有:克拉维酸、舒巴坦、他唑巴坦,三者均含有β-内酰胺环结构,为不可逆竞争性抑制剂[9]。β-内酰胺酶抑制剂的出现很大程度上解决了β-内酰胺类抗生素的耐药问题(表1)。
3 主要β-内酰胺酶的流行情况
CHINET耐药监测网和国家卫计委细菌耐药监测网的数据显示,近8年来我国ESBLs在大肠埃希菌的发生率在50%~60%,大肠埃希菌所产ESBLs基因型90%以上为CTX-M型,各地区产ESBLs大肠埃希菌CTX-M型分布有一定差异。产ESBLs大肠埃希菌对碳青霉烯类抗生素、头孢哌酮/舒巴坦和哌拉西林/他唑巴坦的耐药率均低于15%。肺炎克雷伯菌产生的ESBLs基因型情况与大肠埃希菌相似,以CTX-M型为主。据国家卫计委细菌耐药监测网分析,2013年我国各地区肺炎克雷伯菌的ESBLs检出率介于15.9%~46.7%,而CHINET监测16家三甲医院2013年肺炎克雷伯菌ESBLs检出率为31.8%。产ESBLs肺炎克雷伯菌对亚胺培南、头孢哌酮/舒巴坦和哌拉西林/他唑巴坦的耐药率分别为6.0%、17.8%和23.5%[10-12]。
据2013年CHINET耐药监测网数据显示,肺炎克雷伯菌对碳青霉烯类抗生素耐药超过10.0%。我国肠杆菌科中流行的碳青霉烯酶为KPC-2,在大肠埃希菌、肺炎克雷伯菌,粘质沙雷菌、奇异变形杆菌等肠杆菌科细菌中均有发现,流行地区包括浙江、上海、江苏、湖南、北京、山东等多个省市。由于产KPC-2的菌株常常同时产ESBLs和(或)AmpC酶,甚至同时合并有外膜蛋白缺失,常表现为广泛耐药或全耐药。CHINET近5年数据显示,我国碳青霉烯类抗生素耐药鲍曼不动杆菌检出率从2008年的49.3%上升至2013年的62.8%,产碳青霉烯酶OXA-23是介导鲍曼不动杆菌对碳青霉烯类抗生素耐药的主要机制[10,13]。
4 主要β-内酰胺酶的检测及耐药表型
根据不同β-内酰胺酶水解底物范围、活性及对酶抑制剂抑酶活性的差异,建立了多种β-内酰胺酶表型检测方法,其对临床合理选用抗菌药物有重要的参考价值,但其检测结果易受多种因素的影响,必要时可采用分子生物学技术进一步确认酶的类型。
4.1 ESBLs的检测 目前实验室通常采用CLSI推荐的ESBLs初筛和表型确证试验,也可采用三维试验、Etest条、双纸片协同试验、自动化仪器等[14]。ESBLs种类繁多,耐药表型不一,国内大肠埃希菌和克雷伯菌中主要流行CTX-M型,通常对头孢噻肟和头孢曲松耐药,部分菌株可对头孢他啶体外敏感,对碳青霉烯类抗生素、含酶抑制剂复合制剂头孢哌酮/舒巴坦和哌拉西林/他唑巴坦敏感率高[10]。
4.2 AmpC酶的检测 实验室没有常规开展AmpC酶的检测,其检测方法主要有头孢西丁三维试验、AmpC酶纸片法、头孢西丁琼脂法等,也可以硼酸(30μg/ml)为抑制剂,采用类似于美国临床和实验室标准化委员会(CLSI)推荐的ESBLs检测方法和判断标准。产AmpC酶菌株的典型耐药表型为头孢吡肟敏感、头孢西丁耐药,部分菌株可同时产ESBLs,造成第四代头孢菌素头孢吡肟耐药,仅对碳青霉烯类抗生素敏感。克拉维酸与三代头孢菌素或氨曲南对产头孢菌素酶细菌无协同作用[15]。
4.3 碳青霉烯酶的检测 碳青霉烯酶的表型检测方法主要有两种:改良Hodge试验和EDTA协同试验。改良Hodge试验不能区分碳青霉烯酶类型,主要用于检测肠杆菌科细菌中的碳青霉烯酶,对KPC酶灵敏度和特异性较高,对金属酶会出现假阴性,菌株如高产ESBLs或AmpC酶合并外膜孔蛋白丢失,改良Hodge试验也会出现假阳性[14]。EDTA协同试验用于检测金属酶,以EDTA作为抑制剂,美罗培南或亚胺培南作为指示药物,采用类似于CLSI推荐的ESBLs检测方法和判断标准[16]。产碳青霉烯酶菌株往往对碳青霉烯类抗生素耐药,对目前临床使用的含酶抑制剂复合制剂、广谱头孢菌素也常表现为耐药。
5 β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂的组成原则
β-内酰胺类抗生素与β-内酰胺酶抑制剂组成合剂必须考虑组方和配比的合理性。基本组成原则如下:(1)β-内酰胺类抗生素与β-内酰胺酶抑制剂的药代动力学特征基本吻合,如消除半衰期相近和分布相似,两者在体内的有效浓度能共同维持足够的作用时间,以发挥更好的协同杀菌效果。(2)β-内酰胺类抗生素与酶抑制剂组方后毒理学试验表明合剂与单药相比毒性未显著增加,并且临床研究结果显示联合后不良反应无明显增加。(3)母体和酶抑制剂均需适当剂量。在已上市的β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂基础上增加新配比的品种,必须有充足理由说明现有配比不能完全满足临床需要,临床前和临床研究结果证明新配比合剂与已上市配比合剂相比,在有效性或安全性上具有临床价值的明显优势和(或)新配比合剂有特殊适应证范围等。
目前国内外临床上应用的主要β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂包括:(1)阿莫西林/克拉维酸(针剂5∶1,口服4∶1或2∶1);(2)替卡西林/克拉维酸(15∶1);(3)氨苄西林/舒巴坦(2∶1);(4)头孢哌酮/舒巴坦(2∶1或1∶1);(5)哌拉西林/他唑巴坦(8∶1)。数据来源于各产品说明书及相关文献报道,此5种复合制剂的配方符合抑制剂合剂组成的原则、有详细的药物代谢动力学数据(表2)、详实的体外药敏监测数据及丰富的临床使用数据,成为临床抗感染治疗的重要选择。
6 主要β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂特点
主要β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂共同的特点:(1)除舒巴坦对不动杆菌属有很强抗菌活性外,其他β-内酰胺酶抑制剂仅具有微弱的抗菌作用;(2)β-内酰胺酶抑制剂对多数质粒介导的β-内酰胺酶有较强抑制作用,与阿莫西林、氨苄西林、哌拉西林、替卡西林、头孢哌酮等联合后可保护上述抗生素不被细菌产生的灭活酶水解;(3)β-内酰胺酶抑制剂不增强与其配伍药物对敏感细菌或非产β-内酰胺酶的耐药细菌的抗菌活性;(4)β-内酰胺酶抑制剂合剂的抗菌作用主要取决于其β-内酰胺类抗生素的抗菌谱和抗菌活性;(5)β-内酰胺类抗生素和β-内酰胺酶抑制剂合剂中两药的药代动力学性质相近,具协同抗菌作用;(6)两药联合应用后不良反应无明显增加。
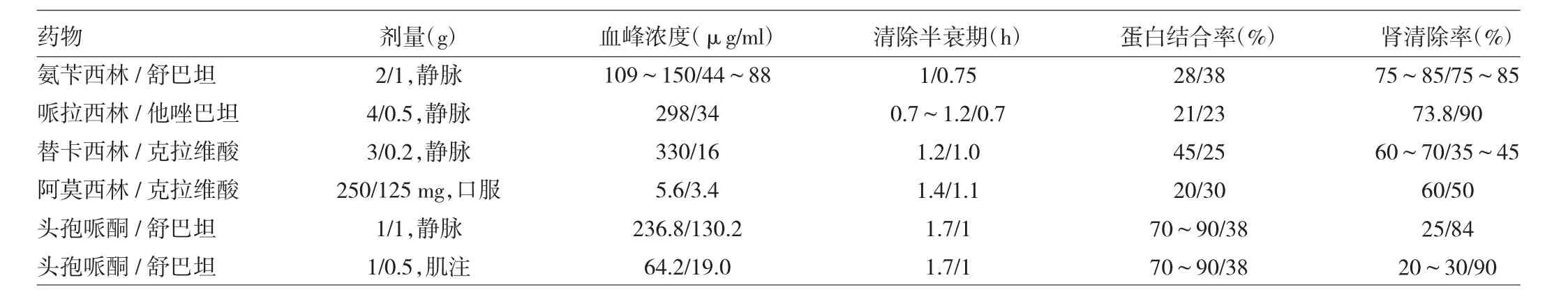
表2 β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂药代动力学参数
5种主要的β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂的抗菌活性有一定差异,表现在:(1)氨苄西林/舒巴坦、阿莫西林/克拉维酸对肠杆菌科细菌抗菌活性总体不如替卡西林/克拉维酸、哌拉西林/他唑巴坦、头孢哌酮/舒巴坦,尤其对非发酵抗菌活性更弱,但氨苄西林/舒巴坦对不动杆菌有较强抗菌活性;(2)替卡西林/克拉维酸、哌拉西林/他唑巴坦、头孢哌酮/舒巴坦均有较强的抗假单胞菌活性,但哌拉西林/他唑巴坦对嗜麦芽窄食单胞菌活性低,替卡西林/克拉维酸对不动杆菌活性差;(3)哌拉西林/他唑巴坦、头孢哌酮/舒巴坦对肠杆菌属细菌抗菌活性强,但产染色体介导的头孢菌素酶的肠杆菌科治疗期间可能因选择出高产AmpC酶菌株而导致耐药发生;(4)氨苄西林/舒巴坦、阿莫西林/克拉维酸可用于敏感革兰阳性菌感染的治疗,但替卡西林/克拉维酸、哌拉西林/他唑巴坦、头孢哌酮/舒巴坦不作为单纯革兰阳性菌感染的治疗药物,头孢哌酮/舒巴坦对肠球菌无抗菌活性。5种药物详细的抗菌活性见表3。

表3 β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂抗菌作用
7 主要β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂临床应用
7.1 主要酶抑制剂合剂在常见革兰阴性菌感染治疗中的地位 根据CHINET的耐药监测结果,我国大型教学医院临床分离菌中约70%为革兰阴性菌,在革兰阴性菌中肠杆菌科细菌分离比例约60%,非发酵菌比例约40%,其中常见的为大肠埃希菌、克雷伯菌、鲍曼不动杆菌、铜绿假单胞菌、肠杆菌属和嗜麦芽窄食单胞菌[13]。
7.1.1 在鲍曼不动杆菌感染中的作用[17]舒巴坦、头孢派酮/舒巴坦、氨苄西林/舒巴坦、哌拉西林/他唑巴坦、替卡西林/克拉维酸等对不动杆菌均有潜在抗菌活性,药敏结果提示敏感时均可以使用。2012年CHINET监测显示不动杆菌对头孢派酮/舒巴坦耐药率33%,对哌拉西林/他唑巴坦耐药率58.3%,替卡西林/克拉维酸耐药率74.9%。2010年CHINET监测显示不动杆菌对氨苄西林/舒巴坦耐药率57.1%。头孢哌酮与舒巴坦在体外对不动杆菌存在协同抗菌活性,敏感性优于氨苄西林/舒巴坦。因舒巴坦存在较强的不动杆菌抗菌活性,对于多重耐药、广泛耐药及全耐药不动杆菌的治疗时含舒巴坦复合制剂是重要的选择。治疗不动杆菌感染时应使用足够剂量的舒巴坦,我国推荐每天4g,国外推荐对多重耐药株可加量至每天6~8g,甚至更高剂量。
7.1.2 在铜绿假单胞菌感染中的作用[18]具有抗假单胞菌活性的酶复合制剂合剂包括:哌拉西林/他唑巴坦、替卡西林/克拉维酸、头孢哌酮/舒巴坦,2012年CHINET监测显示耐药率分别为17.5%、38.3%、19.8%。临床使用较多的是哌拉西林/他唑巴坦和头孢哌酮/舒巴坦,是铜绿假单胞菌所致感染的重要选择。对于非多重耐药铜绿假单胞菌感染或病情较轻的患者可单药治疗,对多重耐药铜绿假单胞菌感染或重症患者常需要与氨基糖苷类或氟喹诺酮类抗菌药物联合使用。
7.1.3 在嗜麦芽窄食单胞菌感染中的作用[19]头孢哌酮/舒巴坦、替卡西林/克拉维酸可用于嗜麦芽窄食单胞菌敏感株所致感染的治疗,耐药率分别为24.4%和15.9%。对于病情较重的患者常需要联合治疗,临床应用的联合治疗方案通常以SMZ-TMP为基础,联合的抗菌药物可以是敏感的β内酰胺类/β内酰胺酶抑制剂合剂(国内多用头孢哌酮/舒巴坦,国外多用替卡西林/克拉维酸);亦可选用喹诺酮类或替加环素联合β内酰胺类抗生素/β内酰胺酶抑制剂合剂。
7.1.4 在肠杆菌科细菌感染中的作用[20]β内酰胺类抗生素/β内酰胺酶抑制剂合剂对肠杆菌科细菌敏感性良好,有较好临床疗效的是头孢哌酮/舒巴坦和哌拉西林/他唑巴坦,耐药率分别为10.5%和8.4%。头孢哌酮/舒巴坦和哌拉西林/他唑巴坦主要用于产ESBLs肠杆菌科细菌的治疗,对于敏感菌株所致下尿路感染,部分患者可口服阿莫西林/克拉维酸。对于产ESBLs肠杆菌科细菌所致感染,应根据感染的严重程度选用抗菌药物:轻中度感染(包括尿路感染、肝脓肿、胆道感染、腹膜炎、医院获得性肺炎等局部感染)并无继发重症脓毒症或脓毒性休克时,可结合药敏结果选用头孢哌酮/舒巴坦、哌拉西林/他唑巴坦等,疗效不佳时可改为碳青霉烯类抗生素。
7.2 肺炎 肺炎的抗菌药物选择取决于经验性治疗时对病原菌的判断和目标治疗时对培养及药敏结果的解读。肺炎的病原菌判断取决于患者本身的高危因素(如免疫抑制、粒细胞缺乏、抗菌药物使用情况、机械通气)和获得感染场所的耐药菌流行情况。除对经验治疗反应良好的社区获得性肺炎外,肺炎均需充分重视合格下呼吸道标本的采集及培养,努力做到经验性治疗向目标治疗的转化。
7.2.1 社区获得性肺炎 社区获得性肺炎的主要病原菌为肺炎链球菌,非典型病原体(支原体、衣原体、军团菌),流感嗜血杆菌,卡他莫拉菌,金黄色葡萄球菌,革兰阴性杆菌等。社区获得性肺炎强调遵循指南的规范治疗[21-22]。阿莫西林/克拉维酸、氨苄西林/舒巴坦可以联合大环内酯类作为没有铜绿假单胞菌高危因素的社区获得性肺炎的抗菌治疗方案。阿莫西林/克拉维酸的口服剂型可以作为轻症社区获得性肺炎的初始治疗选择,亦可作为静脉治疗后的序贯治疗。
7.2.2 医院获得性肺炎 医院获得性肺炎根据发病时间分为早发性(入院≤5d或机械通气≤4d)和迟发性(入院>5d或机械通气>4d),两者的病原菌存在差异。早发性医院获得性肺炎的病原菌主要包括肠杆菌科细菌、流感嗜血杆菌、肺炎链球菌、甲氧西林敏感金黄色葡萄球菌等,阿莫西林/克拉维酸、氨苄西林/舒巴坦等可以作为经验性治疗的选择;晚发性医院获得性肺炎除了需要考虑上述细菌外,还需要考虑铜绿假单胞菌、不动杆菌、产ESBLs的肠杆菌科细菌、甲氧西林耐药金黄色葡萄球菌、肠杆菌属细菌等,经验性治疗常需覆盖假单胞菌,头孢哌酮/舒巴坦、哌拉西林/他唑巴坦单药或联合氨基糖苷类或喹诺酮类抗菌药物是重要的选择。
医院获得性肺炎的病原学判断除了区分早发性和迟发性肺炎外,还需要考虑多重耐药菌感染的其他高危因素,包括:所处病房多重耐药菌流行情况、既往90d内广谱抗菌药物治疗史、免疫抑制患者。对于有多重耐药菌感染风险的患者,经验性治疗方案应参考迟发性医院获得性肺炎选择广谱抗菌药物。
医院获得性肺炎经验性抗菌药物的选择,还应考虑患者感染的严重程度,对于重症医院获得性肺炎适用降阶梯治疗策略,经验性治疗时强调选择广谱抗菌药物覆盖可能病原菌,抗菌治疗方案参考迟发性医院获得性肺炎。但目前医院获得性肺炎感染严重程度的评估虽尚无明确统一的标准,有观点认为可以参照美国感染病学会和胸科学会(IDSA/ATS)2010年关于社区获得性肺炎严重度判断的标准;亦有学者认为医院获得性肺炎因存在多重耐药菌感染风险均应按照重症感染适用降阶梯治疗策略;2012年国际脓毒症指南将感染患者的病情轻重分为脓毒症、重症脓毒症和脓毒性休克,对符合重症脓毒症和脓毒性休克诊断标准的医院获得性肺炎患者应强调降阶梯治疗策略[23]。
7.2.3 结构性肺病 支气管扩张、慢性支气管炎急性发作、慢性阻塞性肺病合并肺炎患者,需要区分是否有铜绿假单胞菌感染高危因素。高危因素包括有反复住院史、90d内或频繁(≥4次/年)抗菌药物使用史、病情严重[一秒用力呼气容积(FEV1)<30%]、糖皮质激素使用(泼尼松>10mg/d,2周以上)[18]。无铜绿假单胞菌感染高危因素患者可以选择喹诺酮类、阿莫西林/克拉维酸等作为治疗药物;铜绿假单胞菌感染高危因素的患者需要选择抗假单胞菌头孢菌素、抗假单胞菌碳青霉烯类、抗假单胞菌β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂(主要为头孢哌酮/舒巴坦、哌拉西林/他唑巴坦)单药或联合氨基糖苷类、抗假单胞菌的喹诺酮类进行治疗。
7.2.4 吸入性肺炎 吸入性肺炎常为需氧菌和厌氧菌的混合性感染,经验性治疗需要覆盖口咽部常见定植菌。对于社区发病的无耐药菌高危因素的患者,需要覆盖链球菌及厌氧菌,可以考虑选择阿莫西林/克拉维酸、氨苄西林/舒巴坦、克林霉素、头孢菌素联合甲硝唑、莫西沙星等。对于医院获得性肺炎中有吸入因素的患者,随着住院时间的延长及抗菌药物的使用,口咽部定植菌中革兰阴性菌比例、非发酵菌比例增加,抗菌药物选择时应该遵循医院获得性肺炎的治疗原则并强调对厌氧菌的覆盖,头孢哌酮/舒巴坦、哌拉西林/他唑巴坦可以作为重要选择。
7.3 尿路感染[24-25]急性单纯性膀胱炎、肾盂肾炎的病原菌主要为大肠埃希菌,偶见腐生葡萄球菌、奇异变形杆菌、克雷伯菌属、肠杆菌属、枸橼酸菌属及肠球菌属细菌等。复杂性尿路感染的病原菌多为多重耐药的大肠埃希菌、变形杆菌属、克雷伯菌属、假单胞菌属和沙雷菌属等,肠球菌属及表皮葡萄球菌所致感染亦有所增加。反复发作的尿路感染病原菌可为上述任何一种。孕妇无症状菌尿常见病原菌为需氧革兰阴性杆菌和溶血葡萄球菌。院内尿路感染的病原菌以肠杆菌科细菌和假单胞菌属细菌为主,革兰阳性球菌以葡萄球菌属和肠球菌属多见。
急性单纯性膀胱炎、肾盂肾炎均可选用SMZ/TMP、阿莫西林、阿莫西林/克拉维酸、头孢菌素类、多西环素、喹诺酮类或磷霉素氨丁三醇等治疗。
住院治疗的重度感染患者,可选用氟喹诺酮类、氨苄西林/舒巴坦或阿莫西林/克拉维酸±氨基糖苷类、头孢菌素或抗假单胞菌青霉素等注射剂。如为肠球菌感染选用氨苄西林/舒巴坦或阿莫西林/克拉维酸联合氨基糖苷类,必要时给予万古霉素。铜绿假单胞菌感染时给予抗假单胞菌β内酰胺类、酶抑制剂合剂、氟喹诺酮类或氨基糖苷类,常需联合用药。
复杂性尿路感染根据细菌培养及药敏结果选用抗菌药物。门诊治疗选用口服氟喹诺酮类、头孢菌素类、阿莫西林、阿莫西林/克拉维酸、氨苄西林/舒巴坦等。重度感染和(或)疑为菌血症者需住院治疗,首先根据尿液涂片革兰染色结果给予经验治疗,选用阿莫西林/克拉维酸、氨苄西林/舒巴坦、哌拉西林/他唑巴坦、头孢菌素类、氟喹诺酮类、碳青霉烯类,必要时联合氨基糖苷类,而后根据药敏结果调整抗菌药物。留置导尿管者一旦有感染的临床症状或怀疑和肯定合并菌血症者,应首先拔除或更换留置时间超过2周的导尿管,并依据细菌培养及药敏结果选用抗生素,经验治疗方案同复杂性尿路感染。
7.4 腹腔感染 腹腔感染几乎都是多种细菌引起的混合感染。一般来说,社区获得性腹腔感染细菌谱相对单纯,多数为革兰阴性菌、厌氧菌,细菌耐药性较低,多为轻-中度腹腔感染;而手术或医疗操作相关的医院获得性腹腔感染细菌谱复杂,可为革兰阴性杆菌、厌氧菌、肠球菌或条件致病菌,细菌耐药性相对较高,多数为重度腹腔感染,在严重免疫低下的患者中,念株菌、凝固酶阴性葡萄球菌感染亦较多见。近年来,随着临床上侵入性诊疗操作增加、肿瘤放化疗及器官移植等免疫低下人群增加及长期广谱抗生素的使用,肠球菌、肠杆菌、非发酵菌、沙雷菌属等耐药菌株在腹腔感染患者中呈明显上升趋势[26]。
根据2010版《复杂腹腔感染诊指南》[27]及《国家抗微生物治疗指南》[28]推荐,对于轻、中症腹腔感染,一般推荐Ⅲ代头孢菌素联合甲硝唑,或β内酰胺酶抑制剂复合制剂,重症腹腔感染推荐首选碳青霉烯类抗生素或β内酰胺酶抑制剂复合制剂。
与β内酰胺类抗生素相比,β内酰胺酶抑制剂复合制剂能有效覆盖产β内酰胺酶的革兰阳性球菌、ESBLs阳性的革兰阴性杆菌及厌氧菌,更适合于需氧菌和厌氧菌的混合感染。美国感染病学会(IDSA)推荐替卡西林/克拉维酸用于轻-中度腹膜炎及化脓性腹腔感染。《国家抗微生物治疗指南》未推荐其作为腹腔感染的首选治疗。哌拉西林/他唑巴坦、头孢哌酮/舒巴坦对原发及继发性腹膜炎、腹腔脓肿及腹腔脏器感染(胰腺感染、胆囊炎、胆管炎)等均具有较好的治疗效果,临床上可作为社区获得性及院内腹腔感染的首选用药。
7.5 血流感染 血流感染中,革兰阴性菌占重要地位,包括大肠埃希菌、铜绿假单胞菌、肺炎克雷伯菌、不动杆菌等。在高度怀疑菌血症时,应在第一时间给予经验性抗感染药物,应结合疾病严重程度、流行病学、前期治疗等选择能够覆盖可能病原菌及耐药菌的药物。目前认为对于严重全身性感染、免疫功能低下、中性粒细胞缺乏的患者,应经验性覆盖多重耐药的革兰阴性杆菌,如产ESBLs肠杆菌科细菌、不动杆菌、铜绿假单胞菌等。碳青霉烯类、头孢哌酮/舒巴坦、哌拉西林/他唑巴坦等酶抑制剂复合制剂是较好的选择,进一步结合鉴定结果调整抗生素。祛除病灶是影响血流感染疗效及预后的重要环节,它与药物治疗同等重要,应尽可能拔除导管,特别是短期留置的导管。
7.6 粒细胞缺乏伴发热 我国目前中性粒细胞缺乏患者的常见细菌病原体分布如下。(1)常见革兰阴性菌:大肠埃希菌、肺炎克雷伯菌、铜绿假单胞菌、鲍曼不动杆菌、嗜麦芽窄食单胞菌;(2)常见革兰阳性菌:凝固酶阴性葡萄球菌、金黄色葡萄球菌(包括MRSA)、肠球菌(包括VRE)、链球菌属。根据《中国中性粒细胞缺乏伴发热患者抗菌药物临床应用指南》[29]将患者分为高危和低危组。对于高危患者应用可覆盖铜绿假单胞菌和其他革兰阴性菌的广谱抗菌药物,包括哌拉西林/他唑巴坦、头孢哌酮/舒巴坦等。对于低危患者,其初始治疗可以接受口服或静脉注射经验性抗菌药物治疗。推荐联合口服环丙沙星和阿莫西林/克拉维酸,也可以单用左氧氟沙星。
8 酶复合制剂的展望
近年来抗菌药的研发进入瓶颈状态,对多重耐药革兰阴性菌有效的广谱抗菌药的进展少,但酶抑制剂合剂近年有一定进展,有2个合剂有望在近期上市,分别为头孢他啶/阿维巴坦及Ceftolozane/他唑巴坦。这2个复合剂均对多重耐药革兰阴性菌具有良好抗菌活性,均已完成Ⅲ期临床试验。
阿维巴坦为新的β内酰胺酶抑制剂,分子结构包含β内酰胺环,对β内酰胺酶不具诱导作用。该酶抑制剂不仅对A类酶中的超广谱β内酰胺酶有抑制作用,而且对临床最常见碳青霉烯酶KPC及对C类酶(头孢菌素酶)具抑制作用,对D类酶中的OXA-48具抑制作用,对B类酶(金属酶)无抑酶作用。故头孢他啶/阿维巴坦对产ESBL、AmpC、KPC或OXA-48的肠杆菌科细菌具很好抗菌活性[30-31],对多重耐药铜绿假单胞菌的作用略优于头孢他啶单药,而对不动杆菌属与头孢他啶相比无增强抗菌活性作用[32]。阿维巴坦的半衰期约为2h,主要由肾脏排出,其药动学特性与头孢他啶相仿。头孢他啶/阿维巴坦已完成Ⅱ期及Ⅲ期临床试验,Ⅱ期临床试验中该合剂与碳青霉烯类抗生素对照治疗复杂性腹腔感染或尿路感染,给药剂量为2.5g/8h(4∶1合剂,头孢他啶2.0g、阿维巴坦0.5g),取得良好的临床与微生物学疗效,不良反应发生率低[32-33]。
Ceftolozane为新的头孢菌素,其化学结构与头孢他啶相仿,其特性为对铜绿假单胞菌的抗菌活性增强,对某些碳青霉烯类、哌拉西林/他唑巴坦或头孢他啶耐药的菌株具抗菌活性,因该头孢菌素能克服铜绿假单胞菌的多种耐药机制,包括外排泵、膜蛋白丢失及青霉素结合蛋白的改变。Ceftolozane与他唑巴坦的联合,使其对产ESBLs革兰阴性杆菌具抗菌作用[34-36]。Ceftolozane的半衰期为2.3h,≥92%的药物从肾脏排出,在肾功能下降时需作剂量调整。Ceftolozane/他唑巴坦已完成Ⅱ期、Ⅲ期临床试验,在Ⅱ期临床试验中Ceftolozane/他唑巴坦1.5g/8h(2∶1合剂)联合甲硝唑与美罗培南对照治疗复杂性腹腔感染,取得了满意的临床疗效,不良反应发生率较低[37]。
项目主持者:浙江大学附属邵逸夫医院感染科(俞云松)
执笔者(按姓氏拼音排序):中国医科大学附属第一医院感染科(陈佰义),复旦大学附属华山医院抗生素研究所(李光辉),上海交通大学医学院附属瑞金医院临床微生物科(倪语星),安徽省立医院血液科(孙自敏),复旦大学附属华山医院抗生素研究所(王明贵),解放军总医院临床药理研究室(王睿),中国医学科学院北京协和医院检验科(徐英春),浙江大学医学院附属第一医院检验科(杨青),东南大学附属中大医院危重医学科(杨毅),复旦大学附属华山医院临床药理研究室(张菁),浙江大学医学院附属第一医院呼吸科(周华、周建英),浙江大学附属邵逸夫医院感染科(周志慧),广州医学院广州呼吸疾病研究所(卓超)
《β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂临床应用专家共识》编写委员会成员(按姓氏拼音排序):首都医科大学附属北京朝阳医院感染科(曹彬),中国医科大学附属第一医院感染科(陈佰义),中华医学杂志社(陈新石),复旦大学附属中山医院呼吸科(何礼贤),复旦大学附属中山医院呼吸科(胡必杰),北京大学人民医院血液科(黄晓军),复旦大学附属华山医院抗生素研究所(李光辉),解放军总医院呼吸科(刘又宁),四川大学附属华西医院感染科(吕晓菊),上海交通大学医学院附属瑞金医院临床微生物科(倪语星),东南大学附属中大医院重症医学科(邱海波),天津医科大学总医院血液科(邵宗鸿),南京军区总医院呼吸科(施毅),安徽省立医院血液科(孙自敏),北京大学人民医院检验科(王辉),复旦大学附属华山医院抗生素研究所(王明贵),解放军总医院临床药理研究室(王睿),中山大学附属第一医院呼吸科(谢灿茂),中国医学科学院北京协和医院检验科(徐英春),浙江大学附属第一医院检验科(杨青),东南大学附属中大医院重症医学科(杨毅),四川省人民医院检验科(喻华),浙江大学附属邵逸夫医院感染科(俞云松),广州医学院附属第一医院呼吸科(钟南山),复旦大学附属华山医院抗生素研究所(张菁),浙江大学附属第一医院呼吸科(周建英,周华),浙江大学附属邵逸夫医院感染科(周志慧),广州医学院附属第一医院检验科(卓超),四川大学附属华西医院感染科(宗志勇)
[1]Nordmann P,MammeriH.Extended-spectrum cephalosporinases:structure,detectionand epidemiology[J].Future Microbiol,2007,2 (3):297-307.
[2]Bush K,Jacoby G A.Updated functional classification of beta-lactamases[J].Antimicrob Agents Chemother,2010,54(3): 969-976.
[3]Queenan A M,Bush K.Carbapenemases:the versatile beta-lactamases[J].Clin MicrobiolRev,2007,20(3):440-458.
[4]Berrazeg M,Diene S,Medjahed L,et al.New Delhi Metallo-beta-lactamase around the world:an eReview using Google maps [J].Euro Surveill,2014,19(20):20809.
[5]Bratu S,Landman D,Haag R,et al.Rapid spread of carbapenem-resistant Klebsiella pneumoniae in New York City:a new threat to our antibiotic armamentarium[J].Arch Intern Med,2005, 165(12):1430-1435.
[6]Wei Z Q,Du X X,Yu Y S,et al.Plasmid-mediated KPC-2 in a Klebsiella pneumoniae isolate from China[J].Antimicrob Agents Chemother,2007,51(2):763-765.
[7]Walther-Rasmussen J,Hoiby N.OXA-type carbapenemases[J].J Antimicrob Chemother,2006,57(3):373-383.
[8]Cornaglia G,Giamarellou H,Rossolini G M.Metallo-β-lactamases:a last frontier for β-lactams?[J].Lancet Infect Dis,2011, 11(5):381-393.
[9]Drawz S M,Bonomo R A.Three decades of beta-lactamase inhibitors[J].Clin MicrobiolRev,2010,23(1):160-201.
[10]胡付品,朱德妹,汪复,等.2013年中国TCHINET细菌耐药性监测[J].中国感染与化疗杂志,2014,14(5):365-374.
[11]孙宏莉,宁永忠,廖康,等.全国10所教学医院产ESBLs和质粒AmpC酶大肠埃希菌及肺炎克雷伯菌的研究[J].中国感染与化疗杂志, 2007,7(5):323-329.
[12]Xia S,Fan X,Huang Z,et al.Dominance of CTX-M-type extended-spectrum β-lactamase(ESBL)-producing escherichia coli isolated from patients with community-onset and hospital-onset infection in China[J].PLoS One,2014,9(7):e100707.
[13]周华,俞云松,周建英.多重耐药革兰阴性杆菌感染诊治专家共识解读[J].中华内科杂志,2014,53(12):984-987.
[14]Clinical and Laboratory Standards Institute.Performance standards for antimicrobial susceptibility testing:twentieth informationalsupplement M100-S19.Wayne,PA:CLSI,2010.
[15]周志慧,李兰娟,俞云松,等.阴沟肠杆菌耐药及ampC基因表达状况研究[J].中华传染病杂志,2002,20(6):337-340.
[16]Maltezou H C.Metallo-beta-lactamases in gram-negative bacteria:introducing the era of pan-resistance[J].Int J Antimicrob Agents,2009,33(5):405.e1-405.e7.
[17]陈佰义,何礼贤,胡必杰,等.中国鲍曼不动杆菌感染诊治与防控专家共识[J].中华医学杂志,2012,92(8):76-85.
[18]中华医学会呼吸病学分会感染学组.铜绿假单胞菌下呼吸道感染诊治专家共识[J].中华结核和呼吸杂志,2014,37(1):9-15.
[19]周华,李光辉,卓超,等.中国嗜麦芽窄食单胞菌感染诊治和防控专家共识[J].中华医学杂志,2013,93(16):1203-1213.
[20]周华,李光辉,陈佰义,等.产超广谱β-内酰胺酶肠杆菌科细菌感染应对策略:中国专家共识[J].中华医学杂志,2014,94(24):1847-1856.
[21]中华医学会呼吸病学分会.社区获得性肺炎诊断和治疗指南[J].中华结核和呼吸杂志,2006,29(10):651-655.
[22]MandellLA,Wunderink R G,AnzuetoA,et al.Infectious Diseases Society of America/American Thoracic Society consensus guidelines on the management of community-acquired pneumonia in adults[J].Clin Infect Dis,2007,44Suppl2:S27-72.
[23]Dellinger R P,Levy MM,Rhodes A,et al.Surviving Sepsis Campaign:internationalguidelines for management of severe sepsis and septic shock,2012[J].Intensive Care Med,2013,39(2): 165-228.
[24]尿路感染诊断与治疗中国专家共识编写组.尿路感染诊断与治疗中国专家共识(2015版)-复杂尿路感染[J].中华泌尿外科杂志,2015, 36(4):241-245.
[25]尿路感染诊断与治疗中国专家共识编写组.尿路感染诊断与治疗中国专家共识 (2015版)-尿路感染抗菌药物选择策略及特殊类型尿路感染的治疗建议[J].中华泌尿外科杂志,2015,36(4):245-249.
[26]Sartelli M,Viale P,Catena F,et al.2013 WSES guidelines for management of intra-abdominal infections[J].World J Emerg Surg,2013,8(1):3.
[27]吴涛,刘玉村.2010年版IDSA复杂腹腔感染诊治指南解读[J].中华医学信息导报,2010,25(24):14-16.
[28]中华人民共和国卫生部医政司卫生部合理用药专家委员会.国家抗微生物治疗指南.北京:人民卫生出版社,2012.
[29]中华医学会血液病学分会,中国医师协会血液科医师分会.中国中性粒细胞缺乏伴发热患者抗菌药物临床应用指南[J].中华血液病学杂志,2012,33(8):693-696.
[30]Lagacé-Wiens P R,Tailor F,Simner P,et al.Activity of NXL104 in combination with beta-lactams against genetically characterized Escherichia coliand Klebsiella pneumoniae isolates producing class Aextended-spectrum beta-lactamases and class C beta-lactamases[J].Antimicrob Agents Chemother,2011,55 (5):2434-2437.
[32]Zhanel G G,Lawson C D,Adam H,et al.Ceftazidime-avibactam:a novel cephalosporin/β-lactamase inhibitor combination [J].Drugs,2013,73(2):159-177.
[33]Lucasti C,Popescu I,Ramesh M K,et al.Comparative study of the efficacy and safety of ceftazidime/avibactam plus metronidazole versus meropenem in the treatment of complicated intra-abdominalinfections in hospitalized adults:results of a randomized,double-blind,PhaseⅡtrial[J].J Antimicrob Chemother,2013,68(5):1183-1192.
[34]Sader H S,FarrellD J,Castanheira M,et al.Antimicrobial activity ofceftolozane/tazobactam tested against Pseudomonas aeruginosa and Enterobacteriaceae with various resistance patterns isolated in European hospitals (2011-12)[J].J Antimicrob Chemother,2014,69(10):2713-2722.
[35]Farrell D J,Flamm R K,Sader H S,et al.Antimicrobial activity of ceftolozane-tazobactam tested againstEnterobacteriaceae and Pseudomonas aeruginosa with various resistance patterns isolated in U.S.Hospitals(2011-2012)[J].Antimicrob Agents Chemother,2013,57(12):6305-6310.
[36]ZhanelG G,Chung P,Adam H,et al.Ceftolozane/tazobactam:a novel cephalosporin/β-lactamase inhibitor combination with activity against multidrug-resistant gram-negative bacilli[J]. Drugs,2014,74(1):31-51.
[37]Lucasti C,Hershberger E,Miller B,et al.Multicenter,double-blind,randomized,phaseⅡtrial to assess the safety and efficacy of ceftolozane-tazobactam plus metronidazole compared with meropenem in adult patients with complicated intra-abdominalinfections[J].Antimicrob Agents Chemother,2014, 58(9):5350-5357.
(本文转载自《中华医学杂志》2015年第95卷第48期)
