miR-99a对乳腺癌细胞侵袭和迁移的负向调控机制研究
2016-12-24张玮陈罗泉叶治国王青青
张玮 陈罗泉 叶治国 王青青
●论 著
miR-99a对乳腺癌细胞侵袭和迁移的负向调控机制研究
张玮 陈罗泉 叶治国 王青青
目的 探讨miR-99a对乳腺癌细胞侵袭及迁移的影响,并初步分析其影响乳腺癌细胞侵袭及迁移的可能分子机制。方法 利用荧光实时定量PCR检测乳腺癌细胞系MDA-MB-231和MCF-7中miR-99a的表达。运用脂质体介导的转染方法分别将miR-99a模拟物(miR-99a mimics)、miR-99a抑制物(miR-99a inhibitors)以及相应对照miRNA转染MDA-MB-231和MCF-7细胞,通过Transwell侵袭实验检测细胞的侵袭力;采用Transwell迁移实验及划痕实验检测细胞的迁移能力;利用生物信息学方法预测miR-99a的靶基因,并对靶基因进行验证。结果 (1)高转移潜能的MDA-MB-231细胞中miR-99a表达明显低于低转移潜能的MCF-7细胞,划痕实验中转染miR-99a mimics的与转染control mimics的MDA-MB-231细胞比较迁移能力显著减弱(P<0.05),而MCF-7细胞转染miR-99a inhibitors后迁移能力明显增强(P<0.01)。(2)Transwell的侵袭及迁移实验显示,转染miR-99a mimics后MDA-MB-231细胞的侵袭和迁移能力明显减弱(P<0.01);MCF-7细胞转染miR-99a inhibitors后迁移能力增强(P<0.01),而侵袭能力基本不变(P>0.05)。(3)生物信息学方法预测微管相关蛋白(MTMR3)是miR-99a的靶点,实时定量PCR和3'UTR荧光素酶报告基因实验验证了该靶点。(4)干扰了MTMR3后MDA-MB-231细胞的迁移和侵袭能力明显减弱。结论 (1)miR-99a对乳腺癌细胞的侵袭及迁移发挥负向调控作用。(2)miR-99a可能通过靶向于MTMR3发挥其对乳腺癌细胞迁移和侵袭的调控作用。
乳腺癌 miR-99a 侵袭 迁移 MTMR3
乳腺癌是女性发病率最高的癌症之一,也是引起女性癌症患者死亡的第二大癌症(仅次于肺癌)[1]。肿瘤转移是引起乳腺癌患者死亡的主要原因。对乳腺癌细胞转移调控机制的深入了解可为研究抗癌策略提供新的思路。miRNA是长约22个核苷酸的非编码RNA,它通过与靶基因的3′端非翻译区(3′UTR)结合来抑制靶基因mRNA的翻译或降解靶基因的mRNA,进而调节靶基因的表达[2-4]。已有大量文献报道,多种miRNA在肿瘤的侵袭和迁移过程中发挥重要的调控作用[5-7]。miR-99a是miR-99家族中的一员,目前有研究表明miR-99a能显著抑制肺癌和口腔癌等肿瘤细胞的侵袭和迁移[8-14],但其是否也参与调控乳腺癌细胞的侵袭和迁移文献报道少见。因此,本研究通过转染miR-99a模拟物(miR-99a mimics)提高乳腺癌细胞中miR-99a的活性,转染miR-99a抑制物(miR-99a inhibitors)抑制乳腺癌细胞中miR-99a的活性,以探讨miR-99a对乳腺癌细胞侵袭及迁移能力的影响,并利用生物信息学方法预测miR-99a的靶基因并对其进行验证,初步分析miR-99a影响乳腺癌细胞侵袭及迁移能力的可能机制,现报道如下。
1 材料和方法
1.1 材料和仪器 人乳腺癌细胞系MCF-7(低转移潜能)和MDA-MB-231(高转移潜能)(美国ATCC公司),人胚肾细胞系HEK-293(中科院上海细胞所),RPMI-1640细胞培养基、FBS(美国Hyclone公司),OPTI-MEM细胞培养基(美国 Gibco公司),Invitrogen LipofectamineTM2000转染试剂(美国 Invitrogen公司),Transwell侵袭小室(美国Corning公司),基质胶(美国 BD公司),miR-99a mimics及control mimics、微管相关蛋白(MTMR3)siRNA(上海吉玛公司),DAPI染料(瑞士罗氏公司),PCR引物序列(生物工程上海股份有限公司),琼脂糖凝胶DNA回收试剂盒、质粒中量制备试剂盒(美国AxyGen公司),实时定量PCR试剂盒、限制性内切酶、T4 DNA连接酶(大连宝生物工程公司),对照质粒pRL-TK、Dual-LuciferaseR报告基因检测系统、荧光发光测定仪(美国Promega公司),微量移液器、低温台式高速离心机(德国Eppendorf公司),二氧化碳恒温细胞培养箱(美国Thermo公司),倒置显微镜(日本Olympus公司),显微图象采集系统(日本尼康公司),PCR仪、CFX-96实时定量PCR系统(美国BioRad公司)。
1.2 细胞培养和接种 MCF-7和MDA-MB-231细胞用含10%FBS的DMEM培养基置于37℃恒温、5%二氧化碳的饱和湿度培养箱中培养。转染前1d将培养好的MDA-MB-231细胞铺于6 cm培养皿中,使其汇合度在60%~70%,置于37℃恒温、5%二氧化碳的饱和湿度培养箱中培养。
1.3 转染 miR-99a mimics及对照(control mimics),miR-99a inhibitors及对照(control inhibitors),MTMR3 siRNA及对照(control siRNA)干粉离心后配制成终浓度为20μmol/L的工作液。铺板24h内进行转染,按照Invitrogen LipofectamineTM2000说明书进行转染。转染后6 h将培养液更换成正常的完全培养基,继续培养以用于后续实验。
1.4 miR-99a和MTMR3表达水平的检测 按照Takara公司实时定量PCR试剂盒的说明提取RNA,并将抽提的RNA进行逆转录,逆转录产物用于实时荧光定量PCR,分析miR-99a和MTMR3的表达,分别以U6和-actin作为内参,相关引物序列如下。miR-99a逆转录引物:5′-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACCACAAGA-3′;miR-99a上游引物:5′-GCAACCCGTAGATCCGAT-3′;miR-99a下游引物:5′-GTGCAGGGTCCGAGGT-3′;U6上游引物:5′-CTCGCTTCGGCAGCACA-3′;U6下游引物(同时作为U6逆转录引物):5′-AACGCTTCACGAATTTGCGT-3′;MTMR3上游引物:5′-CCCAATGGGGGAGACCTTTC-3′;MTMR3下游引物:5′-CAGCCTCCTCCTTTAGCTCG-3′;-actin上游引物:5′-CATGTACGTTGCTATCCAGGC-3′;-actin下游引物:5′-CTCCTTAATGTCACGCACGAT-3′。实验重复3次。
1.5 划痕实验和Transwell侵袭及迁移实验
1.5.1 划痕实验 细胞转染24h后,待细胞丰度达到90%时,用无血清DMEM培养基饥饿12h,然后每个平皿用20μl的小枪头划一条划痕,在显微镜下取划痕处几个不同视野拍照(0h),37℃恒温、5%二氧化碳培养箱中继续培养并每隔24h拍照,然后分析图片中不同视野划痕的宽度。实验重复3次。
1.5.2 Transwell侵袭及迁移实验 细胞转染24h后,用胰蛋白酶消化细胞,细胞计数5×104铺于24孔Transwell小室,每孔铺200μl细胞,然后在板孔中加入600μl完全培养基,小室中补加 200μl无血清培养基。其中侵袭实验在小室接种细胞前一晚将Matrigel(基质胶)无血清DMEM-H培养基稀释成浓度为1∶7,每个侵袭小室加60μl,而迁移实验不加基质胶。37℃恒温、5%二氧化碳培养箱中培养,侵袭实验36h后(迁移实验24h后)取出小室用DAPI染色,置于显微镜下观察并拍照,随机选取8个低倍视野(×100)进行细胞计数,并计算平均值。实验重复3次。
1.6 miR-99a靶基因预测 采用TargetScan、PicTar4和miRanda 3个数据库进行miR-99a检索,预测其靶基因。
1.6.1 靶基因载体的构建与鉴定 从TargetScan网站上获取MTMR3 mRNA 3′UTR与miR-99a结合的序列,设计目标引物序列(MTMR3),在5′端添加SpeⅠ和HindⅢ酶切位点,以便后续连接之用。具体引物序列如下(下划线为酶切位点SpeⅠ和HindⅢ):MTMR3上游引物:5′-GGACTAGTGGGAAGGTTGGAGAAGAG-3′;MTMR3下游引物:5′-CCCAAGCTTGAGTCGGAAGGCTATCTG-3′。两条寡核苷酸退火,作为与pMIR-REPORT TM luciferase质粒(pMIR-Luc,为带荧光素酶基因的载体)连接的插入片段,空载体PMIR-Luc双酶切后,与插入片段连接过夜。将重组质粒PMIR-Luc-MTMR3转化至感受态大肠杆菌DH5α进行扩增,挑选阳性单菌落过夜摇菌,提取质粒进行酶切鉴定后,由Invitrogen公司测序正确后使用。
案例1:学生到学校生物园观察植物,回到教室后遭到了教师的质问:为什么要到那儿去?教师的本意是让学生明白,我们身边到处都有可供观察的植物,但是他的质问已构成了对学生自主行为的一种干预,这或许是教师权威主义的瞬间行为。
1.6.2 质粒转染与双荧光素酶活性检测 转染前24h将2×105/ml的人胚肾细胞系HEK-293接种于96孔板,每孔加100μl无抗1640培养基,当细胞生长密度至培养板底部的75%~80%时开始转染。转染分4组(pMIR-empty+control mimics组、pMIR-empty+miR-99a mimics组、pMIR-MTMR3+control mimics组、pMIR-MTMR3+miR-99a mimics组),各组中均转入对照质粒pRL-TK。按每孔量25μl opti-MEM培养基稀释0.5μl LipofectmineTM2000脂质体,轻柔混合,室温静置5min;按每孔用量25μl opti-MEM培养基稀释0.2μg报告基因载体、0.01 μg pMIR-TK和0.375μl寡核苷酸,轻柔混合;将两者混合,室温孵育20min。每组设3个复孔,分别将50μl质粒DNA-寡核苷酸-转染试剂混合物加至96孔板中,稍微震荡混匀,4h更换1640培养基,37℃ 细胞培养箱培养24h。按照 Dual-LuciferaseR报告基因检测试剂盒说明书进行操作,在荧光发光仪上检测得到各组萤火虫荧光素酶活性值(F)和海肾荧光素酶活性值(R),以R为内参,取F/R为相对活性值进行数据统计。实验重复3次。
1.7 统计学处理 应用SPSS 17.0统计软件,计量资料以表示,两组间比较采用t检验。
2 结果
2.1 MDA-MB-231、MCF-7细胞迁移能力及miR-99a表达水平的比较 见表1。

表1 MDA-MB-231、MCF-7细胞迁移能力及miR-99a表达水平的比较
由表1可见,MDA-MB-231细胞的划痕实验伤口愈合率显著高于MCF-7细胞,而miR-99a表达水平显著低于MCF-7细胞。
2.2 转染miR-99a mimics后MDA-MB-231细胞迁移及侵袭能力的变化 见表2。

表2 转染miR-99a mimics后MDA-MB-231细胞迁移及侵袭能力的变化
由表2可见,转染miR-99a mimics后MDA-MB-231细胞的划痕实验伤口愈合率、侵袭及迁移实验中侵出小室的细胞数均显著低于转染control mimics后的MDA-MB-231细胞。划痕、侵袭和迁移实验结果的代表性照片见图1(插页)。
2.3 转染miR-99a inhibitors后MCF-7细胞迁移能力的变化 见表3。
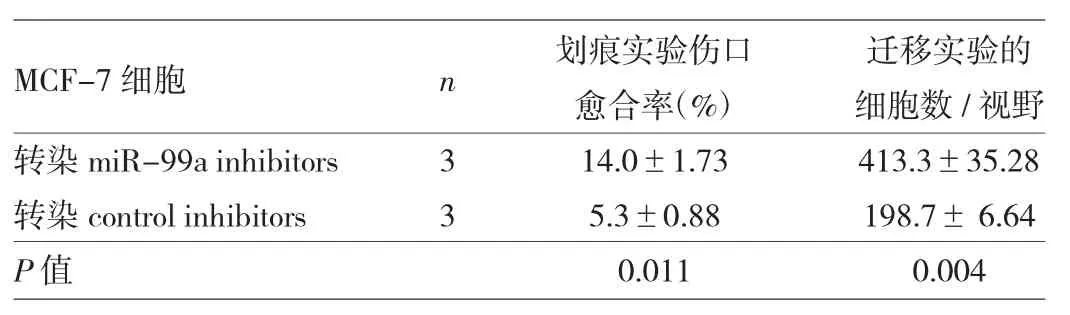
表3 转染miR-99a inhibitors后MCF-7细胞迁移能力的变化
由表3可见,转染miR-99a inhibitors后的MCF-7细胞划痕实验伤口愈合率、迁移实验中侵出小室的细胞数均显著高于转染control mimics后的MCF-7细胞,因侵袭实验中MCF-7细胞几乎没有侵袭能力,即使转染miR-99a inhibitors后侵袭能力有轻微上升,但无统计学差异(P>0.05),故本研究未显示结果。
同时,转染miR-99a mimics后的MDA-MB-231细胞的MTMR3表达水平明显低于转染control mimics后的MDA-MB-231细胞(P<0.01),见图2c。为验证MTMR3对MDA-MB-231细胞的侵袭和迁移的调控作用,利用MTMR3的siRNA敲减其在MDA-MB-231中的表达,再进行Transwell的侵袭和迁移实验,见图2d、 2e,转染MTMR3 siRNA后的MDA-MB-231的侵袭和迁移能力显著低于转染control siRNA后的MDA-MB-231细胞(均P<0.01)。

图2 MTMR3靶基因预测
3 讨论
近年来,乳腺癌的诊断和治疗取得了一定的进展,但是乳腺癌患者依然存在着转移、复发、预后不良以及死亡的风险,有一半以上的乳腺癌患者在接受化疗或者激素药物治疗以后仍会出现肿瘤转移性疾病,所以如何抑制乳腺癌转移是降低乳腺癌患者病死率的关键。miRNA是一种进化上相对保守的非编码RNA,它通过与靶基因的3′UTR结合来抑制靶基因mRNA的翻译或者降解靶基因mRNA进而调控靶基因的表达。它在细胞生长和发育的过程中起着重要的调节作用,参与生命过程中一系列的重要进程,包括发育、造血、器官形成、细胞分化、增殖、凋亡,甚至肿瘤发生[15]。已有大量文献报道多种miRNA在乳腺癌的发生和发展的不同过程中起到关键的调控作用,包括表皮细胞和间充质细胞转化,肿瘤细胞的干性以及肿瘤的侵袭和转移[16-17]。
研究表明,miR-99a在包括前列腺癌、肝癌、子宫内膜癌、肾癌、肺癌、食管癌和口腔癌等多种恶性肿瘤中表达显著下调,miR-99a可能发挥抑制肿瘤发生、发展的功能。其中Cui等[11]发现miR-99a能够引起肾癌细胞的G1期细胞周期阻滞,Chen等[12]报道miR-99a下调可促进非小细胞肺癌细胞A549和H1299细胞的增殖、侵袭和迁移,但对其机制没有深入研究。Sun等[13]发现miR-99a可以促进食管癌细胞的凋亡。
MCF-7和MDA-MB-231是常用的乳腺癌细胞系,MCF-7为低/无转移潜能细胞系,而MDA-MB-231具高转移潜能。本研究比较MDA-MB-231和MCF-7细胞中miR-99a的表达,发现MDA-MB-231细胞中miR-99a的表达显著低于MCF-7细胞。为了明确miR-99a对乳腺癌细胞侵袭和迁移的调控作用,本研究将miR-99a mimics转染至高转移性的人乳腺癌细胞MDA-MB-231中,观察其在MDA-MB-231细胞中的作用,结果发现通过转染miR-99a mimics来过表达miR-99a能够显著抑制MDA-MB-231细胞的侵袭及迁移能力。MCF-7细胞中miR-99a的表达水平显著高于MDA-MB-231细胞,将miR-99a inhibitors转染MCF-7细胞,抑制miR-99a在MCF-7细胞中的活性。划痕实验结果显示,转染 miR-99a inhibitors后的MCF-7细胞划痕愈合速度显著高于转染control mimics后的MCF-7细胞。同时Transwell迁移实验结果显示转染miR-99a inhibitors后的MCF-7细胞侵出小室的细胞数显著增多,说明敲减miR-99a后,无转移潜能的MCF-7细胞迁移能力增强。但体外Transwell的侵袭实验中MCF-7细胞几乎没有侵袭能力,即使转染miR-99a inhibitor后其侵袭能力有轻微上升,但没有统计学差异,说明单独miR-99a的降低并不足以使其获得侵袭能力,可能miR-99a在调控细胞迁移过程中发挥更重要的作用。MDA-MB-231和MCF7两株乳腺癌细胞本身就存在着很多基因和蛋白表达的不同,包括前者为ER-PR-,后者则为ER+PR-[18],这些复杂的因素共同决定着肿瘤细胞的侵袭和转移,以及对治疗的敏感性,而在体内,肿瘤生长的微环境更是通过各个层次对其转移发挥着重要的调控作用[19],因此还需要更深入细致的实验来进一步揭示miRNA在其中发挥的调控作用。
本研究采用TargetScan、PicTar4和miRanda 3个数据库进行miR-99a靶基因的预测,发现MTMR3可能是与细胞侵袭、迁移相关的蛋白,是miR-99a的可能靶基因。最近有报道MTMR3可以通过活化Rac-1促进肿瘤细胞的迁移和侵袭[20]。本研究亦发现过表达miR-99a后能够在mRNA水平上明显抑制MTMR3的表达。接着本研究又通过miR-99a mimics与MTMR3-3′UTR报告基因质粒共转染后荧光素酶相对活性检测实验,发现pMIR-MTMR3+miR-99a mimics组的荧光素酶相对活性减弱,表明MTMR3确实是miR-99a的靶基因。Kuo等[14]的研究发现miR-99a能够在口腔癌细胞中通过靶向MTMR3来抑制肿瘤细胞的侵袭和迁移,但是miR-99a是否也是通过靶向于MTMR3来调控乳腺癌细胞MDA-MB-231的侵袭和迁移能力?本研究用siRNA敲低MTMR3在MDA-MB-231中的表达后,MDA-MB-231的侵袭和迁移能力显著减弱。
综上所述,本研究通过划痕实验和Transwell实验,初步证实了miR-99a能够抑制乳腺癌细胞的侵袭和迁移,同时通过生物信息学方法预测MTMR3是miR-99a的靶点,并通过实时定量PCR和报告基因实验验证了靶点,表明miR-99a可能通过靶向于MTMR3发挥对乳腺癌细胞迁移和侵袭的负向调控作用。上述结果为揭示乳腺癌转移的机制以及研发抑制转移的策略提供了新的思路,但是miR-99a是否确实通过靶向于MTMR3来调控乳腺癌的转移能力,还需要在动物体内进一步的验证。
[1] DeSantis C,Ma J,Bryan L,et al.Breast cancer statistics,2013[J]. CACancer J Clin,2014,64(1):52-62.
[2] Bartel D P.MicroRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):281-297.
[3] BartelD P.MicroRNAs:target recognition and regulatory functions [J].Cell,2009,136(2):215-233.
[4] Huang Y,Shen X J,Zou Q,et al.Biological functions of microRNAs:a review[J].J PhysiolBiochem,2011,67(1):129-139.
[5] Tavazoie S F,Alarcn C,Oskarsson T,et al.Endogenous human microRNAs that suppress breast cancer metastasis[J].Nature, 2008,451(7175):147-152.
[6] Gregory P A,Bert A G,Paterson E L,et al.The miR-200 family and miR-205 regulate epithelialtomesenchymaltransition by targeting ZEB1 and SIP1[J].Nat CellBiol,2008,10(5):593-601.
[7] Valastyan S,Reinhardt F,Benaich N,et al.A pleiotropically acting microRNA,miR-31,inhibits breastcancermetastasis[J].Cell,2009, 137(6):1032-1046.
[8] Sun D D,Lee YS,Malhotra A,et al.miR-99 family of MicroRNAs suppresses the expression of prostate-specific antigen and prostate cancer cellproliferation[J].CancerRes,2011,71(4):1313-1324.
[9] LiD,Liu X,Lin L,et al.MicroRNA-99a inhibits hepatocellular carcinoma growth and correlates with prognosis of patients with hepatocellular carcinoma[J].J Biol Chem,2011,286(42):36677-36685.
[10] Torres A,Torres K,Pesci A,et al.Deregulation of miR-100, miR-99a and miR-199b in tissues and plasma coexists with increased expression of mTOR kinase in endometrioid endometrialcarcinoma[J].BMC Cancer,2012,12:369.
[11] Cui L,Zhou H,Zhao H,et al.MicroRNA-99a induces G1-phase cellcycle arrest and suppresses tumorigenicity in renalcellcarcinoma[J].BMC Cancer,2012,12:546.
[12] Chen C J,Zhao Z Y,Liu Y,et al.microRNA-99a is downregulated and promotes proliferation,migration and invasion in nonsmallcelllung cancer A549 and H1299 cells[J].OncolLett,2015, 9(3):1128-1134.
[13] Sun J,Chen Z,Tan X,et al.MicroRNA-99a/100 promotes apoptosis by targeting mTOR in human esophageal squamous cell carcinoma[J].Med Oncol,2013,30(1):411.
[14] Kuo Y Z,Tai Y H,Lo H I,et al.MiR-99a exerts anti-metastasis through inhibiting myotubularin-related protein 3 expression in oralcancer[J].OralDis,2014,20(3):e65-75.
[15] He L,Hannon G J.MicroRNAs:small RNAs with a big role in gene regulation[J].Nat Rev Genet,2004,5(7):522-531.
[16] Bockhorn J,Dalton R,Nwachukwu C,et al.MicroRNA-30c inhibits human breast tumour chemotherapy resistance by regulating TWF1 and IL-11[J].Nat.Commun,2013,4:1393.
[17] Shimono Y,Zabala M,Cho R W,et al.Downregulation of miRNA-200c links breast cancer stem cells with normal stem cells [J].Cell,2009,1138(3):592-603.
[18] Holliday D L,Speirs V.Choosing the right cellline for breast cancer research[J].Breast Cancer Res,2011,13(4):215.
[19] Joyce J A,Fearon D T.T cell exclusion,immune privilege,and the tumor microenvironment[J].Science,2015,348(6230):74-80.
[20] Oppelt A,Haugsten E M,Zech T,et al.PIKfyve,MTMR3 and their product PtdIns5P regulate cancer cell migration and invasion through activation ofRac1[J].Biochem J,2014,461(3):383-90.
Inhibitory effects of miR-99a on invasion and migration of human breast cancer cells
ZHANG Wei,CHEN Luoquan,YE Zhiguo,et al.Department of Oncology,Hangzhou First People's Hospital,Hangzhou 310006,China
Objective To investigate the effect ofmiR-99a on invasion and migration potentialofhuman breast cancer cells and its possible mechanism. Methods The expression level of miR-99a was detected in human breast cancer cell lines MDA-MB-231 and MCF-7 by qRT-PCR.Human breast cancer MDA-MB-231 cells were transfected with miR-99a mimics and controlmimics by Lipofectamine.Cellinvasion potentialwas evaluated by Transwellinvasion assay;cellmigration was detected by Transwellmigration assay and wound healing assay.The possible targetgenes ofmiR-99a were forecasted by bioinformatics tools and the reliability of these genes was analyzed. Results Remarkable inhibition of cell migration was detected in MDA-MB-231 cells transfected with miR-99a mimics by wound healing and Transwellmigration assay,compared to cells transfected with control mimics.MCF-7 cells transfected with miR-99a inhibitors showed increased migration,compared to cells transfected with control inhibitors.Transfection of miR-99a mimics into MDA-MB-231 cells led to a significant decrease in cell invasion as detected by Transwell invasion assay.Myotubularin related protein 3 (MTMR3)was forecasted by bioinformatics tools as a target of miR-99a, which was verified by RT-qPCR and 3'UTR luciferase reporter assays.Knock down of MTMR3 in MDA-MB-231cells inhibited cell migration and invasion.Conclusion miR-99a negatively may regulate the invasion and migration potentialofhuman breast cancer cells through targeting MTMR3.
Breast cancermiR-99a Invasion Migration MTMR3
2015-08-17)
(本文编辑:李媚)
国家自然科学基金资助项目(81373115)
310006 杭州市第一人民医院,杭州市肿瘤医院(张玮);浙江大学免疫学研究所(陈罗泉、叶治国、王青青)
王青青,E-mail:wqq@zju.edu.cn
