大黄素联合5AzA-cdR对胰腺癌抑癌基因p16、RASSF1A去甲基化作用研究
2016-12-24潘烽平徐鹿平陆松春陈自强唐坚褚永权陈亮
潘烽平 徐鹿平 陆松春 陈自强 唐坚 褚永权 陈亮
大黄素联合5AzA-cdR对胰腺癌抑癌基因p16、RASSF1A去甲基化作用研究
潘烽平 徐鹿平 陆松春 陈自强 唐坚 褚永权 陈亮
目的 研究大黄素是否可增强5AzA-cdR对胰腺癌Panc1细胞抑癌基因p16、RASSF1A的去甲基化作用。方法采用细胞增殖实验检测不同浓度大黄素对Panc1细胞的生长抑制情况,焦磷酸盐测序PCR(BSP)分别检测大黄素、5AzA-cdR及大黄素联合5AzA-cdR对Panc1细胞抑癌基因p16、RASSF1A甲基化状态的影响,并用荧光定量PCR(FQ-PCR)和Western blot分别检测p16、RASSF1A及甲基转移酶DNMT1、DNMT3a在mRNA和蛋白水平的表达情况。结果 大黄素以时间和浓度梯度依赖性抑制Panc1细胞生长。BSP结果显示大黄素具有微弱的去甲基化作用,5AzA-cdR具有一定程度的去甲基化作用,当两者联用时,去甲基化作用更加显著;FQ-PCR和Western blot结果显示大黄素与5AzA-cdR联用时,p16、RASSF1A的表达水平均较空白对照明显增高(均P<0.05),DNMT1、DNMT3a的表达水平均较空白对照明显降低(均P<0.05)。结论 大黄素与5AzA-cdR联用可通过降低DNMT1和DNMT3a的表达水平来增强5AzA-cdR对胰腺癌抑癌基因p16、RASSF1A的去甲基化作用。
大黄素 胰腺癌 去甲基化 5AzA-cdR
胰腺癌是具有高度侵袭性的恶性肿瘤,手术切除和化疗是治疗的常用方法。然而由于胰腺只有20%的肿瘤在诊断时是可切除的,30%~40%的肿瘤虽局限于胰腺区域却不可切除[1],因此提高化疗疗效也是目前临床努力的方向。基因异常甲基化是肿瘤发病的重要原因之一,抑癌基因的高甲基化可引发转录抑制甚至丧失,癌基因低甲基化可使其异常活跃,表达失控,从而导致细胞异常分化和增殖,发生癌变[2]。胰腺癌的发生也涉及到多基因的异常甲基化。现已知,抑癌基因p16、RASSF1A高甲基化可能是胰腺癌发生的重要原因,这为临床研究去甲基化药物抗肿瘤治疗提供理论基础。5AzA-cdR是目前公认的具有去甲基化作用的药物,但其毒副反应大,骨髓抑制明显,临床应用受限;大黄素是具有免疫调节、抗肿瘤等作用的植物型药物。那么大黄素与5AzA-cdR联用是否可增强5AzA-cdR对胰腺癌抑癌基因p16、RASSF1A的去甲基化作用?对此,笔者在实验室进行了研究,以期为胰腺癌临床化疗提供参考,现报道如下。
1 材料和方法
1.1 材料 大黄素(纯度≥98%)、5AzA-cdR均购于美国Sigma公司,CCK-8试剂盒购于美国GIBCO公司,细胞/组织基因组DNA提取试剂盒(离心株型)购于上海捷瑞生物工程有限公司,EpiTectRBisulfite Kit修饰试剂盒、Anti-RASSF1a抗体、p16/INK4a抗体购于美国EPITOMICS公司。
1.2 方法
1.2.1 细胞系培养 将人胰腺癌细胞株Panc1细胞培养于含10%FBS、100U/ml青霉素、100μg/ml链霉素的DMEM培养液中,37℃、饱和湿度、5%二氧化碳条件下培养,每2~4 d更换培养基1次,细胞生长至70%~80%时传代培养,取对数生长期细胞进行实验。
1.2.2 细胞增殖实验 取对数生长期的Panc1细胞按每孔5×103个/100μl细胞接种于96孔板,培养箱培养24h后,分别用0(空白对照)、10、20、40、80μmol/L浓度的大黄素处理细胞,分别作用24、48、72 h,每一浓度同时设5个副孔。细胞培养结束后,每孔加入10μl的CCK-8继续培养1~2h,分别用酶标仪检测每孔在450 nm波长下的吸光度值(OD值)。实验重复3次,计算细胞生长抑制率 [细胞生长抑制率=(1-各浓度大黄素OD值/空白对照OD值)×100%]。实验发现经40μmol/L大黄素处理72h后的Panc1细胞呈现接近50%的生长抑制率,故得出最适大黄素浓度为40μmol/L。
1.2.3 实验分组及用药 将上述增殖培养的Panc1细胞分设空白对照组(只含0.1%的DMSO)、大黄素组(含大黄素40μmol/L)、5AzA-cdR组(含5AzA-cdR 1μmol/ L)、大黄素联合5AzA-cdR组(含大黄素40μmol/L+ 5AzA-cdR 1μmol/L),继续培养72h后进行下述检测。
1.2.4 焦磷酸盐测序PCR(BSP) 按照细胞/组织基因组DNA提取试剂盒说明书的方法分别提取各组细胞的DNA,取1μg的DNA用于亚硫酸盐修饰,修饰过程按照EpiTectRBisulfite Kit修饰试剂盒说明书进行。反应引物序列、产物大小及退火温度见表1。25μl反应体系包括模板DNA 4μl,2×Taq PCR MasterMix 12.5μl,引物各1.5μl,DEPC-H2O 5.5μl。反应条件为95℃5min,94℃30s,退火温度见表1所示,45s,72℃45s,共40个循环,最后72℃10min,10℃10min。反应结束后,取10μl PCR产物经2%琼脂糖凝胶电泳45min,电泳结束后紫外线拍照,验证反应产物后将其送往上海迈普生物技术有限公司回收、克隆,随机挑取10个克隆测序,BiQ Analyzer软件分析样品的甲基化情况。
1.2.5 荧光定量PCR(FQ-PCR) 用TRIzol一步法分别提取各组细胞总的RNA。按RNA逆转录试剂盒说明书行逆转录,合成cDNA。按照SYRB Green5μl、上游下游引物(引物序列见表1所示)各1μl、cDNA1μl,用荧光PCR水补足配成10μl的反应体系,上机余下扩增45个循环。实验重复3次,应用LightCycler 480软件分析。

表1 反应引物序列、产物大小及退火温度
1.2.6 Western blot 使用RIPA裂解液分别提取各组细胞蛋白,按照BCA试剂盒说明书测定蛋白浓度后,经8%~10%聚丙烯酰胺凝胶电泳,切取不同的目的片段,经转膜后用5%脱脂牛奶封闭2h,洗膜后分别4℃孵育于不同浓度不同种类的一抗中过夜,洗膜后对应孵上不同种属的辣根酶标记山羊二抗90min,之后在发光液机器中曝光。以GAPDH为内参,目的蛋白的灰度值与GAPDH的灰度值比为参考来衡量蛋白的表达差异,实验重复3次。
1.3 统计学处理 应用SPSS 17.0统计软件,计量资料以表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。
2 结果
2.1 不同浓度大黄素对Panc1细胞生长抑制率的比较 见图1。

图1 不同浓度大黄素对Panc1细胞生长抑制率的比较
由图1可见,大黄素以时间和浓度梯度依赖性抑制Panc1细胞的生长,40μmol/L的大黄素作用Panc1细胞72h后,生长抑制率为50.6%,接近半数抑制率。
2.2 4组Panc1细胞抑癌基因p16、RASSF1A甲基化的比较 见图2。

图2 4组Panc1细胞抑癌基因p16、RASSF1A甲基化的比较(0:空白对照组;E:大黄素组;A:5AzA-cdR组;E+A:大黄素联合5AzA-cdR组;灰色代表甲基化,黑色代表非甲基化)
由图2可见,p16包含17个CpG岛,空白对照组、大黄素组、5AzA-cdR组及大黄素联合5AzA-cdR组甲基化率分别为80.0%、66.5%、51.8%、30.0%;RASSF1A包含36个CpG岛,各组甲基化率分别为85.0%、72.7%、60.3%、43.6%。大黄素组、5AzA-cdR组及大黄素联合5AzA-cdR组与空白对照组比较,p16、RASSF1A甲基化水平均下降,5AzA-cdR组及大黄素联合5AzA-cdR组下降最明显。
2.3 4组Panc1细胞p16、RASSF1A、DNA甲基转移酶(DNMT)mRNA及蛋白表达水平的比较 见表2、图3。

表2 4组Panc1细胞p16、RASSF1A、DNMT mRNA表达水平的比较
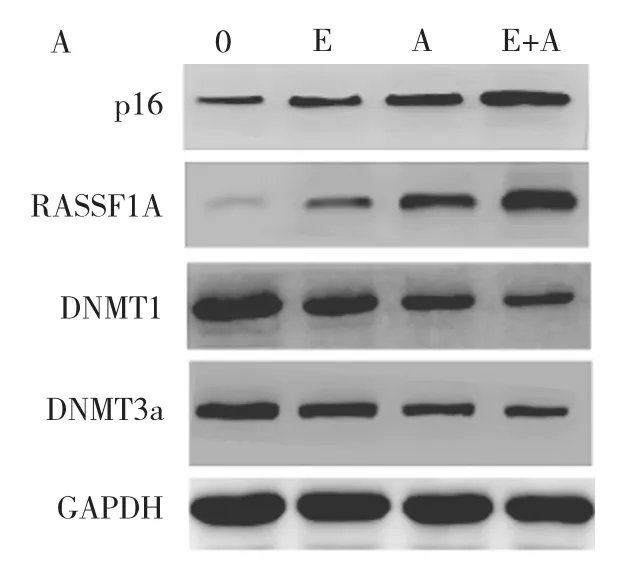
图3 4组Panc1细胞p16、RASSF1A、DNMT蛋白表达水平的比较(0:空白对照组;E:大黄素组;A:5AzA-cdR组;E+A:大黄素联合5AzA-cdR组)
由表2、图3可见,4组比较,大黄素组、5AzA-cdR组及大黄素联合 5AzA-cdR组 Panc1细胞 p16、RASSF1A mRNA及蛋白表达水平均较空白对照组增高(P<0.05);组间两两比较,大黄素联合5AzA-cdR组增高最明显(均P<0.05)。4组比较,大黄素组、5AzA-cdR组及大黄素联合5AzA-cdR组Panc1细胞DNMT1、DNMT3a mRNA及蛋白表达水平均较空白对照组下降(P<0.05);组间两两比较,大黄素联合5AzA-cdR组下降最明显(均P<0.05)。
3 讨论
表观遗传学改变是在基因的DNA序列未发生改变的情况下,基因表型发生可遗传性变化,DNA甲基化是重要的基因表观修饰方式之一。DNMT主要有DNMT1、DNMT3a、DNMT3b 3种,DNMT1对新和成的DNA单链行甲基化修饰,将甲基化信息传递给子代细胞,DNMT3a、DNMT3b是胚胎发育过程中建立起DNA甲基化模式的甲基转移酶,它们参与甲基化的从头和成[3]。DNMT在肿瘤中表达增强,导致抑癌基因高甲基化并失活,最终促进肿瘤发生[4]。在肿瘤基因组中,基因启动子CpG岛去甲基化可促进抑癌基因的表达,因此极有可能成为胰腺癌基因治疗的新靶点。
p16基因在细胞周期的调控中起着重要作用。Peng等[5]认为胰腺癌患者中p16基因和APC基因甲基化程度最高。杨卫华等[6]对46例人类胰腺癌和癌旁组织中p16基因表达及其甲基化的水平进行分析,胰腺癌中p16蛋白表达率为41.3%(19/46),而癌旁组织表达率为95.7%(44/46),两者比较差异有统计学意义(P<0.01)。RASSF1A编码的蛋白主要作用于Ras蛋白相关的细胞信号转导途径,能与ras蛋白结合诱导细胞凋亡,抑制细胞恶性转化。Shimizu等[7]报道,在胰腺癌仓鼠的瘤组织中,RASSF1A表达明显少于正常组织。Dammann等[8]对57例胰腺肿瘤进行检测,发现64%原发性胰腺癌、83%胰腺内分泌瘤细胞株RASSF1A启动子高甲基化。
目前最常用于去甲基化的药物主要有azacytidine和decitabine两种核苷类似物[9],但是其毒副反应大,最明显的是药物毒性和骨髓抑制,限制了其在临床上的应用。因此寻找具有特异性好、安全性高、毒副反应小的具有去甲基化作用的药物迫在眉睫。大黄素药理作用十分广泛,具有免疫调节、抗炎、抗肿瘤等方面的作用。据本课题组之前相关报道可知,大黄素、5AzA-cdR对胰腺癌Panc1细胞具有一定程度的去甲基化作用,且大黄素去甲基化强度弱于5AzA-cdR[10]。基于此,本课题组大胆猜测若将大黄素、5AzA-cdR联合作用于胰腺癌细胞,其去甲基化作用可能会比两者单独作用要强,这也符合目前临床上治疗肿瘤多药联合的原则。
本研究细胞增殖实验证实大黄素以时间和浓度梯度抑制胰腺癌细胞的生长;BSP显示,与空白对照组比较,大黄素组、5AzA-cdR组以及大黄素联合5AzA-cdR组分别作用于Panc1细胞72h后,大黄素联合5AzA-cdR可以明显的对p16、RASSF1A发挥一定程度的去甲基化作用,且联合用药强于单一用药。甲基化常引起抑癌基因的失表达,并且其表达量与CpG岛甲基化率成反比,低水平的甲基化导致67%~90%抑癌基因失表达,而CpG岛高甲基化率引起抑癌基因的完全失表达[11]。FQ-PCR与Western blot结果更进一步的证明大黄素联合5AzA-cdR用药可以增强5AzA-cdR对p16、RASSF1A的去甲基化作用。在生物体内,催化甲基化反应的主要是DNMT1、DNMT3a,使抑癌基因发生去甲基化的途径主要是抑制DNMT的活性和减少DNMT的表达两种方式。本研究结果表明大黄素联合5AzA-cdR可以明显减少DNMT1和DNMT3a的表达,可推测大黄素联合5AzA-cdR用药可以通过减少DNMT1和DNMT3a的表达来增强5AzA-cdR对p16、RASSF1A的去甲基化作用,其是否可以抑制DNMT的活性,还有待于后续研究。
综上所述,本研究BSP证实大黄素联合5AzA-cdR可以对p16、RASSF1A发挥明显的去甲基化作用,且作用要强于两药的单一用药;FQ-PCR以及Western blot结果进一步说明大黄素增强5AzA-cdR去甲基化作用可能是通过抑制DNMT的表达来实现,这可为临床上治疗胰腺癌提供理论参考。
[1] Saif M W.Pancreatic neoplasin in 2011:an update[J].JOP,201l,12 (4):316-321.
[2] Miranda T B,Jones P A.DNA methylation:the nuts and bolts of repression[J].J CellPhysiol,2009,213(2):384-390.
[3] Bestor TH.The DNA methyltransferases of mammals[J].Hum Mol, 2000,9(2):2395-2402.
[4] Baylin S B,Herman J G.DNA hypermethylation in tumorigenesis: epigenetics joins genetics[J].Trends Genet,2000,16(4):168-174.
[5] Peng D F,Kanai Y,Sawada M,et al.DNA methylation of multiple tumor-related genes in association with overexpression of DNA methyltransferase l(DNMT1)during multistage carcinogenesis of the pancreas[J].Carcinogenesis,2014,27(4):1160-1168.
[6] 杨卫华,王春友,朱求实,等.胰腺癌中p16基因甲基化改变及其蛋白表达分析[J].中国普通外科杂志,2007,16(5):446-450.
[7] Shimizu K,Itsuzaki Y,Fujii H,et al.Reduced expression of the Rassfla gene and its aberant DNA methylation in pancreatic duct adenoeareinomas induced by N-nitrosobis(2-oxopropy1)amine in hamsters[J].MolCarcinog,2008,47(2):80-87.
[8] Dammann R,Schaqdarsurenqin U,Liu L,et al.Frequent RASSF1A promoter hypermethylation and K-ras mutations in pancreatic carcinoma[J].Oncogene,2003,22(3):3806-3812.
[9] Brueckner B,Kuck D,Lyko F.DNAmethyltransferase inhibitors for cancer therapy[J].Cancer J,2013,13(4):17-22.
[10] Zhang H,Chen L,Bu H Q,et al.Effects of emodin on the demethylation of tumor-suppressor genes in pancreatic cancer PANC-1 cells[J].OncolRep,2015,33(6):3015-3023.
[11] Tahiliani,Koh KP,Shen,et al.Conversion of 5-methylcytosine to 5-hydroxymethylcytosine in mammalian DNA by MLL partner TET1[J].Science,2009,324(3):930-935.
Emodin enhances 5AzA-cdR-induced demethylation of P16 and RASSF1A genes in pancreatic cancer cells
PAN Fengping,XU Luping,LU Songchun,et al.Department of General Surgery,Jiaxing First Municipal Hospital,Jiaxing 314000,China
Objective To investigate the effects of emodin on 5AzA-cdR-induced demethylation of tumor suppressor genes P16 and RASSF1A in pancreatic cancer cells. Methods Cultured pancreatic cancer Panc1 cells were treated with emodin,5AzA-cdR or emodin plus 5AzA-cdR,respectively.Cell proliferation was determined by CCK-8 kit;methylation of p16 and RASSF1A genes in Panc1 cells was detected by BSP method.The mRNA and protein expressions of p16,RASSF1A and methyltransferase DNMT1 and DNMT3a in Panc1 cells were examined by FQ-PCR and Western blot,respectively. Results Emodin inhibited the growth of pancreatic cancer Panc1 cells in a dose-and time-dependent manner.BSP results showed that the demethylation effect of emodin was weak,5AzA-cdR had a moderate effect on demethylation,while the demethylation of emodin combined with 5AzA-cdR was more significant.FQ-PCR and WB confirmed that the expression of P16 and RASSF1A increased(P<0.05)and the expression of DNMT1 and DNMT3a decrease in combination group compared to control group(P<0.05).Conclusion Emodin combined with 5AzA-cdR can enhance the 5AzA-cdR-induced demethylation of P16 and RASSF1A genes in pancreatic cancer cells though down-regulating the expression of methyltransferase DNMT1 and DNMT3a.
Emodin Pancreatic cancerDemethylation 5AzA-cdR
2015-09-09)
(本文编辑:李媚)
浙江省医药卫生科技计划项目(2016KYB286)
314000 嘉兴市第一医院普外科(嘉兴市医学重点学科)
陈亮,E-mail:542393023@qq.com
