喉癌干细胞的培养及其放射抗拒相关miRNA的筛选研究
2016-12-24段广亮戴辉萍唐婷婷丁飞朱桂婷
段广亮 戴辉萍 唐婷婷 丁飞 朱桂婷
喉癌干细胞的培养及其放射抗拒相关miRNA的筛选研究
段广亮 戴辉萍 唐婷婷 丁飞 朱桂婷
目的 通过培养Hep-2喉癌细胞株,分离并扩增出肿瘤干细胞,放疗后筛选出调控放射抗拒的miRNA。方法 含生长因子的无血清培养基培养Hep-2喉癌细胞株,流式细胞仪检测细胞中侧群细胞的比例。当侧群细胞比例达25%时,收集全部细胞球,筛选出CD133+、CD44+细胞作为喉癌干细胞,X线照射喉癌干细胞。miRNA生物芯片检测照射与未照射的喉癌干细胞,筛选出喉癌干细胞中2倍差异表达的miRNA,确定用以调控放射抗拒的miRNA。结果 成功培养出侧群细胞,流式细胞仪检测其比例达到26.2%,筛选出的CD133+、CD44+细胞的比例均高于91%。通过miRNA芯片成功检测出喉癌干细胞中2倍差异表达的miRNA。结论 本研究成功培养出喉癌干细胞,成功筛选出喉癌干细胞中2倍差异表达的miRNA,发现了可能用以调控放射抗拒的miRNA。
无血清培养基 miRNA 侧群细胞 放疗
肿瘤干细胞是肿瘤组织中少数具有自我更新、无限增殖及多向分化潜能的细胞,且具有放射抵抗能力,因此肿瘤干细胞被认为是肿瘤发生、发展和放射抵抗的根源。侧群细胞和CD133+、CD44+肿瘤细胞是较为认可的头颈部鳞状细胞癌(HNSCC)的标志干细胞[1]。miRNA是目前肿瘤细胞内已知的一类最重要的基因调控分子,特异性miRNA对肿瘤干细胞的细胞特性起独特而重要的调控作用[2-6],包括对辐射耐受基因的调控作用。放射特异miRNA对肿瘤干细胞放射抗拒相关基因发挥着重要的调控作用[7-9]。放疗是治疗喉癌的重要方法,但喉癌细胞的放射抗拒仍是目前严重干扰疗效的难题。本研究通过模拟放疗照射喉癌干细胞,比较照射与未照射的喉癌干细胞的基因检测结果,筛选出喉癌干细胞中2倍差异表达的miRNA,结合miRNA靶基因预测数据库miGEN结果,确定拟调控的放射抗拒相关基因及miRNA,现报道如下。
1 材料和方法
1.1 材料 Anti-CD44-FITC、Anti-CD133-PE(美国e-Bioscience公司),miRNA分离试剂盒 (美国Ambion公司),miRNA芯片(丹麦Exiqon公司),重组表皮生长因子(EGF)、成纤维生长因子(bFGF)(美国PeproTech公司),流式细胞仪(美国BD公司)
1.2 方法
1.2.1 干细胞微球体分离培养 将Hep-2喉癌细胞株接种于含血清培养基中培养传代。待细胞生长至80%瓶底面积时,用PBS液清洗,质量浓度为2.5g/L的胰蛋白酶消化,吸管反复吹打制成单细胞悬液。离心除去终止消化时残留的含血清培养基后重悬于无血清培养基中,无血清培养基为在DMEM/F12培养基中添加EGF(20μg/L)和bFGF(10μg/L)、L-谷氨酰胺(2mmol/ L)、胰岛素(4U/L)、青霉素G(1×105U/L)、链霉素(100mg/L)。台盼蓝染色、计数重悬成103/ml单细胞悬液,接种于培养瓶,在37℃、5%二氧化碳、饱和湿度培养箱中培养,培养瓶直立、每日摇数次以利细胞悬浮生长,观察微球形成,每2d在每个培养瓶中加入2ml新鲜无血清培养基,每6d传代。喉癌细胞增殖形成细胞球4d后,Accutase消化、吹打成单细胞,洗涤后在SFM中传代培养,以扩增和富集喉癌干细胞,按1∶4的比例传代。
1.2.2 侧群细胞检测 选择对数生长期细胞,细胞计数,调节细胞悬液密度至1×109/L。准备2支无菌干燥标准流式上样管(5ml规格,聚丙烯材料),2管中分别加入上述细胞悬液1ml,再加入Hoechst33342溶液至终浓度为5mg/L(Hoechst33342组),同时在其中1支上样管中加入维拉帕米溶液至终浓度50mg/L(Hoechst33342+维拉帕米组)。吹打均匀后 37℃恒温水浴箱作用120min,期间每15min柔和晃动上样管1次,混匀溶液使细胞充分染色。染色完成后4℃1 000r/min离心10min,弃上清液,加入4℃PBS吹洗1次,4℃1 000r/ min离心 10min,小心抽弃上清液,重悬于4℃含体积分数为2%FBS的PBS中。置于4℃环境中待上流式细胞仪检测。
1.2.3 喉癌干细胞的筛选 当侧群细胞比例达25%时,收集全部生长细胞球,制成单细胞PBS悬液100μl,计数细胞密度为1×107/ml。用台盼蓝染色计活细胞数,要求活细胞数>90%~95%。加入Anti-CD44-FITC和Anti-CD133-PE各5μl,4℃避光孵育30min。离心去上清液,PBS洗涤至少3次,1 500r/min,离心3min,200目细胞网筛过滤。加300μl PBS(pH=7.4),上流式细胞仪检测。
1.2.4 喉癌干细胞的放射处理 采用模拟临床非致死剂量对肿瘤干细胞进行放射处理:喉癌干细胞SFM悬液,调整细胞至1×106/ml,接种于6孔培养板中。短期培养后,直线加速器对培养的细胞进行照射,条件为6MV X线垂直照射,剂量率为2Gy/min,照射时于培养板底部加入1.5cm组织等效填充物,源皮距100cm。照射5Gy/次,共3次,照射间隔72h。
1.2.5 差异miRNA的筛选 miRNA分离试剂盒富集和纯化miRNA:总RNA和5倍体积的裂解/结合缓冲液相混合,加入1/10体积的miRNA匀浆添加剂,冰上孵育,加入1/3体积的无水乙醇,混匀后通过滤管。收集液体加入2/3体积的无水乙醇,混匀后95℃预热后二次过滤。用牛肠碱性磷酸酯酶制备标记反应物,用T4连接酶荧光标记miRNA并过柱纯化。在荧光miRNA样本中加入10×GE阻断剂和2×HiRPM杂交缓冲液,并用杂交仪及其旋转烘箱进行miRNA芯片杂交。结束后分别将芯片在GE缓冲液中清洗,Agilent芯片扫描仪扫描读取杂交信号,挑选2倍差异表达miRNA并分析结果。
2 结果
2.1 喉癌干细胞的诱导和富集 Hep-2喉癌细胞株接种后2~3h开始大部分细胞贴壁,第3~7天部分细胞开始悬浮并增生形成松散的串珠状,另一部分细胞凋亡崩解,不能在无血清培养基中存活生长。第9天时,串珠状细胞团分解、凋亡,但仍可见小部分细胞持续扩增形成细胞球,轻轻摇晃培养瓶可见不多的细胞球沉于培养瓶底部。球内细胞折光性较好,连接紧密,不能准确区分细胞与细胞间的界限。新形成的肿瘤干细胞球不甚规则,新生单个细胞常以“出芽”的方式连接在球体上。Accutase消化、吹打成单细胞悬液后第l~2天单个细胞间相互聚集连接成“树枝状”悬浮于SFM中,第3~4天形成不规则细胞球,第5~6天逐渐形成规则球形。随着传代次数的增加,球体趋于圆形。见图1。

图1 无血清培养基培养喉癌细胞形成的细胞球(×200)
2.2 侧群细胞的分选 Hoechst33342组侧群细胞能排出荧光染料Hoechst33342而呈弱染色状态,位于细胞流式图的左下角荧光弱染区域。Hoechst33342+维拉帕米组中加维拉帕米,抑制了细胞转运蛋白的功能,改变了侧群细胞外排荧光染料的特性,使侧群细胞的比例减少到(0.0±0.0)%,经多次扩增和富集后成功使侧群细胞达到26.2%。见图2。
2.3 喉癌干细胞的筛选 采用无血清培养基培养细胞微球体,富集喉癌干细胞。流式细胞仪分别筛选出CD133+、CD44+喉癌干细胞。分选前喉癌细胞CD133+、CD44+的表达率均低于为3%,分选后均高于91%,分选后喉癌细胞HE染色可见细胞分布均匀,体积较大,呈梭形,细胞核与细胞质的比例接近于1∶1,核大浓染,核仁大而突出,有病理性核分裂相,符合恶性肿瘤干细胞病理特点。见图3、4。
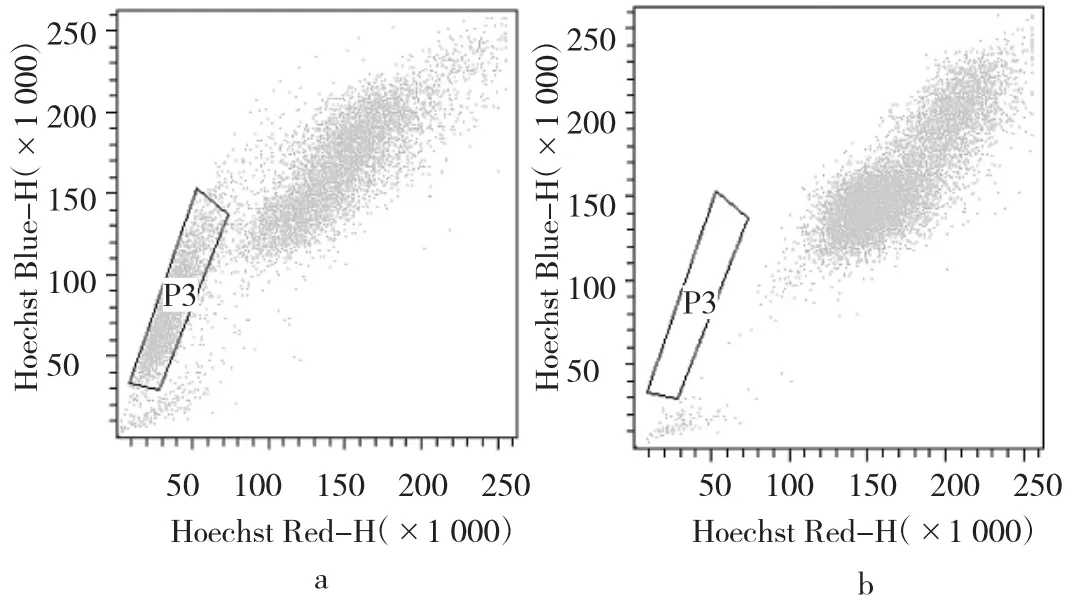
图2 侧群细胞流式检测图(a:Hoechst33342组;b:Hoechst33342+维拉帕米组)
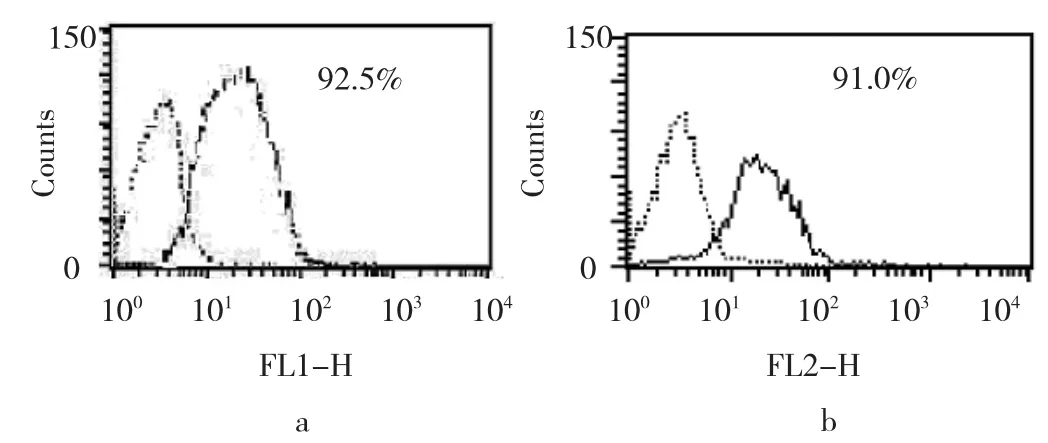
图3 流式细胞仪筛选实体瘤来源的喉癌干细胞结果(a:CD44+细胞;b:CD133+细胞)
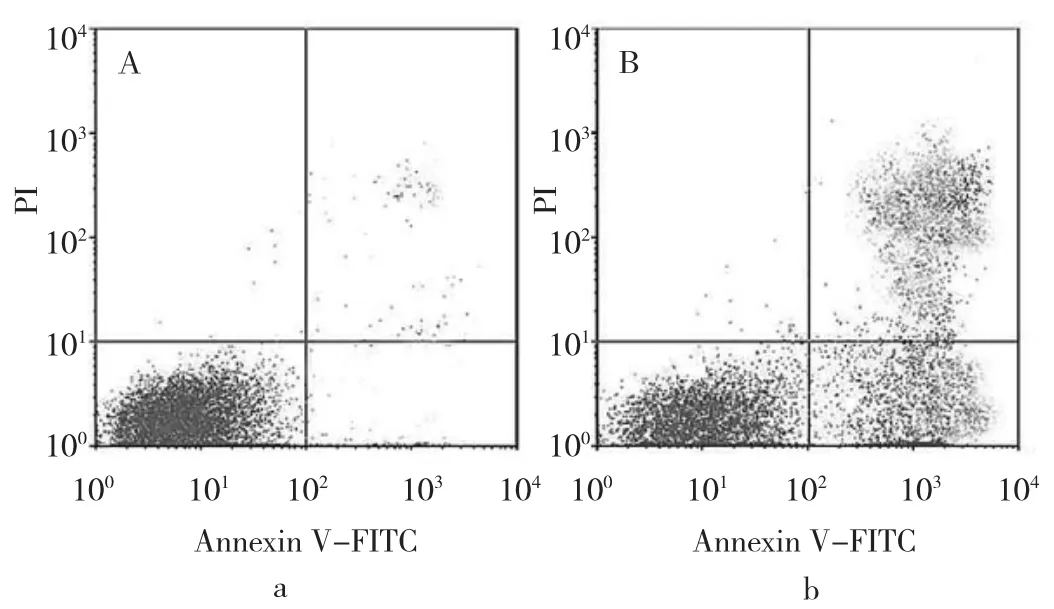
图4 凋亡细胞流式检测图(a:喉癌干细胞;b:喉癌细胞)
2.4 差异miRNA的筛选结果 放疗前后经Agilent芯片扫描仪扫描读取杂交信号,挑选2倍差异表达miRNA,结果发现明显升高2倍以上的miRNA有3条,而明显降低达2倍以上的miRNA有15条,其名称及序列见表1。

表1 2倍差异表达的miRNA
3 讨论
HNSCC居于癌症病死率的第6位,全世界每年新发病例50万,过去几十年治疗HNSCC的主要方法是手术和放疗。临床证明放疗对HNSCC有一定作用,但治疗结果的进展有限,复发和治疗失败仍然有相当的比率。本课题组前期开展了一系列喉癌干细胞相关的研究:从Hep-2喉癌细胞株与人实体瘤组织中成功分离、鉴定并扩增了喉癌干细胞,构建了喉癌干细胞裸鼠成瘤模型,在喉癌干细胞耐药/辐射耐受机制方面取得了部分研究成果。本研究在前期研究的基础上进一步从基因角度深入研究喉癌干细胞放射抗拒的机制。
miRNA作为一类广泛存在的非蛋白编码的小分子RNA,通过转录后水平调节基因的表达而参与调控一系列的生命活动,包括细胞增殖、生长发育、器官形成、造血、凋亡,甚至肿瘤发生。特异性miRNA在肿瘤干细胞的细胞特性方面起独特而重要的调控作用,如对辐射耐受基因的调控作用。可以推断,放射特异的miRNA对肿瘤干细胞放射抗拒相关基因发挥着同样调控作用。基于上述分析,本研究对制备的模拟放疗前后喉癌干细胞的纯化miRNA杂交后经Agilent芯片扫描仪扫描读取杂交信号,挑选2倍差异表达miRNA,结果发现明显升高2倍以上的miRNA有3条,明显降低2倍的有15条。国内学者运用基因芯片技术对miRNA在喉癌组织与正常组织中表达谱的差异进行了筛选,结果发现有13种miRNA在喉癌组织中的水平较正常组织有显著差异;其中mir-let-7a、miR-203、miR-205、miR-21、miR-98和miR-16-1的表达水平在肿瘤组织中升高,miR-100、miR-l-2、miR-122a、miR-143、miR-145、miR-26a-1和miR-34c等7种miRNA在肿瘤组织中的表达水平降低。Amin等[10]对人类癌细胞多种miRNA在放射中的反应作了研究,发现在人宫颈腺癌传代细胞系中,miR-21和miR-17-5p随着照射时间的延长,表达增加;在人结肠癌HCT1 16细胞中,照射后miR-21和miR-17-5p表达都增强,但在人乳腺癌SKBR3细胞和人前列腺癌PC3细胞中却没有发生此现象。这说明特异的miRNA表达水平在照射后发生的变化具有细胞特异性。但目前尚无喉癌干细胞放疗前后的miRNA的表达差异研究。
综上所述,本研究发现的这些明显差异的miRNA为喉癌干细胞放射抗拒相关的miRNA。这可能为解决喉癌放疗抗拒难题,研发新型高效的放疗增敏剂,提高放疗疗效提供重要基础资料。
[1] 孙志刚,黄盛东,张宝仁.肿瘤干细胞研究现状[J].第二军医大学学报, 2008,29(4):443-9.
[2] Mueller D W,BosserhoffAK.Role of miRNAs in the progression of malignant melanoma[J].Br J Cancer,2009,101(4):551-6.
[3] Valeri N,Croce C M,Fabbri M.Pathogenetic and clinical relevance of microRNAs in colorectal cancer[J].Cancer Genomics Proteomics,2009,6(4):195-204.
[4] Schetter A J,Leung S Y,Sohn J J,et al.MicroRNA expression profiles associated with prognosis and therapeutic outcome in colon adenocarcinoma[J].JAMA,2008,299(4):425-36.
[5] Avissar M,McClean M D,Kelsey K T,et al.MicroRNA expression in head and neck cancer associates with alcohol consumption and survival[J].Carcinogenesis,2009,30(12):2059-63.
[6] Hime G R,Somers WG.Micro-RNAmediated regulation ofproliferation,self-renewal and differentiation of mammalian stem cells [J].CellAdh Migr,2009,3(4):425-32.
[7] Yu F,Yao H,Zhu P,et al.Let-7 regulates selfrenewaland tumorigenicity ofbreast cancer cells[J].Cell,2007,131(6):1109-23.
[8] Silber J,Lim D A,Petritsch C,et al.MiR-124 and miR-137 inhibit proliferation of glioblastoma multiforme cells and induce differentiation ofbrain tumor stem cells[J].BMC Medicine,2008,6(1):14.
[9] Friedman J M,Jones P A.MicroRNAs:critical mediators of differentiation,development and disease[J].Swiss Med Wkly,2009, 139(33-34):466-72.
[10] Amin R,Betsehinger J,Fischer A,et al.Mei-F26 regulates microRNAs and cellgrowth in the Drosophila oval'iluistem cell lineage[J].Nature,2008,454(7201):241-245.
Screening of radioresistance-related miRNA from laryngeal cancer stem cells
DUAN Guangliang,DAI Huiping,TANG Tingting,et al. Department of Oncology,the Affiliated Hospital of Hangzhou Normal University,Hangzhou 310015,China
Objective To screen radioresistance-related miRNA from laryngeal cancer stem cells. Methods Laryngeal cancer Hep-2 cells were cultured in SFM containing growth factor,and cancer stem cells(CD133+CD44+)were detected and isolated with flow cytometry.The isolated laryngeal cancer stem cells were exposed to high energy X-ray.The differentially expressed miRNA(2-fold)were screened with miRNAbiologicalchips in irradiated and non-irradiated laryngealcancer stem cells. Results Overtop 91%CD133+CD44+cells were harvested by FACS.The miRNAs of2-fold differentialexpression were successfully screened from irradiated stem cells. Conclusion Laryngeal cancer stem cells have been isolated from Hep-2 cells,and miRNAs related to radioresistance have been screened from laryngealcancerstem cells.
SFM miRNA Side population Radiotherapy
2015-06-29)
(本文编辑:李媚)
2012年杭州市科技计划引导项目[杭科计(2012)259号(17)]
310015 杭州师范大学附属医院肿瘤诊治中心
段广亮,E-mail:dglzx333@163.com
