微泡增强的超声空化增加兔睾丸组织伊文思蓝浓度的研究
2016-12-20萧淑宜柳建华邱春花
萧淑宜 柳建华 邱春花 杜 洪
广州市第一人民医院超声医学科(广州 510180)
微泡增强的超声空化增加兔睾丸组织伊文思蓝浓度的研究
萧淑宜 柳建华 邱春花 杜 洪
广州市第一人民医院超声医学科(广州 510180)
目的 探讨微泡增强的超声空化增加睾丸组织的药物浓度的可行性。方法 18只雄性8月龄性成熟新西兰兔随机分为空白对照组(C)、单纯微泡组(MB)、治疗超声组(TUS)、超声联合微泡辐照组(MEUS)4组,每组各9个。MB组给予静注微泡造影剂 0.1 mL/kg ;TUS组给予超声辐照5min;MEUS组给予静注微泡造影剂0.1 mL/kg的同时超声辐照5min;每组在治疗前5min均经耳缘静脉注射2%伊文思蓝(EB)2.5 mL/kg;治疗后1 h取各组睾丸组织制备组织匀浆测量 EB 浓度。结果 MEUS组兔睾丸组织内 EB 浓度高于其他各组(P<0.05),差异有统计学意义。结论 微泡增强的超声空化可以明显提高睾丸组织内EB浓度。
睾丸;超声空化;微泡;伊文思蓝;兔
血-睾屏障是睾丸组织内存在于生精细胞、精子与血液之间的保护性的屏障结构,有选择、调节物质通过的特点。生理状态时血-睾屏障为生精细胞分裂增殖产生精子提供一个特殊稳定的环境;但病理状态下,其阻止大分子物质进入生精小管的特点却成为药物进入睾丸实质达到有效浓度的障碍,使睾丸成为肿瘤细胞或病原体的庇护所,成为疾病化疗复发的严重隐患[1-2]。已知微泡增强的超声空化能通过毁损血管壁等结构提高血管及细胞膜通透性的作用[3-5]。本研究利用新型脉冲式超声治疗仪,联合静脉注射超声微泡造影剂辐照新西兰兔睾丸,分析辐照后睾丸组织内伊文思蓝浓度,探讨微泡增强的超声空化能否通过提高血-睾屏障的通透性增加睾丸组织内的药物浓度,从而辅助治疗累及睾丸的疾病。
1 材料与方法
1.1 实验动物 雄性新西兰兔18只, 均达性成熟期,体重1.92~2.54 kg,平均体重(2.54±0.33)kg,由广东省医学实验动物中心提供。实验全过程均获得广州市第一人民医院伦理委员会的许可。术前利用速眠新II( 0.15 mL/kg)和2%戊巴比妥钠(1.5 mL/kg)联合肌注麻醉新西兰兔,然后将其保持仰卧姿势固定于实验手术台上,穿刺耳缘静脉建立静脉通道以备注射微泡、生理盐水或EB溶液;剪除睾丸表面体毛作为超声辐照声窗。
1.2 实验材料 ①超声治疗仪:本实验中用于超声治疗的是第三军医大学附属新桥医院研制的脉冲式低频超声治疗仪,该仪器发射的超声频率为1 MHz,脉冲范围100~1000s,峰值声压4.6 MPa,声强均值0.33 W/cm2,占空比1.08%。②超声造影剂:本实验应用的超声造影剂为第三军医大学附属新桥医院研制的“脂氟显”超声造影剂,微泡外壳是磷脂,核心包裹的气体是全氟丙烷,平均粒径2 μm。
1.3 实验方法 18只雄性8月龄性成熟新西兰兔的36个睾丸根据是否进行超声照射、有无微泡介导随机分成4组,每组9个。每组实验均包括以下三个步骤:
第一步:每组动物在超声治疗前均经耳缘静脉均匀推注质量浓度为20 g/L的EB溶液(用量: 2.5 mL/kg)。
第二步:利用“超声微泡振荡仪”震荡“脂氟显”超声微泡45s备用。兔睾丸表面及超声治疗探头表面均均匀涂上耦合剂,以利于超声探头与睾丸表面隔绝空气紧密接触。MEUS组,首先将超声治疗探头垂直于睾丸表面保持紧密接触但不用力重压以免影响睾丸实质血液循环,然后一边经耳缘静脉缓慢匀速推注微泡混悬液(0.1 mL/kg微泡加入10 mL生理盐水中),一边启动脉冲式超声治疗仪辐照5min;TUS组:超声辐照同MEUS组,但不使用微泡,仅使用等量生理盐水代替微泡静推;MB组:微泡静推同MEUS组,超声治疗探头放置同前,但不启动超声治疗仪,仅假照5min;C组,用10 mL的生理盐水替代微泡并用超声治疗头假照5min。
第三步:各组动物相应治疗1 h后,抽取低分子肝素钠(1000 IU/kg)经耳缘静脉推注使兔全身肝素化,然后经腹中线剪开腹腔,暴露腹主动脉,利用连接肝素化生理盐水的静脉注射针穿刺进入腹主动脉后用血管钳固定,同时离断近心端腹主动脉和下腔静脉,并拧开灌注液灌洗直至流出的液体由浑浊转为澄清、睾丸由蓝色转为白色为止。随即取出睾丸组织。
1.4 睾丸组织中 EB 含量的测定
1.4.1 建立EB标准曲线 将2 mg EB溶于100 mL的甲酰胺中配制成浓度为20 μg/mL的EB溶液,然后倍比稀释成浓度分别为10 μg/mL、5 μg/mL、2.5 μg/mL、1.25 μg/mL、0.625 μg/mL、0.317 5 μg/mL、0.158 75 μg/mL的EB溶液,用紫外分光光度仪对各溶液进行光密度扫描,确定其最大吸收峰处的光密度值。依梯度浓度及相对应的光密度值回归分析,推算回归方程并绘制标准曲线。
1.4.2 测定睾丸组织的EB含量 各组实验兔睾丸组织按上述方法相应处理后,首先用电子天平精确称其湿重,然后切成小块投入含有3 mL甲酰胺液体的试管中,加盖标记并置于37 ℃水浴中恒温孵育24 h,接着取出离心5min(3000 r/min)并取上清液用紫外分光光度仪测定光密度值,依光密度值及上上述建立的EB溶液标准曲线得出含有睾丸组织上清液的EB浓度,最后计算出每克睾丸组织中的EB含量(μg/g)。
1.5 统计学分析 计量资料均以均值±标准差表示,EB 标准曲线用回归分析程序分析,各实验组之间对比采用单向方差分析,采用SPSS 13.0软件处理,P<0.05差异有统计学意义。
2 结 果
2.1 动物实验情况及大体标本外观 本实验过程严格遵守《实验动物管理条例》伦理规则;实验过程中动物均处于良好麻醉状态。18只实验兔全部完成实验;大体可见,MEUS组兔睾丸表面及肌层见少许散在出血点,其余各组兔睾丸表面及其周围肌层均色泽正常,未见明显的血肿形成。
2.2 EB浓度 C组及TUS组及MB组兔睾丸内EB浓度极低,MEUS组兔睾丸内EB浓度高于其他三组,差异有统计学意义(P<0.05); TUS组兔睾丸内EB浓度高于MB组及C组,差异有统计学意义(P<0.05)。见表 1。
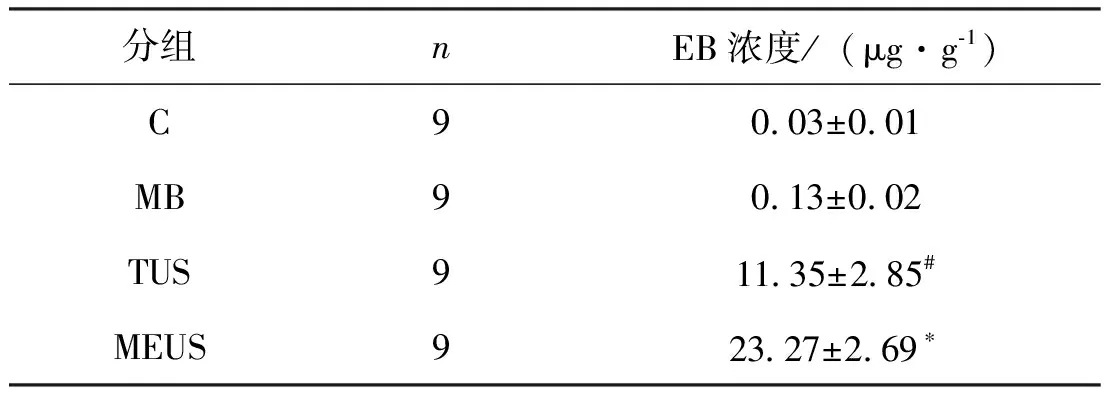
表1 各组睾丸组织EB浓度比较
*与其他各组比较,P<0.05;#与其他各组比较,P<0.05
3 讨 论
血-睾屏障是睾丸组织内存在于生精细胞、精子与血液之间的保护性的屏障结构,有选择、调节物质通过的特点。血-睾屏障能选择性地调节物质通过,一方面供给睾丸必须的营养物质并传达机体的内分泌调节信息促使精子正常发育,另一方面抵御血液内的有害物质进入睾丸实质起防御保护的作用,从而为生精细胞分裂增殖产生精子创造一个特殊的稳定环境。但当出现睾丸疾病,如睾丸炎、睾丸肿瘤时,血-屏障则成为药物进入睾丸实质达到有效浓度的障碍,使睾丸成为肿瘤细胞或病原体等的庇护所,为疾病的复发埋下严重隐患[1-2]。据报道,儿童白血病化疗缓解后睾丸内复发的概率高达17%,成人淋巴瘤化疗完全缓解后40%~50%的复发来自睾丸及中枢神经系统[2]。因此,亟需一种安全有效、可逆开放血睾屏障,促进药物对睾丸疾病治疗的方法。
声孔效应是超声空化在机体血管壁、细胞膜等结构上产生的可逆的生物学效应;微泡增强的超声空化通过静脉推注超声微泡增加血液中的空化核,一方面降低超声空化阈值,一方面增强超声空化效应。怎样有效、可控地利用微泡增强的超声空化效应来克服各种生物膜屏障进行靶向治疗是超声界近年来的研究热点之一[3-5]。有研究发现,利用超声波辐照携带药物或基因的微泡造影剂,利用空化效应以及超声辐射力的作用可以靶向导入和释放药物。目前研究已经证明超声联合微泡可以靶向、局部、可逆性地开放血脑屏障和血肿瘤屏障[6-8]。对于血-睾屏障,也有体外实验提示低强度超声联合微泡可以通过作用于支持细胞上的波形蛋白可逆地开放血-睾屏障[10-11]。既往对于超声空化作用对睾丸影响的相关研究主要有两类:第一类主要针对诊断超声(伴或不伴有微泡)对睾丸生殖细胞的影响[9-10],研究认为其对组织的影响与超声的机械参数、微泡特性及辐照时间密切相关;一定剂量的低强度超声并不诱导生殖细胞凋亡,反而有通过睾酮增加而促进生殖细胞增殖作用的可能,另外即使辐照达一定剂量可以引起生殖细胞的凋亡,但停止辐照后可逐渐恢复正常。第二类是研究治疗超声对血-睾屏障的影响的离体实验,张波等[11-13]利用微泡联合治疗超声作用于离体的大鼠睾丸支持细胞后发现,与紧密连接密切相关的波形蛋白表达降低,提示超声空化可能可以影响血-睾屏障的结构。
笔者前期实验发现微泡增强的超声空化效应可以有效地影响甚至损伤血-睾屏障结构[14],本研究希望进一步探讨药物是否可通过超声空化效应损伤了的血-睾屏障结构在睾丸组织内聚集,从而为超声空化应用于辅助药物治疗睾丸疾病提供依据。本研究结果显示,C组及MB组兔睾丸内EB浓度极低,这是由于这两组均没有超声辐照产生空化效应;TUS组兔睾丸内EB浓度稍高于C组及MB组,推测原因可能是治疗超声联合血液本身固有的少量的空化核产生低程度的空化效应,一定程度上影响了血-睾屏障的通透性,从而轻微影响了EB的扩散。MEUS组睾丸内药物浓度明显高于其他各组,有力的证明了超声联合微泡产生的空化效应可以显著提高血-睾屏障的通透性,增加局部药物的浓度,有望用之于辅助提高药物治疗效果。
总之,笔者前期实验证明微泡增强的超声空化效应能够有效地开放血-睾屏障[14],本实验结果证实超声联合微泡可以提高睾丸组织局部药物浓度。进一步明确其血-睾屏障打开的机制、明确实验中生精细胞的损伤及血睾屏障的破坏是否可逆将成为我们未来探索的问题。
[1] MRUK DD,CHENG CY.Tight junctions in the testis: new perspectives[J]. Philos Trans R Soc Lond B Biol Sci,2010,365(1546):1557-1569.
[2] BART J,GROEN HJM, WINETTE TA,et al.An oncological view on the blood-testis barrier[J]. THE LANCET Oncology,2002(3):357-364.
[3] 卫荆璐,余美玲,韦英丽,等.低频脉冲超声联合微泡对在体微小血管作用的实验研究[J]. 广州医药,2016,47(2):85-87.
[4] 萧淑宜,柳建华,区文财,等.超声联合微泡阻断正常脾脏微循环血流的初步研究 [J]. 中国超声医学杂志,2012(8):684- 688.
[5] LIU JH, XIAO SY, WU SZ, et al. Disruption of splenic circulation using microbubble enhanced ultrasound and prothrombin[J]. Ultrasound Med Biol,2012,38(11): 1930-1937.
[6] 崔海,徐亚丽,吴盛正,等.微泡超声空化声压幅度大鼠血脑屏障通透性关系的研究[J]. 中华超声影像学杂志, 2015,24( 8):715-719.
[7] 夏义春,丛雪枫,刘云会. 低频超声辐照联合小剂量缓激肽选择性开放大鼠血肿瘤屏障及其可能机制[J]. 解剖科学进展 2011,17(3):294-299.
[8] 付赤学,高云华,刘政,等.微泡介导下诊断超声开放人血脑屏障的可行性实验研究[J]. 中国医学影像学杂志,2011,27(2):81- 83.
[9] 杜联芳,张青萍,刘望彭.诊断超声与细胞凋亡[J]. 中华超声影像学杂志,2000,9:374-376.
[10] 刘芳,薛恩生,林礼务,等.彩色多普勒超声对大鼠睾丸生精细胞凋亡的影响[J]. 中华医学超声杂志,2006,3(6): 328-331.
[11] 陈林,詹维伟,刘振华,等.诊断超声联合微泡对比剂辐照不同时间对兔正常睾丸组织的影响[J]. 诊断学理论与实践,2010,9(2):161-165.
[12] 黄伟钦,薛恩生,林礼务,等.超声造影剂在诊断超声辐射下对兔睾丸生精细胞的影响[J]. 中华超声影像学杂志,2010,19(6):527-531.
[13] 张波,张唯利,林艳君,等. 超声靶向微泡破坏对支持细胞的生物学效应研究[J]. 重庆医科大学学报,2010,35(2):175-178.
[14] 萧淑宜,柳建华,区文财,等. 微泡增强的超声空化对正常犬睾丸的影响[J]. 中华超声影像学杂志,2012,21(8):723-726.
Research on the increase of concentration of EB in rabbit testis by microbubbles enhanced ultrasound
XiaoShuyi,LiuJianhua,QiuChunhua,etal.
Department of Medical Ultrasound,The First People’s Hospital of Guangzhou,Guangzhou 510180,China
Objective To investigate feasibility of microbubbles enhanced ultrasound (MEUS) on the concentration of Evans blue (EB) in rabbit,stestis. Methods Eighteen sexually mature male New Zealand rabbits were divided into four groups randomly. Pulsed ultrasound irradiation and intravenous microbubbles injection were both applied in the microbubbles enhanced ultrasound group (MEUS), pulsed ultrasound irradiation and intravenous microbubbles injection were individually applied in the therapeutic ultrasound group (TUS) and the simple microbubbles group (MB). Injection of EB was applied in each group five minutes before the treatment.Concentration of EB in testis tissue was measured homogenated. Results The concentration of Evans blue (EB) in rabbit’s testis in MEUS group was statistically higher than the other groups (P<0.05). Conclusion Microbubbles enhanced ultrasound (MEUS) can increase the concentration of Evans blue (EB) in rabbit’s testis.
Testis;Cavitation;Microbubbles; Evans blue;Rabbit
广州市医药卫生科技项目 (20131A011021 );广东省公益研究与能力建设专项资金项目(2014A020212014);广东省自然科学基金(2016A030313461)
柳建华,E-mail:jhliu666666@163.com
10.3969/j.issn.1000-8535.2016.06.003
2016- 08-12)
