Bcl-2、COX-2在宫颈癌新辅助化疗前后的表达及临床意义的研究
2016-12-20林悦欢胡璐萍何慧仪伍华玲
林悦欢 胡璐萍 何慧仪 伍华玲
1 中山大学附属江门医院妇产科(江门 529100) 2 广州医科大学附属广州市第一人民医院妇产科(广州 510180)
Bcl-2、COX-2在宫颈癌新辅助化疗前后的表达及临床意义的研究
林悦欢1胡璐萍2何慧仪2伍华玲2
1 中山大学附属江门医院妇产科(江门 529100) 2 广州医科大学附属广州市第一人民医院妇产科(广州 510180)
目的 探讨Bcl-2、COX-2在宫颈癌新辅助化疗前后表达的意义, 以及新辅助化疗(NACT)对宫颈癌的近期临床疗效。方法 对32例宫颈癌患者,采集NACT治疗前后的宫颈癌组织标本,采用免疫组织化学SP法检测组织中的Bcl-2及COX-2表达。结果 ①经NACT后,治疗总有效率(CR+PR)为75%,无效率(PD+SD)为25%。②宫颈癌组织中Bcl-2、COX-2的表达均出现明显下降,差异均有统计学意义(P<0.05);临床有效组中Bcl-2、COX-2的表达在NACT后出现显著下降(P<0.05),无效组中Bcl-2、COX-2的表达在NACT前后无明显统计学意义(P>0.05)。结论 Bcl-2、COX-2的表达情况对评价宫颈癌患者新辅助化疗效具有肯定的临床意义,宫颈癌行NACT后近期疗效良好。
宫颈癌;Bcl-2;COX-2;新辅助化疗
子宫颈癌(cervical cancer),习称宫颈癌,高发年龄为50~55 a,是最常见的妇科恶性肿瘤[1]。随着宫颈刮片筛查的广泛使用, 近年来宫颈癌的发生率已有下降的趋势, 但仍严重地威胁广大妇女的健康[2]。而且近20年来宫颈癌的发病人群愈加年轻化[3]。宫颈癌的治疗常采用个性化治疗方案,总原则为采用手术和放疗为主、化疗为辅的综合治疗。宫颈癌的化疗包括新辅助化疗、术后巩固化疗、中晚期姑息化疗等。新辅助化疗(neoadjuvant chemotherapy,NACT)是指对宫颈癌患者在手术和(或)放疗前先行一定疗程的化疗。NACT最佳的适应证是宫颈局部肿瘤直径≥4 cm及局部晚期宫颈癌。2012版FIGO妇癌报告提出,对于巨块型宫颈癌(ⅠB2/ⅡA2期),50%~85%的患者经过初始手术治疗后需行同期放化疗或辅助放疗,对于肿瘤直径超过3 cm的患者,为了最大程度降低术后放化疗和联合治疗所致的并发症,通常不推荐以手术治疗作为初始治疗[4]。患者在接受手术或放疗前给予一定疗程的化疗,可能为患者争取手术机会、增强手术效果,减少手术并发症等,甚至可降低临床分期及复发率。但并非所有宫颈癌患者对化疗都能产生疗效,对化疗不敏感的宫颈癌患者实施NACT很有可能会延误其施行根治性手术或放疗的时机。因此,寻找能预测新辅助化疗疗效的标志物,尽可能及早地评价新辅助化疗的疗效显得极为重要。
1 资料与方法
1.1 临床资料 选择2013年1月—2015年12月在广州市第一人民医院确诊为宫颈癌,同时符合新辅助化疗(NACT)适应症的患者32例,年龄32~65 a,平均年龄(50.8±7.5)a,根据2009年FIGO分期,临床分期为ⅠB2期13例,ⅡA2期13例,ⅡA1期6例。经病理学检查,鳞状细胞癌25例,腺癌7例;中分化20例,低分化12例,无高分化病例。
1.2 检测方法 入组病例行NACT前后行妇检、B超、MR等检查,测量宫颈癌病灶最大直径与垂直横径值。采用免疫组化 (SP) 染色测定Bcl-2、COX-2的表达。所有标本均采用10%的甲醛水溶液固定,常规石蜡包埋连续切片 (厚约4~6 μm),HE 染色,一抗4 ℃ 过夜,DAB 显色,苏木精复染,封片。用已知的Bcl-2和COX-2阳性的宫颈癌切片作为阳性对照,以 PBS 液代替一抗为阴性空白对照。所用试剂单克隆抗体Bcl-2、COX-2购自北京中杉生物工程公司; SP 试剂盒购自广州基因公司。所有操作按照试剂盒说明书进行。
1.3 结果判定 根据实体瘤缓解评价标准(RECIST)评定疗效,其中CR、PR为有效,SD、PD、IR为无效。Bcl-2免疫组化染色以细胞质内呈现棕黄色颗粒为阳性表达;COX-2免疫组化染色以胞质内或核膜上呈棕黄色为阳性表达。结果采用半定量标准,即:阴性(-):无阳性细胞;弱阳性(+):阳性细胞≤25%;中度阳性(++):阳性细胞26%~50%;强阳性(+++):阳性细胞>50%。
1.4 统计学方法 以SPSS 13.0统计软件进行数据处理。研究Bcl-2、COX-2在NACT前后的表达情况应用秩和检验;Bcl-2、COX-2在NACT前后的高表达情况、不同临床疗效的宫颈癌组织在NACT前后的Bcl-2、COX-2的表达情况及Bcl-2、COX-2在NACT前不同临床疗效的宫颈癌组织中的表达情况均应用Fisher确切概率法检验。以P<0.05则认为差异有统计学意义,P≥0.05则认为差异无统计学意义。
2 结 果
2.1 NACT临床疗效 32例宫颈癌患者经NACT后10~14天,利用妇检、B超及MR等比较NACT前后病灶大小差异,观察其化疗疗效。其中,完全缓解(CR)占9.375%(3/32),部分缓解(PR)占65.625%(21/32),疾病进展(PD)占6.25%(2/32),疾病稳定(SD)占18.75%(6/32)。总有效率(CR+PR)为75%(24/32),无效率(PD+SD)为25%(8/32)。
2.2 Bcl-2、COX-2在NACT前后的表达情况 32例宫颈癌患者在NACT前采用免疫组化SP方法检测Bcl-2、COX-2表达的情况,见表1,应用秩和检验提示Bcl-2、COX-2在NACT前后的表达差异均有统计学意义(P均<0.05)。
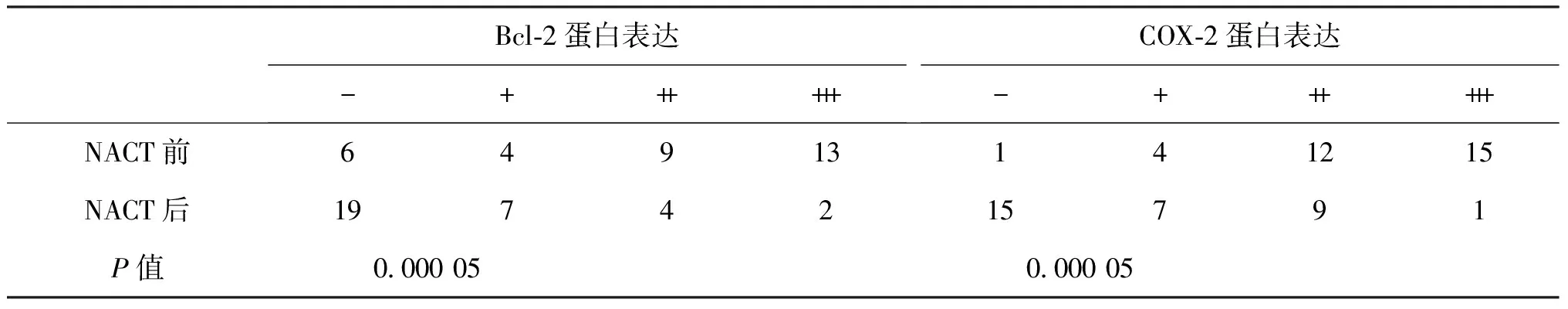
表1 Bcl-2、COX-2在NACT前后的表达情况
中度阳性(++)和强阳性(+++)又称为高表达,此研究病理结果取用半定量标准,容易受主观影响,因此研究Bcl-2及COX-2的高表达率更有利于准确了解NACT前后两因子的表达情况。Bcl-2及COX-2在NACT前后的高表达(++~+++)情况见表2,应用Fisher确切概率法检验提示Bcl-2、COX-2在NACT前后的高表达差异均有统计学意义(P均<0.05)。

表2 Bcl-2、COX-2在NACT前后的高表达情况
2.3 不同临床疗效的宫颈癌组织在NACT前后的Bcl-2、COX-2的表达情况 32例宫颈癌患者行NACT后经评估后有24例判定为临床有效(CR+PR),8例判定为临床无效(SD+PD)。临床有效组中Bcl-2、COX-2在NACT前后的高表达情况经Fisher确切概率法检验提示P均<0.05,差异均有统计学意义(见表3)。
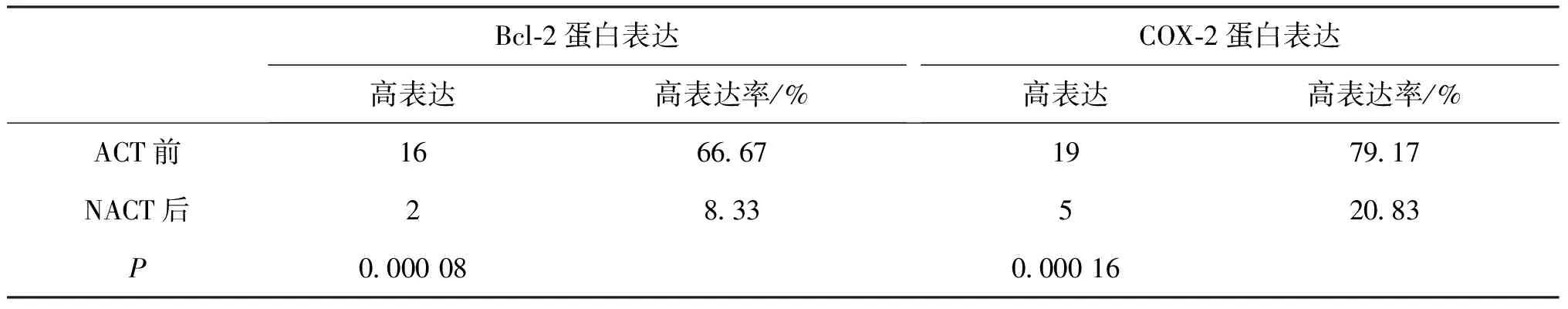
表3 临床有效组中Bcl-2、COX-2在NACT前后的高表达情况
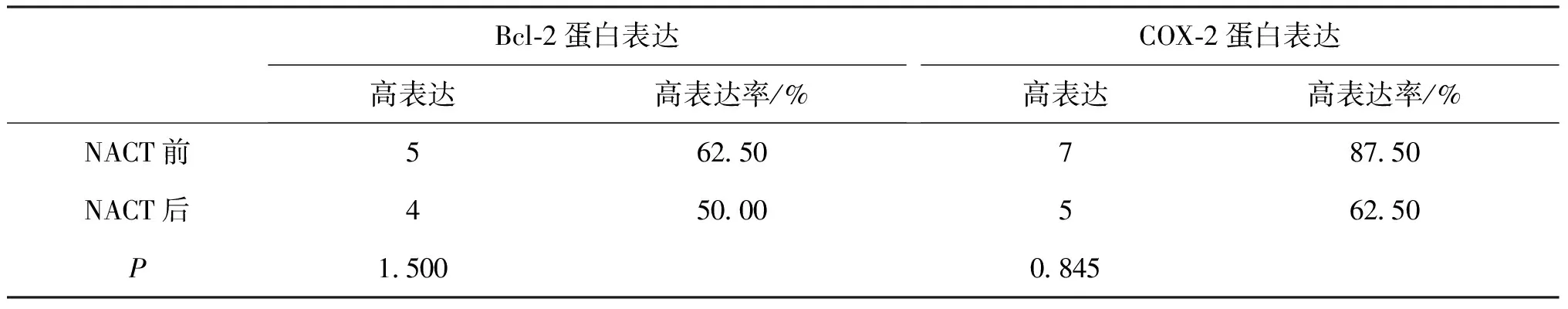
表4 临床无效组中Bcl-2、COX-2在NACT前后的高表达情况
临床无效组中Bcl-2、COX-2在NACT前后的高表达情况经Fisher确切概率法检验提示P均>0.05,认为均无统计学意义(见表4)。
2.4 NACT前Bcl-2及COX-2在不同临床疗效的宫颈癌组织中的表达 为研究Bcl-2及COX-2在预测宫颈癌新辅助化疗疗效敏感性及其可行性,进一步观察NACT前Bcl-2及COX-2在不同临床疗效的宫颈癌组织中的表达情况(见表5)。
Bcl-2在临床有效组66.67%呈高表达(16/24),临床无效组62.50%(5/8),有效组高表达率略高于无效组,经Fisher确切概率法检验提示P>0.05,认为差异无统计学意义。
COX-2在临床有效组79.17%呈高表达(19/24),临床无效组87.50%(7/8),无效组高表达率略高于有效组,经Fisher确切概率法检验提示P>0.05。

表5 NACT前Bcl-2及COX-2在不同临床疗效的宫颈癌组织中的表达
3 讨 论
3.1 新辅助化疗的临床疗效 本研究中32例宫颈癌患者经NACT后10~14天,利用妇检、B超及MR等观察其化疗疗效,根据实体瘤缓解评价标准(RECIST)得出总有效率(CR+PR)为75%(24/32),其中3例为完全缓解(CR),肉眼见肿瘤形态完全消失,1例术后常规病理检查未见癌组织残留。32例患者中30例在NACT后成功行广泛性全子宫切除+盆腹腔淋巴清扫术和腹主动脉旁淋巴结取样,术中发现肿瘤体积减小利于手术的进行,且栓塞术使肿瘤周围组织变软、松动,有利于缩短手术时间,减少术中出血。
3.2 Bcl-2、COX-2在宫颈癌NACT前后的表达意义 目前认为Bcl-2基因蛋白在宫颈癌、消化道癌、乳腺癌、肺癌、结肠癌、前列腺癌、肝癌、胃癌、鼻咽癌、舌癌、口腔癌等癌症细胞中表达水平都有显著升高。本课题组曾应用免疫组化方法检测宫颈上皮内廇变(Cervical intraepithelial neoplasia, CIN)组织和宫颈癌组织中的Bcl-2蛋白的表达,发现在宫颈炎→CINⅠ→CINⅡ-CINⅢ →宫颈癌发展过程中表达率呈逐渐上升趋势,差异有统计学意义[5],验证了Bcl-2的高表达在宫颈癌的发生发展过程中起着重要作用。这与Zhou[6]、朱华[7]、Protrka[8]研究结果基本一致。
COX-2在结直肠癌、胃癌、非小细胞肺癌、食管癌等恶性肿瘤呈高表达[9-10],主要是通过抑制凋亡、促进细胞增殖和促进血管形成等机制参与多种肿瘤的发生、发展[11],并可能促进肿瘤浸润和转移[12]。本课题组也曾对各种宫颈组织中COX-2的表达情况进行研究,发现COX-2蛋白的高表达率在宫颈癌发展阶段呈上升趋势,差异有统计学意义(P=0.003)[5],因此认为COX-2的高表达与肿瘤的发生、发展密切相关。
Bcl-2、COX-2在入组的32例宫颈癌组织中均有一定程度的表达,且在新辅助化疗前后的表达有显著的差异(P均<0.05)。经NACT后Bcl-2的表达明显下降,说明NACT可能通过抑制Bcl-2的表达从而诱导宫颈癌细胞加快进入细胞凋亡途径,达到杀伤癌细胞及抑制宫颈癌进展的治疗目的。COX-2的表达在NACT后明显低于NACT前,说明NACT后宫颈癌组织细胞的增殖活性出现了明显下降,化疗药物抑制了癌细胞的增殖活性。
课题组还比较了不同临床疗效中NACT前后的表达,发现临床有效组(CR+PR)中Bcl-2与COX-2的表达有明显下降,且差异有统计学意义;而临床无效组(SD+PD)在NACT前后Bcl-2与COX-2的表达无明显差异。由此我们认为Bcl-2与COX-2的表达情况与新辅助化疗疗效有关,宫颈癌组织局部相对高浓度的化疗药物可能通过抑制Bcl-2与COX-2的表达从而增加肿瘤细胞的凋亡,减少肿瘤血管的生成,缩小局部肿瘤的体积,增加了手术的机会。因此我们认为Bcl-2与COX-2有可能成为NACT疗效的评价指标。综上所述,检测新辅助化疗前后Bcl-2与COX-2的表达对评价宫颈癌患者NACT效果有肯定的临床意义。虽然,到目前临床常用的疗效评价是观察新辅助化疗前后肿瘤体积大小的变化,但如果将Bcl-2与COX-2作为细胞标志物应用于临床疗效评估,将会更加准确。
3.3 Bcl-2及COX-2在预测宫颈癌新辅助化疗疗效敏感性及其可行性 研究中新辅助化疗的有效率达75%,初步肯定了其疗效,并认为NACT可以缩小局部肿瘤的体积,有利于根治性手术的进行,也可能起到控制亚临床转移的作用。但是,并非所有宫颈癌患者对化疗都能产生疗效,对化疗不敏感的宫颈癌患者实施NACT很有可能会延误其施行根治性手术或放疗的时机。因此,寻找能预测新辅助化疗疗效的标志物,尽可能及早地评价新辅助化疗的疗效显得极为重要。有研究表示,Bcl-2的表达在多种肿瘤(如淋巴瘤、前列腺癌、大肠癌等)中与肿瘤细胞对化疗耐受和敏感性有关[13-15]。但Bcl-2的表达与宫颈癌NACT疗效之间的研究尚少,其对宫颈癌的化疗是否有影响,这还需要我们进一步拓展研究。有研究认为COX-2能较好地预测宫颈癌患者行NACT及手术治疗的临床结局。Nagai[16]于2003年提出认为COX-2的过度表达与宫颈癌新辅助化疗中肿瘤细胞凋亡有关。Ferrandina等[17]于2004年对175例宫颈癌组织用免疫组化方法检测肿瘤与间质中的COX-2的表达比值,发现NACT无反应者较部分反应和完全反应者比值高(P<0.05),并认为肿瘤与间质中COX-2的比值是化疗疗效的独立预后因素(P<0.05)。本研究检测NACT前后Bcl-2与COX-2的表达情况,进一步探讨两者行NACT前在临床有效组与无效组的表达差异,试图能找到预测NACT敏感性的标记物,指导临床上宫颈癌的新辅助化疗。比较在新辅助化疗前临床有效组与无效组中Bcl-2、COX-2的表达差异,提示均无统计学意义,因此认为Bcl-2与COX-2不能作为标记物预测NACT的疗效。但是,因为本研究中实验病例数少,实验结果采用的是阳性表达分级的方法导致结果有偏差。我们将会在后期的研究中进一步扩大临床病例数并且延长观察时间,得出更准确的结论。
[1] 谢幸,苟文丽.妇产科学(第8版)[M]. 北京:人民卫生出版社,2013.304.
[2] 杨炜敏,袁力,何善阳,等.KAI1 转移抑制基因在宫颈鳞癌中的表达及临床意义[J]. 广州医药,2009,40(4):25-27.
[3] LEI T, MAO WM, LEI TH, et al. Incidence and mortality trend of cervical cancer in 11 cancer registries of China[J]. Chin J Cancer Res, 2011, 23(1):10-14.
[4] 林仲秋,王丽娟.国际妇产科联盟2012宫颈癌诊治指南解读[S]. 中国实用妇科与产科杂志,2013,29(5):323-325.
[5] 林悦欢,何慧仪.检测Bcl-2、COX-2在宫颈病变诊断中的可行性研究[J]. 中国妇幼保健,2013,28(28):4618- 4620.
[6] ZHOU XL, WANG M. Expression levels of survivin, Bcl-2, and KAI1 proteins in cervical cancer and their correlation with metastasis[J]. Genet Mol Res, 2015,14(4):17059-17067.
[7] 朱华,施铮铮. Survivin、Bcl-2、HPV 16/18 在宫颈上皮内瘤变及 宫颈癌中的表达及临床意义[J]. 实用妇产科杂志,2010,26(1):57- 60.
[8] PROTRKA Z, ARSENIJEVIC S, et al. Co-overexpression of bcl-2 and c-myc in uterine cervix carcinomas and premalignant lesions[J]. Eur J Histochem, 2011,55(1):44- 49.
[9] 刘美兰,李乐云.COX-2和mPGEs-1与肿瘤关系的研究进展[J]. 中华肿瘤防治杂志,2010,17(14):1134-1137.
[10] 陆俊国,杨磊,谭清和,等.非小细胞肺癌组织COX-2和HER-2表达及其临床意义[J]. 中华肿瘤防治杂志,2010,17(3):206-212.
[11] DEMPKE W, RIE C, et al. Cyclooxygenase-2: a novel target for cancer chemotherapy[J]. Cancer Res Oncol,2001,127(7):411- 417.
[12] 张琦,许进琼.环氧合酶-2及核因子-κB在宫颈癌组织中的表达及意义[J]. 现代医药卫生,2009,25(6):2417-2418.
[13] SCHMITT CA, ROSENTHAL CT, LOWE SW. Genetic analysis of chemoresistance in primary murine lymphomas[J]. Nat Med, 2000,6(9):1029-1035.
[14] SZOSTAK M, KAUR P, AMIN P, et al. Apoptosis and bcl-2 expression inprostate cancer significance in clinical outcome after brachytherapy[J]. J Urol, 2001,165(6 Pt 1):2126-2130.
[15] 黄艳,金淑静,柳红,等. P-gp和Bcl-2在大肠癌中的表达及相关性的研究[J]. 广州医药,2004,35(2):6- 9.
[16] NAGAI G, KANELLETTI FO, LEGGE F, et al. Cyelooxygenase-2(COX-2) expression in locally advanced cervical cancer patients undergoing chemoradiation plus surgery. Int J Radiat Oncol Biol Phys, 2003,55(l):21-27.
[17] FERRANDINA G, RANELLETTI FO, LEGGE F, et al. Prognostic role of the ratio between cyclooxygenase-2 in tumor and stroma compartmentsin cervical cancer[J]. Clin Cancer Res, 2004,10(9):3117-3123.
A study of the expression and clinical significance of the Bcl-2 and COX-2 in cervical cancer before and after neoadjuvant chemotherapy
Lin Yuehuan.
Department of Obstetrics and Gynecology,Jiangmen Hospital Affiliated to Sun Yat-sen University,Jiangmen 529100, China
Hu Luping,He Huiyi,Wu Hualing.
Department of Obstetrics and Gynecology, First People’s Hospital of Guangzhou Affiliated to Guangzhou Medical University,Guangzhou 510180, China
Objective To investigate the expression of Bcl-2 and COX-2 in cervical cancer before and after neoadjuvant chemotherapy; To evaluate the efficacy of neoadjuvant chemotherapy(NACT) for cervical cancer in the recent clinical effects. Methods To select 32 cases of patients with cervical cancer, collect the cervical cancer tissues before and after NACT, immunohistochemical SP method was used to detect the expression of Bcl-2and COX-2 in the tissues. Results After neoadjuvant chemotherapy, total effective rate (CR+PR) was 75%(24/32), inefficient rate(PD+SD) was 25%(8/32). The expression of Bcl-2 and COX-2 of cervical cancer patients who had neoadjuvant chemotherapy (NACT), before and after, had great differences. The difference had statistical significance (P<0.05); The expression of Bcl-2 and COX-2 were significantly lower after neoadjuvant chemotherapy in clinical effective group(P<0.05), there is no statistical significance in clinical non-effective group(P>0.05). Conclusion The expression of Bcl-2 and COX-2 of cervical cancer patients has certain clinical significance in evaluating the effect of neoadjuvant chemotherapy in cervical cancer patients. Recent curative effect after NACT in the cervical cancer patients is good.
Cervical cancer; B-cell lymphoma/leukemia-2(Bcl-2); Cyclooxygenase-2(COX-2); Neoadjuvant chemotherapy(NACT)
广东省科技计划项目(2012B031800328)
何慧仪, E-mail:winniehhy2010@qq.com
10.3969/j.issn.1000-8535.2016.06.002
2016- 09-21)
