大孔吸附树脂分离纯化紫穗槐叶类黄酮的研究
2016-12-20王竞红杨成武刘素欣张秀梅
王竞红,王 非,杨成武,刘素欣,张秀梅,多 多,陈 艾
(东北林业大学 园林学院,黑龙江 哈尔滨 150040)
大孔吸附树脂分离纯化紫穗槐叶类黄酮的研究
王竞红,王 非,杨成武,刘素欣,张秀梅,多 多,陈 艾
(东北林业大学 园林学院,黑龙江 哈尔滨 150040)
为了筛选最优大孔树脂,研究了大孔树脂分离纯化紫穗槐叶类黄酮的最佳工艺条件。以总纯化率为指标,在静态吸附解吸下,筛选最佳大孔树脂和溶解黄酮粗提物的乙醇浓度;在动态吸附解吸下,以单因素为基础,采用正交实验设计方法,研究上样质量浓度、上样流速、上样量、上样pH值、洗脱乙醇体积分数、洗脱流速对总纯化率的影响,并找到最佳工艺条件。结果表明: 用10%乙醇溶解黄酮粗提物,大孔树脂D101分离纯化样品液,最佳工艺为上样质量浓度1.5 mg/mL、上样流速3 mL/min、上样量100 mL、上样pH值4、洗脱乙醇体积分数70%、洗脱流速3 mL/min,在此工艺条件下,能科学合理地分离纯化类黄酮,所得类黄酮含量为56.2%,较纯化前18.9% 提高了2.9倍。
紫穗槐;紫穗槐叶;类黄酮;大孔吸附树脂;分离纯化
紫穗槐Amorpha fruticosa 为豆科紫穗槐属的多年生落叶灌木[1]。生长快,萌蘖能力强,耐干旱,耐瘠薄,耐盐碱,耐水湿,根系发达,具有很强的防风固沙、保持水土、改良土壤等生态作用[2-3],被誉为保持水土流失、防风固沙的“活钢筋”。黄酮类化合物是一类重要的天然有机化合物,是植物在长期自然选择过程中产生的一类次生代谢产物[4],广泛存在于天然产物中[5],于芸香科、唇形科、豆科、伞形科、银杏科与菊科植物中含量最高[6],包括黄酮、异黄酮、黄酮醇、黄烷酮等,能增强植物的保护性,抵御外来生物和非生物的侵害,并能刺激植物的生长[7-8]。园林植物叶片中总黄酮、多酚物质的存在及其含量对植物抗病虫害的影响在特定条件下发挥较显著的作用[9]。类黄酮具有多种生理活性,人体摄入后可产生包括抗衰老、抗病毒、抗炎镇痛、抗癌抗肿瘤、抗骨质疏松、血管舒张等功能[10]。在食品中,类黄酮的抗氧化性除了应用于功能性食品添加剂外,还应用于功能食品[11]。因此,类黄酮在环境保护、药物和食品领域的开发方面具有很好的社会效益和经济效益前景。
随着科学技术的发展,类黄酮分离纯化有很多方法,如硅胶柱色谱法[12]、高速逆流色谱[13]、聚酰胺层析法[14]等。大孔树脂作为新兴纯化技术,具有吸附速度快、吸附容量大、选择性良好、再生简便等优点[15-17],近年来,在类黄酮的分离纯化中被广泛应用[18-19]。本文中主要研究纯化紫穗槐叶中类黄酮的大孔树脂型号以及纯化类黄酮的最佳工艺条件,为以后分离鉴定紫穗槐叶中类黄酮单体奠定基础。
1 材料与方法
1.1 材 料
紫穗槐叶,东北林业大学林场苗圃采取,经东北林业大学园林学院周蕴薇教授鉴定;芦丁标准品,纯度≥99%,上海金穗生物科技公司;无水乙醇、亚硝酸钠、硝酸铝、氢氧化钠均为分析纯;大孔树脂AB-8、D101、S-8、X-5、D4020,天津市光复精细化工研究所。
1.2 仪 器
紫外分光光度计,珀金埃尔默仪器(上海)有限公司;旋转蒸发仪,上海亚荣生化仪器厂;循环真空泵,上海亚荣生化仪器厂;低温高速台式离心机,德国Eppendorf公司;电子天平,北京赛多利斯仪器有限公司;电热恒温鼓风干燥箱,上海森信仪器有限公司。
1.3 标准曲线的制定
精确称取8 mg标准品芦丁,超声溶于80 mL体积分数为60%乙醇中,制备浓度100 μg/mL的标准液。分别吸取 1.0、2.0 、3.0 、4.0 、5.0 mL标准液于10 mL容量瓶中,不足5 mL用60%乙醇加至5 mL。加入5% NaNO20.3 mL,静置6 min;加入10%Al(NO3)30.3 mL,静置6 min;加入4%NaOH 4.0 mL,静置15 min,最后用蒸馏水定容至10 mL。在505 nm处测吸光度。得标准曲线A505nm=0.0114 7ρ-0.005 7,R2=0.998 616。
1.4 类黄酮样品液的制备
称取1 g紫穗槐叶粉末→微波提取→70℃水浴→合并滤液→旋转蒸发→离心→蒸发至膏状→冷冻干燥。将冷冻干燥的干粉溶于一定浓度的乙醇溶液中,制备成样品液。
1.5 大孔树脂的预处理
称取一定量的树脂,在95%乙醇中浸泡24 h,使其充分膨胀,用蒸馏水洗至澄清,无白色溶液流出。再用5%HCl浸泡24 h,除去树脂中碱类化合物,用蒸馏水洗至中性。然后用5% NaOH浸泡24 h,除去树脂中酸类化合物,蒸馏水洗至中性。浸泡在蒸馏水中待用。
1.6 静态优化试验
分别称取3 g处理后的大孔树脂:AB-8、D101、S-8、X-5、D4020,于100 mL锥形瓶中,加40 mL样品液。在室温下,以150 r/min转速摇动吸附12 h,吸取上清液,按照1.3方法测定吸光度。将吸附后树脂抽滤,倒入100 mL锥形瓶中,加入40 mL70%乙醇溶液。室温下,以150 r/min转速解吸12 h,吸取上清液,测定吸光度。通过静态吸附解吸,以总纯化率为指标,筛选最优树脂。

式中:C1为吸附前样品液的质量浓度(mg/mL);C2为吸附后流出液的质量浓度(mg/mL);C3为洗脱液的质量浓度(mg/mL);X1、X2、X分别为吸附率、解吸率和总纯化率。
1.6.1 溶解粗提物乙醇体积分数的选择
分别用蒸馏水、10%、20%、30%、40%、50%、60%、70%、80%、90%乙醇溶解粗提物干粉,按照1.3方法测定吸附液和解析液的吸光度,计算吸附率、解吸率和总纯化率。
1.6.2 最优大孔树脂的选择
AB-8、D101、S-8、X-5、D4020中总纯化率最高,为最优树脂,进行纯化试验。5种大孔树脂的参数见表1。
1.7 动态优化试验
1.7.1 流出液和洗脱液动态曲线
在上样流速3 mL/min、上样浓度1 mg/mL、上样量100 mL、上样pH值7、洗脱流速3 mL/min、洗脱乙醇70%的固定条件下:当样液吸附时,每3 min收集一管吸附后的流出液,直至流出液的吸光度接近于0;当用乙醇洗脱时,每3 min收集一管洗脱液,直至洗脱液的吸光度接近于0。
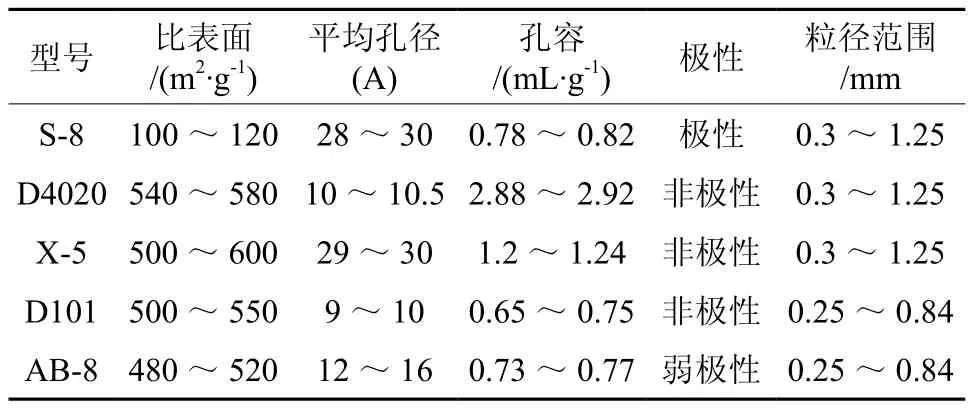
表1 5种大孔树脂的参数Table 1 Parameters of five macroporous resins
1.7.2 上样因素和洗脱因素对总纯化率的影响
在1.7.1中的固定条件下,分别考察上样浓度(mg/mL)、上样量(mL)、上样pH值、上样流速(mL/min)、洗脱流速(mL/min)、洗脱乙醇浓度(%)这6个因素对总纯化率的影响。
1.8 正交试验
在单因素的基础上,为了获取最佳工艺条件,筛选总纯化率变化较大的因素作为试验因素进行正交试验,并应用SPSS 19.0软件进行方差分析。
2 结果与分析
2.1 静态优化实验结果
2.1.1 溶解粗提物乙醇浓度的选择
由图1可知,随着乙醇体积分数的增大,S-8的吸附率变化很小,而且其吸附率都在93%以上,这可能是极性S-8大孔树脂与类黄酮极性基团形成较强的范德华力。其余4种树脂随着乙醇浓度的增大而减小,这可能是乙醇溶液的极性不断增大,非极性和弱极性的大孔树脂不能把类黄酮物质从极性较大的乙醇溶液中分离出来。
由图1可知,用蒸馏水溶解的吸附率最高,但经过一段时间的吸附后,溶液变得浑浊,故选取10%乙醇溶解类黄酮粗提物。
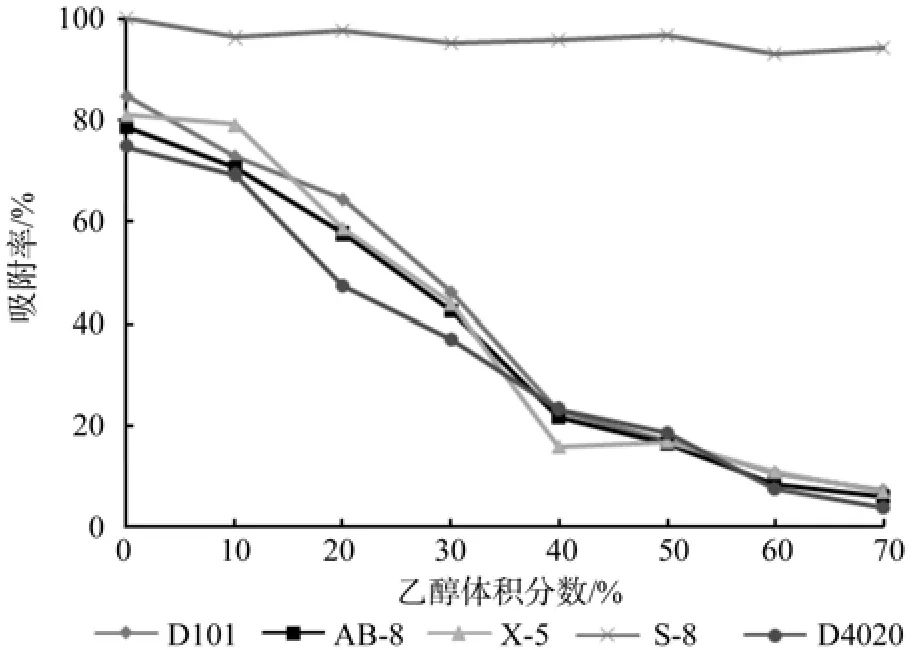
图1 不同体积分数乙醇溶解粗提物的吸附率Fig.1 Adsorption rates of different ethanol concentration to dissolve crude extracts
2.1.2 最优大孔树脂的选择
不同型号大孔树脂的吸附率、解吸率和总纯化率如图2~4所示。吸附能力方面,S-8>X-5>D101>AB-8>D4020(见图2);解吸能力方面,D101>D4020>X-5>AB-8>S-8(见图3);总纯化率方面,D101>X-5>D4020>AB-8>S-8(见图4)。由表1可知,S-8具有强极性,所以在吸附类黄酮时吸附率达到96%。也正是由于S-8与类黄酮形成了较强的极性键,乙醇溶液不能把类黄酮从大孔树脂上洗脱下来,总纯化率最低。因此,综合吸附率和解析率,以总纯化率高者为最优,最后确定D101为最优大孔树脂。
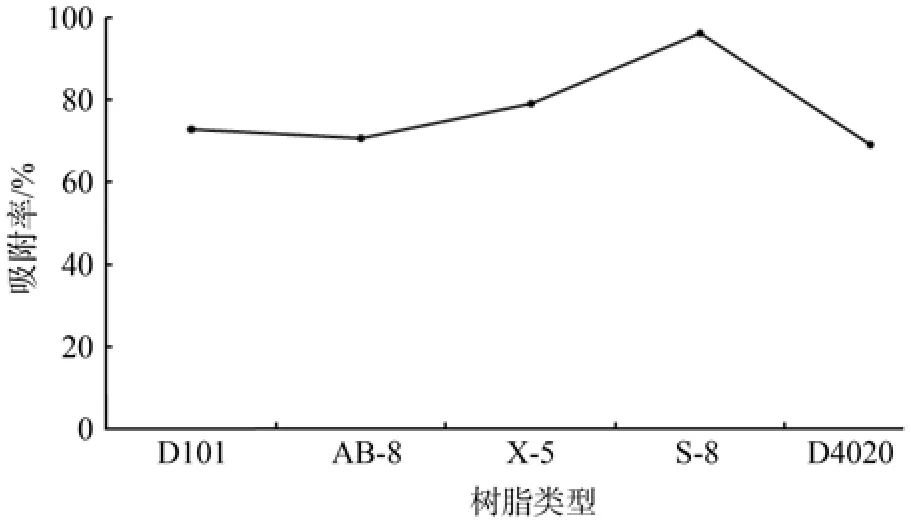
图2 不同类型大孔树脂的吸附率Fig.2 Adsorption rate change of different types of macroporous resins
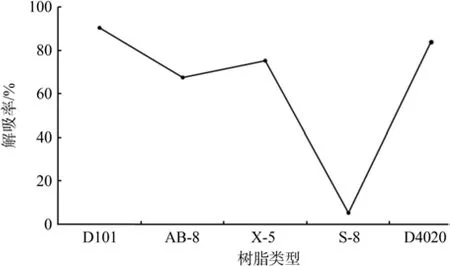
图3 不同类型大孔树脂的解吸率Fig.3 Desorption rate change of different types of macroporous resins
2.2 动态优化实验结果
2.2.1 流出液与洗脱液动态曲线
通过动态吸附与解吸曲线,可以确定收集流出液和洗脱液的大致时间,既能节约资源,又能减少试验的误差。
由图5可知,在上样时间12 min以前,流出液的吸光度小于0.005,可以舍弃,第12 min起开始收集流出液 ;在上样时间为39 min时,吸光度开始小于0.005且趋于0,故在第39 min起,停止收集流出液。
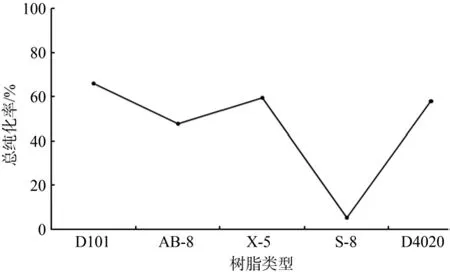
图4 不同大孔树脂的总纯化率Fig.4 Total puri fi cation rate change of different types of macroporous resins
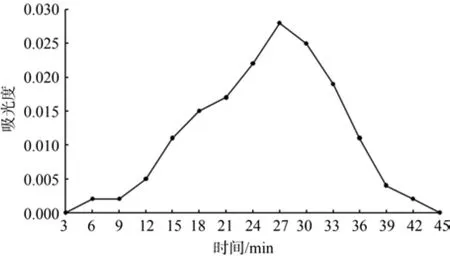
图5 流出液动态曲线Fig .5 Dynamic curve of ef fl uent liquid
由图6可知,在洗脱时间9 min以前,洗脱液吸光度很小,可以舍弃,第9 min起开始收集洗脱液;在洗脱时间为42 min时,吸光度开始趋于为0,因此可以在第45 min起,停止收集洗脱液。
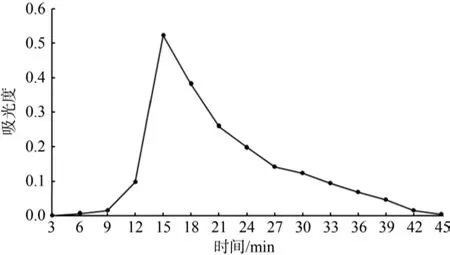
图6 洗脱液动态曲线Fig.6 Dynamic curve of eluent
2.2.2 上样质量浓度对总纯化率的影响
在1.7.1中的固定条件下,分别考察上样质量浓度(mg/mL )0.5、1.0、1.5、2.0、2.5、3.0 对总纯化率的影响。
由图7可知,上样质量浓度低时总纯化率也低,当质量浓度为1.5 mg/mL时达到最大,质量浓度继续增大,总纯化率会相应地降低。这可能由于质量浓度低,类黄酮物质能充分进入到大孔树脂内部,在洗脱时乙醇溶液不能完全把类黄酮从树脂深处洗脱出来;而随着质量浓度增大,大孔树脂在短时间内不能充分吸附即流出,吸附率降低,导致总纯化率下降。因此,从节约材料来看,应选取1.5 mg/mL作为最优条件。
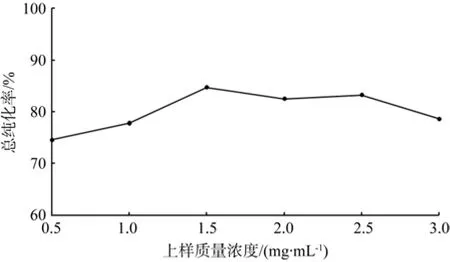
图7 上样质量浓度对总纯化率的影响Fig.7 Effect of sampling in fl ution concentration on total puri fi cation rate
2.2.3 上样流速对总纯化率的影响
在固定条件下,分别考察上样流速(mL/min)1、2、3、4、5对总纯化率的影响。由图8可知,在上样流速较慢时,总纯化率较低,可能是流速慢,样液中非类黄酮物质与大孔树脂吸附时间长,产生微弱的范德华力,洗脱时一起被洗出来,使总纯化率降低。当流速增大时,样液吸附时间短,吸附率低,导致总纯化率低。故选取3 mL/min作为最优条件。
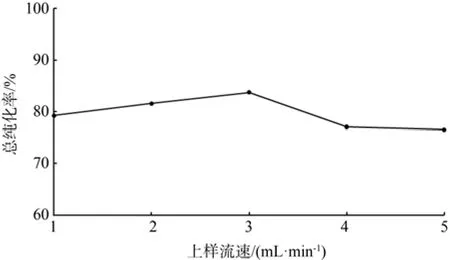
图8 上样流速对总纯化率的影响Fig.8 Effect of sampling fl ow rate to the total puri fi cation rate
2.2.4 上样量对总纯化率的影响
在固定条件下,分别考察上样量(mL)50、100、150、200、250对总纯化率的影响。
由图9可知,在上样量小于100 mL时,总纯化率较低,这可能是上样量少,大孔树脂能够把类黄酮充分吸附至孔隙内部,在洗脱时,不能完全地洗脱下来,解吸率低,导致总纯化率降低。当上样量增大时,样品液中类黄酮物质总量变多,使大孔树脂不能充分吸附,吸附率下降,总纯化率降低。在上样量为100 mL和150 mL时,总纯化率相近,从节约资源角度来看,选100 mL作为最佳上样量。
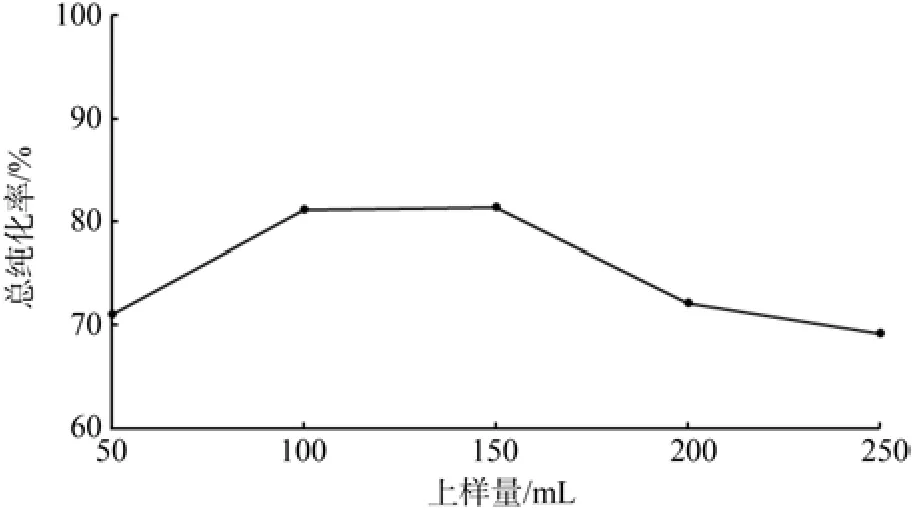
图9 上样量对总纯化率的影响Fig.9 Effect of sampling volume to total puri fi cation rate
2.2.5 上样pH值对总纯化率的影响
在固定条件下,分别考察上样pH值3、4、5、6、7、8、9对总纯化率的影响。
由图10可知,在上样液偏酸或偏碱时,总纯化率低,在pH值为5时,总纯化率最高。这可能是由于类黄酮为多羟基酚类物质,偏弱酸性,故在弱酸性溶液中较易吸附。而在强酸下,类黄酮易生成佯盐;在偏碱下,易破坏类黄酮的结构,都不利于类黄酮的吸附。
2.2.6 洗脱乙醇体积分数对总纯化率的影响
在固定条件下,分别考察洗脱乙醇体积分数(%)40、50、60、70、80、90对总纯化率的影响。
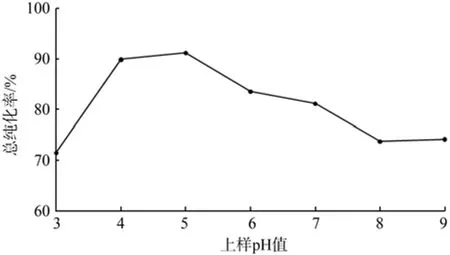
图10 上样pH值对总纯化率的影响Fig.10 Effect of sampling pH to total puri fi cation rate
由图11可知,用低体积分数乙醇洗脱时,总纯化率很低,随着乙醇体积分数的增加,总纯化率随之变大。在乙醇体积分数为70%时,总纯化率达到最大值。这是由于相似相溶的原理,70%乙醇的极性与类黄酮的极性相近,在洗脱时能最大限度地把类黄酮物质从树脂上解吸下来。在用90%乙醇洗脱时,洗脱液浑浊,且无峰值,可能是把其他杂质同时洗脱下来,造成污染。
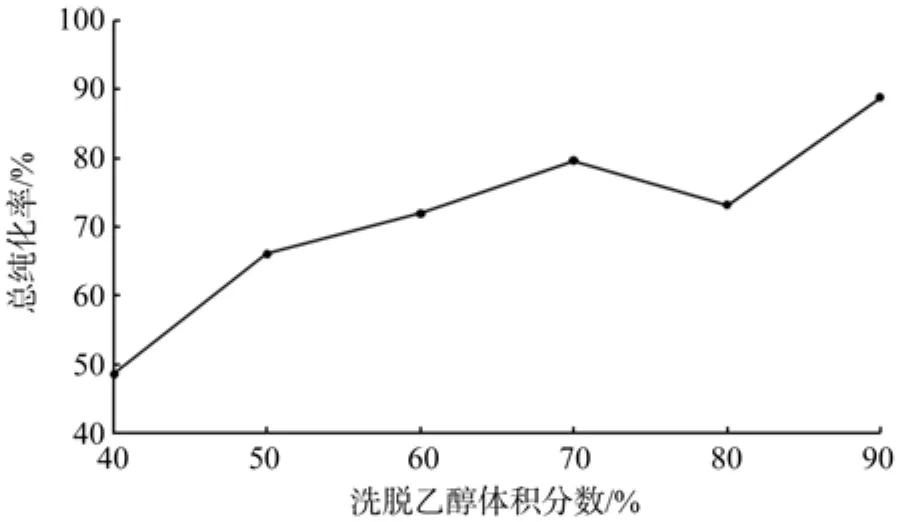
图11 洗脱乙醇浓度对总纯化率的影响Fig.11 Effect of sampling eluent concentration to total puri fi cation rate
2.2.7 洗脱流速对总纯化率的影响
在固定条件下,分别考察洗脱流速(mL/min)1、2、3、4、5对总纯化率的影响。
由图12可知,洗脱流速为3 mL/min时,总纯化率最大。在低流速时,可能由于流速太慢,洗脱下来的类黄酮又被重新吸附;流速过快,洗脱乙醇与类黄酮物质接触时间短,不能完全从树脂上分离下来。洗脱率降低,导致总纯化率下降。
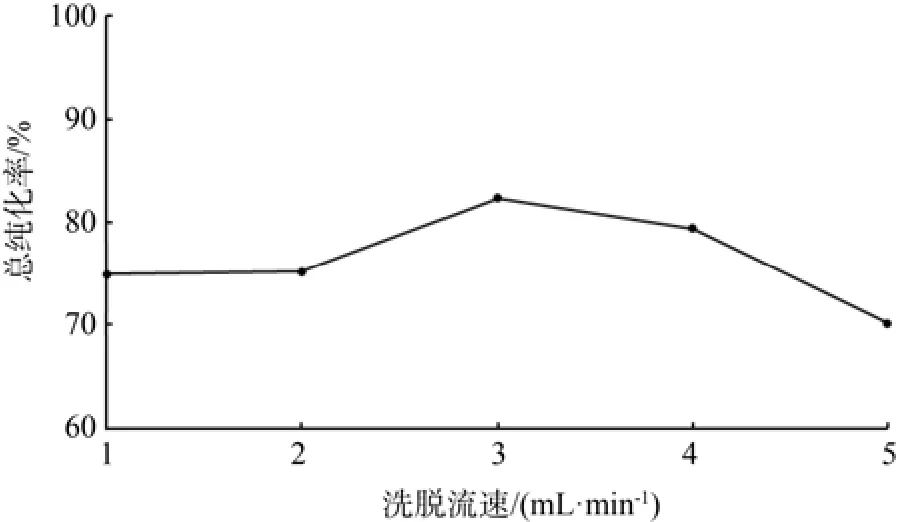
图12 洗脱流速对总纯化率的影响Fig.12 Effect of sampling eluent rate to total puri fi cation rate
2.3 正交试验结果分析
根据单因素实验结果,可知上样质量浓度(mg/mL)、上样pH值、洗脱乙醇体积分数(%)、洗脱流速(mL/min)在不同梯度下,总纯化率的变化明显。因此,选这4个因素做L16(45)正交试验。
以总纯化率为指标,大孔树脂纯化紫穗槐叶类黄酮的正交实验结果见表3和表4。
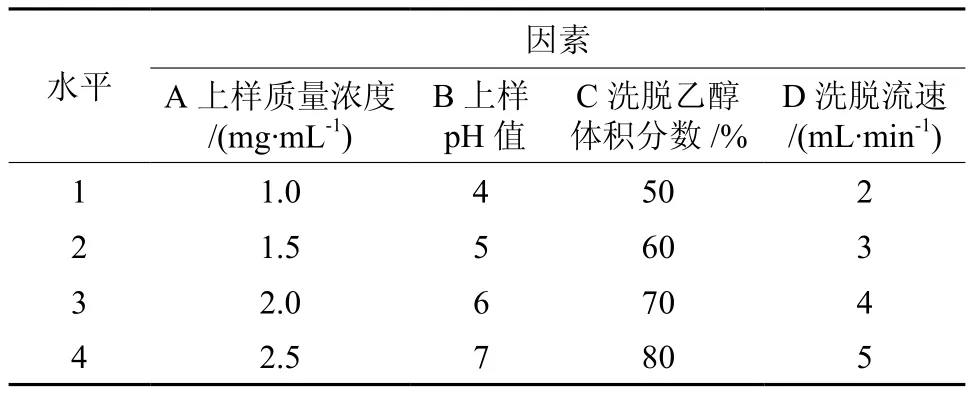
表2 正交实验因素与水平Table 2 Factors and levers of orthogonal array design
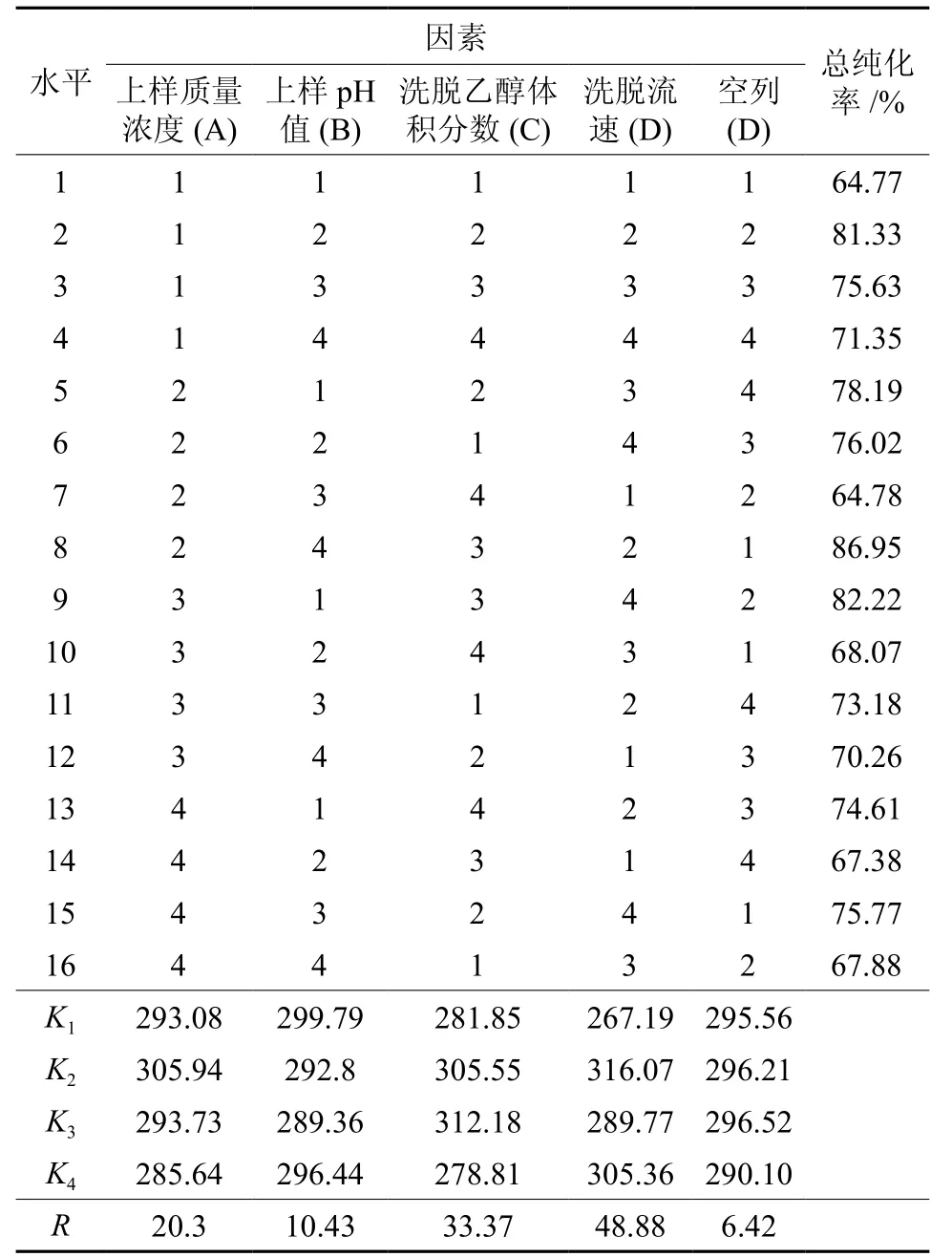
表3 正交实验设计及结果Table 3 Orthogonal array design and results
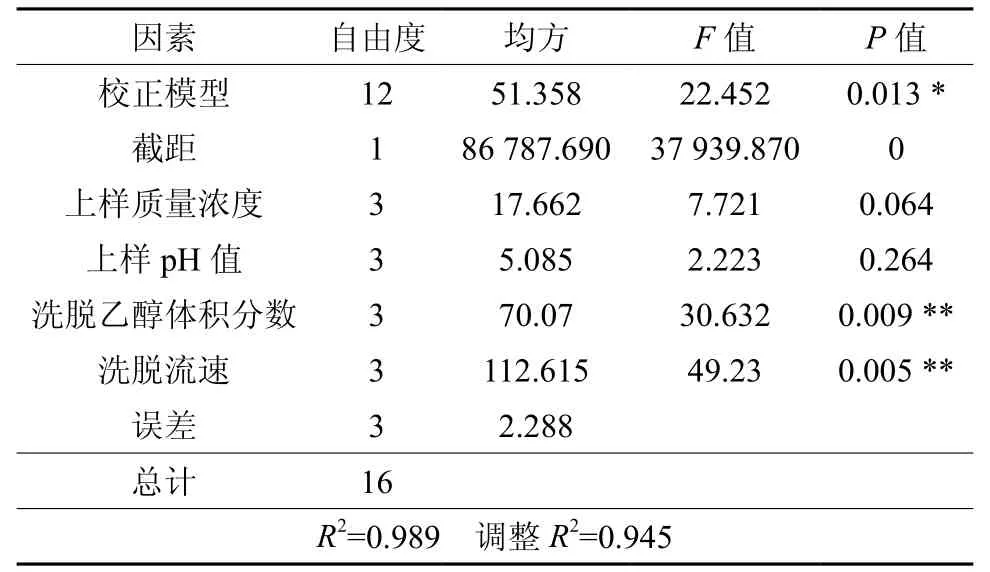
表4 正交实验方差分析†Table 4 Variance analysis on experimental results of orthogonal array design
由表3极差分析可知,各因素对总纯化率的影响顺序为:洗脱流速>洗脱乙醇>上样质量浓度>上样pH值。因为E为空列,且R值最小,所以符合设计要求。最佳搭配为A2B1C3D2。由表4方差分析可知,校正模型的P=0.013<0.05,所以该模型能很好地描述各个因素对总纯化率影响的差异性。4个因素中,洗脱流速、洗脱乙醇体积分数对总纯化率的影响极显著,上样质量浓度和上样pH值对总纯化率的影响不显著。综合分析,确定最佳大孔树脂纯化类黄酮的工艺条件为:上样质量浓度1.5 mg/mL、上样pH值4、洗脱乙醇体积分数70%、洗脱流速3 min/mL。在此条件下平行试验5次,平均总纯化率为87.35%。
2.4 纯化前后的比较
将紫穗槐叶的类黄酮提取液进行旋转蒸发、冷冻干燥,得到类黄酮粗提物干粉,按照1.3方法测定粗提物中类黄酮的含量。然后将粗提物的干粉配置成1.5 mg/mL的上样液,按照最佳工艺条件进行纯化。分别做5次平行实验,纯化前类黄酮的平均含量为18.9%,纯化后类黄酮的平均含量为56.2%,纯化后较纯化前提高了2.9倍。
3 结论与讨论
本文应用D101大孔树脂吸附技术进行纯化,以吸附率、解吸率和总纯化率为纯化指标做静态和动态吸附,研究大孔树脂纯化类黄酮物质的工艺条件。结果表明:(1)静态实验中,确定D101在10%乙醇溶液中对类黄酮物质吸附解吸效果最好,总纯化率达65.88%,优于其他型号的大孔树脂。(2)动态实验中,确定类黄酮溶液配制成1.5 mg/mL,pH值4的上样液,以3 mL/min的流速,100 mL体积的样品液上样,再用70%乙醇,以3 mL/min的流速进行洗脱。(3)优化工艺条件下,收集洗脱液,经过旋转蒸发、冷冻干燥制得纯化后的类黄酮物质。经测定类黄酮物质的含量由纯化前的18.9%变成56.2%,提高了2.9倍。因此,运用大孔树脂吸附技术能对类黄酮物质进行很好的分离纯化 。
大孔树脂吸附与解吸特性与它的化学结构、孔隙率、孔径、颗粒大小和表面积有关[20]。本实验发现树脂孔径与纯化率有很大的关系。在5种树脂中,D101的孔径最小,但总纯化率最高。可能因为不同植物材料提取的类黄酮不同,紫穗槐叶中类黄酮分子结构较小,大孔径树脂泄露的类黄酮多,而小孔径树脂能吸附得更充分,这与刘静等[21]应用D101纯化有柄石韦总黄酮的结果相同。上样质量浓度也可能与树脂孔径有关系。当上样质量浓度较大时,提取物会覆盖在树脂表面,D101孔径小进入树脂内部的提取物速度慢,没完全吸附就流走了;而上样质量浓度较小时,D101能充分吸附,从而总纯化率就会提高。杨佳等[22]在研究D101纯化脐橙皮中橙皮苷时,确定上样质量浓度为0.2 mg/mL,橙皮苷含量达到91.41%,富集倍数为1.49倍,回收率为 70.27%。黄荣等[23]利用D101研究火棘果总黄酮的提取和纯化时,确定上样质量浓度为0.899 mg/mL,纯度由原来的9.00% 提高至 28.11 %。而相比较X-5孔径最大,需要的上样质量浓度就大。葛亮等[24]用X-5研究天山雪莲黄酮类成分大孔树脂纯化时,确定上样质量浓度为50 mg/mL。因此,选择合适的树脂类型,并对其参数进行深入分析,有利于纯化效率。
由本文可知,大孔树脂纯化类黄酮物质需要控制的因素很多,所以需要前期科学的实验设计和后期精准的操作。经大孔树脂纯化,类黄酮化合物纯度得到了显著的提高,与陈志科等[25]研究相符。这就为以后运用高效液相色谱、核磁共振等高科技手段分析类黄酮单体和单体结构奠定了基础。
[1]中国药科大学 . 中药辞海 [M]. 北京 : 中国医药科技出版社 ,1997: 563-565.
[2]颜淑云,周志宇,邹丽娜,等. 干旱胁迫对紫穗槐幼苗生理生化特性的影响[J].干旱区研究,2011,38(1):139-143.
[3]雷丽丽,李 杨. 辽北地区紫穗槐育苗技术措施[J].农民致富之友,2014,2(下半月):104.
[4]王 芳,高 瑾,张 艳,等.白三叶草黄酮含量及其抑菌活性研究[J].中南林业科技大学学报,2015,35(3):43-47.
[5]孙业良,姜明杉,陈 暄,等.基于响应面分析法对绿茶中黄酮提取工艺的优化[J].经济林研究,2009,27(3):33-37.
[6]刘 璐,付明哲,刘 侠,等. 植物黄酮类化合物提取及测定方法研究进展[J].动物医学进展,2011,32(6):151-155.
[7]Somleva T,Ognyanov I. New rotenoids in Amorpha fruticosa fruits[J]. Plant Medica.,1985,51(3): 219-221.
[8]Masayoshi O,Toshiyuki Y,Munekazu I. Aprenylated fl avanone from roots of Amorpha fruticosa[J]. PHytochemistry,1998,48(5): 907-909.
[9]王 明,李阿娜,张伟伟,等. 园林植物叶片中多酚及总黄酮含量与病虫害的关系[J].经济林研究,2010,28(2):42-48.
[10]王 倩,常丽新,唐红梅. 黄酮类化合物的提取分离及其生物活性研究进展[J]. 河北理工大学学报,2011,33(1):110-115.
[11]彭程程,王青山,赵国祥,等. 黄酮类化合物的研究进展[J].农产品加工,2010,5:38-41.
[12]刘 湘,汪秋安. 天然产物化学[M].北京:化学工业出版社,2005.
[13]欧 霞,李劲平,佘志坚,等. 高速逆流色谱法在天然药物研究中的应用概况[J].中南药学,2014,12(3):246-250.
[14]林春梅. 聚酰胺层析法分离纯化牛蒡叶中的总黄酮[J].食品与发酵工业,2014,40(2):236-238.
[15]PANYG,VELOE,PUIGJANER L.Pyrolysisof blends of biomass withpoor coals[J].Fuel,1996,75 (4):412-418.
[16]BLACQUEOE,PERENSEA. Functional genomics of the cilium,a sens ory organelle[J]. Current Biology,2005,15(10):935-941.
[17]徐 宽,杨栋梁,刘佳佳,等.大孔树脂纯化萼翅藤总黄酮工艺[J].化学工程,2012,40(9):64-68.
[18]陈学泽,甘正伟. 用大孔吸附树脂分离纯化香薷总黄酮[J].中南林业科技大学学报,2012,32(2):105-108.
[19]普义鑫,周文化,李 岚,等. 用大孔树脂纯化槟榔多酚的工艺条件优化[J]. 中南林业科技大学学报,2012,32(2):100-104.
[20]Ma C,Tao G,Tang J,et al. Preparative separation and puri fi cation of rosavin in Rhodiola rosea by macroporous adsorption resins[J].Separation and Puri fi cation Technology,2009,69:22-28.
[21]刘 静,程丹丹,辛晓伟,等. 大孔树脂分离纯化有柄石韦总黄酮的工艺优化[J].亚热带植物学,2014,43(3):202-205.
[22]杨 佳,张国文,汪佳蓉,等. 大孔树脂分离纯化脐橙皮中橙皮苷的工艺研究[J].食品科技,2010,35(6):210-213.
[23]黄 荣,傅小红. 火棘果总黄酮的提取和纯化研究[J].化学研究与应用,2014,26(5):690-695.
[24]葛 亮,豆浩然,张 晋,等. 天山雪莲黄酮类成分大孔树脂纯化工艺优选[J].中国实验方剂学杂志,2014,20(7):1-3.
[25]陈志科,谢碧霞.大孔树脂对竹叶黄酮的吸附分离特性研究[J].经济林研究,2003,21(3):1-4.
[26]许 伟,姜惠仙,郑 剑,等.水酶法提取板栗壳棕色素工艺条件的筛选[J].经济林研究,2015,33(2):101-106.
Separation and puri fi cation of fl avones in Amorpha fruticosa leaf by macroporous adsorption resins
WANG Jing-hong,WANG Fei,YANG Cheng-wu,LIU Su-xin,ZHANG Xiu-mei,DUO Duo,CHEN Ai
(College of Landscape Architecture,Northeast Forestry University,Harbin 150040,Heilongjiang,China)
In order to selecting the most optimal macroporous resins,the optimalized process conditions of separation and puri fi cation for fl avones in Amorpha fruticosa. leaves by macroporous adsorption resin were studied. With the total puri fi cation rate as the evaluation index,under the static absorption and desorption,the ethanol concentrations for the most optimal macroporous resin and crude extractings from dissolved fl avones were screened out. Under the dynamic absorption and desorption,by using orthogonal experiment design of single factor,the effects of injecting concentration,sampling flow rate,sampling volume,sampling pH,eluting ethanol concentration,elution fl ow rate on the total puri fi cation rate were investigated,and the optimum process conditions were obtained. The results show that with 10% ethanol,the crude extracts of fl avones were dissolved; with D101 macroporous resins,the puri fi ed sample solution was separated and puri fi ed; the optimum technology were determined as follows: sampling concentration 1.5 mg/mL,sampling fl ow rate 3 mL/min,sampling volume 100 mL,sampling pH=4,eluting ethanol concentration 70%,the elution fl ow rate 3 mL/min. With the optimum technology conditions,the fl avones in A. fruticosa leaves can be scienti fi cally and rationally separated and puri fi ed,the yield rate of fl avones content was 56.2%,was 2.9 times more than that of before puri fi ed (18.9%).
Amorpha fruticosa; Amorpha fruticosa leaves; fl avones; macroporous adsorption resin; separation and puri fi cation
S759.8
A
1673-923X(2016)01-0112-07
10.14067/j.cnki.1673-923x.2016.01.019
2015-03-16
中央高校基本科研业务费专项资金项目(2572014CA27)
王竞红,副教授,博士 通讯作者:王 非,副教授;E-mail:175494899@qq.com
王竞红,王 非,杨成武,等. 大孔吸附树脂分离纯化紫穗槐叶类黄酮的研究[J].中南林业科技大学学报,2016,36(1):112-118.
[本文编校:谢荣秀]
