基于分子对接技术探讨赤芍治疗胆汁淤积型肝炎作用机制的研究
2016-12-19周厚琴黄银秋陆小华赵艳玲
周厚琴,王 建,李 洋,黄银秋,张 璐,陆小华,赵艳玲
(1.成都中医药大学药学院,四川 成都 611137; 2.解放军第302医院药学部,北京 100039)
基于分子对接技术探讨赤芍治疗胆汁淤积型肝炎作用机制的研究
周厚琴,王 建,李 洋,黄银秋,张 璐,陆小华,赵艳玲
(1.成都中医药大学药学院,四川 成都 611137; 2.解放军第302医院药学部,北京 100039)
目的:利用分子对接技术,探讨赤芍中的芍药苷、芍药内酯苷、丹皮酚等4种有效成分分别与法尼酯衍生物X受体(farnesoid X receptor,FXR)的相互作用。方法:采用Autodock 4.2软件进行分子对接。结果:得出芍药苷、芍药内酯苷、丹皮酚等与FXR蛋白1号位点和2号位点以及FXRα蛋白的结合结果。芍药苷、芍药内酯苷、丹皮酚与FXRα蛋白结合的自由能分别为-13.44、-21.77、-16.45 kJ/mol,与FXR蛋白1号位点的自由能分别为-18.21、-48.60、-49.52 kJ/mol,与FXR蛋白2号位点的自由能分别为-15.32、-24.70、-18.59 kJ/mol。结论:芍药苷、芍药内酯苷、丹皮酚与FXR蛋白具有较小的自由能,即结合作用较强。提示赤芍治疗胆汁淤积型肝炎的作用机制可能为其主要成分与FXR受体蛋白具有较强结合作用,引起FXR调节其相应靶基因的表达,从而调控胆汁酸的合成和代谢以达到保肝利胆的作用,为进一步研究赤芍治疗胆汁淤积型肝炎的分子机制提供了理论参考。
芍药苷; 芍药内酯苷; 丹皮酚; 分子对接; FXR
在我国,肝病的发病率极高,各种肝病都有可能致胆汁淤积。肝内胆汁淤积指由胆汁形成、分泌及排泄障碍导致胆汁在肝细胞或胆管内蓄积,阻塞胆管,从而引起肝脏病变[1-2]。随着病情的进一步发展,肝内胆汁淤积可发展为肝纤维化、肝硬化,甚至导致慢性肝衰竭[3]。 因此,及时治疗胆汁淤积对于延缓肝病的进程具有重要意义。目前,胆汁淤积的发病机制尚未明确,临床仍缺乏特异性髙、疗效好、副作用小的治疗药物[4]。随着肝胆系统内的一些核受体和转运体被相继发现,人们对胆汁淤积型肝炎的分子机制有了进一步认识,核受体及转运体在应激反应中的作用成为了研究热点[5]。研究结果显示,法尼酯衍生物X受体(farnesoid X receptor,FXR)作为胆汁酸代谢的调节因子,可通过调控相应的基因抑制胆汁酸的合成,同时增加胆汁酸的排泄,避免肝细胞产生胆汁酸超负荷和过多堆积而造成组织损伤。徐美丽等[4]研究结果显示,龙胆水提取物可通过FXR及其靶基因治疗大鼠胆汁淤积疾病,并揭示其机制可能是通过药物激活FXR的表达,被激活的FXR通过调控其他基因而减少胆汁酸的合成,并促进胆汁酸从肝细胞向胆小管转运,同时还可减少胆汁酸由门静脉向肝细胞回入,最后使胆汁酸获得新的动态平衡,从而达到对急性肝内胆汁淤积型肝炎退黄保肝的药理效应。
赤芍为毛茛科植物芍药paeoniaLactiflorapall.或川赤芍PaeoniaveitchiiLynch.的干燥根。赤芍苦,微寒,归肝经,具有清热凉血、散瘀止痛之效[6],用于温毒发斑、目赤肿痛、肝郁胁痛等[7]。其主要成分为芍药苷、芍药内酯苷、丹皮酚等[1],芍药苷为其主要有效成分。药理及临床研宄结果显示,赤芍具有保肝、抗凝血、抗血栓、抗炎及多途径抑制自身免疫反应等多种药理作用,在临床上用于治疗胆汁淤积型肝炎尤其是重度黄疸的疗效显著[8]。但目前关于赤芍治疗胆汁淤积型肝炎的机制研究的报道并不多见。最初,科学家在基于分子水平来研究生物体系中的化学问题时提出了分子对接方法。1894年,Fisher用“锁和钥匙”来比喻酶与底物的专一性结合,称为识别。同时,Langley提出了受体学说,指出大多数药物与细胞膜上或细胞内某些特定分子结合来发生效应,而这些特定的分子被称作受体[9]。所以,在受体学说中与分子对接中,受体的概念基本相同,其为分子对接方法奠定了理论基础。本研究采用Autodock软件模拟预测赤芍中4种主要成分芍药苷、芍药内酯苷、芍药花苷、丹皮酚等与FXR的相互作用,为探究赤芍治疗胆汁淤积型肝炎的相关作用机制提供参考。
1 材料与方法
1.1 材料
Autodock 4.2软件来源于美国斯克利普斯研究所(autodock.scripps.edu);所有蛋白受体晶体结构来源于蛋白质数据库(http://www.rcsb.org)。软件运行于Linux操作平台下。相关软件均为已授权或免费授权的软件。
1.2 方法
1.2.1 结构预处理:芍药苷、芍药内酯苷、丹皮酚等化学结构来源于中医药资料库(http://tcm.cmu.edu.tw);在蛋白质数据库晶体结构数据库(http://www.rcsb.org)中找寻蛋白受体的结构:FXRα的结构,见图1(A),提取码为4OIV;FXR的结构,见图1(B),提取码为4QE6,为FXR与鹅去氧胆酸和类固醇受体激活蛋白2的复合物晶体结构。查阅文献发现,4QE6蛋白受体具有2个结合位点,分别标注4QE61和4QE62。对接模拟前,将所有配体从蛋白受体复合物中去除,随后得到FXR和FXRα蛋白,此时加上极性氢原子及电荷,最后与芍药苷、芍药内酯苷、丹皮酚进行分子对接。

A. FXRα蛋白;B.FXR蛋白A.FXRα protein;B.FXR protein图1 FXRα、FXR蛋白的结构Fig 1 Structure of FXRα and FXR protein
1.2.2 Autodock分子对接运用:采用Autodock 4.2软件预测芍药苷、芍药内酯苷、丹皮酚与蛋白受体的结合,用Autogrid计算格点能量,对接运算采用拉马克遗传算法,芍药苷、芍药内酯苷、丹皮酚与FXR蛋白受体之间的结合情况用半经验的自由能计算方法评价。参数设置过程中,将参数“maximum number of energy evaluations”改为 2 500 000,“运行次数”改为100,其他参数采用软件的默认设置。根据相关文献报道,确定各蛋白活性口袋的氨基酸残基和中心点坐标,4OIV的氨基酸残基包括Pro368、Tyr365、Phe370、Met369、Ile356、Tyr373、Phe333、His298、Trp458、Val460,中心点为0.375、9.574、18.816、-30.061;4QE6-1的氨基酸残基为His294、Val297、Gln263、Arg331、Led298、Dhe301、Tyr260、Ser259、Thr386,中心点为0.375、3.431、-20.47、18.411;4QE6-2的氨基酸残基为Met328、Ala291、Led287、Thr288、Trp469,中心点为0.375、11.912、-11.442、12.952。
2 结果
经Autodock运算分析,得到芍药苷、芍药内酯苷、丹皮酚与FXR和FXRα等2个蛋白受体结合的复合结果。对接信息包括半经验化的自由能评价评分、抑制常数值、对接模拟温度。对于多构象的对接结果,选取前3位的对接构象结果。芍药苷、芍药内酯苷、丹皮酚与FXRα的结合自由能取其第1个值,分别为-13.44、-21.77、-16.45 KJ/mol,抑制常数分别为 4.450、0.153、1.310 μmol/L,见表1。
表1 芍药苷、芍药内酯苷、丹皮酚与FXRα蛋白(4OIV)受体分子对接信息
Tab 1 Paeoniflorin, albiflorin, paeonol and FXRα protein (4OIV) receptor molecular docking information

蛋白名蛋白号配体名配体号自由能/(kJ/mol)抑制常数/(μmol/L)温度/KFXRα4OIV芍药苷SYG-13 444 450298 15-13 274 740298 15-13 145 010298 15芍药内酯苷SYNZ-21 770 153298 15-21 560 168298 15-20 640 244298 15丹皮酚DPF-16 451 310298 15-16 161 490298 15-15 531 900298 15
通过Autodock自带的分析程序,分析得到了FXRα蛋白和芍药苷、芍药内酯苷、丹皮酚的最佳对接构象及其相关作用方式。芍药苷与FXRα蛋白结合的空间构型见图2,对应表1中芍药苷的对接结果。结果显示,芍药苷与FXRα蛋白中Lej444、Val329的氨基酸残基有相应的相互作用。图2(A)中显示,芍药苷与Tyr365、Val329、Lcu444有氢键相互作用,其键长分别为2.94、2.92、2.7和2.53,除此之外,另有数个氨基酸残基与芍药苷之间具有疏水作用但并没有形成相关配位键或氢键。另外,对应表1中芍药内酯苷的对接结果发现,芍药内酯苷与FXRα蛋白中Ala328、Gly326、Leu324、Leu469、Leu468的氨基酸残基有相应的相互作用,如图2(B)所示,还与Leu469、Gly326、Ala328、Leu324形成氢键相互作用,键长分别为3.29、2.64、3.32、2.56。而其他几个氨基酸残基与芍药内酯苷之间具有疏水作用但没有形成相关配位键或氢键。结合表1中丹皮酚相应的对接结果发现,丹皮酚与FXRα蛋白中Val329的氨基酸残基有相互作用。且如图2(C)所示,丹皮酚与仅与数个氨基酸残基之间具有疏水作用但没有形成相关配位键或氢键。芍药苷、芍药内酯苷、丹皮酚与FXRα蛋白(4OIV)的对接交互作用二维平面图见图3。

A.芍药苷;B.芍药内酯苷;C.丹皮酚A.Paeoniflorin;B.Albiflorin;C.Paeonol图2 芍药苷、芍药内酯苷、丹皮酚与FXRα蛋白(4OIV)的对接空间位置示意图Fig 2 Paeoniflorin, albiflorin, paeonol and FXRα protein(4OIV)docking space position

A.芍药苷;B.芍药内酯苷;C.丹皮酚A.Paeoniflorin;B.Albiflorin;C.Paeonol图3 芍药苷、芍药内酯苷、丹皮酚与FXRα蛋白(4OIV)的对接交互作用二维平面图Fig 3 Paeoniflorin, albiflorin, paeonol and FXRα protein(4OIV)docking interactions 2D plane picture
FXR的1号位点(4QE6-1)与芍药苷、芍药内酯苷、丹皮酚的结合自由能取其第1个值分别为-18.21、-48.60、-49.52 kJ/mol,而抑制常数分别为2.07、215.76、2.97 μmol/L,见表2。
表2 芍药苷、芍药内酯苷、丹皮酚与FXR1号位点蛋白(4QE6-1)受体分子对接信息
Tab 2 Paeoniflorin, albiflorin, paeonol and FXRα protein No.1 spot(4QE6-1)receptor molecular docking information
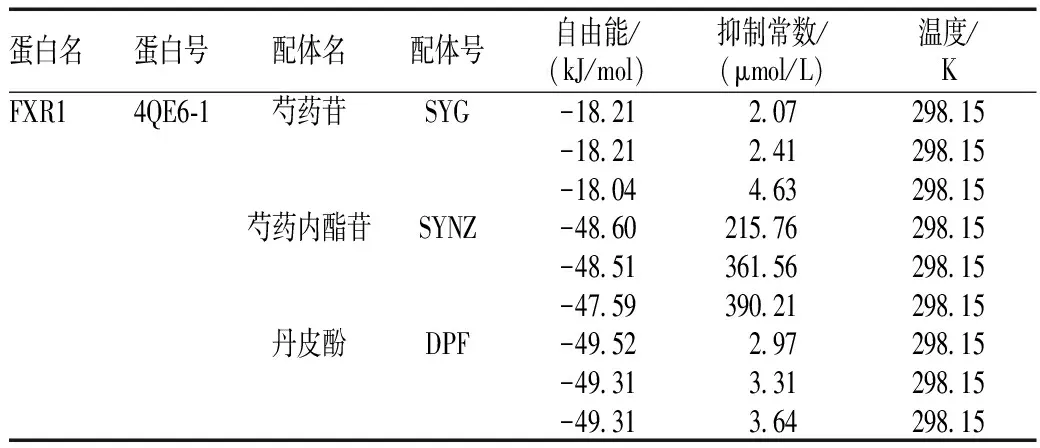
蛋白名蛋白号配体名配体号自由能/(kJ/mol)抑制常数/(μmol/L)温度/KFXR14QE6⁃1芍药苷SYG-18 212 07298 15-18 212 41298 15-18 044 63298 15芍药内酯苷SYNZ-48 60215 76298 15-48 51361 56298 15-47 59390 21298 15丹皮酚DPF-49 522 97298 15-49 313 31298 15-49 313 64298 15
FXR蛋白1号位点(4QE6-1)和芍药苷、芍药内酯苷、丹皮酚的最佳对接构象及其相关作用方式见图4。结合图4(A)中芍药苷与4QE6-1蛋白结合的空间构型和表2中芍药苷与4QE6-1的对接结果发现,芍药苷与4QE6-1蛋白中Ala327的氨基酸残基有相互作用,结合图5(A)发现,芍药苷与Ala327、Ile256均存在氢键的相互作用,有数个氨基酸残基与芍药苷之间具有疏水作用没有形成相关配位键或氢键。如图4(B)所示,芍药内酯苷与4QE6-1蛋白中Glu334的氨基酸残基有相应的相互作用,结合图5(B)发现,芍药内酯苷与Glu334有氢键的相互作用,其键长为2.85,且与数个氨基酸残基之间具有疏水作用但没有形成相关配位键或氢键。结合图4(C)和表2中丹皮酚相应的对接结果显示,其与4QE6-1蛋白中Ala383的氨基酸残基有相应的相互作用,且两者间存在氢键的相互作用,其键长为2.80,如图5(C),还与几个氨基酸残基之间具有疏水作用但没有形成相关配位键或氢键。

A.芍药苷;B.芍药内酯苷;C.丹皮酚A.Paeoniflorin;B.Albiflorin;C.Paeonol图4 芍药苷、芍药内酯苷、丹皮酚与FXR1号位点蛋白(4QE6-1)的对接空间位置示意图Fig 4 Paeoniflorin, albiflorin, paeonol and FXRα protein No.1 spot(4QE6-1)docking space position
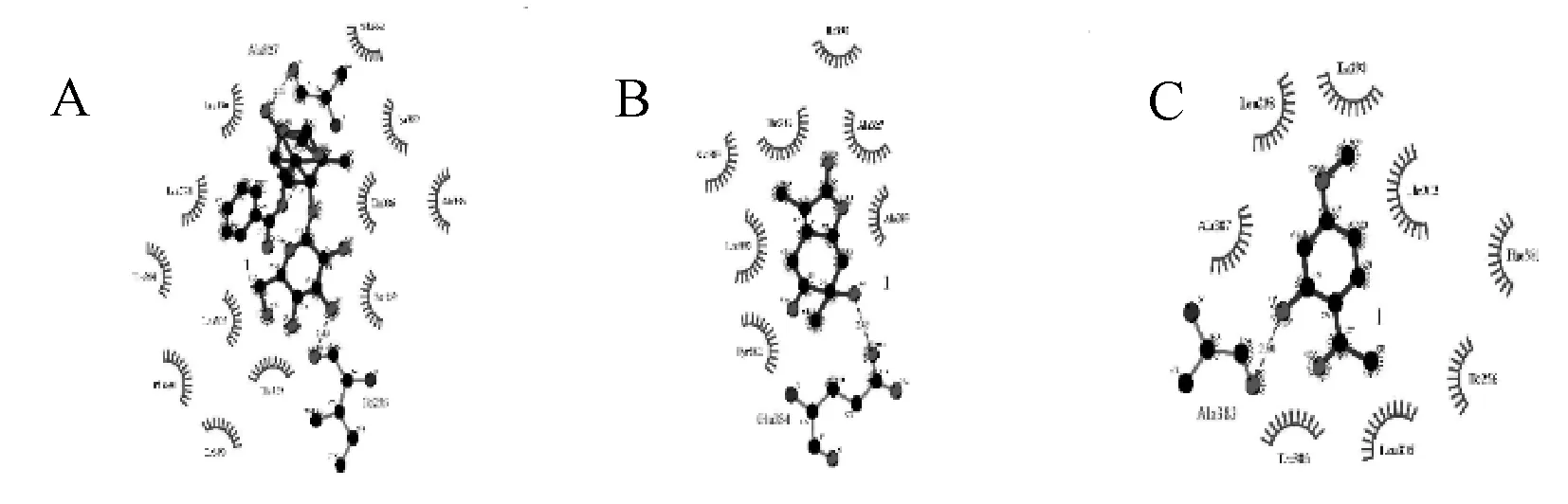
A.芍药苷;B.芍药内酯苷;C.丹皮酚A.Paeoniflorin;B.Albiflorin;C.Paeonol图5 芍药苷、芍药内酯苷、丹皮酚与FXR1号位点蛋白(4QE6-1)的对接交互作用二维平面图Fig 5 Paeoniflorin, albiflorin, paeonol and FXRα protein No.1 spot(4QE6-1)docking interactions 2D plane picture
另外,芍药苷、芍药内酯苷、丹皮酚与FXR2号位点的结合自由能取第1个值分别为-15.32、-24.70、-18.59 kJ/mol,其抑制常数分别为2.080 00、0.047 40、0.559 31 μmol/L,见表3。
表3 芍药苷、芍药内酯苷、丹皮酚与FXR2号位点蛋白(4QE6-2)受体分子对接信息
Tab 3 Paeoniflorin, albiflorin, paeonol and FXRα protein No.1 spot(4QE6-2)receptor molecular docking information

蛋白名蛋白号配体名配体号自由能/(kJ/mol)抑制常数/(μmol/L)温度/KFXR24QE6⁃2芍药苷SYG-15 322 08000298 15-14 992 39000298 15-12 985 37000298 15芍药内酯苷SYNZ-24 700 04740298 15-23 900 06516298 15-23 780 06843298 15丹皮酚DPF-18 590 55931298 15-18 420 59476298 15-17 460 87937298 15
芍药苷、芍药内酯苷、丹皮酚与FXR蛋白2号位点(4QE6-2)的最佳对接构象及其相关作用方式见图6—7。结合表3中芍药苷与4QE6-2蛋白的对接结果和其空间构型[如图6(A)]发现,芍药苷与4QE6-2蛋白中His447、Typ361、Ser358的氨基酸残基产生相互作用,且与Ser332、His447、Tyr361、Ile357、Ile353均存在氢键的相互作用,尤其是与His447作用最强,具有双重氢键,氢键键长分别为2.84、2.81和3.30、2.91、2.64、2.54,结合图7(A)发现,还与数个氨基酸残基之间具有疏水作用但没有形成相关配位键或氢键。同样发现,芍药内酯苷与4QE6-2蛋白中His447、Ala291、His294的氨基酸残基产生相应的相互作用,如图6(B);并与Ala291、His294具有氢键的相互作用,其键长为2.65、2.93,如图7(B),另外其还与几个氨基酸残基之间具有疏水作用但没有形成相关配位键或氢键。结合图6(C)和表3中丹皮酚与4QE6-2蛋白的对接结果发现,丹皮酚与4QE6-2中His294、Ile468、His447的氨基酸残基发生相应的相互作用,并与His447、Ile468具有氢键的相互作用,其键长分别为3.03、3.13,如图7(C),同时丹皮酚还和几个氨基酸残基之间具有疏水作用但没有形成相关配位键或氢键。

A.芍药苷;B.芍药内酯苷;C.丹皮酚A.Paeoniflorin;B.Albiflorin;C.Paeonol图6 芍药苷、芍药内酯苷、丹皮酚与FXR2号位点蛋白(4QE6-2)的对接空间位置示意图Fig 6 Paeoniflorin, albiflorin, paeonol and FXRα protein No.1 spot(4QE6-2)docking space position

A.芍药苷;B.芍药内酯苷;C.丹皮酚A.Paeoniflorin;B.Albiflorin;C.Paeonol图7 芍药苷、芍药内酯苷、丹皮酚与FXR2号位点蛋白(4QE6-2)的对接交互作用二维平面图Fig 7 Paeoniflorin, albiflorin, paeonol and FXRα protein No.1 spot(4QE6-2)docking interactions 2D plane picture
3 讨论
分子对接方法在药物设计方法中是一种比较成熟的直接的药物设计方法。从已知结构的受体(靶蛋白或活性位点)和配体出发,通过化学计量学方法模拟分子的几何结构和分子间作用力来进行分子间相互作用识别并预测受体-配体复合物结构的方法即为分子对接[10]。
FXR是核受体家族中一员,与机体中胆汁酸代谢、脂质代谢、糖代谢密切相关[11],尤其在胆汁酸代谢和维持胆汁酸内稳态方面尤为重要[12]。生理情况下胆汁酸促进FXR的表达[13-15],FXR与胆汁酸结合,其空间构象发生改变,并上调靶基因转录,使胆汁酸合成减少、胆汁酸代谢增加,以维持胆汁酸在体内的平衡,减少疏水性胆汁酸的过度增加而造成肝细胞损伤,从而形成胆汁酸代谢的自身反馈调节机制[16-17]。
赤芍凉血止血、活血祛癖之功效尤为显著,临床研究结果证实,重用赤芍退黄疗效显著。文献报道[18],重用赤芍治疗异硫氰酸-1-萘酯所致大鼠急性胆汁淤积型肝炎效果显著。同时还发现其主要有效成分芍药苷治疗胆汁淤积型肝炎同样具有显著的疗效[19]。然而,对于赤芍及其主要有效成分是否会通过激活FXR蛋白受体来治疗胆汁淤积型肝炎,目前尚未见文献报道。经Autodock模拟分析赤芍中芍药苷、芍药内酯苷、丹皮酚与FXRα、FXR蛋白受体的相互作用,结果提示,3种成分与FXR蛋白具有较小的自由能,有较强的结合作用。根据计算机模拟所得的结果,猜测赤芍治疗胆汁淤积型肝炎的作用机制可能与赤芍中主要成分对FXR蛋白具有较强的结合作用,引起FXR调控其靶基因减少胆汁酸合成,并增加胆汁酸排泄,减少肝细胞中胆汁酸过多堆积而引发的肝损害。但其详细的分子作用机制还有待进一步的实验研究。
[1]Heathcote EJ.Diagnosis and management of cholestatic liver disease[J].Clin Gastroenterol Hepatol,2007,5(7):776-782.
[2]孙进.口服药物吸收与转运[M].北京:人民卫生出版社,2006:146-149.
[3]Balasubramaniyan N,Luo Y,Sun AQ,et al.SUMOylation of the farnesoid X receptor(FXR).Regulates the expression of FXR target genes[J].J Biol Chem,2013,288(19):13850-13862.
[4]Boyer JL.New perspectives for the treamtment of cholestasis: lessons from basic science applied clinically[J].J Hepatol,2007,46(3):365-371.
[5]徐美丽.龙胆水提物通过FXR及其靶基因对胆汁淤积大鼠保护作用的机制研究[D].广州:广州中医药大学,2014.
[6]国家药典委员会.中华人民共和国药典:一部[S].2005年版.北京:化学工艺出版社,2005:79,125.
[7]陈贻胜.胆汁淤积的诊断与治疗肝内胆汁淤积的病因[J].中华消化杂志,2000,20(5):335-365.
[8]王瑞.川赤芍化学成分与芍药质量控制方法研究[D].沈阳:沈阳药科大学,2005.
[9]魏思思,赵艳玲,江凤娟.重用赤芍治疗ANIT诱导大鼠急性淤胆型肝炎的研究[J].中国实验方剂学杂志,2012,18(12):151-155.
[10] 段爱霞,陈晶,刘宏德.分子对接方法的应用与发展[J].分析科学学报,2009,25(4):473-475.
[11] 国家药典委员会.中华人民共和国药典:一部[S].北京:中国医药科技出版社,2010:147.
[12] Fahmy A,Wagner G.TreeDock: a tool for protein docking based on minimizing van der Waals energies[J].J Am Chem Soc,2002,124(7):1241-1250.
[13] Chiang JY.Bile Acid regulation of gene expression: roles of nuclear hormone receptor[J].Endocr Rev,2002,23(4):443-463.
[14] Makishima M,Okamoto AY,Repa JJ,et al.Identification of a nuclear receptor for bile acid[J].Science,1999,284(5418):1362-1365.
[15] Parks DJ,Blanchard SG,Bledsoe RK,et al.Bile acid: natural ligands for an orphan nuclear receptor[J].Science,1999,284(5418):1365-1368.
[16] Wang H,Chen J,Hollister K,et al.Endogenous bile acids are ligands for the nuclear receptor FXR/BAR[J].Mol Cell,1999,3(5):543-553.
[17] Gerloff T,Geier A,Roots I,et al.Functional analysis of the rat bile salt export pump gene promoter[J].Eur J Biochem,2002,269(14):3495-3503.
[18] Lu TT,Makishima M,Repa JJ,et al.Molecilar basis for feedback regulation of bile acid synthesis by nuclear receptors[J].Mol Cell,2000,6(3):507-515.
[19] Chen Z,Ma X,Zhu Y,et al.Paeoniflorin ameliorates ANIT-induced cholestasis by activating Nrf2 through an PI3K/Akt-dependent pathway in rats[J].Phytother Res,2015,29(11):1768-1775.
Study on Mechanism of Radix Paeoniae Rubra in Treatment of Cholestatic Hepatitis Based on Molecular Docking TechnologyΔ
ZHOU Houqin1,2, WANG Jian1, LI Yang1,2, HUANG Yinqiu1,2, ZHANG Lu1,2, LU Xiaohua1,2, ZHAO Yanling2
(1.Pharmacy College, Chengdu University of Traditional Chinese Medicine,Sichuan Chengdu 611137, China; 2.Dept.of Pharmacy, 302 Military Hospital of China, Beijing 100039, China)
OBJECTIVE:To probe into the interactions of the main active ingredients in Radix paeoniae rubra as paeoniflorin, albiflorin, paeonol and farnesoid X receptor (FXR) based on molecular docking technology. METHODS: Autodock 4.2 software was used for molecular docking. RESULTS: It was obtained that paeoniflorin, albiflorin and paeonal combined with FXR protein No.1 spot and No.2 spot and FXRα protein. The free energy of paeoniflorin, albiflorin and paeonol and FXRα protein binding were -13.44 kJ/mol, -21.77 kJ/mol and -16.45 kJ/mol; for FXR protein No.1 spot, the free energy were -18.21 kJ/mol, -48.60 kJ/mol and -49.52 kJ/mol; for FXR protein No.2 spot, the free energy were -15.32 kJ/mol, -24.70 kJ/mol and -18.59 kJ/mol. CONCLUSIONS: Paeoniflorin, albiflorin and paeonol and FXR protein have little free energy, which have strong binding. It is indicated that the mechanism of Radix paeoniae rubra in treatment of cholestatic hepatitis may be related to the strong binding of the main active ingredient paeoniflorin and FXR receptor protein, which can make FXR adjusts its corresponding expression of target genes so as to protect the liver by regulating the synthesis and metabolism of bile acid. This study provides a theoretical reference for the further study of TPG treatment with cholestatic hepatitis.
Paeoniflorin; Albiflorin; Paeonol; Molecular docking; FXR
国家自然科学基金资助项目(No.81342571、No.81173571)
R932
A
1672-2124(2016)11-1456-05
2016-08-29)
*硕士研究生。研究方向:中药理论与应用。E-mail:771496957@qq.com
#通信作者:主任药师,博士,研究员。研究方向:中药药理学。E-mail:zhaoyl2855@126.com
DOI 10.14009/j.issn.1672-2124.2016.11.004
