新型无氟喹诺酮类药物奈诺沙星的研究进展
2016-12-19苗贝贝梁蓓蓓贾晋生
苗贝贝,梁蓓蓓,王 睿,贾晋生
(1.山西医科大学药学院,山西 太原 030001;2.解放军总医院临床药物研究中心,北京 100853;3.山西医科大学附属晋煤集团总医院药学部,山西 晋城 048006)
·综 述·
新型无氟喹诺酮类药物奈诺沙星的研究进展
苗贝贝,梁蓓蓓,王 睿,贾晋生
(1.山西医科大学药学院,山西 太原 030001;2.解放军总医院临床药物研究中心,北京 100853;3.山西医科大学附属晋煤集团总医院药学部,山西 晋城 048006)
DOI 10.14009/j.issn.1672-2124.2016.11.048
氟喹诺酮类药物由于抗菌谱广、作用机制独特而被广泛应用,但随着此类药物的长期广泛使用,细菌对其的耐药性亦不断增加。奈诺沙星作为新型无氟喹诺酮类药物迅速进入人们的视线。奈诺沙星的化学名为7-[(3S,5S)-3-氨基-5-甲基-哌啶-1-基]-1-环丙基-8-甲氧基-4-氧络-1,4-二氢-喹啉-3-羟酸,分子式为C20H25N3O4,分子量为317.43,化学结构式见图1。喹诺酮母核的6位无氟是奈诺沙星区别于其他氟喹诺酮类药物的显著特点,8位甲氧基结构扩大了奈诺沙星的抗菌谱,降低了突变选择性。作为6-无氟-8-甲氧基喹诺酮类药物,奈诺沙星表现出对耐氟喹诺酮类抗菌药物的耐甲氧西林金黄色葡萄球菌(methicillin-resistant staphylococcus aureus,MRSA)和引起社区获得性肺炎(community-acquired pneumonia,CAP)的肺炎链球菌有很强的抗菌活性。
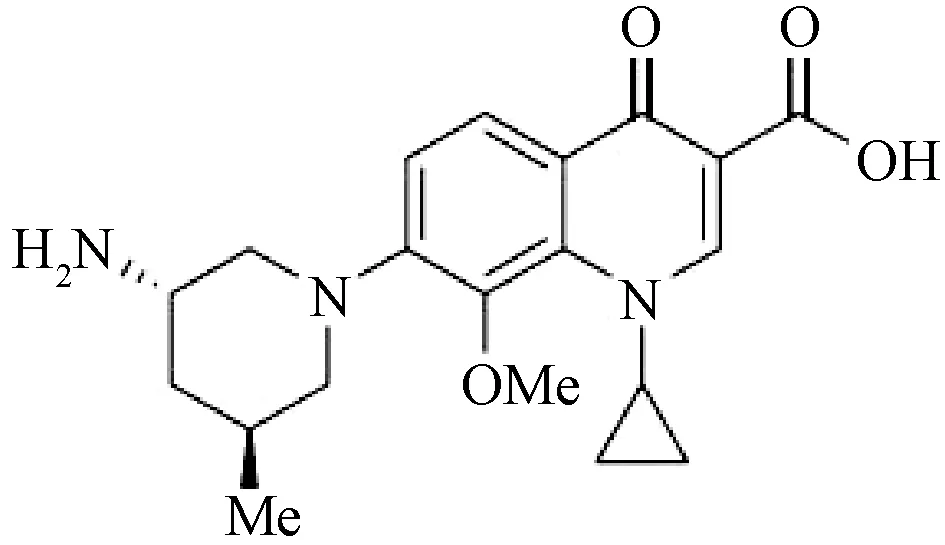
图1 奈诺沙星的化学结构式
1 奈诺沙星的作用机制
与其他氟喹诺酮类药物一样,奈诺沙星的主要作用部位是细菌DNA促旋酶(拓扑异构酶Ⅱ)和DNA拓扑异构酶Ⅳ,而细菌对氟喹诺酮类药物耐药的机制有靶酶突变导致细菌耐药、质粒和染色体介导的调节靶酶数量变化和外排泵表达过度导致细菌耐药。DNA促旋酶和DNA拓扑异构酶Ⅳ均为A2B2型异源四聚体。DNA促旋酶由2分子GyrA蛋白(由gyrA基因编码)和2分子GyrB蛋白(由gyrB基因编码)构成;拓扑异构酶Ⅳ由2分子ParC蛋白(由parC基因编码)和2分子ParE蛋白(由parE基因编码)构成,也有观点认为构成拓扑异构酶Ⅳ的2种亚基是parC和parE(革兰阴性菌)或grlA和grlB(革兰阳性菌)。DNA促旋酶和拓扑异构酶Ⅳ对氟喹诺酮类药物抗菌活性的贡献大小与细菌及氟喹诺酮类药物的种类有关。氟喹诺酮类药物不与DNA、DNA促旋酶或拓扑异构酶Ⅳ直接结合,而是与DNA促旋酶-DNA复合体或拓扑异构酶Ⅳ-DNA复合体结合,4种亚基中任一亚基的变异均可导致氟喹诺酮类药物与酶-复合体的亲和力下降而产生细菌耐药性。奈诺沙星可双重作用于细菌DNA促旋酶和DNA拓扑异构酶Ⅳ,减少细菌耐药的发生[1-4]。细菌对氟喹诺酮类药物耐药的决定域主要位于gyrA、gyrB、parC和parE等基因上,尤其是gyrA和parC是细菌对氟喹诺酮类药物发生耐药突变的热点基因。而对肺炎链球菌的实验结果显示,耐奈诺沙星菌株的突变基因局限于gyrA、gyrB和parE,没有parC基因突变[5],这也是无氟喹诺酮类药物奈诺沙星区别于其他氟喹诺酮类药物的一个重要特点。
2 奈诺沙星的体外抗菌活性与动物实验
奈诺沙星一种抗革兰阴性菌、革兰阳性菌、厌氧菌和非典型病原菌的广谱抗菌药物,而且对MRSA、耐万古霉素金黄色葡萄球菌和多重耐药病原菌有效[6]。2009年加拿大学者Heather J Adam等在《Antimicrobial Agents and Chemotherapy》上发表了奈诺沙星与其他氟喹诺酮类药物对2 440株细菌的最小抑菌浓度(minimal inhibitory concentration,MIC)测定结果,结果显示,奈诺沙星对革兰阳性菌的效果明显强于左氧氟沙星等氟喹诺酮类药物,其对革兰阴性菌的效果则与其他氟喹诺酮类药物相仿或次之[7-8],见表1。在革兰阳性菌中,奈诺沙星对甲氧西林敏感金黄色葡萄球菌(methicillin sensitive staphylococcus aureus,MSSA)、MRSA和肺炎链球菌均有良好疗效,但其对社区获得性MRSA和对环丙沙星耐药的MRSA的疗效次于对医院获得性MRSA和对环丙沙星敏感的MRSA[9]。动物实验结果显示,奈诺沙星对革兰阳性球菌有良好的抗菌活性[10],尤其是对MRSA、耐左氧氟沙星和甲氧西林的头状葡萄球菌、耐青霉素肺炎链球菌和耐万古霉素肠球菌。
在革兰阴性菌中,大肠埃希菌和肺炎克雷伯菌等肠杆菌科细菌是引起医院感染最常见的病原菌。而产超广谱β-内酰胺酶(extended spectrumβ-lactamase,ESBL)肠杆菌科细菌的多重耐药性是其显著特点,临床以厄他培南等碳青霉烯类抗菌药物为一线治疗用药。对412株对厄他培南不敏感(MIC≥0.5 mg/L)肠杆菌科细菌的体外抗菌活性实验结果显示,奈诺沙星与环丙沙星等氟喹诺酮类药物的效果相似,次于厄他培南等碳青霉烯类抗菌药物,对肠杆菌科细菌效果一般[11],见表2。
奈诺沙星对流感嗜血杆菌、淋病奈瑟菌和卡他莫拉菌都有效,而对结核杆菌的效果差,其抗结核杆菌效果与吉米沙星相仿,但次于左氧氟沙星和莫西沙星等[12],见表3。
表1 3种氟喹诺酮类药物对2 440株细菌的MIC范围及MIC90比较(mg/L)
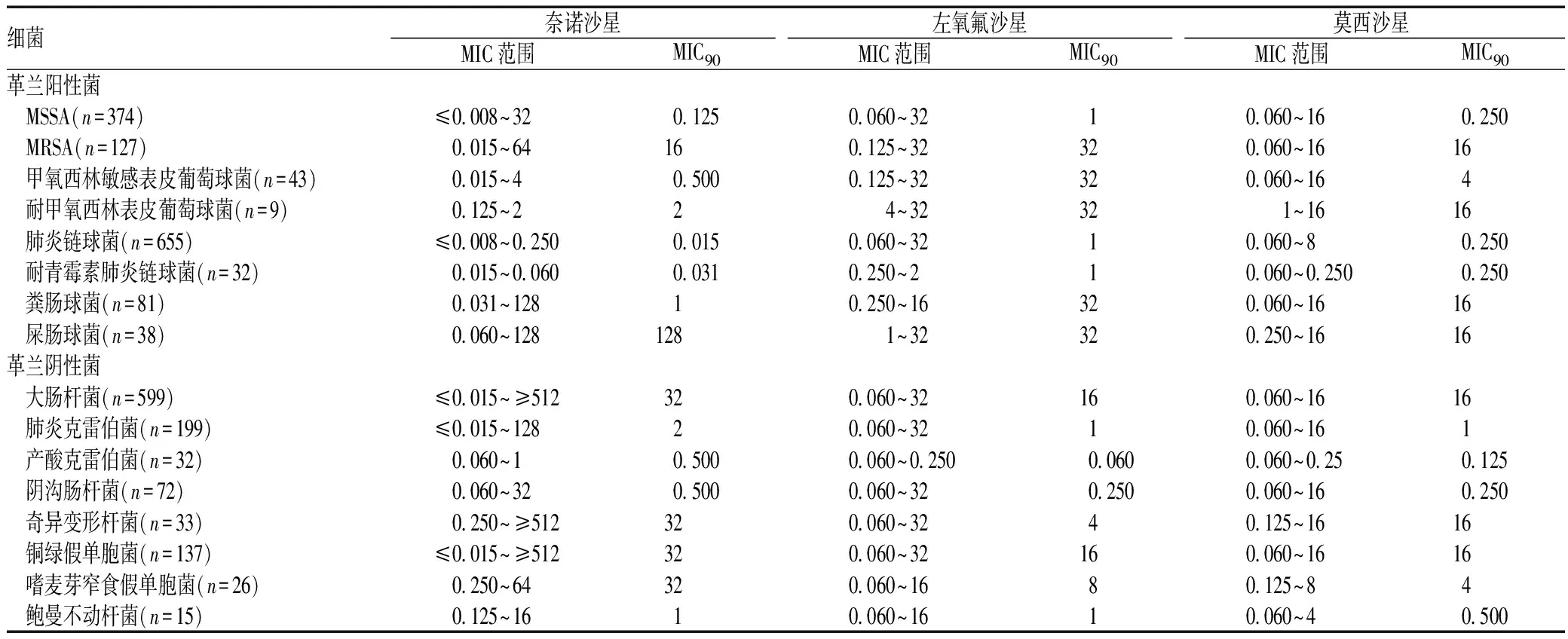
细菌奈诺沙星左氧氟沙星莫西沙星MIC范围MIC90MIC范围MIC90MIC范围MIC90革兰阳性菌 MSSA(n=374)≤0 008~320 1250 060~3210 060~160 250 MRSA(n=127)0 015~64160 125~32320 060~1616 甲氧西林敏感表皮葡萄球菌(n=43)0 015~40 5000 125~32320 060~164 耐甲氧西林表皮葡萄球菌(n=9)0 125~224~32321~1616 肺炎链球菌(n=655)≤0 008~0 2500 0150 060~3210 060~80 250 耐青霉素肺炎链球菌(n=32)0 015~0 0600 0310 250~210 060~0 2500 250 粪肠球菌(n=81)0 031~12810 250~16320 060~1616 屎肠球菌(n=38)0 060~1281281~32320 250~1616革兰阴性菌 大肠杆菌(n=599)≤0 015~≥512320 060~32160 060~1616 肺炎克雷伯菌(n=199)≤0 015~12820 060~3210 060~161 产酸克雷伯菌(n=32)0 060~10 5000 060~0 2500 0600 060~0 250 125 阴沟肠杆菌(n=72)0 060~320 5000 060~320 2500 060~160 250 奇异变形杆菌(n=33)0 250~≥512320 060~3240 125~1616 铜绿假单胞菌(n=137)≤0 015~≥512320 060~32160 060~1616 嗜麦芽窄食假单胞菌(n=26)0 250~64320 060~1680 125~84 鲍曼不动杆菌(n=15)0 125~1610 060~1610 060~40 500
表2 3种抗菌药物对412株对厄他培南不敏感的肠杆菌科细菌的MIC范围及MIC90比较(mg/L)
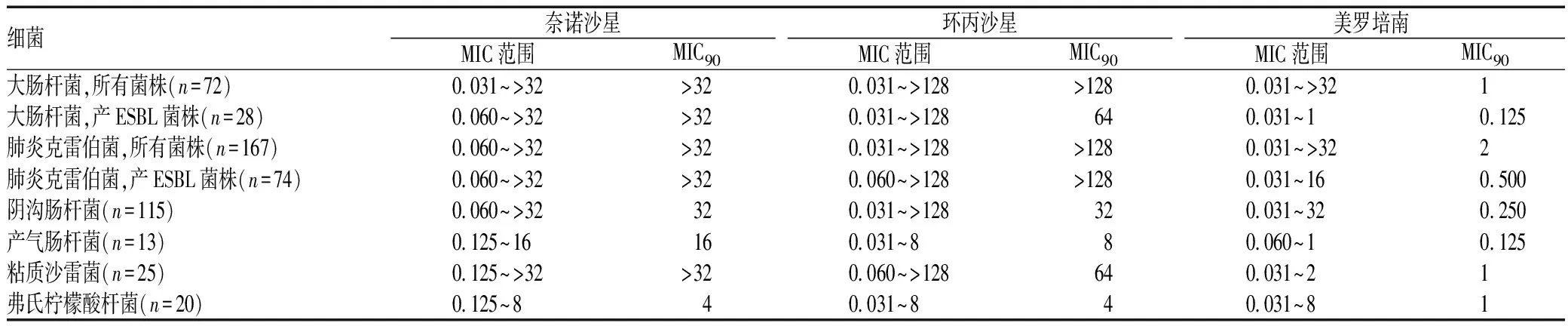
细菌奈诺沙星环丙沙星美罗培南MIC范围MIC90MIC范围MIC90MIC范围MIC90大肠杆菌,所有菌株(n=72)0 031~>32>320 031~>128>1280 031~>321大肠杆菌,产ESBL菌株(n=28)0 060~>32>320 031~>128640 031~10 125肺炎克雷伯菌,所有菌株(n=167)0 060~>32>320 031~>128>1280 031~>322肺炎克雷伯菌,产ESBL菌株(n=74)0 060~>32>320 060~>128>1280 031~160 500阴沟肠杆菌(n=115)0 060~>32320 031~>128320 031~320 250产气肠杆菌(n=13)0 125~16160 031~880 060~10 125粘质沙雷菌(n=25)0 125~>32>320 060~>128640 031~21弗氏柠檬酸杆菌(n=20)0 125~840 031~840 031~81
抗菌药物的大量使用,可能会造成肠道菌群失调,艰难梭菌大量繁殖导致伪膜性肠炎和抗菌药物相关性腹泻。奈诺沙星对艰难梭菌的活性优于左氧氟沙星和环丙沙星等氟喹诺酮类药物,但次于甲硝唑、替加环素和达托霉素等[13],见表4。
表3 4种抗菌药物对结核杆菌的MIC范围及MIC90比较(mg/L)

细菌奈诺沙星左氧氟沙星莫西沙星吉米沙星MIC范围MIC90MIC范围MIC90MIC范围MIC90MIC范围MIC90多重耐药结核杆菌(n=66)<0 031~>32>320 250~880 250~841~>32>32非多重耐药结核杆菌(n=43)2~16160 250~110 250~10 1252~1616
表4 4种抗菌药物对403株艰难梭菌的MIC范围及MIC90比较(mg/L)

细菌奈诺沙星左氧氟沙星甲硝唑替加环素MIC范围MIC90MIC范围MIC90MIC范围MIC90MIC范围MIC90艰难梭菌(n=403)0 250~>3281~>128128≤0 031~40 500≤0 031~10 060
台湾某医院报道了奈诺沙星对151株诺卡菌的MIC测定,结果显示,虽然奈诺沙星对不同种属的诺卡菌效果相差较大,但总体优于左氧氟沙星等其他氟喹诺酮类抗菌药物,复方磺胺甲恶唑对诺卡菌有较好效果,奈诺沙星、利奈唑胺和替加环素等可作为第二选择[14]。
幽门螺杆菌是导致胃炎、消化性溃疡甚至胃癌的重要病原菌。奈诺沙星对幽门螺杆菌的效果优于左氧氟沙星等氟喹诺酮类抗菌药物,与克拉霉素和阿莫西林等常用抗幽门螺杆菌药相仿或略次之[15],见表5。
奈诺沙星对非典型病原体如沙眼衣原体和肺炎衣原体的抗菌活性强[16],见表6;对支原体和军团菌等的抗菌活性尚缺乏有效实验数据。
3 奈诺沙星的药动学/药效学特点及安全性(不良反应)
复旦大学附属华山医院抗生素研究所曹国英等在我国健康志愿者中分别对奈诺沙星的口服及注射剂型进行了安全性、耐受性和药动学等的研究,结果见表7—8。对于口服剂型而言,一般1~2 h即可达到血药峰浓度(Cmax)。单剂量或多剂量口服时,Cmax和药-时曲线下面积(AUC∞)与剂量成正比,消除半衰期(T1/2)约12 h,给药72 h内60%~70%的奈诺沙星以原形药形式经尿液排泄。临床前试验结果表明,奈诺沙星既不诱导也不抑制肝药酶CYP3A4的活性,其在体内基本不代谢[2]。进食对其Cmax和AUC∞有很大影响(P<0.001),使Cmax和AUC∞分别下降34%和18%;性别因素不影响药物的吸收[17]。单剂量静脉滴注给药后,奈诺沙星在人体内迅速分布,与口服剂型一样,奈诺沙星注射剂型也主要经肾脏排泄。在250~750 mg剂量范围内,AUC0-72 h和AUC∞与剂量间有线性关系,人体对奈诺沙星氯化钠注射液的耐受范围为25~1 250 mg;单剂量递增耐受性试验结果表明,最大耐受剂量为1 250 mg,滴注速度为0.42~5.56 mg/min。多剂量静脉滴注给药试验结果证实,此种给药方案可能会达到临床和微生物学的良好效果[18-19]。
表5 4种抗菌药物对幽门螺杆菌的MIC范围及MIC90比较(mg/L)

细菌奈诺沙星左氧氟沙星阿莫西林克拉霉素替加环素MIC范围MIC90MIC范围MIC90MIC范围MIC90MIC范围MIC90幽门螺杆菌(n=330)≤0 031~40 2500 060~320 500≤0 015~20 1250 031~1288
表6 4种抗菌药物对沙眼衣原体和肺炎衣原体的MIC范围及MIC90比较(mg/L)

病原体奈诺沙星左氧氟沙星多西环素阿奇霉素MIC范围MIC90MIC范围MIC90MIC范围MIC90MIC范围MIC90沙眼衣原体(n=10)0 031~0 1250 0600 125~0 5000 2500 031~0 2500 1250 003~0 0310 015肺炎衣原体(n=10)0 031~0 1250 0600 5000 5000 060~0 1250 1250 031~0 0600 060


剂量/mgCmax/(mg/L)T1/2/hAUC0⁃∞/(h·mg/L)肾清除率(CLr)/(L/h)口服静脉滴注口服静脉滴注口服静脉滴注口服静脉滴注250(n=12)3 24±0 674 83±1 3210 73±2 7111 10±2 2421 52±3 3617 21±4 100 14±0 03415 30±3 68500a5 91±1 357 15±1 3312 83±3 7210 92±2 9642 41±5 8339 51±5 360 14±0 03712 87±1 75750b8 20±1 3711 03±3 1310 92±3 7810 52±3 1965 04±6 2362 21±11 470 13±0 02712 46±2 48
注:a口服(n=11)、静脉滴注(n=12);b口服(n=12)、静脉滴注(n=11)


剂量/mgCmax/(mg/L)达峰时间(tmax)/hT1/2/hAUC24/(h·mg/L)CLr/(L/h)口服静脉滴注a静脉滴注b口服静脉滴注a静脉滴注b口服静脉滴注a静脉滴注b口服静脉滴注a静脉滴注b5007 02±1 779 6±1 847 13±1 471 25±0 456 20±1 396 30±1 1546 92±12 1544 03±8 6240 46±9 520 10±0 0426 95±1 367 22±1 997509 13±1 5511 0±2 209 96±2 331 46±0 816 34±1 215 72±0 9965 75±9 0665 82±10 7871 34±17 790 13±0 0246 89±0 987 94±1 62
注:a滴注速度5.56 mg/min;b滴注速度4.17 mg/min
由于多价金属离子和氟喹诺酮类药物之间的螯合作用,Al3+、Mg2+等可显著降低奈诺沙星的血浆峰浓度而导致临床治疗失败。一项在24名中国健康男性中的临床试验结果显示,当奈诺沙星与抗酸剂氢氧化铝、氢氧化镁同时服用时,其吸收程度会被大幅降低,但在给予奈诺沙星2 h后再给予含Al3+、Mg2+的抗酸剂时,奈诺沙星的吸收则不受影响,原因可能是奈诺沙星的达峰时间tmax约1 h;反之,由于含Al3+、Mg2+抗酸剂的吸收受胃排空时间等的影响,个体差异化很大,奈诺沙星应在给予抗酸剂4 h后服用;金属离子Fe2+也可影响奈诺沙星的口服吸收,其Cmax和AUC0-∞分别下降57.0%和63.7;而Ca2+对奈诺沙星吸收的影响很小[20]。抗痛风药丙磺舒由于抑制尿酸盐在肾小管的主动重吸收和竞争性抑制弱酸在肾小管的分泌而增加多种药物(青霉素、氨苄西林等)的Cmax和作用时间,同样,丙磺舒可降低奈诺沙星的CLr,增加萘诺沙星的作用时间。抑制胃酸分泌药西咪替丁对奈诺沙星的作用小,无临床意义[21]。
太景生物技术有限公司对奈诺沙星做了单次给药剂量递增及多剂量给药连续10 d的药动学研究,结果表明,单次给药25~1 500 mg人体均能耐受,且无明显严重不良反应或实验室异常指标改变[5,22],见表9。
表9 健康志愿者口服多剂量给药(1 日1 次、连续10 d)时第10 日奈诺沙星的药动学参数(x±s)
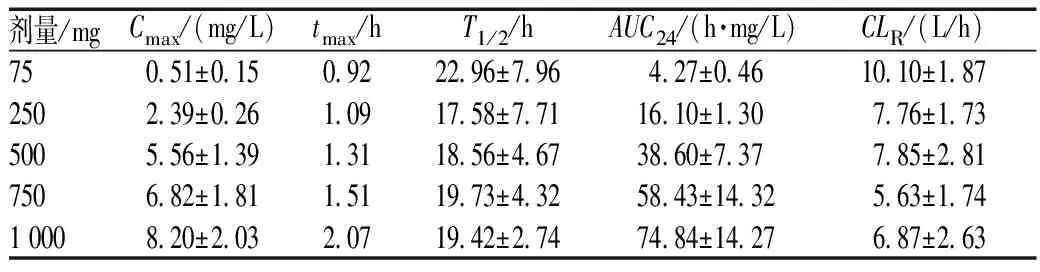
剂量/mgCmax/(mg/L)tmax/hT1/2/hAUC24/(h·mg/L)CLR/(L/h)750 51±0 150 9222 96±7 964 27±0 4610 10±1 872502 39±0 261 0917 58±7 7116 10±1 307 76±1 735005 56±1 391 3118 56±4 6738 60±7 377 85±2 817506 82±1 811 5119 73±4 3258 43±14 325 63±1 7410008 20±2 032 0719 42±2 7474 84±14 276 87±2 63
在奈诺沙星的Ⅰ期耐受性试验中,单剂量给药1 500 mg无明显严重不良反应发生;其常见的不良反应为接触性皮炎、皮肤瘙痒和红疹,发生率分别为12%、12%和10%;无明显心电图QT间期延长、糖调节异常或肝细胞毒性发生。Ⅰ期多剂量给药研究中,最常见的不良反应为白细胞减少症(29.2%)、皮疹(25%)、恶心(16.7%)及丙氨酸氨基转移酶、天门冬氨酸氨基转移酶升高(20.8%、16.7%);除750 mg奈诺沙星多剂量给药外,校正QT间期值不超过500 ms,QT间期值相差<60 ms。奈诺沙星治疗CAP的Ⅱ期临床试验将其与左氧氟沙星500 mg的不良事件发生率进行对比,结果见表10[2,23-24]。
表10 奈诺沙星治疗CAP的Ⅱ期临床试验不良反应发生情况
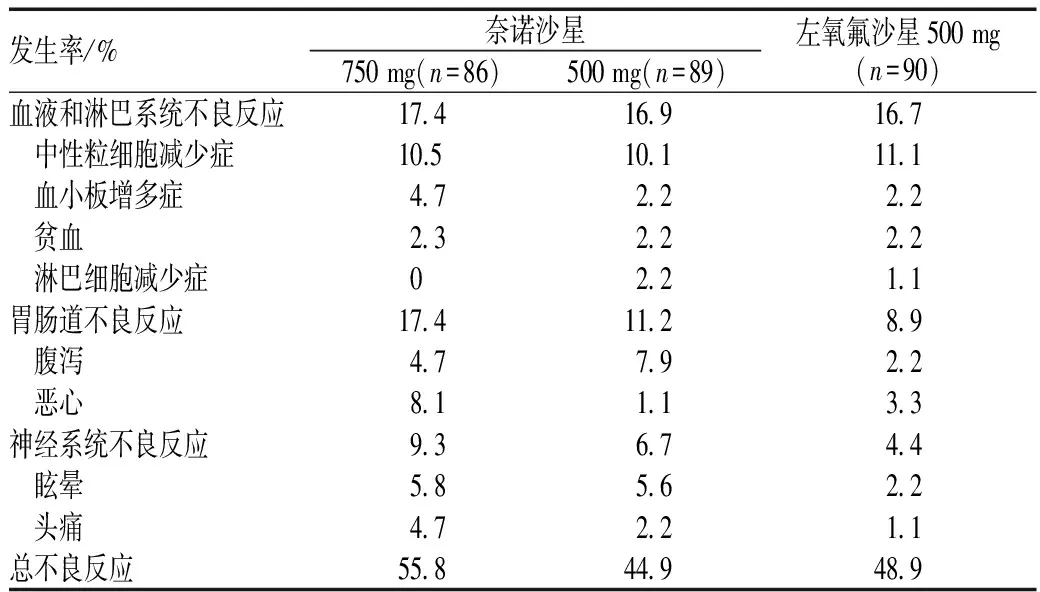
发生率/%奈诺沙星750mg(n=86)500mg(n=89)左氧氟沙星500mg(n=90)血液和淋巴系统不良反应17 416 916 7 中性粒细胞减少症10.510 111 1 血小板增多症4 72 22 2 贫血2 32 22 2 淋巴细胞减少症02 21 1胃肠道不良反应17 411 28 9 腹泻4 77 92 2 恶心8 11 13 3神经系统不良反应9 36 74 4 眩晕5 85 62 2 头痛4 72 21 1总不良反应55 844 948 9
4 奈诺沙星的临床疗效
在临床上,奈诺沙星对CAP和糖尿病足感染取得了良好效果[23,25-26]。奈诺沙星的Ⅲ期临床试验(NCT01529476,TG-873870-C-4)和 Ⅱ 期临床试验(NCT00434291,TG-873870-02)分别入组532和265例CAP患者,结果显示,奈诺沙星的疗效并不次于左氧氟沙星;在细菌学方面,其对肺炎链球菌、金黄色葡萄球菌和肺炎克雷伯菌的有效率均>90%甚至达到100%。Ⅱ 期临床试验(NCT00685698,TG-873870-04)评价了奈诺沙星治疗糖尿病足感染的疗效,结果显示,其临床疗效和治疗结束终点疗效分别达95.7%和100%,其对金黄色葡萄球菌(包括MRSA)、大肠杆菌、粪肠球菌、无乳链球菌和化脓性链球菌的效果显著。
总之,奈诺沙星为新型广谱无氟喹诺酮类抗菌药物,对革兰阳性菌、多数革兰阴性菌和非典型病原菌都有强大的抗菌活性,尤其对革兰阳性球菌如MRSA和耐青霉素肺炎链球菌的作用较强。奈诺沙星良好的药动学特点(tmax短、T1/2长、血浆蛋白结合率低、经生物利用度校正的表观分布容积大等),与其他氟喹诺酮类抗菌药物类似。奈诺沙星在临床上用于治疗CAP和糖尿病足感染的效果良好,其注射剂型也即将上市。
[1]范柏.喹诺酮类抗菌药的作用机制及细菌耐药性的研究进展[J].国外医药:抗生素分册,2004,25(1):27-29,48.
[2]Qin X,Huang H.Review of nemonoxacin with special focus on clinical development[J].Drug Design Devel Ther,2014,8:765-774.
[3]李宵宁,柴芸,刘明亮.喹诺酮类抗菌药的作用机制及耐药机制研究进展[J].国外医药:抗生素分册,2015,36(3):97-102.
[4]张致平.喹诺酮类抗菌药研究的新进展[C]//2005年抗菌药物研究与临床应用进展学术研讨会报告和论文集,2005:68-76.
[5]Roychoudhury S,Makin K,Twinem T,et al.In Vitro Resistance Devel-opment to Nemonoxacin in Streptococcus pneumoniae:A Uni-que Profile for a Novel Nonfluorinated Quinolone[J].Microb Drug Resist,2016,22(7):578-584.
[6]Chung DT,Tsai CY,Chen SJ,et al.Multiple-dose safety,tolera-bility,and pharmacokinetics of oral nemonoxacin(TG-873870)in healthy volunteers[J].Antimicrob Agents Chemother,2010,54(1):411-417.
[7]Adam HJ,Laing NM,King CR,et al.In vitro activity of nemo-noxacin,a novel nonfluorinated quinolone,against 2,440 clinical isolates[J].Antimicrob Agents Chemother,2009,53(11):4915-4920.
[8]Li ZX,Liu YN,Wang R,et al.Nemonoxacin has potent activity against gram-positive,but not gram-negative clinical isolates[J].Clin Ter,2015,166(6):e374-e380.
[9]Chen YH,Liu CY,Lu JJ,et al.In vitro activity of nemonoxacin(TG-873870),a novel non-fluorinated quinolone,against clinical isolates of Staphylococcus aureus,enterococci and Streptococcus pneumoniae with various resistance phenotypes in Taiwan[J].J Antimicrob Chemother,2009,64(6):1226-1229.
[10] Li CR,Li Y,Li GQ,et al.In vivo antibacterial activity of nemo-noxacin,a novel non-fluorinated quinolone[J].J Antimicrob Chemother,2010,65(11):2411-2415.
[11] Hsu MS,Liao CH,Liu CY,et al.In vitro susceptibilities of clinical isolates of ertapenem-non-susceptible Enterobacteriaceae to nemo-noxacin,tigecycline,fosfomycin and other antimicrobial agents[J].Int J Antimicrob Agents,2011,37(3):276-278.
[12] Tan CK,Lai CC,Liao CH,et al.Comparative in vitro activities of the new quinolone nemonoxacin(TG-873870),gemifloxacin and other quinolones against clinical isolates of Mycobacterium tuberculosis[J].J Antimicrob Chemother,2009,64(2):428-429.
[13] Liao CH,Ko WC,Lu JJ,et al.Characterizations of clinical isolates of clostridium difficile by toxin genotypes and by susceptibility to 12 antimicrobial agents, including fidaxomicin (OPT-80) and rifaximin: a multicenter study in Taiwan[J].Antimicrob Agents Chemother,2012,56(7):3943-3949.
[14] Lai CC,Liu WL,Ko WC,et al.Multicenter study in Taiwan of the in Vitro activities of nemonoxacin,tigecycline,doripenem,and other antimicrobial agents against clinical isolates of various Nocardia species[J].Antimicrob Agents Chemother,2011,55(5):2084-2091.
[15] Yang JC,Lee PI,Hsueh PR.In vitro activity of nemonoxacin,tigecycline,and other antimicrobial agents against Helicobacter pylori isolates in Taiwan,1998-2007[J].Eur J Clin Microbiol Infect Dis,2010,29(11):1369-1375.
[16] Chotikanatis K,Kohlhoff SA,Hammerschlag MR.In vitro activity of nemonoxacin,a novel nonfluorinated quinolone antibiotic,against Chlamydia trachomatis and Chlamydia pneumoniae[J].Antimicrob Agents Chemother,2014,58(3):1800-1801.
[17] Guo B,Wu X,Zhang Y,et al.Safety and clinical pharmacokinetics of nemonoxacin,a novel non-fluorinated quinolone,in healthy Chinese volunteers following single and multiple oral doses[J].Clin Drug Investig,2012,32(7):475-486.
[18] Wu XJ,Zhang J,Guo BN,et al.Pharmacokinetics and pharma-codynamics of multiple-dose intravenous nemonoxacin in healthy Chinese volunteers[J].Antimicrob Agents Chemother,2015,59(3):1446-1454.
[19] Cao GY,Zhang J,Zhang YY,et al.Safety,tolerability,and pharm-acokinetics of intravenous nemonoxacin in healthy chinese volunteers[J].Antimicrob Agents Chemother,2014,58(10):6116-6121.
[20] Zhang YF,Dai XJ,Wang T,et al.Effects of an Al(3+)-and Mg(2+)-containing antacid, ferrous sulfate, and calcium carbonate on the absorption of nemonoxacin(TG-873870) in healthy Chinese volunteers[J].Acta Pharmacol Sin,2014,35(12):1586-1592.
[21] Zhang YF,Dai XJ,Yang Y,et al.Effects of probenecid and cimetidine on the pharmacokinetics of nemonoxacin in healthy Chinese volunteers[J].Drug Des Devel Ther,2016,10:357-370.
[22] Lin L,Chang LW,Tsai CY,et al.Dose escalation study of the safety,tolerability,and pharmacokinetics of nemonoxacin(TG-873870),a novel potent broad-spectrum nonfluorinated quinolone,in healthy volunteers[J].Antimicrob Agents Chemother,2010,54(1):405-410.
[23] Poole RM.Nemonoxacin:First global approval[J].Drugs,2014,74(12):1445-1453.
[24] van Rensburg DJ,Perng RP,Mitha IH,et al.Efficacy and safety of nemonoxacin versus levofloxacin for community-acquired pneumonia[J].Antimicrob Agents Chemother,2010,54(10):4098-4106.
[25] 刘鑫荣.无氟喹诺酮:奈诺沙星[J].国外医药:抗生素分册,2016,37(2):73-76,92.
[26] 曹国英,张菁,施耀国.无氟喹诺酮类新药奈诺沙星研究进展[J].中国感染与化疗杂志,2011,11(5):389-394.
R978.1
A
1672-2124(2016)11-1577-04
2016-08-12)
*在读硕士研究生。研究方向:临床药学。E-mail:1499871669@qq.com
#通信作者:主任药师,教授,硕士生导师。研究方向:临床抗感染。E-mail:sxjiajsh@aliyun.com
