间歇式低氧对主动脉弓缩窄模型小鼠肠道菌群的影响
2016-12-17周仙杰鲁飞翔夏靖媛刘庆春
周仙杰,李 军,鲁飞翔,夏靖媛,刘庆春
间歇式低氧对主动脉弓缩窄模型小鼠肠道菌群的影响
周仙杰1,李 军2,鲁飞翔1,夏靖媛1,刘庆春1
目的 了解间歇式低氧对主动脉弓缩窄(transverse aortic constriction, TAC)模型小鼠肠道菌群的影响。方法 18只C57 BL/6雄性小鼠随机分为3组,假手术常氧组(C组),主动脉弓缩窄模型常氧组(TC组),主动脉弓缩窄模型低氧组(TH组),每组各6只。间歇式低氧的条件为氧浓度10.5%,每天8 h低氧,16 h常氧,交替进行,连续10 d。获取小鼠盲肠粪便中细菌DNA,经16 S rDNA测序检测小鼠盲肠粪便中微生物组成,应用微生物生态学定量观察进行生物信息学分析。结果 主动脉弓缩窄模型常氧组与假手术常氧组、主动脉弓缩窄模型低氧组相比,互营杆菌科显示出更低的丰度。TC组与C组比较差异有统计学意义(P=0.004),TC组与TH组比较P=0.013。结论 间歇式低氧处理使主动脉弓缩窄模型小鼠肠道菌群发生了改变,这种改变对主动脉弓缩窄的进程是否有影响仍需进一步研究。
间歇式低氧;主动脉弓缩窄;肠道菌群
间歇式低氧是低氧和常氧反复交替周期循环的一种供氧模式[1]。间歇式低氧训练可用于适应高海拔时的低氧环境和提高需氧耐受。同时可增加红细胞总数和血红蛋白浓度,降低运动时的心率反应[2]。此外,间歇性低氧可增加心肌血管,冠状动脉血流,心肌红蛋白和增加抗氧化酶和应激蛋白的表达[3]。本课题组动物实验发现,主动脉弓缩窄模型小鼠心脏发生肥大且肺内有炎性反应细胞浸润,间歇式低氧处理可以抑制主动脉弓缩窄(transverse aortic constriction,TAC)模型小鼠的心肌肥厚和肺部炎性反应。通过基因和蛋白水平检测发现,间歇式低氧处理后主动脉弓缩窄模型小鼠的S100A8和S100A9的表达量增加。S100A8和S100A9是固有免疫效应分子抗菌肽的成员,同时也是钙结合蛋白S100家族的成员[4]。钙结合蛋白是炎性反应性肠病的标志物[5],炎性反应性肠病发生,细胞内钙结合蛋白的表达量会发生改变,同时宿主肠道菌群的组成和功能也会发生改变。肠道菌群可通过多条途径参与免疫反应,对炎性反应的发生和抑制具有重要作用[6]。从菌对机体的影响来说,肠道内微生物可分为致病菌、条件致病菌和益生菌等。从氧依赖的角度来说,肠道内微生物主要包括专性厌氧菌、兼性厌氧菌和需氧菌,随着宿主免疫状态的改变,这些菌处于动态变化中。肠道菌群不仅可参与免疫调节,还可通过调节血压,参与机体内多种反应的进行[7]。目前,间歇式低氧处理能否通过调节肠道菌群来抑制主动脉弓缩窄模型小鼠的心肌肥厚和肺部炎性反应及其相关研究尚无报道。本研究将通过16S rDNA测序的方法检测间歇式低氧处理后小鼠肠道内微生物的组成,探讨间歇式低氧处理后主动脉弓缩窄模型小鼠肠道菌群的变化。
1 材料与方法
1.1 实验动物和分组 选择8~10周龄清洁级雄性C57BL/6小鼠18只,体重20~25 g。购自北京维通利华提供实验动物技术有限公司,许可证编号为SCXK(京)2012-0001。饲养于北京大学实验动物中心,许可证编号 SYXK(京)2011-0003。按国家标准啮齿类动物饲料喂养,动物自由摄食和饮水,光照为明暗12/12 h交替。适应性喂养7 d后,动物随机分为3 组,假手术常氧组(C组),主动脉弓缩窄模型常氧组(TC组),主动脉弓缩窄模型低氧组(TH组),每组各6只。
1.2 方法
1.2.1 主动脉弓缩窄手术 将雄性C57BL/6小鼠麻醉后,去除颈部和胸部的毛,再用优碘和酒精清洗后置于仰卧位,用加热垫使温度保持在37 ℃。水平切开0.5~1.0 cm胸骨上切迹皮肤。拨开胸腺,在胸骨近端处,纵向切割2~3 mm,为低放大倍率观察主动脉弓提供视野。一端带有圈套的线从右无名小管根部和左颈总动脉之间的主动脉下穿过,用6-0缝合线绑在圈套上将线从主动脉拉出。弯曲的27号针头放于主动脉弓旁,然后紧贴针和主动脉周围缝合。结扎后,迅速取出针。闭合皮肤,将小鼠放在暖垫上恢复,直到他们完全清醒[8-10]。假手术组,除不结扎,其他与主动脉弓缩窄组相同。
1.2.2 间歇式低氧处理 模型制作后,常规饲养第8天对TH组小鼠进行间歇式低氧干预。间歇式低氧条件为,通过制氮机(北京创文气体有限公司)、冻干机(杭州超滤)和空气压缩机(美国英格索兰) 共同作用将空气中的氮气通入动物饲养室内达到10.5%的氧浓度(相当于海拔4500 m的高度),每天8 h低氧,16 h常氧,交替进行,连续10 d。C组和TC组小鼠在常规环境中饲养,氧浓度为21%。
1.2.3 小鼠盲肠粪便中细菌DNA的提取 间歇式低氧干预后,小鼠颈椎脱臼处死,称取0.1~0.2 g小鼠盲肠粪便,提取细菌DNA。使用强力粪便DNA提取试剂盒,购自深圳市安必胜科技有限公司,按照说明书进行操作。通过琼脂糖凝胶电泳和Qubit检测来确定DNA的大小和质量。TC组1只小鼠DNA样品量未达到样品测序要求,因此后续试验TC组实验动物数为5只。
1.2.4 PCR扩增和16S rDNA测序 小鼠盲肠粪便中细菌DNA提取和检测后,将16S rDNA基因V4区进行PCR扩增,PCR引物为341F(5’-CCTAYGGGRBGCASCAG-3’)和806R(5’-GGACTACNNGGGTATCTAAT-3’)。反应程序为 98 ℃预变性1 min; 30 个循环(98 ℃,10 s;50 ℃,30 s;72 ℃,30 s); 72 ℃,5 min。琼脂糖凝胶电泳检测PCR 产物, GeneJET 胶回收试剂盒(购自Thermo Scientific 公司)纯化2次。NEB Next® UltraTMDNA Library Prep Kit建库试剂盒(购自New England Biolabs 公司)构建文库,构建好的文库经过Qubit定量和文库检测,合格后,使用Illumina公司的HiSeq进行上机测序。
1.2.5 生物信息学分析 对测序后得到的有效数据进行分类单元(operational Taxonomic Units,OTUs)聚类和物种分类分析,结合物种注释信息,从而得到每组样品的OTUs数和物种注释的基本分析结果。再根据物种注释结果,进行组间群落组成分析,挖掘组间样品的物种组成差异[11,12]。
1.3 观测指标 测序后的序列进行分类聚类和物种注释。通过各组总的序列数目、无法聚类到OTUs的序列数目、聚类到OTUs但没有获得注释信息的序列数目和构建到OTUs且获得注释信息的序列数目,了解测序的基本情况。根据注释结果,计算香农指数(Shannon)和Chao1指数,用以评估样品组间微生物群落的平均多样性和丰富度。根据各组样品OTUs(物种)数目,获得组间共有的物种数和特有的物种数。同时通过分析不同细菌水平样品中微生物的组成,获得门、科和属三个细菌水平上,相对丰度较高的菌的组成,并筛选差异菌。
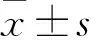
2 结 果
2.1 小鼠体重的变化 实验处理前后,小鼠体重C组和TC组、TC组和TH组组间均无统计学差异。处理后C组和TC组小鼠体重与各自处理前相比无统计学差异,但TH组间歇式低氧处理后与处理前相比小鼠体重有增加的趋势,差异有统计学意义(P<0.05,表1)。

表1 主动脉弓缩窄模型小鼠低氧处理前后体重比较 ;g)
注:C组. 假手术常氧组;TC组. 主动脉弓缩窄模型常氧组;TH组. 主动脉弓缩窄模型低氧组;P1. 处理前组间P值;P2. 处理后组间P值;P3. 各组处理前后P值
2.2 间歇式低氧组和常氧组小鼠肠道菌群多样性评估 将测序后C组获得的41 505条序列,TC组获得的42 739条序列和TH组获得的39 072条序列进行分类单元(OTUs)聚类和注释,其中C组有38 664条序列,TC组有41 143条序列,TH组有37 491条序列构建到OTUs且获得注释信息,TC组和C组比较P值为0.661,TH组和TC组比较P值为0.296,各组聚类和注释情况见图1。根据聚类和注释结果,利用α-多样性指数,香农指数(Shannon)和Chao1评估样品组间微生物群落的平均多样性和丰富度,见表2。TC组和C组比较,TH组和TC组比较,均无统计学差异。说明本研究处理条件下样品组间微生物群落的平均多样性和丰富度并未发生改变。将构建到OTUs且获得注释信息的序列均一化处理之后进行后续分析。C组有827个OTU,TC组有704个OTU,TH组有777个OTU用于分析。其中C组、TC组和TH组共有的OTUs数目为578,C组和TC组共有的OTUs数目为69,C组和TH组共有的OTUs数目为113,TC组和TH组共有的OTUs数目为39。C组、TC组和TH组特有的OTUs数目分别为67、18和47。不同组间共有和特有的OTU数目(物种数目),见图2。
2.3 间歇式低氧组和常氧组小鼠粪便样本中微生物16S rDNA序列分析 根据OTUs的注释结果,分析不同细菌水平样品中微生物的组成。在门水平, 相对丰度较高的菌为拟杆菌门、厚壁菌门和变形菌门,见图3。TC组和C组相比,拟杆菌门的相对丰度为0.404和0.428,厚壁菌门的相对丰度为0.302和0.357,变形菌门的相对丰度为0.27和0.202,组间均无显著性差异。TH组和TC组相比,拟杆菌门的相对丰度为0.447和0.404,变形菌门的相对丰度为0.25和0.27,组间均无显著性差异。厚壁菌门的相对丰度为0.258和0.302,与TC组相比,TH组厚壁菌门的相对丰度有降低趋势,差异显著,但厚壁菌门与拟杆菌门相对丰度的比值并无显著性差异。在科水平,组间有差异的细菌主要是乳酸杆菌科和互营杆菌科,见表3。与C组相比,TC组乳酸杆菌科和互营杆菌科的相对丰度有降低的趋势,差异有显著性。与TC组相比,TH组互营杆菌科的相对丰度有增加的趋势,差异有显著性。TC组和C组、TH组比较,互营杆菌科的相对丰度具有显著性差异。在属水平,TC组和C组相比,有显著性差异的菌属为乳杆菌属(P=0.045),梭菌属(P=0.034)和吉氏副拟杆菌属(P=0.045)。同时TC组相比于C组乳杆菌属和梭菌属的相对丰度降低,吉氏副拟杆菌属的相对丰度增加。TH组和TC组相比,有显著性差异的菌属为Butyricicoccus,P=0.028,且TH组Butyricicoccus的相对丰度较低。本研究,TC组和C组比较,主要的菌门的相对丰度未发现显著性变化,但科水平上乳酸杆菌科和互营杆菌科的相对丰度发生改变,同时属水平上吉氏副拟杆菌属、乳杆菌属和梭菌属的相对丰度发生改变。TH组和TC组比较,主要的菌门中厚壁菌门的相对丰度发生改变,但厚壁菌门与拟杆菌门相对丰度的比值并未发生改变。主要的菌科中互营杆菌科的相对丰度发生改变,且主要的菌属中Butyricicoccus的相对丰度发生改变。因此TC组和C组、TH组相比,互营杆菌科的相对丰度有降低趋势,差异有统计学意义。
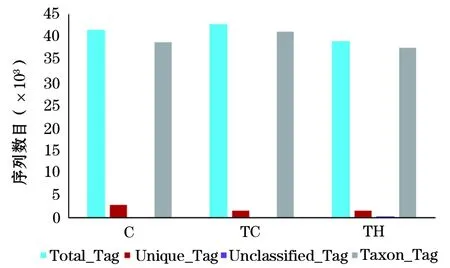
图1 C组、TC组和TH组样品OTUs聚类
注:Total_Tag:测序后各组总的序列数目;Unique_Tag:无法聚类到OTUs的序列数目;Unclassified_Tag:聚类到OTUs但没有获得注释信息的序列数目;Taxon_Tag:构建到OTUs且获得注释信息的序列数目

组别nChao1P1ShannonP2C组6518.00±56.28-6.17±0.41-TC组5483.20±91.680.4585.60±0.550.08TH组6462.33±45.030.6335.67±1.030.991
注:C组. 假手术常氧组;TC组. 主动脉弓缩窄模型常氧组;TH组. 主动脉弓缩窄模型低氧组;P1. Chaol组间P值;P2. Shannan组间P值
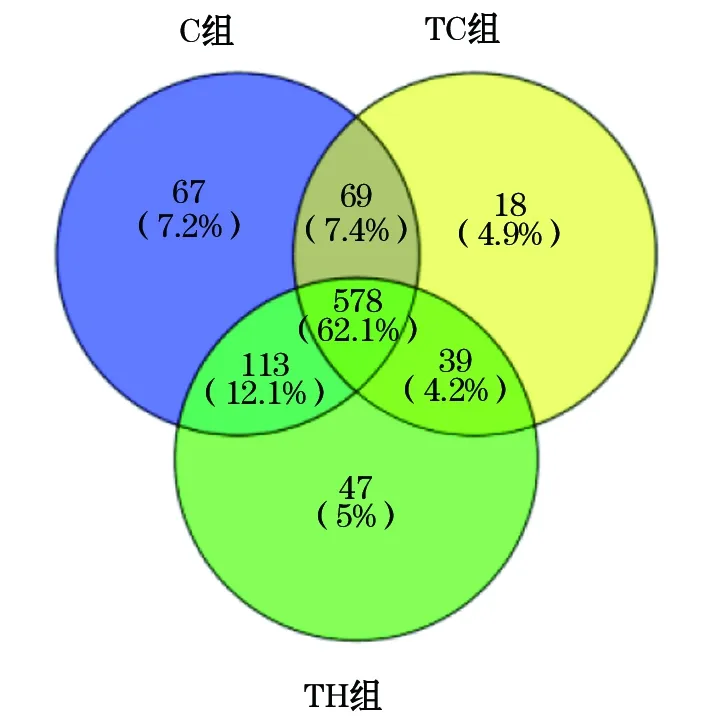
图2 C组、TC组和TH组样品OTUs(物种)数目
注: C组、TC组和TH组共有的OTUs为578个; C组和TC组共有的OTUs为69个; C组和TH组共有的OTUs为113个; TC组和TH组共有的OTUs为39个

表3 C组、TC组和TH组科水平物种的相对丰度
注:C组. 假手术常氧组;TC组. 主动脉弓缩窄模型常氧组;TH组. 主动脉弓缩窄模型低氧组;P1. Lactobacillaceae组间P值;P2. Odoribacteraceae组间P值;P3. Syntrophobacteraceae组间P值
3 讨 论
本研究运用16S rDNA测序的方法检测了间歇式低氧处理后主动脉弓缩窄模型小鼠肠道微生物的组成。间歇式低氧处理后TH组小鼠体重与处理前相比显著性增加。此外TC组和C组、TH组相比,Syntrophobacteraceae的相对丰度有降低趋势,有统计学差异。有研究显示持续性低氧可能影响蛋白质的代谢,导致体重的丢失[13]。本研究间歇式低氧处理后小鼠体重出现增加的趋势,这表明间歇式低氧模式可能对小鼠具有有利的影响,其因果关系仍需进一步研究。此外,本研究结果显示,门水平上,相对丰度较高的菌为拟杆菌门、厚壁菌门和变形菌门,这与其他肠道微生物相关研究的结果是一致的。主动脉弓缩窄模型常氧组与假手术常氧组相比,科水平上,Lactobacillaceae、Odoribacteraceae和Syntrophobacteraceae的相对丰度发生改变。属水平上Lactobacillus、Odoribacter、Clostridium和Parabacteroides的相对丰度发生改变。Lactobacillus对血压的影响目前还存在争议,Odoribacter和Parabacteroides与主动脉弓缩窄相关研究尚未见报道,Lactobacillus、Odoribacter和Parabacteroides与主动脉弓缩窄的关系仍需进一步研究。Clostridium属于厌氧芽孢杆菌,在主动脉弓缩窄组显著性减少,间歇式低氧组未出现降低趋势。其下属的丁酸梭菌可以促进肠道有益菌的增值和抑制有害菌的繁殖,其代谢产物丁酸对肠上皮组织和钠的吸收具有促进作用,对血压具有一定的影响。间歇式低氧处理后相对丰度发生改变的菌主要是Syntrophobacteraceae和Butyricicoccus。低氧处理后Syntrophobacteraceae的相对丰度有增加的趋势。Syntrophobacteraceae属于厌氧互营菌,参与丙酸盐向乙酸盐、二氧化碳和氢气等有机物的降解过程,可以为其他微生物提供基质[14]。同时有研究显示,依赖肠道菌群产生的丙酸盐可通过嗅觉受体78(Olfr78)和G蛋白偶联受体41(Gpr41)调节血压[15]。Butyricicoccus可以代谢产生丁酸盐,间歇式低氧Butyricicoccus相对丰度降低,这与已报道的Butyricicoccus的相关研究结果不一致。这可能与Butyricicoccus的活性受到抑制相关,有待进一步研究验证。实验结果显示相对丰度发生改变的菌多是厌氧菌,间歇式低氧处理可能通过改变小鼠肠道内氧气的浓度,提高厌氧菌耐受和代谢,通过小鼠肠道内微生物组成的改变及其产物的代谢对主动脉弓缩窄小鼠的血压和炎性反应等具有一定的影响。间歇式低氧处理是如何通过调节肠道菌群来抑制主动脉弓缩窄模型小鼠的心肌肥厚和肺部炎性反应的相关内容仍需进一步研究。
[1] Neubauer J A. Invited review: physiological and pathophysiological responses tointermittent hypoxia[J]. J Appl Physiol, 2001,90(4):1593-1599.
[2] Casas M, Casas H, Pagés T,etal. Intermittent hypobaric hypoxia induces altitude acclimation and improves the lactate threshold[J]. Aviat Space Environ Med,2000,71(2):125-130.
[3] Zhuang J, Zhou Z. Protective effects of intermittent hypoxic adaptation onmyocardium and its mechanisms[J]. Biol Signals Recept,1999,8(4-5):316-322.
[4] Zou X, Sorenson B S, Ross K F,etal. Augmentation of epithelial resistance to invading bacteria by using mRNA transfections[J]. Infect Immun, 2013,81(11):3975-3983.
[5] Røseth A G, Schmidt P N, Fagerhol M K. Correlation between faecal excretion ofindium-111-labelled granulocytes and calprotectin, a granulocyte marker protein, in patients with inflammatory bowel disease[J]. Scand J Gastroenterol,1999,34(1):50-54.
[6] Cammarota G, Ianiro G, Cianci R,etal. The involvement of gut microbiota in inflammatory bowel disease pathogenesis: potential for therapy[J]. Pharmacol Ther,2015,149:191-212.
[7] Honour J W. Historical perspective: gut dysbiosis and hypertension[J]. Physiol Genomics, 2015,47(10):443-446.
[8] Faerber G, Barreto-Perreia F, Schoepe M,etal. Induction of heart failure by minimally invasive aortic constriction in mice: reduced peroxisome proliferator-activated receptorγcoactivator levels and mitochondrial dysfunction[J]. J Thorac Cardiovasc Surg,2011,141(2):492-500.
[9] Chen Y, Guo H, Xu D,etal. Left ventricular failure produces profound lung remodeling and pulmonary hypertension in mice: heart failure causes severe lung disease[J]. Hypertension,2012,59(6):1170-8.
[10] 李 军,尚海豹,刘庆春,等. 微创手术致主动脉弓狭窄在小鼠心力衰竭模型制作中的应用[J]. 山东医药,2014, 54(12):5-7.
[11] 汪小军,李 鑫,李 瑾,等.膀胱癌全腹膜外回肠膀胱术术式改良探讨[J].武警医学,2016,27(4):334-338.
[12] Moreno-Indias I, Torres M, Montserrat J M,etal. Intermittent hypoxia alters gut microbiota diversity in a mouse model of sleep apnoea[J]. Eur Respir J, 2015,45(4):1055-1065.
[13] Kayser B. Nutrition and high altitude exposure[J]. Int J Sports Med,1992,13(Suppl 1) :S129-132.
[14] Plugge C M, Henstra A M, Worm P,etal. Complete genome sequence of Syntrophobacter fumaroxidans strain (MPOB(T)[J]. Stand Genomic Sci, 2012,7(1):91-106.
[15] Pluznick J L, Protzko R J, Gevorgyan H,etal. Olfactory receptor responding to gut microbiota-derived signals plays a role in renin secretion and blood pressureregulation[J]. Proc Natl Acad Sci USA, 2013,110(11):4410-4415.
(2016-05-11收稿 2016-09-23修回)
(责任编辑 郭 青)
Effect of intermittent hypoxia on transverse aortic constriction of intestinal flora in a murine model
ZHOU Xianjie1,LI Jun2, LU Feixiang1, XIA Jingyuan1, and LIU Qingchun1.1.General Hospital of Chinese People’s Armed Police Force,Beijing 100039,China;2.Laboratory Animal Center, Peking University, Beijing 100871, China
Objective To study the influence of intermittent hypoxia on transverse aortic constriction (TAC) of intestinal flora in a murine model.Methods Eighteen C57BL/6 mice were evenly and randomly divided into three groups: Group C, Group TC and Group TH. Twelve of these mice were subjected to transverse aortic constriction and six model mice to a pattern of intermittent hypoxia (8 h at 10.5% O2 and 16 h at room air) for 10 days. Twelve mice served as normoxic controls. Faecal samples were obtained and microbiome composition was determined by 16 S rDNA pyrosequencing and bioinformatics analysis by Quantitative Insights into Microbial Ecology.Results A lower abundance of Syntrophobacteraceae was detected in the normoxic-exposed transverse aortic constriction model mice than in controls.The difference between TC and C was of statistical significance (P=0.004), but wasP=0.013 between TC and TH.Conclusion sIntermittent hypoxia can alter intestinal flora in a mouse model. Whether this change has influence on the progress of the transverse aortic constriction needs to be further studied.
intermittent hypoxia;transverse aortic constriction;intestinal flora
周仙杰,硕士研究生。
1.100039 北京,武警总医院采购中心;2.100871,北京大学实验动物中心
刘庆春,E-mail:lqc@vip.163.com
R37.1
