赭曲霉毒素A完全抗原的制备及鉴定
2016-12-17周景明李春革祁艳华张罗莎张改平王爱萍
周景明,李春革,祁艳华,张罗莎,张改平,王爱萍
(郑州大学生命科学学院,河南郑州 450001)
赭曲霉毒素A完全抗原的制备及鉴定
周景明,李春革,祁艳华,张罗莎,张改平,王爱萍*
(郑州大学生命科学学院,河南郑州 450001)
赭曲霉毒素A(OTA)是一种对人和动物具有广泛毒性的霉菌毒素,为建立OTA在食品和饲料中的快速检测方法,采用活性酯法(NHS)将OTA与牛血清白蛋白(BSA)、鸡卵清白蛋白(OVA)偶联,分别制备了免疫原OTA-BSA和包被原OTA-OVA。紫外扫描和SDS-PAGE鉴定表明,OTA与BSA和OTA与OVA偶联成功,偶联物OTA-BSA和OTA-OVA的偶联比分别为7∶1和4.5∶1。用免疫原OTA-BSA免疫Balb/c小鼠,制备多克隆抗体,用OTA-OVA包被ELISA板进行检测,小鼠血清中抗OTA的抗体效价最高可达1∶51200。表明制备的免疫原OTA-BSA具有良好的免疫原性,为OTA单克隆抗体的制备奠定了基础。
赭曲霉毒素A;活性酯法;完全抗原;多克隆抗体
赭曲霉毒素(ochratoxin)是由曲霉菌属(Aspergillus)和青霉菌属(Penicillium)的某些种产生的二级代谢产物,包含7种结构类似的化合物。其中赭曲霉毒素A(ochratoxin A,OTA)最普遍且毒性最强。OTA具有肾脏毒性、肝脏毒性、免疫毒性,以及致畸、致癌和致突变等特性,对动物和人体健康有很大的潜在危害[1]。根据已发现的真菌毒素的重要性及危害性排序,OTA仅次于黄曲霉毒素而位列第2,国际癌症研究机构于1993年将OTA列为2B类致癌物[2]。因此,世界各国均非常重视对OTA的检测和控制,分别制定了相关的限量标准,以确保食品安全和消除国际贸易的技术壁垒。目前,用于检测OTA的方法主要有高效液相色谱法(high-performance liquid chromatography,HPLC)、液相-质谱联用法(liquid chromatography mass spectrometer,LC-MS)[3]、毛细管电泳-二极管列阵检测法、酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)、胶体金免疫层析法(gold immunochromatography assay,GICA)等,其中免疫学方法以其快速、方便、成本低的优点成为较常运用的OTA检测方法之一[4]。
OTA分子质量为403.8u,属于小分子物质,具有免疫反应性,不具备免疫原性,必须与大分子物质偶联之后,借助大分子的T细胞表位才能刺激机体产生针对OTA的特异性抗体应答。本试验采用活性酯法,先将OTA转化成较活泼的中间体,然后与大分子物质偶联,分别获得免疫原OTA-BSA和包被原OTA-OVA,并从紫外扫描、SDS-PAGE和动物免疫3个方面对制备的偶联抗原进行鉴定。
1 材料与方法
1.1 材料
1.1.1 主要试剂 赭曲霉毒素(OTA)为Pribolab公司产品;牛血清白蛋白(BSA)、鸡卵清白蛋白(OVA)、N-羟基琥珀酰亚胺(NHS)、弗氏完全佐剂、弗氏不完全佐剂均为Sigma公司产品;碳二亚胺盐酸盐(EDC)、N-N-二甲基甲酰胺(DMF)、四氢呋喃(THF)、乙醇均购自国药集团化学试剂有限公司;考马斯亮蓝法蛋白含量测定试剂盒购自北京索莱宝科技有限公司;辣根过氧化物酶标记羊抗鼠 IgG(G@M-IgG-HRP)为Abbkine公司产品;其他试剂均为分析纯。
1.1.2 主要仪器 TP-214分析天平为Denver公司产品;Mini-PROTEAN Tetra System电泳仪、Gel DocTMXR+ 凝胶成像系统、Immuno WashTM1575微孔洗板机、iMARKTM酶标仪,Bio-Rad公司;NanoDrop 2000c分光光度计、Barnstead Nanopure超纯水仪,Thermo公司;CMAG HS4加热磁力搅拌器为德国IKA公司产品;H1650-W台式高速离心机为湖南湘仪实验室仪器开发有限公司产品;WD-9405B型水平摇床为北京市六一仪器厂产品;透析袋为北京索莱宝科技有限公司产品。
1.1.3 实验动物 3只健康雌性Balb/c小鼠,6周龄,郑州大学分子免疫学实验室自繁自养。
1.2 方法
1.2.1 偶联抗原的制备 称取1mg OTA溶解于2mL的无水四氢呋喃(THF)中,按照摩尔比OTA∶NHS∶EDC=1∶2∶4的比例分别加入NHS和EDC,于室温下避光剧烈摇动4h。活化后10000r/min离心15min,取上清,弃沉淀,挥发THF,残留物溶解于0.2mL的二甲基甲酰胺中,此为活化产物。称取10mg BSA,充分溶解于2mL 0.13mol/L NaHCO3溶液中,于4℃预冷。将活化产物缓慢滴加于BSA溶液中,室温避光缓慢摇动,偶联时间为4h。反应产物于0.05mol/L 的NaHCO3溶液中透析72h,去除游离的OTA以及其他小分子物质,透析结束后3000r/min离心10min,上清即为OTA与BSA的偶联物,置-20℃保存,备用。同法制备OTA-OVA偶联物[5]。
1.2.2 偶联物的浓度测定及鉴定
1.2.2.1 偶联物蛋白浓度测定 采用考马斯亮蓝试剂盒按照使用说明测定偶联物OTA-BSA和OTA-OVA的浓度。
1.2.2.2 偶联物紫外扫描及偶联比鉴定 在特定波长范围内,根据偶联物偶联前后的特征吸收峰,分析吸收峰位置及吸收强度的变化,判断OTA与BSA、OVA的偶联效果。用PBS配制一定浓度的OTA(OTA标准品先用无水乙醇溶解,之后用PBS稀释)、BSA、OVA、OTA-BSA、OTA-OVA溶液,在200nm~800nm范围内进行紫外扫描,判断偶联物偶联情况[6]。以OTA-BSA为例,分别测定OTA、BSA以及OTA-BSA在333nm、279nm处的吸光度值,按照下面公式进行计算偶联比[7]。
K为物质在其最大吸收峰处的克分子消光系数,ρ为浓度,A为吸光度值,M为摩尔质量。
1.2.2.3 偶联物SDS-PAGE鉴定 对合成的偶联物进行SDS-PAGE(sodiumdodecylsulfatepolyacrylamidegelelectropheresis)分析,浓缩胶浓度为50g/L,电压设为90V,分离胶浓度为120g/L,电压设为120V。上样量为20μL,蛋白胶用考马斯亮蓝染色液2h后,置于脱色液中进行脱色,直至蛋白条带清晰可见,根据结果判断是否偶联成功。
1.2.2.4OTA-BSA免疫原性鉴定
(1)选取3只6周龄健康雌性Balb/c小鼠,用OTA-BSA进行免疫。免疫方式是皮下多点注射,免疫剂量为20μg/200μL/只,首免加弗氏完全佐剂,再次免疫均用不完全佐剂,首免3周后,进行第2次免疫,之后每隔2周免疫1次,共免疫4次[8]。末次免疫2周后,断尾采血并用PBS进行100倍稀释,3000r/min离心10min,分装并保存。
(2)多抗血清效价的检测。用碳酸盐缓冲液将OTA-OVA稀释为2μg/mL,50μL/孔包被于ELISA板上,4℃包被过夜。次日PBST洗板3次后,加入50mL/L猪血清进行封闭,200μL/孔,37℃温育2h。PBST洗板3次,拍干封闭液。第1孔加入100μL1∶100稀释的血清,其余孔加入PBS,50μL/孔,用多通道微量移液器从第1孔吸取50μL血清与第2孔铺底的PBS混匀后取50μL加入第3孔,以此类推进行倍比稀释,稀释到第10列为止;第11列加入阴性血清作为阴性对照,50μL/孔;第12列加入PBS作为空白对照,50μL/孔,37℃作用1h。PBST洗涤6次,加入1∶5000稀释的G@M-IgG-HRP,50μL/孔,37℃孵育1h。PBST洗板6次,加入TMB显色液,50μL/孔,显色5min。然后加入2mol/L的硫酸终止显色,50μL/孔,测定各孔的OD450nm值,同时设立阴性(NC)对照和空白(BC)对照。以P/N≥2.1的血清最高稀释度作为该免疫血清的效价(P为待测孔的OD450nm值,N为阴性对照孔的OD450nm值)[9]。
(3)多抗血清敏感性的检测。检测血清多抗敏感性时按如前所述方法包被抗原后,抗原包被方法如前所述,第1孔加入640ng/mL的OTA标准品,之后用PBS倍比稀释,50μL/孔,然后每孔加入检测效价时OD450nm值为1.0左右的稀释度的阳性血清,50μL/孔,最后留2孔做阴性对照和空白对照,37℃作用1h。PBST洗板6次,每孔加入50μL1∶5000稀释的G@M-IgG-HRP,37℃孵育1h。PBST洗板6次,加入TMB显色液,50μL/孔,显色5min,加入2mol/L的硫酸终止显色,用酶标仪读数,分析并保存数据。计算不同浓度OTA的抑制率,并制作标准曲线。抑制率=(1-B/B0)×100%(B0为不加OTA孔的OD450nm值,B为加入不同浓度OTA孔的OD450nm值),并计算IC50值[10]。
2 结果
2.1 偶联物浓度测定结果
利用考马斯亮蓝试剂盒测得OTA-BSA浓度为2.94mg/mL,OTA-OVA的浓度为1.20mg/mL。
2.2 紫外扫描及偶联物偶联比鉴定结果
对OTA、BSA、OVA、OTA-BSA、OTA-OVA进行紫外扫描分析,结果如图1、图2所示。OTA在333nm处有特征吸收峰,BSA、OVA在279nm处有特征吸收峰,偶联物的最大吸收峰为379nm处,相对于OTA、BSA、OVA的峰值产生了一定位置的偏移与叠加现象,初步证明偶联物制备成功。进而得到OTA、BSA、偶联物在333、279、379nm处的吸光度值,根据1.2.2.2所示公式计算得出OTA-BSA的偶联比为7∶1,OTA-OVA的偶联比为4.5∶1。

图1OTA、BSA、OTA-BSA紫外扫描鉴定图
Fig.1UltravioletspectrumofOTA,BSA,OTA-BSA
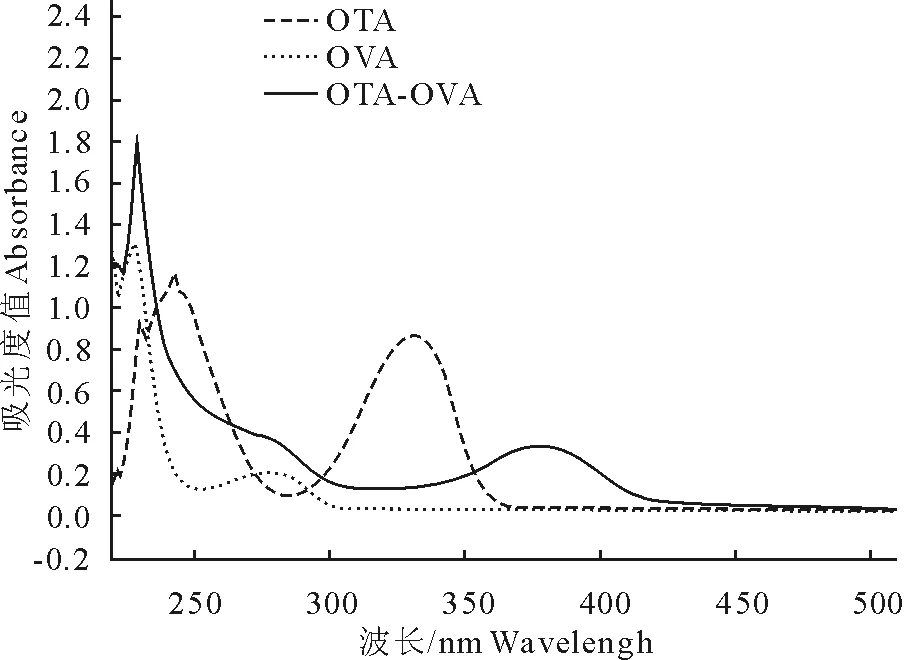
图2OTA、OVA、OTA-OVA紫外扫描鉴定图
Fig.2UltravioletspectrumofOTA,OVA,OTA-OVA
2.3 SDS-PAGE鉴定结果
电泳鉴定结果见图3、图4。由图3和图4可知,偶联物OTA-BSA、OTA-OVA的条带比BSA、OVA条带滞后,且有拖尾现象,证明偶联成功。由于BSA分子质量约为67ku,OVA的分子质量约为45ku,OTA分子质量约为0.403ku,偶联物OTA-BSA、OTA-OVA分子质量分别比BSA、OVA稍大,所以SDS-PAGE鉴定中泳动距离不明显。
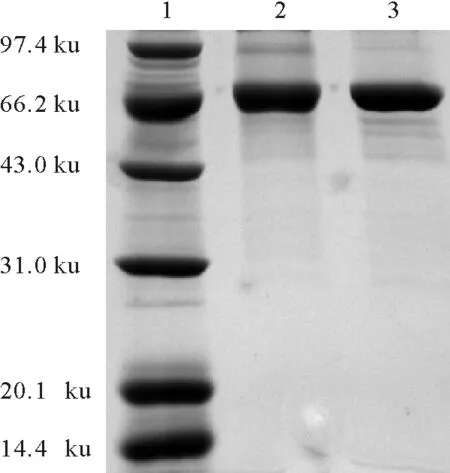
1.蛋白分子质量标准; 2.OTA-BSA; 3.BSA
1.ProteinmolecularweightMarker; 2.OTA-BSA; 3.BSA
图3OTA-BSA的SDS-PAGE分析
Fig.3AnalysisofOTA-BSAbySDS-PAGE
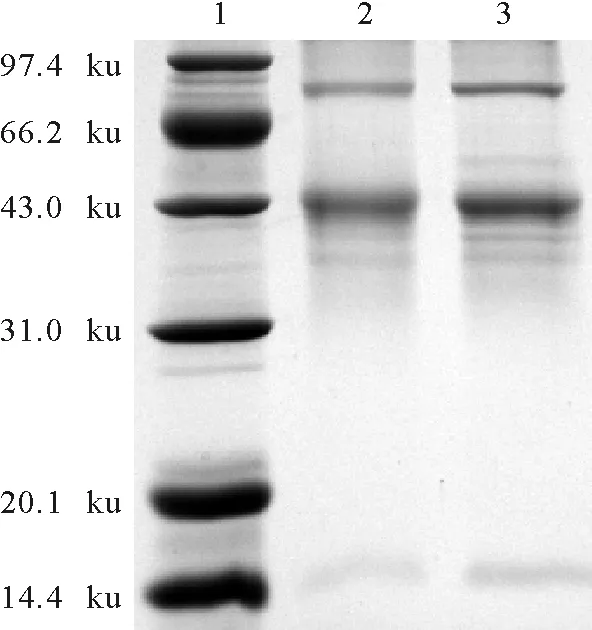
1.蛋白分子质量标准;2.OTA-OVA; 3.OVA
s1.ProteinmolecularweightMarker; 2.OTA-OVA; 3.OVA
图4OTA-OVA的SDS-PAGE分析
Fig.4AnalysisofOTA-OVAbySDS-PAGE
2.4 免疫学鉴定结果
2.4.1 抗血清效价检测 虽然OTA与载体蛋白在分子结构上已经证明偶联成功,但合成的偶联抗原能否诱导机体产生针对OTA的抗体,还要通过动物免疫来检验。用OTA-BSA免疫的3只小鼠,以OTA-OVA为包被抗原通过ELISA检测免疫小鼠血清中针对OTA的抗体及效价如表1所示。从表1可以看出,1号和2号小鼠的血清抗体效价均达到了1∶51200,其中1号小鼠的免疫效果最好。根据血清抗体检测结果可知,合成的OTA-BSA具有良好的免疫效果。
2.4.2 血清多抗敏感性检测 多抗敏感性检测结果见表2。通过间接竞争ELISA方法检测小鼠血清敏感性,选取抗体效价较高的1号小鼠血清进行试验。以OTA浓度的对数值为横坐标,以B/B0为纵坐标,绘制1号小鼠血清的抑制曲线,如图5所示,并计算其IC50值。结果IC50为9.467ng/mL。进一步说明了合成的OTA-BSA具有较好的免疫原性,能够刺激机体产生针对OTA的特异性抗体。
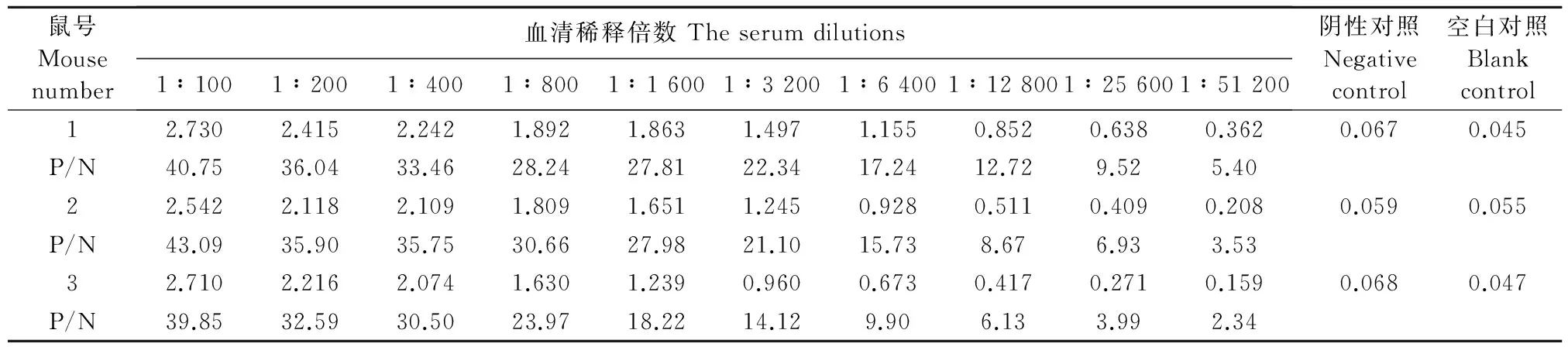
表1 间接ELISA测定小鼠血清抗OTA抗体效价Table 1 OTA antibody titers of mouse sera detected by indirect ELISA
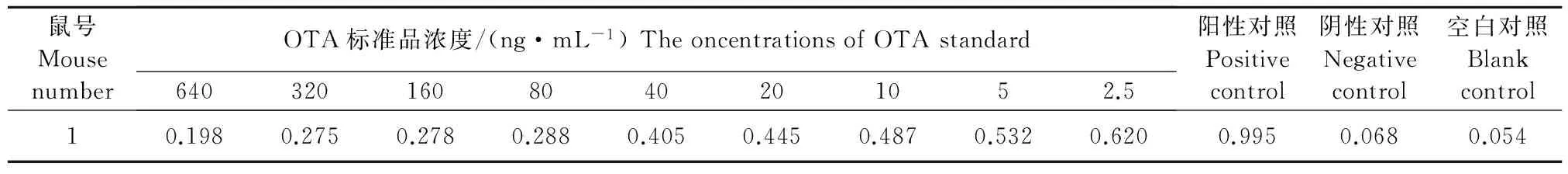
表2 间接竞争ELISA测定1号小鼠血清的抑制效果Table 2 The inhibitive effect of number one mouse serum detected by icELISA

图5 间接竞争ELISA测定1号小鼠血清的抑制曲线
Fig.5TheinhibitivecurveofnumberonemouseserumdetectedbyicELISA
3 讨论
OTA属于小分子物质,不能作为完全抗原免疫动物制备其单克隆抗体,与大分子物质偶联制备偶联物,用偶联物免疫动物才能刺激动物产生针对OTA的特异性的抗体。由于BSA价廉易得,理化性质稳定,在水相或某些有机溶剂中有较高的溶解度、分子内含有大量的活泼基团(如氨基、羧基)等优点,所以本试验选用OTA与BSA的偶联作为免疫原。用偶联物免疫动物时,动物至少会产生两类抗体,一类是针对小分子半抗原的,另一类则是针对载体。为了检测产生的针对半抗原的抗体,必须排除针对载体的抗体的干扰,所以合成包被原的载体也尤为重要,本试验选用与BSA结构差别较大的OVA作为包被原载体,用来检测免疫原免疫动物的效果。
半抗原与载体结合的部位直接影响所制备抗体的特异性。一般来说,应选择对免疫识别不太重要的部位进行偶联,如距离半抗原主要抗原决定簇部位较远且不是维持半抗原结构必要的部位。这是因为抗体通常对远离偶联位点的半抗原具有较好的识别能力,有利于产生效价高且特异性好的抗体[11]。OTA分子中有羧基,可以用混合酸酐法和活性酯法对其进行偶联,由于混合酸酐法步骤繁杂,制备的抗体血清特异性差以及副产物多等缺点,而活性酯法却有步骤简便、制备的抗体特异性强、副产物少等优点,所以本试验选用活性酯法制备免疫原与包被原。
人工合成抗原偶联比的大小与半抗原功能基团的活性、位阻、反应条件及反应原料等有关。偶联比的大小与偶联物免疫动物产生的抗血清的特异性有关。因此,免疫前测定偶联物偶联比具有特殊意义。一般情况下,半抗原与载体偶联比为3∶1~45∶1时具有较强的免疫原性[12]。并不是载体上偶联的半抗原数目越多越好,据报道,载体表面覆盖过多的半抗原不利于载体与淋巴细胞抗原受体的结合,也不能刺激机体产生有效的免疫反应[13]。不同偶联比的合成抗原,可以根据试验需要调节免疫剂量来达到较好的免疫效果。本试验合成的人工抗原OTA与BSA偶联比为7∶1,OTA与OVA偶联比为4.5∶1,从小鼠免疫试验结果看,合成的偶联抗原具有较好的免疫效果。
在对合成的偶联物进行紫外扫描及SDS-PAGE电泳鉴定中,由于偶联物特征吸收峰相对于BSA、OVA及OTA的特征吸收峰有位置偏移,且有叠加效应;OTA与载体的偶联物分子质量要大于单纯载体的分子质量,所以在电泳鉴定中,偶联物条带相对于载体条带有滞后、拖尾的现象。在本试验中,从动物免疫结果来看,抗OTA的抗体效价可达1∶51200,其IC50为9.467ng/mL,说明本研究制备的抗体具有较高的效价和特异性。人工抗原的成功制备为后续制备OTA单克隆抗体奠定了基础[14]。
[1] 龙 淼,李颜鹏,任艳苗,等.微生物对赭曲霉毒素脱毒作用研究进展[J].动物医学进展,2014,35(6):132-135.
[2]MedinaA,MateoR,Lopez-OcanaL,etal.StudyofSpanishgrapemycobiotaandochratoxinAproductionbyisolatesofAspergillus tubingensisandothermembersofAspergillussectionNigri[J].ApplEnvironMicrobiol,2005,71(8):4696-4702.
[3]JeswalP,KumarD.Mycobiotaandnaturalincidenceofaflatoxins,ochratoxinA,andcitrinininindianspicesconfirmedbyLC-MS/MS[J].IntJMicrobiol,2015,2015:242486.
[4] 王 颖,张妮娜,雒丽娜,等.赭曲霉毒素A检测方法的研究进展[J].中国卫生检验杂志,2014,24(5):757-760.
[5] 陈雪岚,许 杨,吴成钢.赭曲霉毒素A的酶联免疫检测——Ⅰ抗原的制备[J].卫生研究,2002,31(1):53-55.
[6]LuoM,TangY.Preparationofanti-zearalenonemonoclonalantibodyandpreliminaryestablishmentofcolloidalgoldimmunochromatographicassayforzearalenone[J].XiBaoYuFenZiMianYiXueZaZhi,2013,29(7):729-733.
[7] 蔡 敏,周常义,李 健,等.黄曲霉毒素B1人工抗原的制备及鉴定[J].湖南农业科学,2013,23:10-13.
[8] 王 铮,王铁成,冯 娜,等.犬瘟热病毒单克隆抗体的制备及其生物学特性鉴定[J].动物医学进展,2014,35(3):73-77.
[9]WeiL,ChengbiaoZ,YulanZ,etal.Preparationofpolyclonalantibodiestoaderivativeof1-aminohydantion(AHD)anddevelopmentofanindirectcompetitiveELISAforthedetectionofnitrofurantoinresidueinwater[J].AgriFoodChem,2007,55(17):6829-6834.
[10]XinL,LiPeiwu,ZhangZhaowei,etal.ASensitiveimmunoaffinitycolumn-linkedindirectcompetitiveELISAforochratoxinAincerealandoilproductsbasedonanewmonoclonalantibody[J].FoodAnal,2013,6(5):1433-1440.
[11]KinHJ,LiuS,KeumYS,etal.Developmentofanenzyme-linkedimmunosorbentassayfortheinsecticidethiamethoxam[J].AgriFoodChem,2003,51(7):1823-1830.
[12]ErlangerBF.Thepreparationofantigenichaptencarrierconjugate:asurvey[J].MethEnzymol,1980,70(A):85-104.
[13] 张 梅,张继瑜,李剑勇,等.兽药人工抗原合成的研究进展[J].中国兽医医药杂志,2006(1):63-65.
[14] 谢华丽,邵华斌,杨 峻,等.禽白血病病毒p27蛋白单克隆抗体的制备及鉴定[J].动物医学进展,2013,34(12):34-37.
Preparation and Identification of Complete Antigen for Ochratoxin A
ZHOU Jing-ming,LI Chun-ge,QI Yan-hua,ZHANG Luo-sha,ZHANG Gai-ping,WANG Ai-ping
(SchoolofLifeScience,ZhengzhouUniversity,Zhengzhou,Henan,450001,China)
Ochratoxin A (OTA) is a mycotoxin which has a wide range of toxicity to human and animals.In order to establish a rapid detection method of OTA in food and cereals,OTA was coupled with BSA and OVA using NHS method to prepare the immunogen OTA-BSA and coating antigen OTA-OVA.UV scanning spectrum and SDS-PAGE methods showed that BSA and OVA were successfully coupled with OTA.The coupling ratio of them were 7∶1and 4.5∶1,respectively.The polyclonal antibody was prepared by immunizing Balb/c mice with OTA-BSA,and the titer was up to 1∶51200by ELISA after coating ELISA plate with OTA-OVA.The result showed that the prepared immunogen OTA-BSA had a satisfied immunogenicity and provided a basis for the preparation of OTA monoclonal antibody.
ochratoxin A;NHS method;complete antigen;polyclonal antibody
2015-06-12
国家科技支撑计划项目(2014BAD13B05);郑州大学2015年度大学生创新创业训练计划项目
周景明(1972-),男,河南南阳人,副教授,博士,主要从事分子免疫学和免疫学检测技术研究。*通讯作者
Q949.32
A
1007-5038(2016)01-0038-05
