葡萄叶总黄酮的提取及体外抑菌活性研究
2016-12-17库尔班江巴拉提周兆祥
库尔班江·巴拉提,周兆祥
(1.伊犁师范学院自治区教育厅普通高等学校重点实验室,新疆伊宁 835000;2.西北农林科技大学动物医学院,陕西杨凌 712100)
葡萄叶总黄酮的提取及体外抑菌活性研究
库尔班江·巴拉提1,周兆祥2
(1.伊犁师范学院自治区教育厅普通高等学校重点实验室,新疆伊宁 835000;2.西北农林科技大学动物医学院,陕西杨凌 712100)
为测定葡萄叶总黄酮体外抑菌活性,采用索氏提取器回流法提取葡萄叶总黄酮;采用K-B琼脂扩散法分别用大肠埃希菌、金黄色葡萄球菌、白假丝酵母菌、枯草芽胞杆菌做抑菌试验;以抑菌效果最明显的金黄色葡萄球菌为指示菌,以总黄酮的提取率及抑菌圈直径为指标,单因素试验筛选葡萄叶总黄酮最佳提取工艺,乙醇浓度750mL/L、料液比1∶40、提取温度70℃、提取时间3.5h,在此提取条件下测得葡萄叶中总黄酮的平均提取率为7.16%;葡萄叶中总黄酮对金黄色葡萄球菌和大肠埃希菌具有较强的抑菌作用,其中对金黄色葡萄球菌抑菌活性最大,而对枯草芽胞杆菌的抑菌作用不太明显。
葡萄叶总黄酮;提取工艺;体外抑菌活性
葡萄(Vitisvinifera)是葡萄科(Vitaceae)葡萄属(Vitis)落叶藤本植物,是世界最古老的植物之一。 葡萄栽培在我国各地普遍存在,尤其是新疆地区有丰富的葡萄资源[1-3]。葡萄叶作为一种传统民间中药材,大量临床研究表明其能够有效地治疗呕吐、水肿、目赤以及小便不利等病症。葡萄叶含有丰富的具有高生理活性的黄酮类、有机酸、鞣质类、低聚芪类等化合物。在土耳其、希腊及中东一带,葡萄叶被普遍作为烹饪材料,以葡萄叶包米和绞肉的菜肴[3-6]。因而,葡萄叶资源有待进一步得到开发利用。
类黄酮(flavonoids)作为一种天然色素,广泛存在于自然界中的水果、蔬菜和谷物等,其常与维生素C伴存,是植物自身代谢产生的次级代谢物,因多呈黄色而称类黄酮。近年来随着研究方法和技术的不断改善和提高,发现了许多新的类黄酮种类和生理作用,推动着生物类黄酮的研究开发进入了全新的阶段,掀起了生物类黄酮的研究和开发热潮,其在医药、食品领域具有广泛的应用前景[7-11]。本研究以乙醇为提取剂,提取葡萄叶总黄酮,单因素试验优化提取条件,并测定提取物的体外抗菌活性,为提取葡萄叶黄酮类化合物及其进一步开发和利用奠定良好的基础。
1 材料与方法
1.1 材料
1.1.1 仪器设备 UV2600PC紫外可见光光度计由上海博讯实业有限公司医疗设备厂生产;SHA-B多功能恒温振荡器为江苏金坛市正基仪器有限公司产品;HZQ-X100A恒温振荡培养箱为上海一恒科技有限公司产品;BSP-250生化培养箱为上海博讯实业有限公司医疗设备厂生产;SHZ-Ⅲ循环水真空泵为上海亚荣生化仪器厂生产;FW80高速万能粉碎机为北京市光明医疗仪器厂生产。
1.1.2 原料和试剂 葡萄叶为2013年9月18日采自吐鲁番市恰特喀勒乡,自然晾干,于电热恒温鼓风干燥箱中40℃避光干燥、粉碎后,4℃冷藏备用;金黄色葡萄球菌(Staphyloccocusaureus)、枯草芽胞杆菌(Bacillussubtilis)、大肠埃希菌(Escherichiacoli)、白假丝酵母(Canidiaalbicans)均购自北京莱耀生物科技有限公司;牛肉膏蛋白胨琼脂培养基、LB培养基、土豆培养基等均购自杭州微生物试剂有限公司;芦丁标准品(98%)购自国药集团化学试剂有限公司(批号:100080-200707);琼脂粉、蛋白胨为天津市英博生化试剂有限公司产品;牛肉膏为北京奥博星生物技术有限责任公司产品;葡萄糖为天津市天新精细化工开发中心产品;无水乙醇(AR)为成都市科龙化工试剂厂产品。其余试剂均为分析纯。
1.2 方法
1.2.1 芦丁标准液的制备 准确称取芦丁标准品5mg置于50mL的容量瓶中,用600mL/L乙醇溶解定容,配成0.1mg/mL的芦丁标准液,备用。
1.2.2 样品溶液的制备 精密称取葡萄叶粉末2g置于250mL的索氏提取器中,用750mL/L乙醇以1∶20(g/mL)的料液比在80℃下热回流3.5h,提取液用750mL/L乙醇定容至100mL,备用。
1.2.3 最大吸收波长的确定 精密取0.1mg/mL的芦丁标准液适量,加入到10mL容量瓶中,在波长350nm~650nm进行全波长扫描,结果显示510nm处具有芦丁最大吸收峰。因此,选择510nm为测定波长。
1.2.4 标准曲线的绘制 分别精密吸取0.1mg/mL的芦丁标准液0、0.4、0.8、1.2、1.6、2.0mL,分别移至10mL容量瓶中(编号:0~5),分别各加入0.3mL 50g/L亚硝酸钠、静置6min,再加入0.3mL 100g/L硝酸铝、再静置6min,最后加入4mL 40g/L氢氧化钠,用600mL/L乙醇定容至刻度、放置15min。用UV2600PC紫外可见光光度计在波长510nm下测定系列标准溶液的吸光度。
1.2.5 样品含量测定 精密取样品提取液适量移至10mL容量瓶中,按1.2.4项下方法操作,在波长510nm下测定样品提取液的吸光度。根据标准曲线,由下式计算样品的含量和提取率:
式中:Y为黄酮类物质的浓度(mg/mL);V为原提取液体积(mL);W为样品的质量(g);a为稀释倍数。
1.2.6 葡萄叶总黄酮的提取工艺优化 以总黄酮含量及抑菌圈直径为考察指标,分别考察乙醇浓度、提取时间、提取温度及料液比对葡萄叶中总黄酮提取率及抑菌活性的影响[12-14]。
研究乙醇浓度对葡萄叶总黄酮提取率及抑菌活性的影响。精确称取葡萄叶粉若干份(每份2.000g),置于250mL索氏提取器中,按1∶40的料液比分别加入450、600、750、900mL/L的乙醇溶液,在70℃下提取3.5h。从中吸取提取液适量,按1.2.1方法,在510nm处测定提取液的吸光度,并根据回归方程计算出总黄酮的质量和总黄酮的提取率。将剩余的提取液用旋转蒸发仪减压浓缩回收乙醇,得到干燥的提取物浸膏,再用5mL的无菌水溶解,用4种提取液分别作抑菌试验。
研究不同料液比对葡萄叶总黄酮提取率及抑菌活性的影响。精确称取葡萄叶粉若干份(每份2.000g),分别按1∶20、1∶30、1∶40和1∶50料液比,加入750mL/L乙醇在70℃下提取3.5h。考察不同时间比对葡萄叶总黄酮提取率及抑菌活性的影响。精确称取葡萄叶粉若干份(每份2.000g),按1∶40的料液比,加入750mL/L乙醇在70℃下分别提取1.5、2.5、3.5h和4.5h;考察提取温度比对葡萄叶总黄酮提取率及抑菌活性的影响精确称取葡萄叶粉若干份(每份2.000g),按1∶40的料液比,加入750mL/L乙醇,在温度分别为60、70、80、90℃下提取3.5h;其余同上。
1.2.7 体外抑菌活性的测定
1.2.7.1 供试菌的活化 用750mL/L的酒精棉擦净安瓿管,将安瓿管顶端用火焰加热,在加热的安瓿管顶端滴无菌水至致使顶端玻璃开裂,用镊子敲去已开裂的安瓿管的顶端。用无菌移液器吸取0.3mL~0.4mL液体培养基,滴入安瓿管内,轻轻振荡,溶解冻干菌体呈悬浮状,取约0.2mL菌体悬浮液,均匀涂抹于琼脂斜面培养基上,剩余的菌液移入到指定的液体培养基中,然后将培养基置于适宜的温度下培养。
1.2.7.2 菌悬液的制备 将活化好的菌种挑取单个菌落分别接种于盛有25mL液体培养基的三角瓶内,封口,35℃~37℃、200r/min振荡培养18h~24h,真菌在29℃下培养。培养结束后,用移液枪吸取1mL菌体置于装有9mL无菌生理盐水的试管内,摇匀,制成菌悬液(106CFU/mL~108CFU/mL),置4℃保存备用。
1.2.7.3 培养基的制备 牛肉膏蛋白胨培养基:蛋白胨10g,牛肉膏3g,琼脂15g~20g,NaCl5g用蒸馏水定容至1000mL,pH调至7.0~7.2,在121℃灭菌30min,冷却至约50℃适量倒入平板,供培养细菌。
马铃薯培养基(PDA培养基):马铃薯200g,葡萄糖20g,琼脂15g~20g,马铃薯去皮,切成块煮沸30min,然后用纱布过滤,再加糖及琼脂,溶化后补足水至1000mL,121℃灭菌30min,冷却至约50℃适量倒入平板,供培养真菌。
1.2.7.4 无菌滤纸片的制备 将干净的滤纸片打成直径为0.9cm的小圆纸片,置于121℃的烘箱中30min,干热灭菌、冷却、备用。
1.2.7.5 抑菌方法 细菌的抑菌方法(滤纸片法):将培养好的细菌菌悬液吸取10μL,在无菌条件下,加入到装有牛肉膏蛋白胨固体培养基的培养皿中,用无菌三角玻璃涂布棒涂抹均匀,按无菌操作将预先灭菌烘干并浸蘸葡萄叶乙醇提取液的6.0mm滤纸片平贴在含菌培养基上,在每只含菌平板上间隔一定的距离贴3片,呈三角状排列,其中一片蘸无菌水滤纸片做空白对照,共重复3次,结果取平均值。放入培养箱37℃培养24h后观察并测量抑菌圈直径。
真菌的抑菌方法(滤纸片法):将培养好的真菌悬液吸取10μL,在无菌条件下,加入到装有PDA培养基的培养皿中,用涂布棒涂抹均匀,在每个平板中用镊子加入2个不同条件下葡萄叶乙醇提取液中浸泡过的滤纸片,1个浸有无菌水的滤纸片作为空白对照,3次重复,放入培养箱中28℃培养24h后观察并测量抑菌圈直径。
2 结果
2.1 标准曲线的绘制结果
以芦丁标准溶液浓度对应吸光度值进行线性回归,其回归方程为:y=0.3295x+0.0012(R2=0.995)。结果表明,芦丁标准溶液的浓度在0.4mg/mL~2.0mg/mL的范围内线性关系良好(图1)。
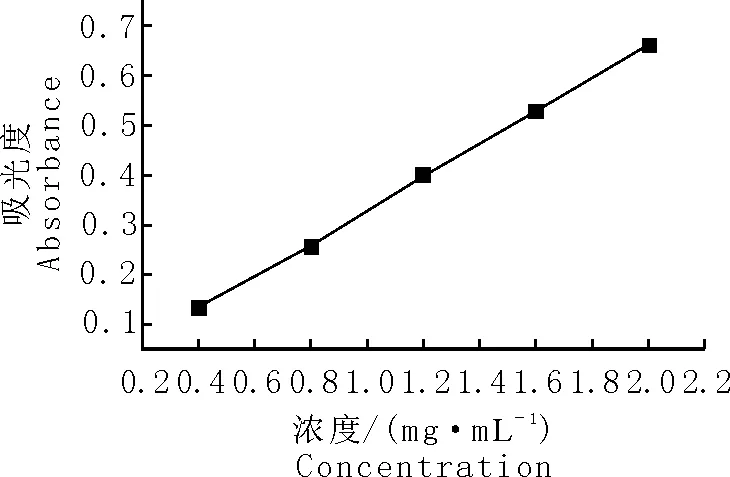
图1 芦丁标准曲线
Fig.1Standardcurveforrutin
2.2 单因素试验结果
2.2.1 乙醇浓度对总黄酮提取率及抑菌效果的影响结果 不同浓度乙醇对葡萄叶总黄酮的提取率不同,如表1所示。用450mL/L乙醇所得其提取率最低,提高乙醇浓度至750mL/L时,提取率最高为11.17%;当乙醇浓度高于600mL/L所得的葡萄叶总黄酮提取率并无差异显著性。不同浓度乙醇提取所得黄酮类物质的抑菌效果不同(表1)。乙醇浓度为450mL/L时,抑菌圈最小;750mL/L乙醇的抑菌圈最大,但与600mL/L乙醇的抑菌效果无差异显著性;但900mL/L乙醇提取的黄酮类物质抑菌效果显著降低。
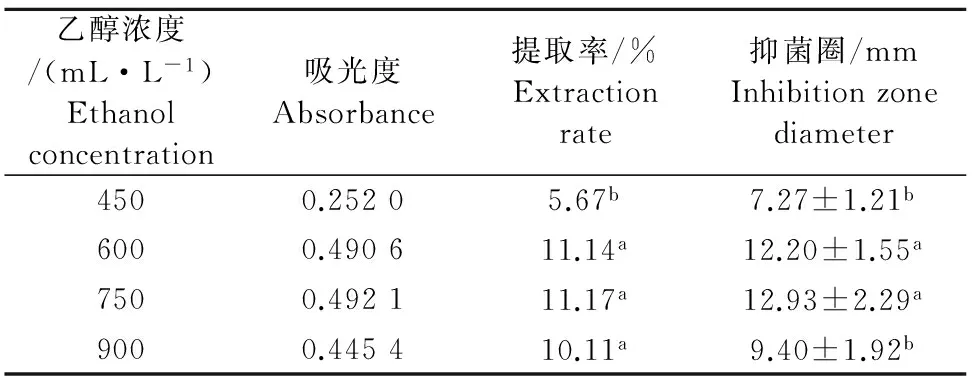
表1 乙醇浓度对黄酮提取率及其金黄色葡萄球菌抑菌圈大小的影响结果Table1 Effect of ethanol concentration on the extraction rate offlavonoids and inhibition zone diameter to Staphylococcus aureus
2.2.2 料液比对黄酮提取率及抑菌效果的影响结果 不同料液比对葡萄叶总黄酮的提取率不同,如表2所示,用料液比为1∶20提取率最低,提高料液比至1∶40,提取率最高为6.67%;当料液比高于1∶40所得的葡萄叶总黄酮提取率并无显著性差异。不同料液比所得黄酮类物质的抑菌效果不同(表2)。料液比为1∶20,抑菌圈最小;1∶40的抑菌圈最大,但与1∶50的抑菌效果无显著性差异。
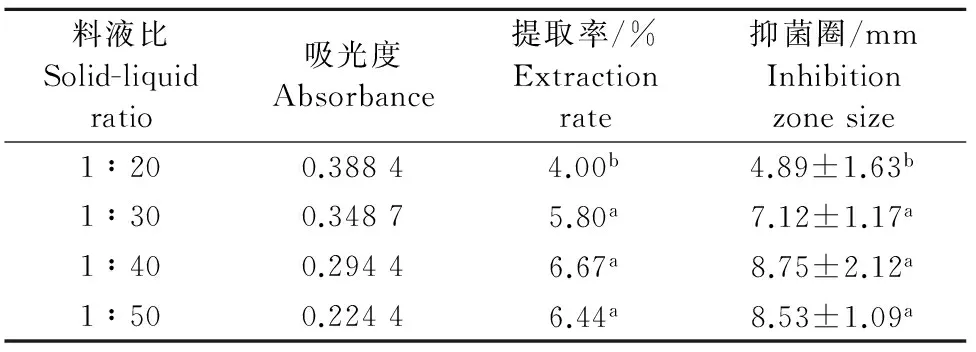
表2 料液比对总黄酮提取率及其金黄色葡萄球菌抑菌圈大小的影响Table 2 Effect of solid-liquid ratio on the extraction rate of totalflavonoids and inhibition zone size to Staphylococcus aureus
2.2.3 提取时间对黄酮提取率及抑菌效果的影响 不同提取时间对葡萄叶总黄酮的提取率不同,如表3所示,提取时间为4.5h提取率最低,缩短提取时间至3.5h,提取率最高为7.27%;当提取时间在1.5h~3.5h间所得的葡萄叶总黄酮提取率并无差异显著性。不同提取时间所得黄酮类物质的抑菌效果不同(表3)。提取时间为4.5h,抑菌圈最小;3.5h时的抑菌圈最大,且与1.5h和2.5h所得抑菌效果差异显著。
2.2.4 提取温度对黄酮提取率及抑菌效果的影响结果 不同提取温度对葡萄叶总黄酮的提取率不同,如表4所示,提取温度为80℃,提取率最低,提高温度至90℃,提取率最高为8.33%,且二者间差异显著。不同提取温度所得黄酮类物质的抑菌效果不同,70℃所得总黄酮类物质抑菌效果最好,为8.89mm;80℃抑菌效果最差为4.97mm,且二者差异显著。以抑菌效果为依据判断提取温度为70℃时效果最佳。
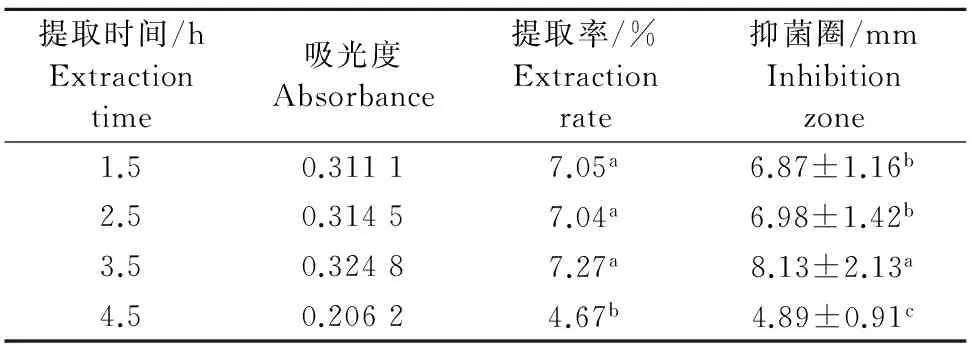
表3 提取时间对总黄酮提取率及其金黄色葡萄球菌抑菌圈大小的影响Table 3 Effect of extraction time on the extraction rate of totalflavonoids and inhibition zone to Staphylococcus aureus
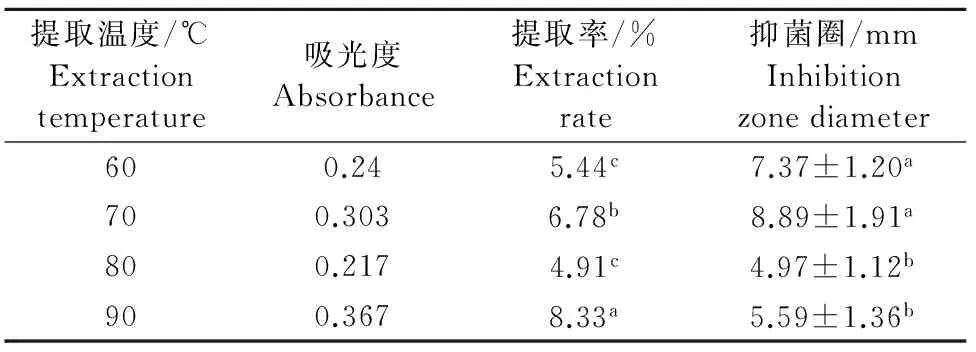
表4 温度对黄酮提取率的影响及其金黄色葡萄球菌抑菌圈大小的影响Table 4 Effect of extraction temperature on extraction rate offlavonoids and inhibition zone to Staphylococcus aureus
2.3 最佳提取条件下提取黄酮的抑菌试验
葡萄叶的最佳提取条件(乙醇浓度900mL/L,提取温度70℃,料液比为1∶40,提取时间为3.5h),并在此条件下获得葡萄叶乙醇提取物,在最佳的提取工艺条件下测得葡萄叶中总黄酮的平均含量为71.6mg/g。
以大肠埃希菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、枯草芽胞杆菌(Bacillus subtilis)、白假丝酵母菌(Candida albicans)为供试菌,采用滤纸片法,严格按照无菌操作进行抑菌试验,通过3次重复试验,测得4种菌的抑菌圈直径结果见图2。
在最佳提取条件下,葡萄叶乙醇提取物对金黄色葡萄球菌和大肠埃希菌具有较显著地抑菌作用,而对枯草芽胞杆菌的抑菌作用不显著。
3 讨论
本文在预试验中分别采用乙醚、乙酸乙酯、石油醚、丙酮、正丁醇、乙醇等对葡萄叶总黄酮进行提出并各提取物进行了抑菌试验,发现采用乙醇提取时,总黄酮的提取率及抑菌效果很好,因此本试验选用乙醇作为提取溶剂。随着乙醇浓度的提高,脂溶性物质溶出增加,而脂溶性物质对吸光度的测定有干扰,使测量结果偏高,并且不利于黄酮类物质的进一步提纯。当提取时间小于3.5h时黄酮的提取率较低,抑菌效果不明显,可能是由于加热时间短,葡萄叶内的抑菌活性物质未充分浸提所致。
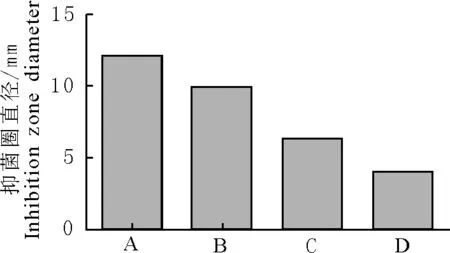
A.大肠埃希菌;B.金黄色葡萄球菌;C.枯草芽胞杆菌;D.白假丝酵母菌
A.Escherichia coli;B.Staphylococcus aureus;C.Bacillus subtilis;D.Candida albicans
图2 最佳条件下提取的黄酮抑菌效果对比
Fig.2Comparisonofantibacterialeffectoftotalflavonoidsextractedunderoptimumconditions
提取时间在3.5h总黄酮提取率能够达到最佳的提取的效果,随着提取时间的继续增加,总黄酮的提取含量反而降低,其可能是因为提取时间太长,提取液中部分乙醇挥发而导致沸点逐渐增大,往往会破坏某些黄酮类化合物,因而从提取工艺角度出发,我们选择3.5h为最佳提取时间。
温度对总黄酮的提取率及其抑菌效果作用不同。随提取温度的升高,总黄酮提取率波动较大,其可能是由于黄酮在乙醇中的溶解度随着温度的升高而增大,同时随着温度升高,提取液黏度减少,扩散系数增加,促使提取速度加快。但温度过高,一方面提取液活性成分易被破坏,杂质的溶出量增加,给后续操作带来不便;另一方面造成提取溶剂的大量损失,成本费用增大。综合各方面因素,浸提温度以70℃为宜。在提取温度为70℃时,抑菌效果最明显,平均抑菌圈直径为8.89mm。在60℃~70℃之间,随着浸提温度的升高葡萄叶乙醇提取液的抑菌活性逐渐增大,这可能是因为随着温度的升高,葡萄叶中抑菌活性物质的提取除了具有溶解效应以外,还有热效应,在一定温度下有利于其溶解,使提取效率得到提高,从而具有更好的抑菌效果。当浸提温度高于70℃后,其抑菌活性又逐渐减小,可能是当温度超过70℃时,会造成葡萄叶中抑菌物质在过高温度下,活性下降或失去活性。
葡萄叶总黄酮的最佳提取工艺为:乙醇浓度750mL/L,料液比1∶40,提取温度70℃,提取时间3.5h,在此提取条件下测得葡萄叶中总黄酮的平均提取率为7.16%;葡萄叶中总黄酮对金黄色葡萄球菌和大肠埃希菌具有较强的抑菌作用,其中对金黄色葡萄球菌抑菌活性最大,而对枯草芽胞杆菌的抑菌作用不太明显。葡萄叶中总黄酮对4种菌种抑菌活性顺序为金黄色葡萄球菌>大肠埃希菌>白假丝酵母菌>枯草芽胞杆菌。
[1]Zong-yuanZ,YangP.Studyontheoptimumextractionoftotalflavonoidsfromtheleavesofgrape[J]Biotechnology,2007(6): 24.
[2] 古丽巴哈尔·阿巴拜克力. 新疆琐琐葡萄叶总黄酮提取工艺及抗氧化活性[J].FoodSci,2013,34(12): 104-108.
[3] 边梅娜,李松泽,白红进,等.响应面法优化赤霞珠葡萄叶总黄酮的提取工艺[J].新疆农业科学,2013,50(11): 2037-2045.
[4]BradK,LiuW,ZhangY.Optimizationoftheextractionofflavonoidsfromgrapeleavesbyresponsesurfacemethodology[J].JChemSocPakistan,2013,35(4):1103-1105.
[5] 孙磊磊,康 健,邹积赟,等.葡萄叶复合茶的研制[J].食品科技,2014,39(11): 59-62.
[6]BaydarNG,ÖzkanG,YasarS.Evaluationoftheantiradicalandantioxidantpotentialofgrapeextracts[J] .FoodControl,2007,18(9): 1131-1136.
[7] 张甘良,汪 钊,鄢洪德.生物类黄酮化合物的结构与生物活性的关系[J].生物学杂志,2005,22(1): 4-7.
[8]Rodriguez-MateosA,VauzourD,KruegerCG,etal.Bioavailability,bioactivityandimpactonhealthofdietaryflavonoidsandrelatedcompounds:anupdate[J].ArchToxicol,2014,88(10) :1803-1853.
[9]WangY,LiJY,HanM,etal.PreventionandtreatmenteffectoftotalflavonoidsinStellera chamaejasmeL.onnonalcoholicfattyliverinrats[J].LipidsHealthDis,2015,6;14:85.doi: 10.1186/s12944-015-0082-6.
[10] 徐 璐,李艳明,刘婧陶,等.黄芪总黄酮对小鼠免疫功能的影响[J].动物医学进展,2013,34(11):36-39.
[11] 雷燕妮.黄芩总黄酮对高血脂大鼠的降血脂作用研究[J].动物医学进展,2014,35(7):64-68.
[12] 张晓文,高 贝,任秀梅,等.两种提取方法对通经草不同部位总黄酮提取率的影响[J].陕西农业科学,2015,61(5):28-30.
[13]UttamaS,ItharatA,RattaromR,etal.BiologicalactivitiesandchemicalcontentofSungYodricebranoilextractedbyexpressionandsoxhletextractionmethods[J].JMedAssocThai,2014,97(Suppl8):S125-132.
[14] 李 兵,何翠薇,陈青青,等.广西木薯叶总黄酮提取工艺及抗菌性研究[J].湖北农业科学,201453(23):5816-5820.
Extraction and Antibacterial Activities of Total Flavonoids Extracted from Grape Leaves
Korbanjhon BRAD1,ZHOU Zhao-xiang2
(1.KeyLaboratoryatUniversitiesofEducationDepartmentofXinjiangUygurAutonomousRegion,YiliNormalUniversity,Yining,Xinjiang,835000,China; 2.CollegeofVeterinaryMedicine,NorthwestA&FUniversity,Yangling,Shaanxi,712100,China)
In order to optimize extraction process of total flavonoids from grape leaves and study their antibacterial activities,total flavonoids were prepared by Soxhlet extraction.The total flavonoids of grape leaves was determined by aluminum nitrate chromogenic spectrophotometry.The antibacterial activity was determined by K-B and agar diffusion method.The antibacterial activity was tested toEscherichiacoli,Staphylococcusaureus,Candidaalbicans,Bacillussubtilis.Staphylococcusaureuswas used to indicate the antibacterial effect of extracted flavonoids by different methods.The extraction rate of total flavonoids and the diameter of inhibition zone were optimized based on the single-factor test.The optimum extraction conditions were extracted with 750mL/L ethanol at the ratio of material to liquid 1∶40at 70℃ for 3.5h.The average extraction rate of total flavonoids in grape leaves at the optimum extraction conditions was 7.16%.Total flavonoids of grape leaves had a significant antibacterial effect onStaphylococcusaureusandEscherichiacoli,but not onBacillussubtilis.
total flavonoids of grape leaf;extracting technology;antibacterial activity
2015-06-12
新疆维吾尔自治区教育厅普通高等学校重点实验室开放项目(2013YSHXYB06)
库尔班江·巴拉提(1962-),男(维吾尔族),新疆伊宁人,教授,主要从事天然产物与抗菌药物研究。
S853.75
A
1007-5038(2016)01-0058-05
