西方马脑炎病毒TaqMan MGB荧光定量RT-PCR检测方法的建立
2016-12-21郑小龙邓明俊张晓文孙明君朱来华
郑小龙,王 群,邓明俊,张晓文,孙明君,朱来华
(山东出入境检验检疫局,山东青岛 266002)
西方马脑炎病毒TaqMan MGB荧光定量RT-PCR检测方法的建立
郑小龙,王 群,邓明俊,张晓文,孙明君,朱来华
(山东出入境检验检疫局,山东青岛 266002)
通过RT-PCR从西方马脑炎病毒(WEEV)中扩增得到1317bp特异的保守序列,将其克隆到pMD-20T载体中,进行体外转录,制备标准品cRNA。以10倍比稀释的cRNA为模板,进行TaqMan MGB荧光定量RT-PCR扩增并制作标准曲线,建立了WEEV荧光定量RT-PCR检测方法。对建立的方法进行了特异性和敏感性试验。结果表明,建立的荧光定量RT-PCR方法最低可检测10拷贝的cRNA;且与马鼻肺炎病毒(EHV-1)、马动脉炎病毒(EAV)、马流感病毒(EIV,H3N8)、西尼罗病毒(WNV)、东方马脑炎病毒(EEEV)和日本脑炎病毒(JEV)不发生交叉反应。与常规RT-PCR相比,该方法更加快速,特异性和敏感性更高,灵敏度为常规RT-PCR方法的100倍。
西方马脑炎病毒;TaqMan MGB;荧光定量RT-PCR
西方马脑炎病毒(Wastern equine encephalitis virus,WEEV)属于披膜病毒科甲病毒属,是引起西方马脑炎的病原体。该病毒可经呼吸道传播感染,但主要通过蚊虫传播[1]。西方马脑炎可引起人和马发病,病马常呈亚临床症状,病死率低于30%;WEEV对人的致死率明显低于东方马脑炎病毒[2-5]。该病在北美西部呈地方性流行,主要分布于加拿大、美国西部和中部,南美一些国家也有该病发生,如巴西、阿根廷、智利、秘鲁和乌拉圭等国家[6]。
西方马脑炎在我国也有报道,1990年何海怀等[7]从新疆乌苏县采集的按蚊和博乐县采集的全沟硬蜱中分离出WEEV。吕新军等[8]在对我国人体血清调查中发现,WEEV抗体的阳性率为2.71%,但在马属动物中的流行情况未见相关报道。随着我国马术运动的发展,国际马术比赛的日益频繁,我国进出境马匹的数量也在不断增加。为保障我国养马业的健康发展,保证国际赛事的顺利进行,建立快速、敏感、特异的WEEV 荧光定量RT-PCR检测方法十分必要。本试验针对WEEV E1基因,筛选高度保守的片段,设计引物和探针,建立WEEVTaqMan MGB 荧光定量RT-PCR,并对其敏感性和特异性进行分析。
1 材料与方法
1.1 材料
1.1.1 病毒及核酸 马鼻肺炎病毒(EHV-1)、马动脉炎病毒(EAV)、马流感病毒(H3N8)、西尼罗病毒(WNV)RNA、东方马脑脊髓炎病毒(EEEV)RNA、西方马脑炎病毒(WEEV)RNA和日本脑炎病毒(JEV)RNA均由山东检验检疫技术中心实验室保存。
1.1.2 临床样品 荷兰进口马血样18份,美国进口马血样12份,俄罗斯进口马血样12份,由山东检验检疫技术中心实验室收集并保存。
1.1.3 试剂 DNA/RNA提取试剂盒、连接试剂盒、DH5α、pMD20T和DNA Marker DL 2000均为TaKaRa公司产品;One-step RT-PCR试剂盒、TaqPCR mastermix为Qiagen公司产品;TaqMan RT- PCR试剂盒为ABI公司产品;SP6RiboMax Large Scale RNA Production System为Promega公司产品;其他试剂为进口或国产分析纯。
1.2 方法
1.2.1 引物、探针的设计与合成 根据GenBank公布的WEEV基因序列,利用Mega 5.0软件进行分析,选择保守区域,利用Primer Express 5.0软件设计引物,用于标准阳性模板的制备。引物序列:T1:5′-TTCGAACATGCGACCACTGTGC-3′;T2:5′-TCTACGTGTGTTTATAAGCAT-3′。根据荧光定量RT-PCR要求,利用Primer Express 3.0软件在选取的保守区域内设计荧光定量RT-PCR引物和探针。引物和探针序列:P1:5′-GCGGGTCCCTCGAGTGTAA-3′;P2:5′-CAAAAACGCGGCATGTGTAA-3′;Probe:5′-NED-CATCCTCAAAGGCG-MGB-3′。引物和探针均由英骏生物科技有限公司合成。
1.2.2 WEEV基因特异性保守片段的扩增 以WEEV RNA为模板,加入适量T1、T2;5×RT-PCR buffer;dNTP和Enzyme mix进行RT-PCR扩增。反应条件为: 50℃ 30min;94℃ 15min;94℃ 30s,58℃ 45s,72℃ 45s,35个循环;72℃ 10min。反应完毕,取5μL扩增产物,于10g/L琼脂糖凝胶在1×TAE电泳缓冲液中以100V电压进行电泳,用凝胶成像系统观察记录结果。
1.2.3 标准阳性模板的制备 用T1和T2引物按照1.2.1的方法进行RT-PCR扩增,将RT-PCR产物按试剂盒说明书进行切胶回收,连接至pMD20-T载体,转化大肠埃希菌DH5α感受态细胞,37℃培养过夜,挑取单个菌落,扩大培养后提取质粒,挑选经PCR鉴定正确的重组质粒,送英骏生物科技有限公司测序。将测序正确的重组质粒命名为pMD20T-WEE。
选用限制性内切酶XbaⅠ将重组质粒pMD20T-WEE进行线性化,并纯化回收,用SP6RiboMax Large Scale RNA Production System试剂盒进行体外转录,转录产物经无RNase的DNase消化后除去其中的DNA,然后用RNeasy Kit 进行纯化,制备出所需的cRNA。用核酸蛋白分析仪测定cRNA浓度,计算拷贝数。
1.2.4 荧光定量RT-PCR反应体系和反应条件的优化 以样本阈值循环数(Ct值)、产物荧光值、标准曲线斜率和相关系数等为标准,分别对荧光RT-PCR反应体系中的引物浓度(100、200、400、600、800nmol/L),探针浓度(50、100、200、300、400nmol/L)和反应参数中循环数(35、40、45个循环)、反应温度(58、60、62℃)进行优化。
1.2.5 标准曲线的建立 用10倍系列稀释法处理pMD20T-WEE cRNA标准品。取7个浓度梯度 (108、107、106、105、104、103拷贝和102拷贝) cRNA标准品作为模板,以优化好的反应体系和反应参数进行荧光RT-PCR 反应。根据实时荧光RT-PCR 的动力学曲线,检测仪系统自动生成标准曲线及回归方程。
1.2.6 荧光定量RT-PCR方法特异性和敏感性试验 分别提取EHV-1、EAV、H3N8、WNV、JEV、WEEV和EEEV的核酸,用所建立的荧光定量RT-PCR进行检测,用ddH2O作为阴性对照。收集荧光信号,检测其特异性。
用ddH2O对标准模板进行10×系列稀释,取1copies/μL~1.0×108copies/μL用所建立的荧光定量RT-PCR方法对各个稀释度的样品进行检测,同时应用常规RT-PCR进行检测。
1.2.7 临床样品检测 应用建立的荧光RT-PCR方法和常规RT-PCR对荷兰进口的马血样18份,美国进口马血样12份,俄罗斯进口马血样12份进行检测。
2 结果
2.1 标准阳性模板的制备
将扩增得到的WEEV基因特异性保守片段克隆至pMD20T载体中,利用体外转录试剂盒制备出所需的cRNA作为阳性模板,对其进行RT-PCR鉴定,得到1317bp的片段(图1)。经序列测定,扩增得到的特异性保守序列与GenBank中登陆序列同源性达到100%。
2.2 荧光定量RT-PCR反应体系和反应条件确立
为确保荧光定量RT-PCR的高效性、特异性及敏感性,对其反应体系和反应条件进行了优化。由试验结果可知,反应的最佳引物和探针浓度分别为400nmol/L和200nmol/L,反应温度为60℃,反应循环数为45个循环。
2.3 标准曲线的建立
利用试剂盒纯化pMD20T-WEE cRNA标准品,测定其OD值,通过公式计算得到其浓度为2.3×1010copies/μL。稀释cRNA至1.0×1010copies/μL作为母液备用。
标准曲线:把含有1.0×1010copies/μL的cRNA母液10倍比稀释,分别以1×102~1.0×108
copies/μL稀释度的cRNA为标准品进行荧光定量RT-PCR,以起始模板的拷贝数为横坐标,以Ct值为纵坐标绘制标准曲线,结果见图2。由图2可知,Ct值与拷贝数浓度在1×102copies/μL~1.0×108copies/μL之间呈线性关系,标准曲线方程式为y=49.28-3.72logx,R2=0.999。
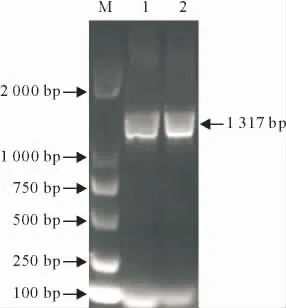
M.DNA 标准DL 2000;1,2.cRNA RT-PCR产物
M.DNA Marker DL 2000;1,2.RT- PCR products of cRNA
图1 cRNA的RT-PCR鉴定
Fig.1 RT-PCR identification of cRNA
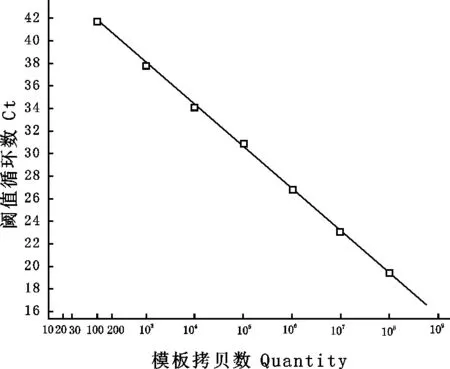
图2TaqMan MGB荧光定量RT-PCR检测WEEV的标准曲线
Fig.2 Standard curve of WEEV detected byTaqMan MGB real-time PCR
2.4 荧光定量RT-PCR方法特异性、敏感性
用建立的TaqMan MGB荧光定量RT-PCR方法对EHV-1、EAV、H3N8、WNV、JEV、WEEV和EEEV阳性样本进行检测,只有WEEV样本呈现扩增曲线(图3)。将cRNA标准品10倍稀释,进行扩增,扩增曲线见图4,由图4可知,所建立的检测方法在10copies/μL时,仍有荧光曲线,拷贝数浓度在1copies/μL时,无扩增。核酸浓度为1.0×103copies/μL时普通RT-PCR后电泳可见到清晰条带(图5),进一步稀释检测不到目的条带,因此所建立方法的灵敏度为常规RT-PCR方法的100倍。
2.5 临床样品检测结果
用建立的方法对42份进口马血样进行检测,结果显示,阳性对照出现扩增曲线,阴性对照无扩增曲线,试验成立,42份马血样均未出现扩增曲线,WEEV检测为阴性。同时用普通RT-PCR方法对其检测,二者符合率为100%。
图3 WEEV荧光定量RT-PCR检测方法特异性分析
Fig.3 Analytical specificity of the real-time RT-PCR for WEEV
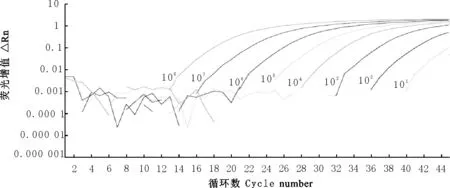
图4 WEEV荧光定量RT-PCR检测方法敏感性分析
Fig.4 Analytical sensitivity of the real-time RT-PCR for WEEV
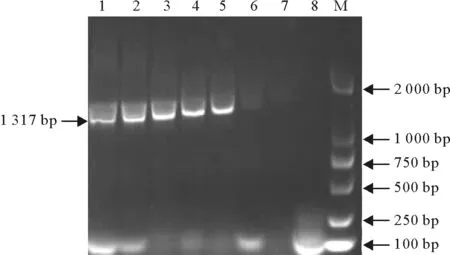
M.DNA 标准DL 2000;1~7.1.0×107copies/μL~1.0×101copies/μL cRNA RT-PCR 产物;8.空白对照
M.DNA Marker DL 2000;1-7.1.0×107-1.0×101copies/μL cRNA RT-PCR products;8.Blank
图5 WEEV RT-PCR检测敏感性分析
Fig.5 Analytical sensitivity of the RT-PCR for WEEV
3 讨论
西方马脑炎是一种人兽共患病,主要通过蚊虫传播给人和马等动物,主要侵袭中枢神经系统,病毒感染率较高,病愈后多留有神经系统后遗症[9]。由于该病属于急性病毒性人兽共患传染病,被国际社会列为生物恐怖的主要病原之一。随着经济全球化的发展,国际间马匹的交流也越来越频繁,建立快速高效敏感的WEEV检测方法,对于保障人们的健康和预防疫情的暴发具有重要意义。
目前,对于WEE的诊断主要是通过病原学和血清学两个方面。病原学诊断虽然可以确诊,但是费时费力,检出率低,且需要在生物安全三级以上实验室中进行操作。血清学诊断中ELISA尚无商品化的试剂盒,血凝抑制试验受主观因素影响较大,而且血清学方法存在着与其他病毒的交叉反应问题[9]。RT-PCR方法是一种快速敏感的检测方法[10-12],在一定程度上解决了上述问题,但比荧光荧光定量RT-PCR其检测特异性、灵敏度及检测速度均稍逊一筹[13-15]。因此,建立WEEV的荧光定量RT-PCR检测方法就显的尤其重要。
本试验以WEEV E1基因为目标基因,应用MEGA5.0软件对其进行分析,筛选保守片段,制备标准品cRNA,设计引物及MGB探针,建立了WEEV的TaqMan MGB荧光定量RT-PCR方法。根据样本阈值循环数(Ct值)、产物荧光值、标准曲线斜率和相关系数等,对荧光定量RT-PCR反应体系进行了优化,最终确定循环数为45个循环,反应温度为60℃,引物浓度为400nmol/L,探针浓度为200nmol/L。用建立的荧光定量RT-PCR对EHV-1、EAV、H3N8、WNV、JEV、EEEV和WEEV阳性样本进行扩增,只有WEEV样本呈现扩增曲线,说明该方法特异性高,与其他马属动物病毒无交叉反应。将制备的cRNA标准品10倍稀释,进行扩增,当每个反应加入10拷贝的cRNA时可以稳定地检测到扩增信号,但当加入1拷贝的cRNA时,检测不到扩增信号。因此该方法的最低检测限为10拷贝。用普通RT-PCR可检测到103拷贝的cRNA,因此本试验建立的荧光定量RT-PCR方法的灵敏度是普通RT-PCR方法的100倍。将所建立的方法应用于临床检测,其与普通RT-PCR方法的检测结果一致。因近期血液样品保存较少,无法进行大量的临床应用,我们会在后期的日常检测中进行进一步的应用与验证。
综上所述,本试验建立了灵敏、快速、特异的WEEVTaqMan MGB荧光定量RT-PCR检测方法,该方法在进出境动物检验检疫、流行病学调查及病原鉴定中具有重要的应用价值。
[1] 王林林,杨 宇,王 旺,等.西方马脑炎病毒抗体快速检测试纸条的研制[J].中国媒介生物学及控制杂志,2011,22(5):421-423.
[2] Monath T P. Arthropod-borne encephalitis in the Americas[J].Bull WHO,1979,57:513-533.
[3] 何海怀,吕新军,杨益良.我国分离的两株病毒为重组甲病毒[J].中华实验和临床病毒学杂志,2001,15(2): 120-124.
[4] 谷 强,吴亚琼,高志强,等.西部马脑脊髓炎病毒实时荧光RT-PCR检测方法建立及标准质控品制备[J].中国动物检疫,2013,30(11):80-84.
[5] Steven D Z,Susan A J,Joseph G,et al.Quadraplex qRT-PCR assay for the simultaneous detection of Eastern equine encephalitis virus and West Nile virus[J].Diagn Microbiol Infect Dis,2013,77:129-132.
[6] 汪中明,赵彤言.西方马脑炎的媒介、宿主及影响其传播的环境因素[J].中国媒介生物学及控制杂志,2007,18(6):530-533.
[7] 何海怀,吕新军,杨益良,等.我国分离的2株病毒为重组甲病毒[J].中华实验和临床病毒学杂志,2001,15(2):120-124.
[8] 吕新军,付士红,杨益良,等.我国分离的XJ-290260病毒鉴定为西方马脑炎病毒[J].病毒学报,2001,17(4):307-312.
[9] Calisher C H.Medically important arboviruses of the United States and Canada[J].Clin Microbiol Rev,1994(7):89-116.
[10] 徐 倩,谢芝勋,谢丽基,等.禽流感病毒H9和N2亚型双重RT-PCR检测方法的建立[J].动物医学进展,2015,36(1):11-15.
[11] 吴媛琼,谢芝勋,胡庭俊,等.H4亚型禽流感病毒套式RT-PCR检测方法的建立[J].动物医学进展,2015,36(2):11-15.
[12] 王 黎,李 碧,周远成,等.猪传染性胃肠炎病毒RT-PCR检测方法的建立及临床应用[J].中国兽医学报,2015,35(2):190-194.
[13] 王楠楠,刘 芳,许 漩,等.坦布苏病荧光定量RT-PCR检测方法的建立与初步应用[J].中国兽医科学,2015,45(1):15-19.
[14] 千莎莎,何 彪,涂忠忠,等.委内瑞拉马脑炎病毒一步法荧光定量RT-PCR方法的建立[J].病毒学报,2015,31(2):107-113.
[15] 温青娜,周其伟,周玲玲.鉴别欧洲型和美洲型PRRSV荧光定量RT-PCR方法的建立[J].动物医学进展,2013,34(3):51-57.
Development ofTaqMan MGB Real-time PCR for Detection of Western Equine Encephalitis Virus
ZHENG Xiao-long,WANG Qun,DENG Ming-jun,ZHANG Xiao-wen,SUN Ming-jun,ZHU Lai-hua
(ShandongEntry-exitInspectionandQuarantineBureau,Qingdao,Shandong,266002,China)
The 1317bp specific and consensus sequence of Western equine encephalitis virus (WEEV) was amplified by RT-PCR and cloned into plasmid pMD-20T,RNA was transcribedinvitrousing linearised plasmid DNA.Serial dilutions of cRNA were used as standard templates for real-time RT-PCR to quantify the genomic copy number of WEEV.We developed aTaqMan MGB real-time RT-PCR to detect WEEV.Sensitivity analysis showed that the developedTaqMan MGB real-time RT-PCR could detect 10copies/μL.The specificity assay exhibited that negative control and the other equine pathogens could not be detected.The result demonstrated a 100fold sensitivity of the real-time RT-PCR assay was developed compared with gel-based real-time RT-PCR method.
Western equine encephalitis virus;TaqMan MGB;real-time RT-PCR
2015-06-09
国家质检总局科技项目(2014IK240)
郑小龙(1979-),男,山东平邑人,高级兽医师,硕士,主要从事进出境动物检疫研究。
S855.3
A
1007-5038(2016)01-0006-05
