猪胸膜肺炎放线杆菌的分离鉴定、毒力基因检测及药敏试验
2016-12-17周信荣宋德平陈燕君李安琪张帆帆唐玉新
周信荣,宋德平,彭 棋,陈燕君,李安琪,张帆帆,吴 琼,唐玉新
(江西农业大学动物科技学院,江西南昌 330045)
猪胸膜肺炎放线杆菌的分离鉴定、毒力基因检测及药敏试验
周信荣,宋德平,彭 棋,陈燕君,李安琪,张帆帆,吴 琼,唐玉新*
(江西农业大学动物科技学院,江西南昌 330045)
2015年3月,江西省上饶市万年县某规模化养猪场部分肥猪出现体温升高、呼吸困难、咳嗽等症状,部分发病猪出现死亡,病死率为35%,疑似猪传染性胸膜肺炎放线杆菌感染。用TSA及鲜血培养基进行了胸膜肺炎放线杆菌的分离和纯化,经培养特性、染色镜检、生化试验及16S rDNA PCR鉴定等证明了分离菌为生物Ⅰ型胸膜肺炎放线杆菌。毒力基因检测表明该菌具有ApxⅣ毒力基因。药敏试验结果显示,分离菌对头孢哌酮、诺氟沙星高度敏感,对青霉素G耐药。
猪胸膜肺炎放线杆菌;分离鉴定;ApxⅣ毒力基因;药敏试验
猪传染性胸膜肺炎是由猪胸膜肺炎放线杆菌(Actinobacilluspleuropneumoniae,APP)引起猪的一种急性呼吸系统传染病[1],APP是一种革兰阴性小杆菌[2],在适宜的培养基中,该菌菌落表面光滑、圆形、稍突起、边缘整齐、针尖大小。根据其生长是否需要烟碱腺嘌呤二核苷酸(NAD)可分为生物Ⅰ型和生物Ⅱ型[1]。生物Ⅰ型的生长依赖NAD的存在,能在含NAD和小牛血清的胰蛋白胨大豆培养基(TSA)平板上生长,在血平板上出现溶血现象;当有葡萄球菌存在时,在葡萄球菌生长区周围溶血现象加强(CAMP现象)。生物Ⅱ型APP可以在没有葡萄球菌和NAD存在的血琼脂培养基上生长[3-5]。APP引起的猪群发病分为最急性、急性和慢性胸膜肺炎[6],发病猪主要出现体温上升到41℃左右,沉郁、厌食、呼吸困难、咳嗽,鼻子、耳朵、腿上的皮肤乃至全身发红甚至发绀等临床症状[7]。剖检时,病理变化主要出现在呼吸道和肺部,局灶性病变且界限明显,形成纤维素性胸膜炎,肺实质与胸膜壁粘连[8]。APP有Apx Ⅰ、Apx Ⅱ、Apx Ⅲ和Apx Ⅳ 4种毒力基因,分别分泌Apx Ⅰ、Apx Ⅱ、Apx Ⅲ和Apx Ⅳ 4种溶细胞毒素(RTX)。其中,APP的Apx Ⅳ毒力基因表达分泌的Apx Ⅳ溶细胞毒素(RTX)是主要的致病因子之一[9-11]。2015年3月下旬,江西省上饶市万年县某规模化养猪场部分肥猪出现体温升高、呼吸困难、咳嗽等疑似猪传染性胸膜肺炎的症状,并有部分发病猪出现死亡。剖检发现死亡肥猪肺脏大面积肝样变、严重充血,部分死亡猪肺脏化脓、肺表面出现粘连现象,疑似APP感染。取典型发病猪肺脏进行病原菌的分离鉴定、毒力基因检测及药敏试验,现将结果报道如下。
1 材料与方法
1.1 材料
1.1.1 病料 2015年3月,病料采集来自江西省上饶市万年县某规模化养猪场的发病育肥猪病变肺脏。
1.1.2 培养基 含NAD及小牛血清的TSA平板、含血清但不含NAD的TSA平板、巧克力琼脂培养基、普通琼脂培养基、鲜血琼脂培养基等。
1.1.3 其他试剂及物品 金黄色葡萄球菌菌种,由江西农业大学预防兽医实验室保存;生化试管及药敏试纸为杭州天河生化有限公司产品;Taq酶等PCR反应试剂、pMD18-T vector为宝生物工程(大连)有限公司产品;TOP10感受态细胞为北京天根生化科技有限公司产品。
1.1.4 16S rDNA和Apx Ⅳ毒力基因PCR引物序列 16S rDNA细菌通用引物27F/1492R(上游:5′- AGAGTTTGATCMTGGCTCAG -3′;下游:5′-ACCTTGTTACGACTT-3′);Apx Ⅳ 毒力基因引物采用刘婉婧等[12]设计的Apx Ⅳ毒力基因引物(上游:5′- CGCGAATTCATGGAGCAACAACGTCGCACAATT-3′;下游:5′- ATAGTCGACATCACCGTCAGTGCCAA-3′),由上海生工生物工程技术服务有限公司合成。
1.2 方法
1.2.1 病原菌的分离纯化及染色镜检 无菌操作将发病猪肺脏病料处理后接种于TSA固体平板(每100mL培养基含小牛血清3mL和100μL 0.1g/L NAD辅酶)及鲜血平板上,置于37℃恒温培养箱内培养24h,挑单个菌落染色镜检。将疑似APP的菌落接种到新的TSA培养基上进行传代纯化。
1.2.2 生化试验 无菌操作挑取纯化后的单个菌落分别接种于脲酶、甘露醇、蔗糖、乳糖、麦芽糖、七叶苷等微量生化发酵管(含1μL 0.1g/L NAD),置于37℃恒温培养箱内培养24h,观察发酵结果。
1.2.3 卫星生长现象试验 将金黄色葡萄球菌单个菌落在不含NAD的鲜血培养基上划一横线,在横线的两侧垂直横线画线接种分离菌;同时,在涂布有分离菌的不含NAD的血清培养基上将金黄色葡萄球菌划一横线接种于培养基上。37℃培养24h,观察是否出现卫星现象。
1.2.4 16S rDNA PCR扩增、测序及序列比对分析 用接种环从TSA平板上刮取3个~5个纯化的菌落洗脱于含100μL灭菌双蒸水中。用磁珠法细菌基因组DNA抽提试剂盒提取分离菌基因组DNA,按照试剂盒说明书操作,获得的DNA用NanoDrop 2000(Thermo Scientific,USA)测定其浓度。以基因组DNA为模板,采用细菌通用引物27F/1492R扩增细菌 16S rDNA[12]。取5μL PCR产物电泳,观察条带的大小。将含目的基因片段的PCR产物纯化、克隆后测序,获得的序列在NCBI Blast上比对分析。
1.2.5 Apx Ⅳ毒力基因PCR扩增、测序及分析 以提取的分离菌DNA为模板,用文献[13]设计的Apx Ⅳ毒力基因引物,PCR扩增 Apx Ⅳ毒力基因。将含目的基因片段的PCR产物纯化、克隆后测序,获得的序列用DNAStar(Version 7.10)及MEGA6.02软件进行编辑、组装、构建进化树等分析。
1.2.6 药敏试验 参照Clinical and Laboratory Standards Institute (CLSI)推荐的药敏试验方法进行。将鉴定的分离菌接种于含血清及NAD的胰蛋白胨大豆肉汤(TSB)中,220r/min振荡培养8h~12h。将培养好的细菌(浓度稀释至1×108CFU/mL~1.5×108CFU/mL)均匀涂布于TSA培养基上,待液体吸干后将药敏试纸轻轻贴在培养基上,37℃培养24h,记录抑菌直径并根据常规药敏试验判定标准判断分离菌株对不同抗菌药的敏感程度[14]。
2 结果
2.1 分离菌的鉴定及培养特性
在含NAD的TSA培养基上生长出直径1mm左右的表面光滑、圆形、边缘整齐、稍突起、针尖大小的菌落(图1);在接种了金黄色葡萄球菌的鲜血琼脂培养基上越靠近金黄色葡萄球菌线的细菌长势越好,说明分离菌的生长依赖NAD的存在,为生物Ⅰ型。革兰染色镜检观察结果表明,分离菌为革兰阴性的小球杆菌(图2)。
2.2 生化试验结果
将纯化菌接种到微量生化发酵管中,37℃培养24h后观察发现分离菌株对脲酶水解试验、蔗糖、乳糖、葡萄糖、麦芽糖试验呈阳性;对山梨醇、甘露醇、阿拉伯糖、七叶苷试验呈阴性(表1)。
2.3 16S rDNA PCR鉴定及序列分析结果
经PCR扩增后得到约1500bp大小的16S rDNA目的条带(图3)。目的条带进行T-A克隆后,阳性重组质粒送至上海生工生物工程技术服务有限公司测序,测序结果在GenBank数据库进行比对,确定为猪胸膜肺炎放线杆菌。同时将16S rDNA序列提交到GenBank,登录号为KR071801。
2.4 Apx Ⅳ毒力基因PCR扩增及序列分析
经PCR扩增后得到约1200bp大小的ApxⅣ毒力基因目的条带(图4)。目的片段进行T-A克隆后,阳性菌液送至上海生工生物工程技术服务有限公司测序,测序结果在GenBank上进行比对,确定为猪胸膜肺炎放线杆菌Apx Ⅳ毒力基因。同时将Apx Ⅳ毒力基因序列提交到GenBank上,获得的登录号为KR089051。采用MEGA6.02软件中的Maximum Likeihood tree的方法制作APP毒力基因序列进化树(图5),进化树分析表明,分离菌与APP strain JX2014ApxⅣA(295474)亲缘关系最近,与APP RTX ApxⅡA(AF363362)亲缘关系较远。

图1 TSA平板菌落形态
Fig.1 Colonial morphology on TSA culture medium

图2 革兰染色菌体形态(40×100)
Fig.2 Bacterial morphology stained with Gram(40×100)
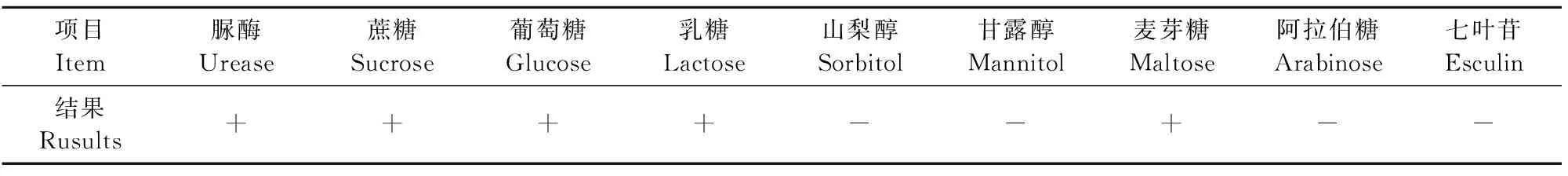
表1 分离菌株的部分生化试验结果Table 1 The results of biochemical tests of the isolate

1.PCR产物; 2.DNA 标准DL 2000
1.PCR products; 2.DNA Marker DL 2000
图3 分离菌16S rDNA PCR扩增结果
Fig.3 PCR results of the isolate 16S rDNA

1.PCR产物; 2.DNA 标准DL 2000
1.PCR products; 2.DNA Marker DL 2000
图4 分离菌Apx Ⅳ毒力基因PCR扩增结果
Fig.4 PCR results of the isolate Apx Ⅳ toxin gene
2.5 药敏试验结果
药敏试验结果显示,分离菌对诺氟沙星、头孢哌酮、头孢曲松钠等药物高度敏感,对氨苄西林、青霉素G、杆菌肽等药物耐药(表2)。
3 讨论
APP感染猪后,可引起严重的呼吸系统病症,导致猪传染性胸膜肺炎的发生,这不仅大大降低饲料报酬和增加药物费用,也引起了一定的死亡率,给养猪业造成了严重的损失。在临床诊断上,猪传染性胸膜肺炎易与猪瘟、猪链球菌病和猪丹毒等病混淆[5],因此需通过细菌的分离纯化、染色镜检和PCR等实验室方法进行鉴别诊断。APP对培养基的营养要求较高,需要在培养基中添加一定量的小牛血清和NAD。根据“卫星生长”现象可区分生物Ⅰ型和生物Ⅱ型的APP。生物Ⅰ型为NAD依赖型放线杆菌,在含金黄色葡萄球菌的培养基上会出现“卫星生长”现象;生物Ⅱ型的生长则不依赖NAD,不会出现“卫星生长”现象。
本研究利用TSA和血琼脂分离到了病原菌并鉴定为APP生物Ⅰ型,该菌株具有APX Ⅳ毒力基因。APX Ⅳ所控制表达的APX Ⅳ溶血细胞毒素是APP主要的致病因子之一[9-11]。
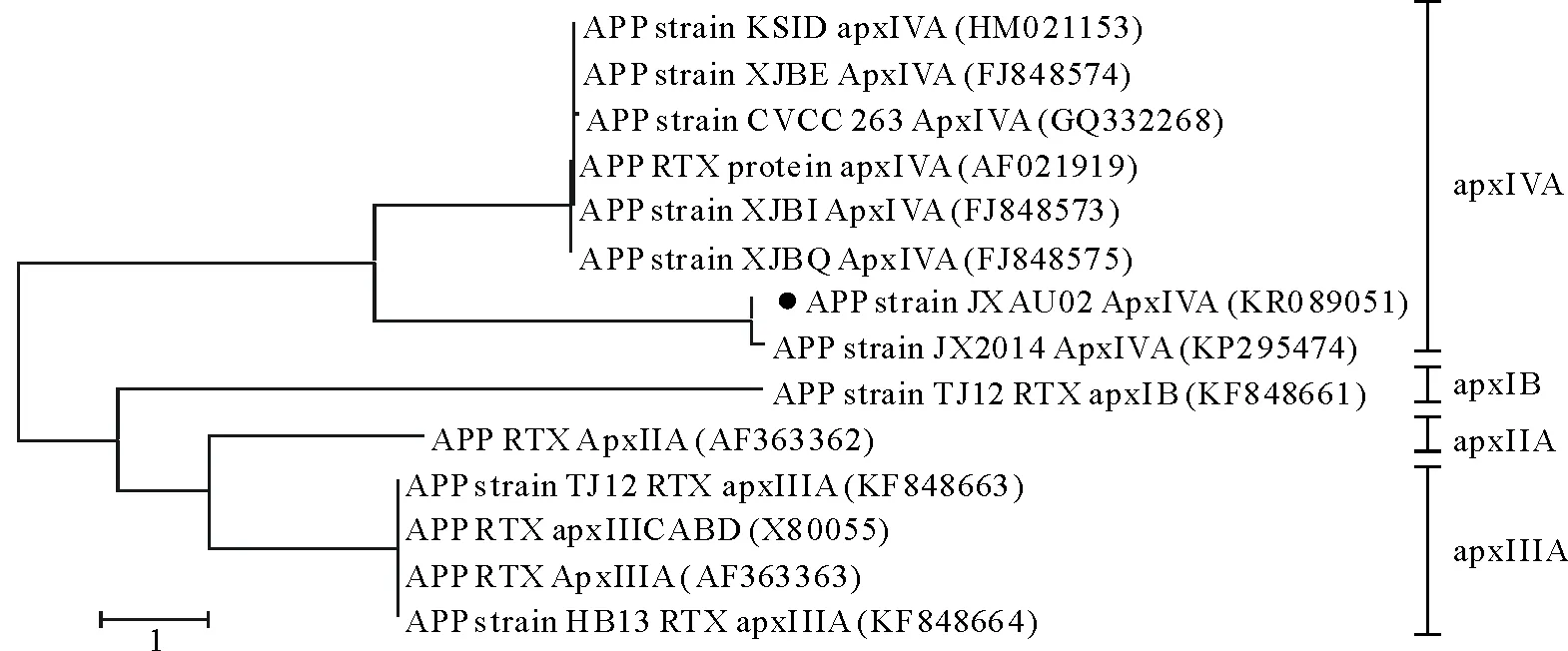
图5 APP 毒力基因进化树(“●”为本次分离菌毒力基因序列)
Fig.5 The phylogenetic tree of APP toxin gene("●"represents the isolate of this study)

表2 分离菌株的部分药敏试验结果Table 2 Results of antimicrobial susceptibility tests of the isolate
随着临床生产实践中抗菌药物大量的使用,APP的耐药性也越来越严重。从药敏试验结果来看,分离菌仅对头孢哌酮、诺氟沙星等少量药物敏感,对青霉素G、氨苄西林、四环素等大部分药物耐药,可将头孢哌酮、诺氟沙星等少量药物作为该猪场治疗猪传染性胸膜肺炎的首选药物。与以往的报道不同的是,本次得到的分离菌株毒力出现增强,发病猪群不仅表现出严重的咳嗽、流鼻涕、发热等症状,也导致了较高的病死率(35%)。因此,需进一步研究该菌的致病力和了解是否有其他病原的混合感染。由于病猪和带菌猪是主要的传染源[5,15-16],因此加强生物安全工作,及时消毒,做好隔离工作,是防控猪传染性胸膜肺炎的一种有效的办法[17]。
[1] 厚华艳,梁 武,吕茂杰,等.猪传染性胸膜肺炎亚单位疫苗研究进展[J].动物医学进展,2015,36(2): 84-88.
[2] 梁鹏展.猪传染性胸膜性肺炎的诊断与防控[J].湖北畜牧兽医,2015(2): 19-20.
[3] Nicolet J,de Meuron P A.Isolation and characterization of mycoplasmas in the calf pneumoenteritis syndrome[J].Zentralbl Veterinarmed B,1970,17(10): 1031-1042.
[4] Kilian M.The haemolytic activity ofHaemophilusspecies[J].Acta Pathol Microbiol Scand B,1976,84B(6): 339-341.
[5] Shope R E.Porcine contagious pleuropneumonia.I.Experimental transmission etiology,and pathology[J].J Exp Med,1964,119: 357-368.
[6] 唐文山,李 昕.猪传染性胸膜肺炎研究进展[J].动物医学进展,2008,29(2): 98-102.
[7] 李双喜.猪传染性胸膜肺炎的防控[J].猪业观察,2014(9):33-38.
[8] 孔祥英.猪传染性胸膜肺炎的诊断与防治 [J].养殖技术顾问,2014(1):55-59.
[9] Haesebrouck F,Chiers K,Van Overbeke I,et al.Actinobacilluspleuropneumoniaeinfections in pigs: the role of virulence factors in pathogenesis and protection[J].Vet Microbiol,1997,58(2-4): 239-249.
[10] Gottschalk M,Broes A,Mittal K R,et al.Non-pathogenicActinobacillusisolates antigenically and biochemically similar toActinobacilluspleuropneumoniae: a novel species?[J].Vet Microbiol,2003,92(1-2): 87-101.
[11] 刘金林.胸膜肺炎放线杆菌毒素ApxⅣ的致病性及基因缺失弱毒疫苗的研究[D].湖北武汉:华中农业大学,2009.
[12] 余建福,韦革宏,丁小平,等.陕西太白尾矿废弃地豆科植物根瘤菌16S rDNA PCR-RFLP及全序列分析[J].西北植物学报,2007,27(3): 502-508.
[13] 刘琬婧,陶明江,郑教雀,等.猪胸膜肺炎放线杆菌江西分离株ApxⅣA基因PCR扩增及基因分析[J].江西农业大学学报,2014,36(2):378-382.
[14] 何启盖,王贵平,刘军发,等.猪胸膜肺炎放线杆菌的分离鉴定及药敏试验[J].中国预防兽医学报,2003,25(5): 41-44.
[15] 刘 岩.猪传染性胸膜肺炎的综合防治措施[J].中国畜禽种业,2015(1):94-98.
[16] 杨孟鸿,袁斌香.简论猪传染性胸膜肺炎的防控[J].中兽医学杂志,2013(2): 44-46.
[17] 魏良思,徐云昊.猪传染性胸膜肺炎的诊治案例[J].猪业观察,2015(1): 102-107.
Isolation,Identification Toxic,Gene Detection and Antimicrobial Susceptibility Test of Actinobacillus pleuropneumoniae
ZHOU Xin-rong,SONG De-ping,PENG Qi,CHEN Yan-jun,LI An-qi,ZHANG Fan-fan,WU Qiong,TANG Yu-xin
(CollegeofAnimalScienceandTechnology,JiangxiAgriculturalUniversity,Nanchang,Jiangxi,330045,China)
In March 2015,some fattening pigs in Wannian,Shangrao City,Jiangxi province had high fever,acute respiratory distress syndrome and cough accompanied with 35% mortality,which resembled the manifestations of porcine contagious pleuropneumonia.To isolate and identify the causative agent(s),TSA and blood culture media were used.According to the results of culture characteristics,microscopic examination,biochemical test and PCR,the isolate was identified asActinobacilluspleuropneumoniaebiotype I.The consequence of identification of toxic gene showed that the isolated strain had Apx Ⅳ toxic gene.The results of antimicrobial susceptibility test demonstrated that the isolate was sensitive to cefoperazone and norfloxacin,but resistant to penicillin G.
Actinobacilluspleuropneumoniae; isolation and identification; Apx Ⅳ toxic gene; antimicrobial susceptibility test
2015-05-11
国家自然科学基金项目(31260611);江西省科技厅落地计划项目(KJLD13029)
周信荣(1990-),男,江西广丰人,硕士研究生,主要从事动物传染病与病原学研究。*通讯作者
S852.619
A
1007-5038(2016)01-0067-05
