四川部分猪场PEDV、TGEV、GARV和PKV感染状况调查
2016-12-16曹恭貌任玉鹏
曹恭貌,张 斌,岳 华,费 磊,任玉鹏
(西南民族大学生命科学与技术学院,四川成都 610041)
兽医临床
四川部分猪场PEDV、TGEV、GARV和PKV感染状况调查
曹恭貌,张 斌,岳 华,费 磊,任玉鹏*
(西南民族大学生命科学与技术学院,四川成都 610041)
为了解四川省部分猪场4种猪腹泻病毒的感染情况,为本地区猪腹泻的诊断和治疗提供依据,采用RT-PCR方法,分别对来自四川省成都、绵阳、德阳、眉山、资阳、雅安、内江、宜宾、达州等地9个规模化猪场的90份临床健康猪和130份腹泻猪的粪便样品,进行猪流行性腹泻病毒(PEDV)、猪传染性胃肠炎病毒(TGEV)、猪嵴病毒(PKV)和猪A群轮状病毒(GARV)的检测。结果表明,在所有9个猪群中PEDV和PKV检出率达100%(9/9),且在部分猪群腹泻样本中的检出率可达到60%以上,表明此2种病原在检测猪场感染比较普遍。此外腹泻样本中TGEV和GARV阳性率分别为11.54%(15/130)、7.69%(10/130),表明该2种病原在本地区猪场仍有感染情况存在。对PKV的检测结果表明腹泻猪粪便中PKV的阳性率为43.85%(57/130),显著高于外表健康猪粪便样本23.33%(21/90),且PEDV和PKV的混合感染在4种病原混合感染类型中所占比例最大,推断PKV与猪只腹泻具相关性,PEDV和PKV具有协同致病的可能。
病毒性腹泻;混合感染;反转录-聚合酶链反应;检测
猪腹泻是目前国内外常见的猪临床肠道病症候群,主要以引起不同年龄、品系猪只的呕吐、腹泻及脱水,严重影响新生仔猪存活率。据2010年-2011年统计显示中国南部10省腹泻死亡猪只数超过100万头,对我国生猪养殖业造成巨大经济损失[1]。目前国内外对不同腹泻病原流行病学调查结果显示,临床上由猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)、猪传染性胃肠炎病毒(Porcine transmissible gastroenteritis,TGEV)和猪A群轮状病毒(Porcine group A rotavirus,GARV)3种病原引起腹泻病例数所占比例较高,且多以混合感染形式呈现[2-3],进一步对本地区传统腹泻病毒感染状况调查,为针对本地区猪腹泻病的有效防控措施制定提供依据。
此外,诸多罕见病原也不断从腹泻粪便中检出,嵴病毒属成员猪嵴病毒(Porcine kobuvrius,PKV)是其中之一,该病毒自2007年在匈牙利首次被发现后世界各地就陆续有检出报道[4]。虽然对于此类病毒是否与腹泻相关尚无确切定论,但有证据表明其在腹泻病例的检出率较高[5],推断其对猪胃肠炎有协同致病作用,故而对该病毒在健康猪中的携带率和与其他腹泻共感染引起腹泻阳性率的调查,有利于进一步追述其与仔猪腹泻的关系,对疾病防控有重要意义。
为进一步调查四川部分规模化养殖场主要病毒性腹泻病原的感染及流行情况,采用已建立针对PEDV、TGEV、PKV、GARV的RT-PCR方法,分别对2014年9月~2015年3月采自四川省成都、绵阳、德阳、眉山、资阳、雅安、内江、宜宾、达州等地9个规模化猪场的220份粪便样本(其中90份外表健康猪只样本和130份腹泻猪只样本)进行检测,同时将扩增片段克隆测序以确定其正确性,分析4种病原在不同猪群中的感染情况,现将结果报告如下。
1 材料与方法
1.1 材料
1.1.1 主要试剂及仪器 2×TaqPCR Master Mix、DNA Marker Ⅱ为北京天根生化科技有限公司产品;pMD19-T Simple Vector、PrimeScriptTM RT-PCR Kit (RNA反转录试剂盒)为宝生物工程(大连)有限公司产品;质粒抽提试剂盒、DNA凝胶回收试剂盒为美国Omega生物技术公司产品;PCR仪(Veriti 96well tThermal cycle)为ABI 公司产品;凝胶成像仪(Universal hoodⅡ) 为Bio- rad 公司产品;电泳仪(DYY- 5型)为北京六一仪器厂产品。
1.1.2 引物 本试验所用检测 PEDV、TGEV 和 GARV 的引物参照文献[6]合成;PKV 引物以 S-1-HUN株(登录号:EU787450)全基因序列为模板设计,所有引物均由宝生物工程(大连)有限公司合成。具体参数见表1。

表1 PEDV、TGEV、GARV、PKV扩增引物Table 1 The primers for RT-PCR of PEDV,TGEV,GARV and PKV
1.2 方法
1.2.1 样本采集与处理 本试验检测的粪便样本采自四川省成都、绵阳、德阳、眉山、资阳、雅安、内江、宜宾和达州等9地暴发腹泻病的规模化养殖场,所有样本均来源于5日龄~10日龄哺乳仔猪。腹泻猪粪便样本共计130份,采自精神沉郁,呕吐、腹泻和脱水等临床症状明显的患病仔猪,健康猪粪便样本共计90份,来源于同群无临床症状,精神食欲俱佳的仔猪。
将样本与无菌0.1mol/L PBS缓冲液按1∶4(m/V)比例稀释,振荡混匀,静置 5min,以10000r/min离心10min,取上清液待检。
1.2.2 cDNA模板的制备 参照 TaKaRa 公司 RNAiso plus (Total RNA提取试剂) 说明书,提取样本中的总RNA。依次加入样本 200μL,RNAiso plus 500μL、氯仿 150μL 振荡混匀后离心取上清;并加入等体积异丙醇后离心弃上清;再加入 750mL/L乙醇 1mL (经DEPC处理) 后离心弃上清,将样品自然干燥后加入 30μL~50μL 无 RNA 酶去离子水溶解沉淀,置 -40℃ 保存。
根据 TaKaRa 公司反转录试剂盒说明书进行反转录。反应体系:病毒总 RNA 4μL,5×buffer 4μL,Random primer 1μL,PrimeScript RTase 1μL,dH2O 10μL,总体系20μL。反转录程序:37℃ 15min,85℃ 15s,16℃ 1min。反转录产物置-40℃保存备用。
1.2.3 cDNA的PCR扩增 分别用PEDV、TGEV、GARV、PKV的检测引物,对制备的待检核酸样本cDNA模板进行PCR扩增。反应体系均为:cDNA 2.0μL,2×PCR MasterMix 12.5μL,上、下游引物各1.0μL,dH2O 8.5μL,总体积25μL。PCR扩增条件为:94℃ 5min;94℃ 30s,55℃ 30s,72℃ 55s,35个循环;72℃ 10min,25℃保存10min。取上述扩增产物各3μL,在含溴乙锭的琼脂糖凝胶板上点样,加入DNA分子质量Marker作对照,以130V恒压电泳40min,在凝胶成像仪中观察结果。参照《分子克隆》(第3版)[7]将基因片段克隆至pMD19-T载体,并送样到上海英骏生物技术有限公司测序,用Blast比对分析结果。统计受检猪群4种腹泻病原的阳性检出率并分析感染情况。
2 结果
2.1 RT-PCR扩增产物电泳及测序
将待检样本cDNA的PCR扩增产物克隆至pMD19-T载体,并送样到上海英骏生物技术有限公司测序,经Blast比对分析结果表明,PEDV 扩增片段与NCBI上已登录的序列同源性为 99%,TGEV 扩增片段同源性为 93% ,GARV扩增片段同源性为 93%、PKV 扩增片段同源性为 96%(图1)。
2.2 不同猪群中病原感染率
本试验对四川省成都、绵阳、德阳、眉山、资阳、雅安、内江、宜宾、达州等9地暴发腹泻病的规模化养殖场,220份样本进行了RT-PCR检测,结果表明,在所有9个猪群中PEDV和PKV阳性率达100% (9/9) (表2),且在部分猪群腹泻样本中的检出率可达到60%以上,表明此2种病原在四川地区腹泻猪群中感染状况普遍。在所有130份腹泻样本中,4种病原的阳性检出率分别为PEDV 41.54% (54/130)、PKV 43.85% (57/130)、TGEV 11.54% (15/130)、GARV 7.69% (10/130);表明导致本地区猪只腹泻的病原种类具有多样性,传统病毒性病原如TGEV、GARV等仍有感染情况存在。
在90份健康猪只粪便样本中PKV检出率为23.33%(21/90),9个猪群的阳性检出率为 100% (9/9),这显著高于其他3种病原,表明在9个地方猪群中普遍存在PKV的感染,且隐性感染状况较严重。
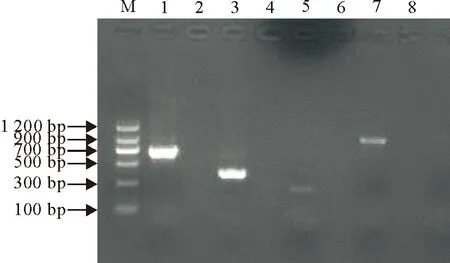
M.DNA Marker Ⅱ; 1、3、5、7.分别为 PEDV、TGEV、GARV、PKV阳性样本扩增结果; 2、4、6、8.分别为PEDV、TGEV、GARV、PKV阴性样本扩增结果
M.DNA Marker Ⅱ; 1,3,5,7.Positive sample of PEDV,TGEV,GARV,PKV,respectively; 2,4,6,8.Negative control of PEDV,TGEV,GARV,PKV,respectively
图1 4种病原的RT-PCR扩增结果
Fig.1 Amplified results of gene segments of four pathogens by RT-PCR
2.3 病原的混合感染情况
在所检测的腹泻样本中,均存在多种病原混合感染的情况。其中 PEDV 与TGEV 的混合感染率为 4.61% (6/130),PEDV与GARV混合感染率为2.3% (3/130),PEDV 与 PKV 混合感染率为13.07% (17/130);此外在5份样本中同时检出PEDV、TGEV 和 PKV,混合感染率为 3.84% (8/130)。结果表明,在混合感染类型中,PEDV 与 PKV混合感染所占比例较高,这可能与二病原流行情况较普遍有关,也一定程度上反应出 PEDV 和 PKV 存在协同致病的可能。
3 讨论
近年来猪腹泻严重困扰国内外生猪养殖业,由腹泻导致的猪只死亡率逐年上升。流行病学调查资料表明,PEDV是目前引起猪腹泻的主要病毒性病原之一。在诸多亚洲国家,如日本、韩国、泰国、越南等[8-10]均有该病毒感染情况的报道;此外自Wang L等[11]在猪小肠上皮细胞中分离鉴定获得2株PEDV野毒株后,美国俄亥俄州和爱德华州均出现了PED暴发[12],对生猪养殖及生猪贸易等造成严重影响;在国内,北京、上海、黑龙江、山东、河南、浙江、广东、广西、福建、新疆等8省2直辖市的多个养殖场也均不同程度存在PEDV的感染和流行情况[13]。由此可见对PEDV的感染情况调查,可以为针对本地区的猪腹泻病的有效防控措施制定提供理论依据。此外TGEV和GARV作为猪腹泻的传统病原在国内猪场时有感染情况的报道[14],且与PEDV多呈混合感染。本试验对来自四川省9个不同地区猪场,共计130份腹泻猪粪便样本,进行了RT-PCR检测。结果显示,PEDV检出率达41.54%(54/130),这显著高于TGEV 11.54%(15/130)和GARV 7.69% (10/130)。表明目前本地区引起猪腹泻的病毒性病原仍以 PEDV为主。
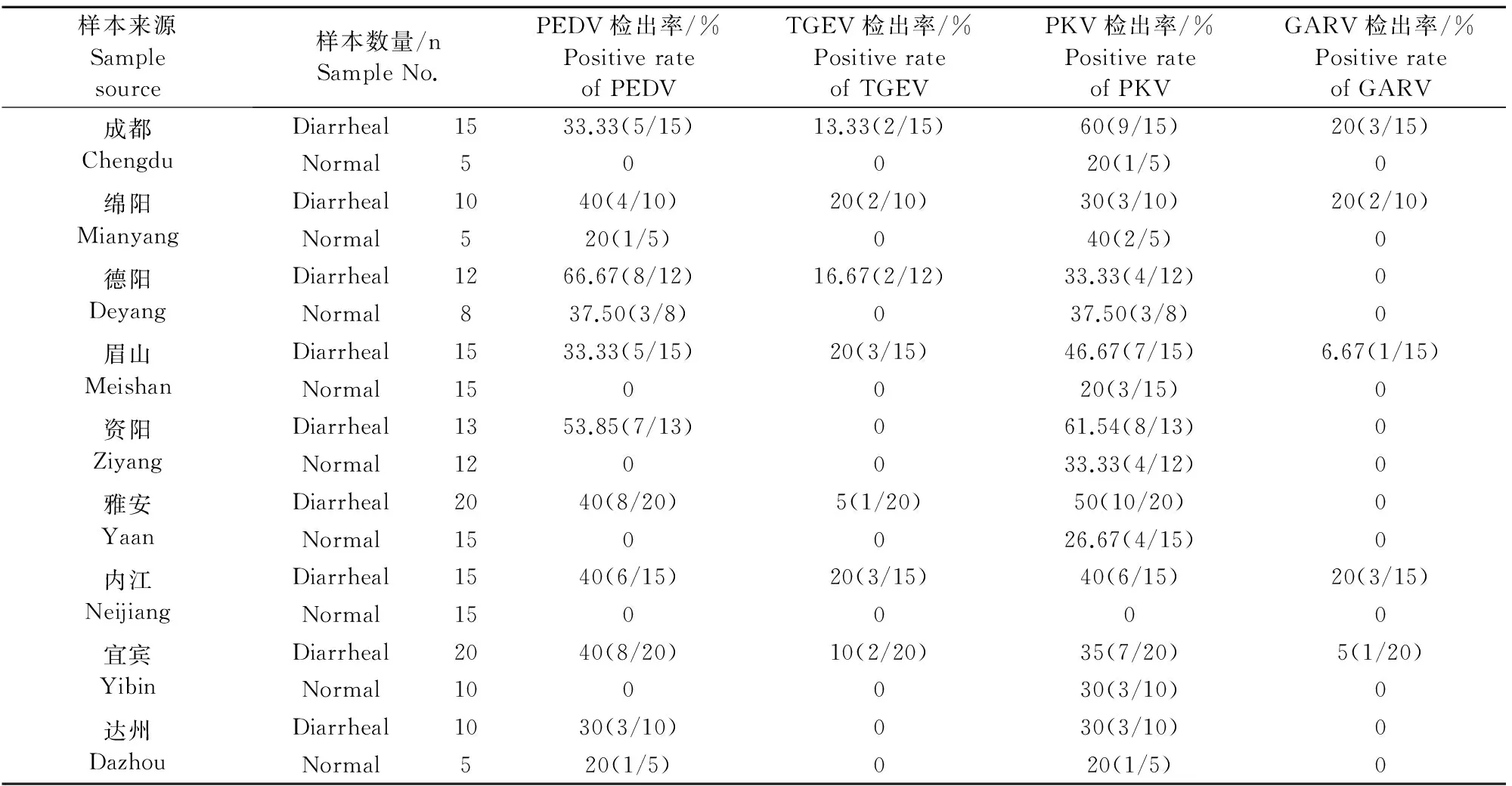
表2 4种病原阳性检出率结果Table 2 The positive detection rates of four kinds of pathogens
PKV是近年新发现的一类与腹泻相关的肠道病毒,在世界各地检出PKV阳性率从16.7%到99.0%不等[15-16];张莎等[17]对来自我国24省236份病料进行PKV检测发现阳性率为 42.85%,病毒分布几乎覆盖整个中国大陆。本试验结果显示,不论在外观健康猪或腹泻猪的粪便样本中,PKV的检出率均高于其他3种病原,提示本地区PKV感染情况也较为严重。值得注意的是在腹泻猪粪便中PKV的阳性检出率为43.85% (57/130),显著高于外观健康猪粪便样本 23.33% (21/90);在来源于成都、眉山、资阳和雅安的部分猪场腹泻猪粪便样本中,PKV阳性检出率均显著高于PEDV,同场腹泻猪粪便样本中PKV阳性检出率也显著高于外观健康猪样本,这进一步表明PKV与猪只腹泻具有密切联系。同时在多种病原混合感染类型中,PEDV与PKV混合感染所占比例也最高,可能与这2种病原流行情况较普遍有关,也在一定程度上反映出PEDV和PKV存在协同致病的可能。
本试验对来自四川省9个不同地区猪场的粪便样本进行了4种病毒性病原的 RT-PCR 检测,结果表明引起腹泻的主要病毒病原为PEDV,但其他传统腹泻病原如TGEV和GARV也存在不同程度的感染。对PKV的检测结果表明,在 9个猪群的群体阳性率为 100%,表明其广泛流行于本地区的养殖场,同时 PKV 在腹泻粪便中的阳性检出率显著高于外表健康样本,提示其可能是腹泻的重要因素之一。
[1] Sun R Q,Cai R J,Chen Y Q,et al.Outbreak of porcine epidemic diarrhea in suckling piglets,China [J].Emerg Infect Dis,2012,18(1): 161-163.
[2] 甘海霞,梁 晟,韦显凯,等.2011年广西猪群猪流行性腹泻和猪传染性胃肠炎调查 [J].动物医学进展,2012,33(10): 125-127.
[3] 秦谷雨,杨 勇,李 郁,等.安徽省仔猪腹泻5种病毒感染情况的调查研究 [J].动物医学进展,2012,33(12): 59-63.
[4] Reuter G,Kecskemeti S,Pankovics P.Evolution of porcine kobuvirus infection,Hungary [J].Emerg Infect Dis,2010,16(4): 696-698.
[5] Ribeiro J,Leme A D,Alfieri A F,et al.High frequency of Aichivirus C (porcine kobuvirus) infection in piglets from different geographic regions of Brazil [J].Trop Anim Health Prod,2013,45(8): 1757-1762.
[6] 任玉鹏,陈弟诗,苏生禹,等.三种猪腹泻病毒性病原多重RT-PCR检测方法的建立及应用 [J].中国兽医科学,2013,43(10): 881-885.
[7] Sambrook J,Russell D W.Molecular cloning: a laboratory manual [M].3rd ed.New York: Cold Spring Harbor Laboratory Press,2001.
[8] Park S J,Kim H K,Song D S,et al.Molecular characterization and phylogenetic analysis of porcine epidemic diarrhea virus (PEDV) field isolates in Korea [J].Arch Virol,2011,156(4): 577-585.
[9] Puranaveja S,Poolperm P,Lertwatcharasarakul P,et al.Chinese-like strain of porcine epidemic diarrhea virus,Thailand [J].Emerg Infect Dis,2009,15(7): 1112-1115.
[10] Duy D,Toan N T,Puranaveja S,et al.Genetic characterization of porcine epidemic diarrhea virus (PEDV) isolates from southern Vietnam during 2009-2010outbreaks [J].Thai J Vet Med,2011,41(1): 55-64.
[11] Wang L,Byrum B,Zhang Y.Detection and genetic characterization of delta coronavirus in pigs [J].Emerg Infect Dis,2014,20(7): 1227-1230.
[12] Lowe J,Gauger P,Harmon K,et al.Role of transportation in spread of porcine epidemic diarrhea virus infection,United States [J].Emerg Infect Dis,2014,20(5): 872-874.
[13] 刘孝珍,陈建飞,时洪艳,等.2011年猪流行性腹泻病毒的遗传变异分析 [J].中国预防兽医学报,2012,34(3): 180-183.
[14] 杨丽梅,马 力,徐倩倩,等.我国猪病毒性腹泻的诊断与流行病学调查研究概况 [J].动物医学进展,2014,35(2):115-119.
[15] Khamrin P,Maneekarn N,Kongkaew A,et al.Porcine kobuvirus in piglets,thailand [J].Emerg Infect Dis,2009,15(12): 2075-2076.
[16] Park S J,Kim H K,Moon H J,et al.Molecular detection of porcine kobuviruses in pigs in Korea and their association with diarrhea [J].Arch Virol,2010,155(11): 1803-1811.
[17] 张 莎,石 达,陈建飞,等.2012年猪嵴病毒流行病学调查及3D基因的遗传变异分析 [J].中国预防兽医学报,2013,35(2): 95-98.
Survey on Infections with PEDV,TGEV,GARV and PKV in Pig Farms of Sichuan Province
CAO Gong-mao,ZHANG Bin,YUE Hua,FEI Lei,REN Yu-peng
(CollegeofLifeScienceandTechnology,SouthwestUniversityforNationalities,Chengdu,Sichuan,610041,China)
In order to survey the infections with PEDV,TGEV,GARV and PKV in 9pig farms from different regions in Sichuan province,and provide theoretical basis for the prevention of porcine diarrhea,this study detected four kinds of pathogens from a total of 220feces samples (90normal feces samples and 130diarrheal feces samples) by RT-PCR.The results showed that in total of 9pig herds,the detection rates of PEDV and PKV were 100% (9/9).The positive rate of these two kinds of pathogens in some pig herds were over 60%.It indicated that PEDV and PKV co-infection was widespread in pig farms of Sichuan province.Besides,the positive rates of TGEV and GARV were 11.54% (15/130) and 7.69% (10/130),respectively.It showed that this two kinds of pathogens still present in Sichuan province.In this study,the detection rate of PKV was 43.85% (57/130) in diarrheal feces samples.It was significantly higher than that in normal feces samples,23.33% (21/90).It could be inferred that PKV was associated with diarrheal piglets,and these two pathogens might be synergistic pathogenicity.
viral diarrhea;co-infection;RT-PCR;detection
2015-06-01
“十二五”国家高技术研究发展(863)计划项目(2012AA101304);西南民族大学2015年研究生“创新型科研项目” (140952002708);兽医专业学位研究生省级教育实践基地建设项目
曹恭貌(1990-),男,四川成都人,硕士研究生,主要从事动物传染病学研究。*通讯作者
S858.28
B
1007-5038(2016)01-0118-05
