小鼠感染猪源鼠伤寒沙门菌分离株的检测
2016-12-16胡茂志李文华赵维芯严秋香李红英崔桂友
胡茂志,李文华,赵维芯,高 巍,严秋香,李红英,崔桂友
(1.扬州大学测试中心,江苏扬州 225009;2.扬州大学旅游烹饪学院,江苏扬州 225009;3.扬州大学兽医学院,江苏扬州 225009)
小鼠感染猪源鼠伤寒沙门菌分离株的检测
胡茂志1,李文华2,赵维芯2,高 巍3,严秋香1,李红英1,崔桂友2
(1.扬州大学测试中心,江苏扬州 225009;2.扬州大学旅游烹饪学院,江苏扬州 225009;3.扬州大学兽医学院,江苏扬州 225009)
小鼠对鼠伤寒沙门菌感染的检测分析有助于沙门菌致病机理的研究。从扬州市某屠宰场猪胴体表面采样分离出了一株沙门菌,通过生化鉴定及血清型分析,判断该菌株为鼠伤寒沙门菌。药物敏感性分析表明,该菌株对氨苄青霉素高度耐药,而对头孢类等药物敏感。动物试验结果表明,腹腔注射5×105CFU/只的剂量即可致死小鼠,1×104CFU/只的剂量感染后,虽然不能致死小鼠,但能引起小鼠肝脏和脾脏的病理损伤和炎症反应,脏器系数升高,肝脏抗氧化系统紊乱;细菌在小鼠体内的定殖能力较强,4周以后肝脏和脾脏中仍能分离到;感染小鼠血清生化指标(ALT、AST、ALP、TP、ALB)异常,部分细胞因子(IFN-γ和TNF)升高。说明该菌株能诱导脾脏中T淋巴细胞的活化。通过以上分析,对该分离菌株的生物学特性有了初步的了解。
鼠伤寒沙门菌;分离鉴定;生物学特性
沙门菌(Salmonella)是人和动物最主要的食源性病原菌之一[1]。目前已鉴定出2500多种血清型。据统计,在世界各国的细菌性食物中毒中,沙门菌常列榜首。在我国,根据国家卫生计生委办公厅公布的2013年-2014年全国食物中毒事件通报显示,沙门菌所致细菌性食物中毒位居食物中毒首位。世界卫生组织(WHO)将沙门菌列入具有严重危害和中等危害的食物传播性病原菌。
带菌食品动物和污染蛋类是引起人类沙门菌病的主要原因[2],肉用动物屠宰、加工等环节是引起食品带菌的主要原因之一。欧洲食品安全局(European food safety authority,EFSA)就2011年欧盟95548人沙门菌病例的来源和趋势研究发现,猪肉和猪肉制品中沙门菌污染仅次于鸡肉和火鸡肉[3]。我国不同地区的超市和农贸市场猪肉中沙门菌污染率也较高[4-5]。因此,了解猪肉中沙门菌的污染情况,有助于沙门菌疾病的早期控制和预防。鼠伤寒沙门菌宿主范围广,可感染人、啮齿类动物和禽类等,小鼠是其研究的常用模型。在长期的进化过程中,沙门菌逐步演化出了适合自身的逃逸机制,从而在机体内定殖并引起致病[6]。本研究针对扬州市某屠宰场猪胴体进行样品采集,分离出一株鼠伤寒沙门菌菌株,并对其生化特性、药物敏感性和对小鼠的致病性等进行了分析。
1 材料与方法
1.1 材料
1.1.1 实验动物 6周龄~7周龄C57BL/6小鼠,购自扬州大学比较医学中心。
1.1.2 主要试剂 缓冲蛋白胨水(Buffered peptone water,BPW)干粉、XLT4培养基干粉、XLT4琼脂添加剂、RV(Rappaport vassiliadis)肉汤培养基干粉为美国Becton Dickinson 公司产品;酵母提取物、胰蛋白胨为英国OXOID公司产品;API 20E生化鉴定试剂盒为法国梅里埃公司产品;沙门菌属60种诊断血清为宁波天润生物药业有限公司产品;丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒为南京建成生物工程研究所产品;荧光素标记的抗小鼠CD 分子单抗CD4-PE、CD69-FITC、CD3-FITC、CD8a-APC,Mouse inflammation kit 为美国Becton Dickinson公司产品;NH4Cl(10×)红细胞裂解液为自己配置。
1.1.2 主要仪器 VITEK 2Compact全自动细菌鉴定药敏分析仪为法国Biomerieux(生物梅里埃)公司产品;7170A型全自动生化分析仪为日本日立公司产品;5417R型台式冷冻离心机为德国Eppendorf公司产品;Cary 5000紫外-可见-近红外吸收光谱仪为美国Varian公司产品。
1.2 方法
1.2.1 细菌分离与鉴定 从扬州市某屠宰场猪胴体表面采集样品,沙门菌的分离鉴定参照文献[7-8]方法进行。用API 20E生化鉴定试剂盒对LB平板上生长的菌落进行生化鉴定,具体方法参考说明书进行,所得出的7位数字代码,查询数据库。确认为沙门菌属后进行血清型鉴定,具体方法参考国家标准(GB4789.4-2010)进行。
1.2.2 药物敏感性试验 用VITEK-2Compact AST-GN13药敏卡检测超广谱β-内酰胺酶(extended-spectrum beta-lactamase,ESBLs)和药物敏感性,具体方法参照说明书进行。
1.2.3 分离菌的小鼠感染试验
1.2.3.1 小鼠的致死性试验 挑取沙门菌单个菌落接种LB液体培养基,培养过夜。用灭菌PBS洗涤细菌沉淀,2730r/min离心5min。洗涤3次后,用适量的灭菌PBS稀释沉淀。调整菌液浓度。分别按照5×104、5×105、5×106、5×107CFU/只的剂量,腹腔注射6周龄C57BL/6小鼠,观察小鼠的死亡情况。对照组腹腔注射等体积的灭菌PBS。
1.2.3.2 供病变观察的小鼠感染试验 6周龄C57BL/6雌性小鼠48只,随机分为2组。试验组腹腔注射1×105CFU/mL的沙门菌分离株(100μL/只)。对照组腹腔注射等体积的灭菌PBS。
1.2.3.3 小鼠组织病理切片观察 在感染3周后,采集肝脏和脾脏,进行组织病理切片和苏木素-伊红(hematoxylin-eosin,HE)染色观察。
1.2.3.4 血清学分析 将小鼠摘除眼球取血,全血置于37℃水浴10min,3500r/min离心10min,取上清液置于离心管中,置-20℃冰箱保存备用。血清中谷丙转氨酶(alanine transaminase,ALT)、谷草转氨酶(aspartate transaminase,AST)、碱性磷酸酶(alkaline phosphatase,ALP)、总蛋白(total protein,TP)和白蛋白(albumin,ALB)含量采用全自动生化分析仪检测。血清中白细胞介素-6(interleukin-6,IL-6)、IL-10、单核细胞趋化蛋白-1(monocyte chemoattractant protein,MCP-1)、干扰素-γ(interferon-γ,IFN-γ)、肿瘤坏死因子(tumor necrosis factor,TNF)和IL-12P70用流式细胞仪检测。
1.2.3.5 肝脏中氧化指标分析 MDA和SOD分别采用巴比妥酸法(thibabituric acid,TBA)和黄嘌呤
氧化酶法(羟胺法)测定,具体参照说明书进行,用紫外-可见-近红外吸收光谱仪检测。
1.2.3.6 沙门菌的定殖分析 每组各取6只小鼠,无菌取其脾脏、肝脏,称重,加入1mL无菌的PBS彻底研磨,取100μL研磨液进行10倍稀释,选取3个合适的稀释度,每个稀释度取100μL涂布LB平板,每个稀释度做3个重复,取其平均值。37℃培养16h~24h后,计数细菌菌落。
1.2.3.7 脾脏中T淋巴细胞的活化分析 无菌采集小鼠脾脏细胞,制备单细胞悬液,计数。同时标记CD4-PE、CD69-FITC和CD8-APC,4℃避光孵育20min后,加入红细胞裂解液裂解,再用PBS 洗涤2次后,上流式细胞仪检测。
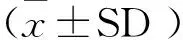
2 结果
2.1 分离菌的生化试验鉴定结果
用革兰阴性菌生化鉴定试剂盒鉴定结果表明,该分离株产H2S,尿素酶阴性,β-半乳糖苷酶阴性,能发酵葡萄糖产酸产气,甘露醇、甘露糖利用阳性,确定为沙门菌属。经进一步血清学鉴定表明,该分离菌为鼠伤寒沙门菌。在透射电镜下,细菌呈椭圆形短杆状,有长丝状鞭毛(图1)。
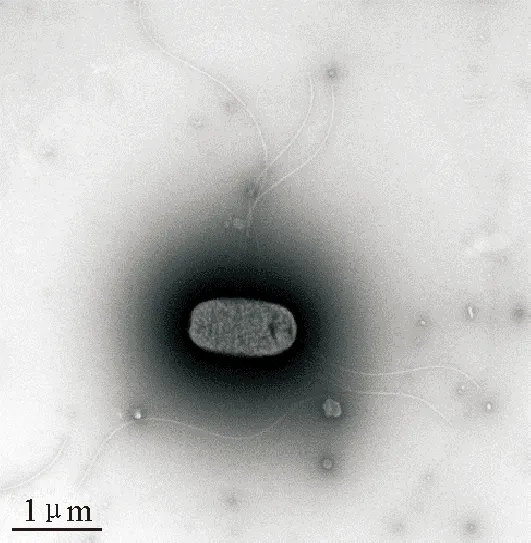
图1 细菌的透射电镜观察
Fig.1 Transmission microscopy observation ofSalmonella
2.2 分离菌的药物敏感性试验
VITEK 2Compact系统分析表明,该分离株对哌拉西林/三唑巴坦、头孢他啶、头孢三嗪、头孢平、头孢唑啉、头孢替坦二钠、氨曲南、亚胺培南、厄他培南、妥布霉素、左氧氟沙星、阿米卡星、庆大霉素、复方新诺明等药物高度敏感;对氨苄青霉素/青霉素烷砜钠、呋喃妥因等中度敏感;而对氨苄青霉素耐药。
2.3 分离菌对小鼠的致死性试验结果
将该沙门菌分离株按照不同剂量腹腔注射感染小鼠后结果表明,5×107CFU/只剂量组12h内即全部死亡;5×106CFU/只剂量组从感染后第2天开始死亡,5d后全部死亡;而5×105CFU/只剂量组到第3天开始死亡,7d后全部死亡;5×104CFU/只剂量组小鼠状态仍较好,无死亡发生。对照组小鼠状态良好。表明该鼠伤寒沙门菌分离株具有较强的致病性。
2.4 感染后小鼠肝脏和脾脏病理切片观察
相对于对照组,感染组小鼠的肝脏肿大,表面粗糙,散在出血点;感染组脾脏肿大,质地柔软,边缘钝圆,被膜紧张,呈喑红色或者黑红色。经过组织病理切片和HE染色(图2和图3),在显微镜下,细胞核呈蓝色;细胞浆、肌肉、结缔组织、红细胞和嗜伊红颗粒呈不同程度的红色。肝脏观察发现,对照组肝细胞清晰,感染组肝脏内出现坏死灶,肝细胞裂解,淋巴细胞和巨噬细胞(macrophages,Mφs)浸润。脾脏观察结果表明,对照组脾脏淋巴小结清晰,而感染组脾脏肿大,炎性细胞浸润明显。
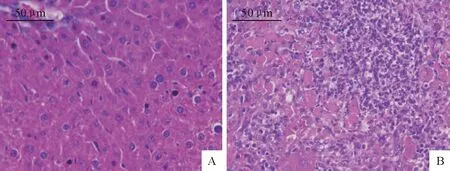
A.对照组;B.感染组
A.Control;B.Infected group
图2 小鼠肝脏组织病理切片
Fig.2 Pathological section of mouse livers

A.对照组;B.感染组
A.Control;B.Infected group
图3 小鼠脾脏组织病理切片
Fig.3 Pathological section of mouse spleens
2.5 感染后小鼠血清生化指标分析
从表1中可以看出:①感染组小鼠血清中ALT 含量均高于对照组(P<0.01),并且第2周达到高峰,之后逐渐降低;②感染组小鼠血清中AST含量在感染后前3周均高于对照组(P<0.01),并且第2周达到高峰,之后降低;③感染组小鼠血清中ALP含量均低于对照组(P<0.01),但随着时间的延长,呈现递增趋势;④感染组小鼠血清中TP含量在感染后前3周均明显低于对照组(P<0.01),第4周与对照组无显著差异;⑤感染组小鼠血清中ALB含量均显著低于对照组(P<0.01)。
2.6 感染后小鼠血清中细胞因子分析
从表2中可以看出,对照组小鼠血清中各种细胞因子含量均低于检测限(20pg/mL)。在沙门菌感染组中,IL-6含量第1周达到112.17pg/mL,之后低于检测限;MCP-1和IFN-γ含量均第2周达到高峰,然后降低;TNF第3周达到高峰,之后降低。IL-10和IL-12P70均低于检测限。
2.7 感染后肝脏中MDA和SOD分析
经统计学分析表明,沙门菌感染后,感染组MDA含量均高于对照组(P<0.01),但与感染时间无相关性。感染组SOD含量在第1周明显高于对照组(P<0.01),然后逐渐降低(表3)。
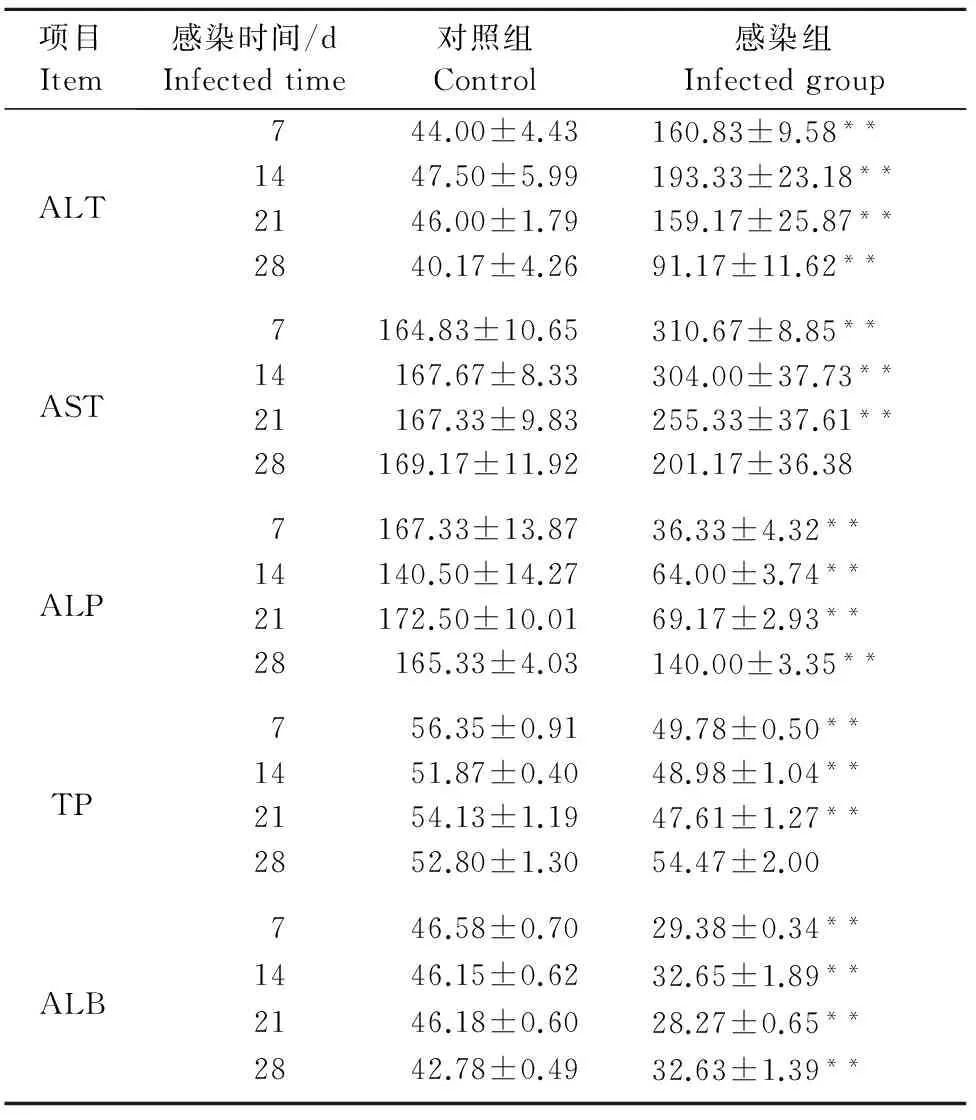
表1 小鼠血清中ALT含量分析结果Table 1 Contents of ALT in mouse sera U/L
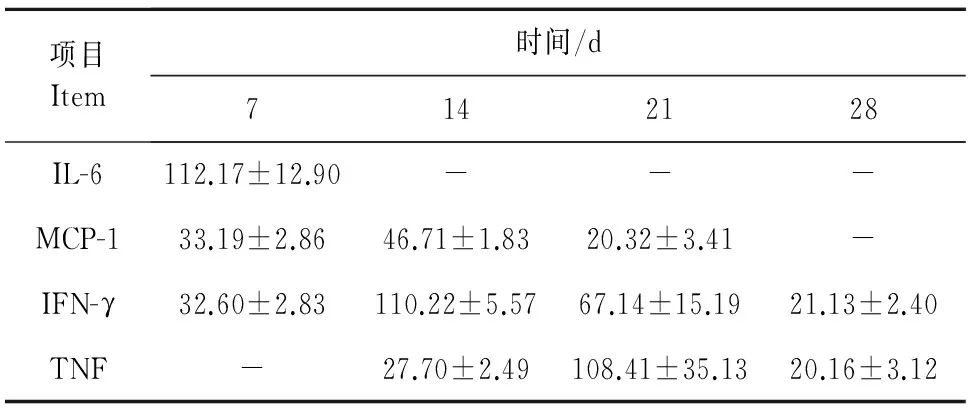
表2 小鼠血清中细胞因子分析Table 2 The cytokine contents in mouse sera pg/mL
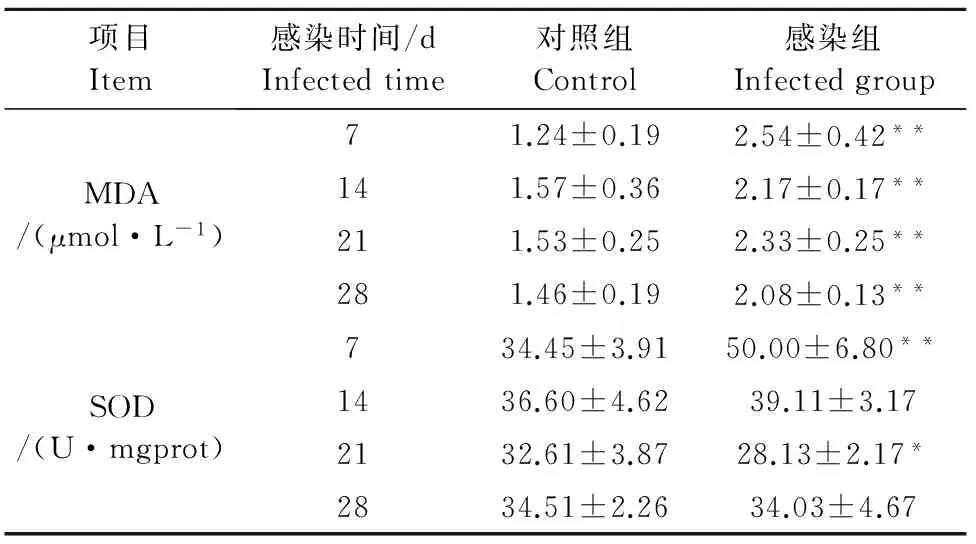
表3 肝脏中MDA和SOD含量动态分析结果Table 3 The dynamic assay of MDA and SOD contents in livers of mice mgprot
2.8 感染后沙门菌在小鼠体内的定殖情况
从表4中可看出,沙门菌感染后,小鼠肝脏和脾脏中能明显地分离到沙门菌,7d达到高峰(肝脏中约为注射剂量的13倍,脾脏中约为60倍),然后随着时间的延长,细菌数量逐渐降低,第4周时仍然接近注射剂量。而对照组自始至终未分离到细菌。说明该沙门菌分离株能够在体内存活并繁殖。

表4 沙门菌在小鼠体内的定殖分析结果Table 4 Salmonella colonization in the liver and spleen of mice 104 CFU/g
2.9 感染后小鼠脾脏中T细胞活化分析
从表5分析结果表明,沙门菌感染后,CD4+/CD8+T细胞比率升高。并且感染组CD4+和CD8+T细胞的活化情况均明显高于对照组(P<0.01)。
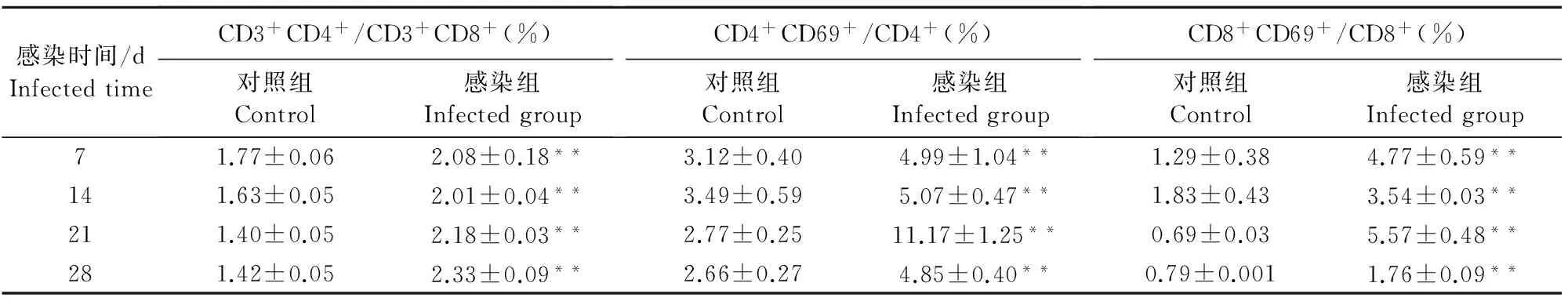
表5 小鼠脾脏T细胞亚群分析结果Table 5 T lymphocyte subsets in splenocytes of mice
3 讨论
猪对多种血清型的沙门菌易感,亚临床感染猪可以携带沙门菌,虽不呈现任何症状,但能加重疾病的传播[2]。2006年-2007年,欧盟对13个成员国屠宰场中猪胴体擦拭样品调查发现,沙门菌污染中主要为鼠伤寒沙门菌[9]。Arguello H等[7]分别在2004年-2006年和2009年-2010年期间对西班牙4家屠宰场的猪胴体调查发现,沙门菌分离率较高,并且鼠伤寒沙门菌是主要血清型之一。在中国,侯小刚等[10]随机抽取四川省某屠宰场胴体肉样调查发现,污染的沙门菌中鼠伤寒沙门菌也是优势血清型之一。本研究从扬州某屠宰场猪胴体擦拭样品中分离并鉴定出一株鼠伤寒沙门菌,进一步验证了鼠伤寒沙门菌的污染较为普遍。
鼠伤寒沙门菌的宿主极其广泛,染菌的人、家禽、家畜及鼠类是该病的主要传染源,其主要通过污染的食物和水经口传播,引起胃肠炎等疾病。鼠伤寒沙门菌能够逃避机体防御系统,并在体内生存,造成持续感染[11]。沙门菌感染的严重程度取决于细菌毒力、感染剂量和宿主免疫系统的遗传结构[2]。本试验利用该分离株感染小鼠发现,5×105CFU/只的剂量腹腔注射即可导致小鼠死亡,1×104CFU/只的剂量虽不能致死小鼠,但能引起明显的组织损伤,说明该菌株具有较强的致病性。沙门菌的耐药性复杂多样,已经成为全球关注的焦点[12]。头孢类药物和第3代氟喹诺酮类是目前临床抗沙门菌感染的首选药,该分离株的药敏试验结果也说明了这一点。
病原菌感染后往往会引起小鼠血清生化指标的改变。AST/ALT是氨基酸降解过程中的重要转氨酶,是判断肝脏受损的重要指标[13]。本试验中,小鼠感染沙门菌后,血清中ALT和AST活性水平显著升高,可能是由于肝脏受损、细胞结构破坏或膜通透性增加所致。另外,AST/ALT浓度先升后降,说明小鼠肝脏受损后有恢复的趋势。血清中的ALP主要来源于肝脏和骨骼,是生物体代谢的关键酶之一[13]。试验中,该酶活性明显降低,推测可能与肝、肾小管和小肠黏膜等细胞伤害,或碱性磷酸酶从胆管排除出现障碍等有关。在感染的4周内,ALP含量不断回升,说明沙门菌感染可能导致肝细胞受损或肠道活力的减弱,但随时间延长,由于沙门菌的调节和小鼠的自我修复与调整,肝细胞或肠道功能逐渐恢复。血清白蛋白是血清总蛋白的一部分,由肝脏合成。血清TP、ALB的含量反映了机体蛋白的吸收和代谢状况[14]。本试验中,ALB迅速降低,表明小鼠的肝细胞受到损害,合成蛋白的能力下降。血清中ALP、TP和ALB水平先降后升,说明肝脏功能部分恢复,与血清AST/ALT检测结果相一致。
细胞因子在启动和调节针对沙门菌的先天性和获得性免疫反应中起关键作用。在机体发生炎症时,单核细胞、巨噬细胞、成纤维细胞、血管内皮细胞、B细胞、平滑肌细胞等都能分泌产生MCP-1,且MCP-1对单核/巨噬细胞具有特异性趋化激活作用[15]。IFN-γ主要由Th1细胞分泌,是强有力的吞噬细胞和中性粒细胞的激活物。TNF-α主要由活化的巨噬细胞产生,同时又是巨噬细胞的主要激活剂。另外,TNF-α也是IFN-γ清除细菌的增强剂。本试验中,沙门菌感染小鼠后,血清中MCP-1、IFN-γ和TNF-α均显著升高,并且呈现先升后降的趋势,说明沙门菌感染初期,小鼠对沙门菌的免疫应答活跃;而后降低,反映了沙门菌为了在细胞内生存而逃逸杀伤的结果。
自由基理论认为,许多疾病的发生和转归与自由基有关,在物理性、化学性和生物性致病因素的作用下,产生的氧自由基可引起细胞发生膜脂质过氧化作用,从而导致组织损伤。生物体内存在着自由基的清除系统,如抗氧化酶系统(如SOD)等。MDA是膜脂过氧化的终产物之一,其含量可反映细胞受损程度,特别是细胞膜的损伤。SOD是机体内最主要的抗氧化酶之一,其活性的变化直接影响细胞内氧自由基和其终末产物脂质过氧化物的含量。正常生理条件下,自由基的产生与清除处于动态平衡。据报道,肠炎沙门菌感染三黄鸡后,脾脏SOD活性先降后升,而MDA含量先升后降[16]。本研究中,沙门菌感染小鼠后,肝脏细胞生物膜自由基代谢中产生的MDA升高,说明肝脏细胞受损,而SOD先升后降的趋势说明,一方面机体为了抵抗沙门菌的伤害,逐渐被诱导合成了相应的氧化酶,降低细胞内氧化剂对细胞的伤害。另一方面,沙门菌为了在细胞内存活,通过分泌效应蛋白调节细胞内的抗氧化过程。这也证明了机体细胞与沙门菌之间的斗争是一个复杂的过程。
免疫细胞的活化是免疫反应成功的一个标志。适度活化的T淋巴细胞具有增强机体免疫监视、消除体内有毒有害因子的功能,是机体执行免疫效应功能的基础。静息的T淋巴细胞极少表达CD69,而活化的T淋巴细胞则可上调表达,所以CD69可作为T细胞早期活化的标志[17]。本试验发现,沙门菌感染后,小鼠脾脏中T淋巴细胞被活化,并且CD4+/CD8+T细胞比例升高,说明机体针对沙门菌感染产生了获得性免疫应答。
本研究通过猪肉中沙门菌的分离鉴定及其生物学特性分析,为控制和预防猪沙门菌感染提供了参考。
[1] Lee K M,Runyon M,Herrman T J,et al.Review ofSalmonelladetection and identification methods: aspects of rapid emergency response and food safety[J].Food Control,2015,47: 264-276.
[2] Calenge F,Kaiser P,Vignal A,et al.Genetic control of resistance to salmonellosis and toSalmonellacarrier-state in fowl: a review[J].Genetics Selection Evolution,2010,42:1-11.
[3] Ecdc E.The European Union summary report on trends and sources of zoonoses,zoonotic agents and food-borne outbreaks in 2011[J].EFSA J,2013,11(4): 3129.
[4] 刘 杰,张秀丽,陈 磊,等.肉猪养殖和屠宰环节沙门菌污染状况监测分析[J].中国食品卫生杂志,2013,25(1): 61-64.
[5] Li Y C,Pan Z M,Kang X L,et al.Prevalence,characteristics,and antimicrobial resistance patterns ofSalmonellain retail pork in Jiangsu province,eastern China [J].J Food Prot,2014,77(2): 236-245.
[6] 熊 丹,宋 丽,胡茂志,等.沙门菌免疫逃逸机制及其应用研究进展[J].动物医学进展,2015,36(4): 96-100.
[7] Arguello H,Carvajal A,Collazos J A,et al.Prevalence and serovars ofSalmonellaentericaon pig carcasses,slaughtered pigs and the environment of four Spanish slaughterhouses [J].Food Res Int,2012,45(2): 905-912.
[8] Piras F,Brown D J,Meloni D,et al.Investigation ofSalmonellaentericain Sardinian slaughter pigs: prevalence,serotype and genotype characterization [J].Int J Food Microbiol,2011,151(2): 201-209.
[9] EFSA.Report of the task force on zoonoses data collection on the analysis of the baseline survey on the prevalence ofSalmonellain slaughter pigs,Part A [R].EFSA J,2008,135: 1-111.
[10] 侯小刚,刘书亮,韩新锋,等.四川部分地区猪肉产业链中沙门氏菌的分离及其鉴定[J].食品科学,2013,34: 250-253.
[11] Malik-Kale P,Jolly C E,Lathrop S,et al.Salmonella-at home in the host cell [J].Front Microbiol,2011(2): 125.
[12] 陈 龙,张春霞,康元环,等.猪源沙门菌耐药机制及耐药性研究进展[J].动物医学进展,2014,35(8): 79-83.
[13] Seeff L B.Drug-induced liver injury is a major risk for new drugs [J].Dig Dis,2015,33(4): 458-463.
[14] Abhishek S N,Mubeen K,Vijayalakshmi K R,et al.Serum total protein,albumin and advanced oxidation protein products (AOPP)-implications in oral squamous cell carcinoma [J].Malaysian J Pathol,2012,34(1):47-52.
[15] 毛志敏,周如丹,赵学凌,等.MCP-1在炎性反应中的研究进展[J].医学综述,2013,19(6): 964-966.
[16] 吴 强,郁建生,崔恒敏,等.白鸡屎藤挥发油抗肠炎沙门菌内毒素作用的分析[J].中国兽医科学,2012,42(7): 758-764.
[17] Vitales-Noyola M,Doniz-Padilla L,Alvarez-Quiroga C,et al.Quantitative and functional analysis of CD69(+) NKG2D(+) T regulatory cells in healthy subjects [J].Hum Immunol,2015,76(7): 511-518.
Detection of Mice Infected with Salmonella typhimurium Isolated from Pigs
HU Mao-zhi1,LI Wen-hua2,ZHAO Wei-xin2,GAO Wei1,YAN Qiu-xiang1,LI Hong-ying1,CUI Gui-you2
(1.TestingCenter,YangzhouUniversity,Yangzhou,Jiangsu,225009,China;2.CollegeofTourism&Cuisine,YangzhouUniversity,Yangzhou,Jiangsu,225009,China;3.CollegeofVeterinaryMedicine,YangzhouUniversity,Yangzhou,Jiangsu,225009,China)
Analysis of mice infected withSalmonellatyphimuriumwill benefit the understanding of bacterial pathogenic mechanism.In this experiment,aS.typhimuriumstrain was isolated from the pig carcass in Yangzhou slaughterhouse and identified by biochemical and serologic assays.The drug sensitivity assay indicated that this isolate was sensitive to cephalosporins,but not to ampicillin.It was found that the mice could be killed after 5×105CFU per mouse intraperitoneal injection.After intraperitoneally injected with the dose of 1×104CFU per mouse,no dead mice were found,but the obvious pathological damages and inflammation reactions in liver and spleen were shown.The colonization ability of this isolate was strong and it could still be isolated from liver and spleen four weeks after infection.Besides,the organ coefficients,the MDA and SOD levels in liver and the ALT,AST,ALP,TP and ALB levels in serum were significantly changed.What's more,the concentrations of cytokines (IFN-γ and TNF) in serum were elevated and this isolate also could induce the activation of T lymphocytes in spleen.Through the above analysis,we can get a preliminary understanding of the biological characteristics of this isolate.
Salmonellatyphimurium; isolation; biological property
2015-07-21
国家自然科学基金项目(31372414);江苏省动物预防医学重点实验室开放课题(K13040)
胡茂志(1976-),男,山东临沂人,副研究员,博士,主要从事微生物学和免疫学研究。
S852.612
A
1007-5038(2016)01-0052-06
