广西地区猪伪狂犬病病毒gE基因的序列分析
2016-12-16覃雨阳李雪梅冯淑萍何奇松
覃雨阳,李雪梅,马 军,吴 军,冯淑萍,熊 毅,何奇松*
(1.广西大学动物科学技术学院,广西南宁 530005;2.广西动物疫病预防控制中心,广西南宁 530001)
广西地区猪伪狂犬病病毒gE基因的序列分析
覃雨阳1,李雪梅1,马 军1,吴 军1,冯淑萍2,熊 毅2,何奇松2*
(1.广西大学动物科学技术学院,广西南宁 530005;2.广西动物疫病预防控制中心,广西南宁 530001)
探讨广西地区近期流行猪伪狂犬病病毒(PRV)gE基因的变异规律,以及与国内外毒株的基因差异性,为制定有效的猪伪狂犬病防控措施提供科学依据。对广西不同地区流行的PRV gE基因进行克隆和序列测定,并与国内外PRV毒株的gE基因进行同源性比对分析,构建遗传进化树。广西地区流行的PRV与广东Fa株、湖北HD株的gE基因核苷酸的同源性与编码氨基酸序列同源性最高,分别为99.8%和99.7%;广西地区流行毒株间gE基因同源性达99.5%~99.8%,推导氨基酸序列同源性为98.8%~99.7%,广西地区近期流行PRV毒株的变异不明显。4株PRV毒株与近年国内分离的毒株ZK、NY、QBA、HNXX、MZ1处于同一分支上,遗传关系较近;而与国内经典株Ea、GDSH遗传关系稍远,与国外分离株Yangsan、NiA3、Becker、Rice处于不同的遗传分支,保持较远的亲缘关系。4株PRV gE基因的48位点氨基酸和其中的GXNN1、GXBH1的496位点氨基酸增加1个天冬氨酸的插入,具有变异株的特征。广西地区流行的PRV毒株属于目前我国主要流行的变异株,其氨基酸的插入将对变异株的分子流行病学调查提供重要的参考。
伪狂犬病病毒;gE基因;序列测定;同源性分析;猪
猪伪狂犬病(Porcine pseudorabies,PR)是由猪伪狂犬病病毒(Pseudorabies virus,PRV)引起的一种急性败血性传染病。猪感染伪狂犬病后临诊症状因日龄而异,成年猪一般呈隐性感染,成为保毒宿主,怀孕母猪可导致流产、死胎、木乃伊胎和种猪不育等症状。仔猪通常表现为神经症状、麻痹死亡,15日龄以内的仔猪病死率可达100%,断奶仔猪发病率可达40%,病死率20%左右[1]。宋宏晓等[2]检测临床上伴有神经症状的病猪病料样本发现,猪群中PRV、猪圆环病毒2型(PCV-2)和猪瘟病毒(CSFV)3种引起神经症状的免疫缺陷性疫病病毒中,以PRV单独感染情况最为严重。杨庆芳等[3]从病死仔猪的脑、肺、肝组织病料中分离出1株疑似PRV毒株,经克隆、测序分析,证实所分离病毒为PRV。PRV为双股DNA病毒,核酸大小约150kb,其中的TK基因、gE基因和gI基因决定着PRV对猪的毒力,是其重要的毒力因子。gE基因编码蛋白的氨基酸序列中第125位的缬氨酸和第126位的半胱氨酸对病毒的生物学功能有重要的影响,并且gE基因是所有野毒株均表达的一类糖蛋白[4]。因此,研究分析PRV的gE基因序列,了解其变异规律及其与国内外毒株基因间的差异,对有效防控猪伪狂犬病的暴发和流行具有重要意义。白丽丽等[5]设计一对扩增PRV gE基因的特异性引物,建立可以区分PRV野毒株与疫苗株的PCR检测方法。并从广东分离得到1株PRV毒株,经克隆测序后与其他PRV gE基因序列进行比较,发现其核苷酸序列与其他PRV毒株的同源性介于98.3%~99.9%之间,与PRV Ea株的亲缘关系最近为99.9%。姚敬明等[6]选用国产和进口的猪伪狂犬病gE基因缺失弱毒疫苗,用4种不同的免疫程序,对母猪和仔猪进行了免疫试验,结果都产生了良好的免疫效果。占松鹤等[7]对8株PRV安徽分离株的gE基因进行PCR扩增和序列分析,对gE基因序列核苷酸和推导的氨基酸序列同源性分析表明,分离株之间的核苷酸同源性分别为96.8%~99.7%,氨基酸序列同源性为97.9%~100.0%;与国内外参考毒株的核苷酸同源性为97.0%~99.7%,氨基酸序列同源性为97.4%~100.0%。周松峰等[8]通过对PRV gE基因主要抗原表位区(KgE)进行表达,获得了表达量高、免疫原性好的KgE蛋白,为研制灵敏度高、特异性好的胶体金试纸条打下良好基础。张文通等[9]于2013年从使用gE基因缺失疫苗猪场的病料中检测出PRV野毒。笔者对2013年广西地区18个种猪场送检血清进行检测发现,其与广西本地区付薇等[10]报道广西PRV阳性感染率(0.76%)相比较高,也比黄夏[11]2005年对广西部分种猪场检测阳性率(2.74%)高,说明近年来广西地区PRV的野毒感染率呈逐年上升趋势,这也与2011年以来,全国大部分地区PR的发病率升高的情况相符。由于PRV野毒在我国猪场的长期存在,并随着养殖模式、环境因素的变化,增加了PRV野毒株发生变异的可能性,gE基因存在的变异对野毒株与疫苗株的鉴别诊断起到极大作用,因此有必要及时掌握gE基因的变异规律,从而研究广西地区PRV的变异趋势,为预防猪伪狂犬病提供参考。对广西不同地区流行的PRV gE基因进行克隆和序列测定,并与国内外分离的PRV毒株的gE基因进行同源性比对和遗传进化分析,从分子水平上了解广西PRV的流行和亲缘关系以及推测病毒的来源,为制定有效防控猪伪狂犬病的措施和制备合适的疫苗提供科学依据。
1 材料与方法
1.1 材料
1.1.1 样品和试剂 本试验样品为2013年10月~2014年4月间广西南宁、北海和玉林三市送检的疑似伪狂犬病病死猪病料共33份。送检材料为无菌采集有明显病变的脑、脾脏、胰脏和淋巴组织样品。血液/细胞/组织基因组DNA提取试剂盒、DNA Marker DL 2000、琼脂糖凝胶回收试剂盒、高纯度小质粒抽提取试剂盒,为天根生化科技(北京)有限公司产品;M-MLV反转录酶、HIR抑制剂、限制性内切酶EcoR Ⅰ、Hind Ⅲ为宝生物工程(大连)有限公司产品;TransTaqHiFi DNA Polymerase、dNTPs、MgCl2、pEASY-T1载体、Trans1-T1感受态细胞为北京全式金生物技术有限公司产品。
1.1.2 引物 参照GenBank已公布的Ea株、GDSH株等PRV参考毒株的基因组核苷酸序列,应用Primer 5.0软件进行引物设计(表1),包括PRV gE基因的特异性诊断引物(P1/P2)及gE基因的PCR扩增引物(E1/E2),两对引物均由宝生物工程(大连)有限公司合成。
1.2 方法
1.2.1 病毒DNA的提取及PCR反应程序 采用天根血液/细胞/组织基因组DNA提取试剂盒来提取PRV的核酸;PCR反应体系25.0μL:10×TransTaqHiFi buffer(含Mg2+) 5.0μL,2.5mmol/L dNTPs 2.0μL,上、下游引物各0.5μL,TransTaqHiFi DNA Polymerase 0.3μL,cDNA 5.0μL,ddH2O至25.0μL。PCR程序:94℃ 5min;94℃ 50s,65℃ 50s,72℃ 50s,35个循环;72℃ 10min。反应结束后取7.0μL PCR产物用10g/L琼脂糖凝胶进行电泳检测,然后置于凝胶成像系统中观察摄影结果。
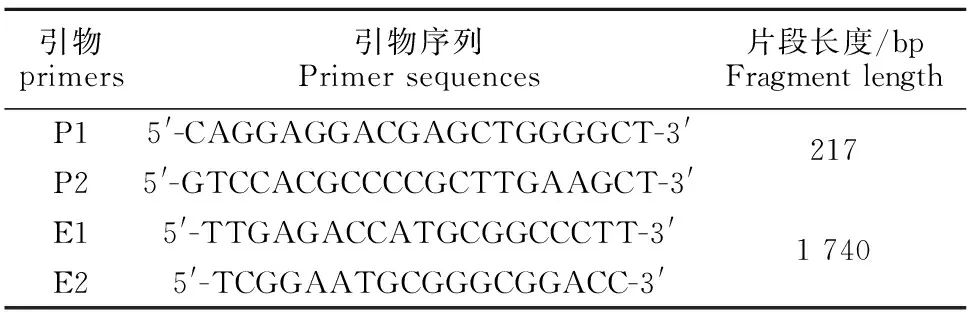
表1 本研究所用引物Table 1 Primers used in this study
1.2.2 gE基因PCR扩增 gE基因的PCR扩增反应体系25.0μL:DNA模板5.0μL,2×GC buffer 12.5μL,2.5mmol/L dNTPs 4.0μL,上、下游引物各1.0μL,TransTaqHiFi DNA Polymerase 0.5μL,MgCl21.0μL。PCR程序:94℃ 5min;94℃ 50s,65℃ 50s,72℃ 90s,35个循环;72℃ 10min。反应结束后,PCR产物用10g/L琼脂糖凝胶电泳检测和回收。
1.2.3 PCR产物回收及测序分析 回收采用天根公司通用型DNA纯化回收试剂盒进行,然后将回收产物与pEASY-T1载体连接,连接体系(5.0μL):胶回收产物4.0μL,pEASY-T11.0μL。将连接产物转化Trans1-T1感受态细胞,然后涂布于LA固体培养基上,37℃培养12h后挑取白色菌落,接种到含有100μg/mL氨苄青霉素(Amp)的LB液体培养基中,37℃摇床培养12h~16h。取1.0mL菌液抽提重组质粒,经酶切及PCR鉴定,挑选阳性质粒送至宝生物工程(大连)有限公司测序。测序结果用Lasergene 7.0软件进行序列拼接,以MegAlign比较分析其与GenBank中下载的参考毒株基因序列及其推导氨基酸序列的同源性,再用MEGA 5.0软件构建基因进化树。
2 结果
2.1 阳性样品的鉴定结果
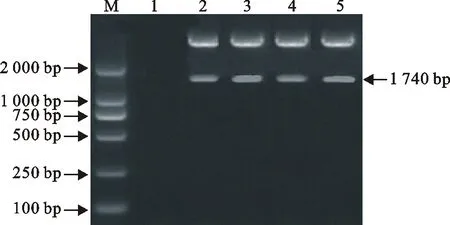
用PRV gE基因的特异性诊断引物(P1/P2)对所收集的33份病料样品进行鉴定,结果发现有4份阳性病料,其余29份为阴性病料。以4份阳性样品作为本试验研究对象,根据来源地不同将其命名为GXNN1、GXBH1、GXYL1和GXYL2(图1)。

M.DNA标准DL 2000;1.阴性对照;2~5.GXNN1、GXBH1、GXYL1、GXYL2
M.DNA Marker DL 2000;1.Negative control;2-5.GXNN1,GXBH1,GXYL1,GXYL2
图1 PRV PCR阳性产物电泳
Fig.1 Electrophoresis of PRV PCR positive products
2.2 gE基因PCR扩增及测序验证
PCR扩增4份猪伪狂犬阳性样品的gE基因,经10g/L琼脂糖凝胶电泳检测,gE基因约1740bp(图2),与预期结果一致。重组质粒pEASY-T1-gE经EcoR Ⅰ和Hind Ⅲ双酶切鉴定,酶切结果出现两条带,与载体带片段大小(约2700bp)及目的基因片段大小(约1740bp)相符(图3)。将阳性重组质粒送至宝生物工程(大连)有限公司测序,测序结果为GXNN1、GXBH1的gE基因全长为1740bp,而GXYL1、GXYL2的 gE基因全长为1737bp。
2.3 gE基因核苷酸序列及其推导氨基酸序列的同源性
由表2可以看出,4株广西流行PRV的gE基因与国内外8株PRV gE基因核苷酸及其推导氨基酸序列同源性分别为97.4%~99.8%和95.0%~99.7%,表明近期广西地区流行的PRV与国内外的PRV毒株之间存在的差异较小。广西地区流行毒
株间gE基因核苷酸同源性达99.5%~99.8%,推导氨基酸序列同源性为98.8%~99.7%,说明广西地区流行毒株间的同源性较高,其gE基因具有严格的保守性(表2)。

M.DNA标准DL 2000;1.阴性对照;2~5.GXNN1、GXBH1、GXYL1、GXYL2
M.DNA Marker DL 2000;1.Negative control;2-5.GXNN1,GXBH1,GXYL1,GXYL2
图2 PRV gE基因的PCR产物电泳
Fig.2 Electrophoresis of PCR products of PRV gE genes
M.DNA标准DL 2000;1.阴性对照;2~5.GXNN1、GXBH1、GXYL1、GXYL2
M.DNA Marker DL 2000;1.Negative control;2-5.GXNN1,GXBH1,GXYL1,GXYL2
图3 重组质粒pEASY-T1-gE的双酶切鉴定
Fig.3 Identification of pEASY-T1-gE by double enzyme digestion
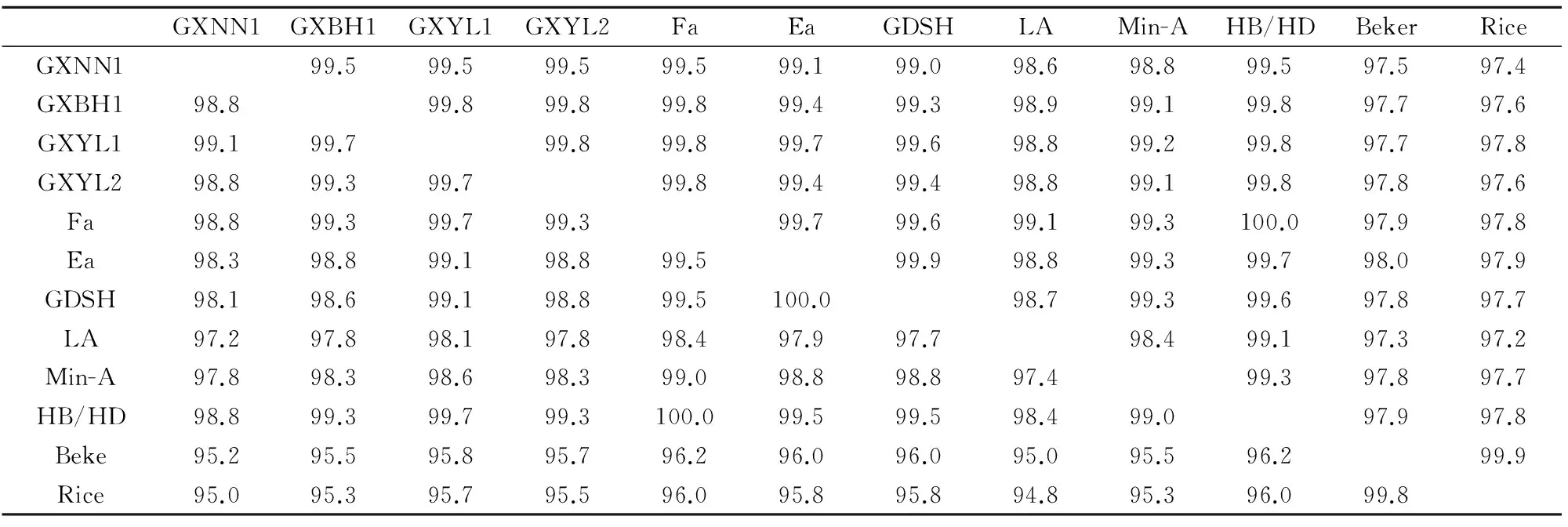
表2 4株广西流行PRV gE基因核苷酸序列及其推导氨基酸序列的同源性Table 2 Homologies of nucleotide and amino acid sequences of gE genes of 4GX strains
2.4 氨基酸变异位点分析结果
将4株广西流行PRV与国内外其他毒株的gE基因编码氨基酸序列进行比对,发现4株PRV gE基因中的2个明显氨基酸变异位点。4株PRV gE基因的48位点氨基酸与国内分离株GDSH、Min-A及国外分离株Beke、Rice相比多了1个天冬氨酸(D)的插入,在核苷酸上的表现为在其142-144位点上连续3个碱基GAC的插入。其中的2株GXNN1、GXBH1与Ea、GDSH、Beke、Rice相比在496位点氨基酸亦增加了1个天冬氨酸(D)的插入,在核苷酸上表现为在1488-1490位点上存在连续3个碱基CGA的插入,与赵鸿远等[12]研究的从吉林和黑龙江分离的2株PRV变异株的gE基因氨基酸变异结果基本一致。
2.5 遗传进化树分析结果
本研究用MEGA 5.0软件分析4株广西地区流行PRV毒株gE基因序列与GenBank上国内外已发表参考毒株的亲缘性与进化关系,并构建遗传进化树。由图4结果表明,广西4株PRV毒株与近年国内分离的毒株ZK、NY、QBA、HNXX、MZ1处于同一分支上,遗传关系较近;与国内经典株Ea、GDSH的遗传关系稍远,而与国外分离株如Yangsan、NiA3、Becker、Rice处于不同的遗传分支上,具有较远的亲缘关系。

图4 基于gE基因的PRV遗传进化树
Fig.4 Phylogenetic tree based on nucleotide sequences of PRV gE genes
3 讨论
目前,关于PRV的分子流行病学调查主要是通过对其全基因或某个特定区域核苷酸序列(如gE基因)及编码氨基酸序列进行测定与变异分析,然后绘制遗传进化树追溯其起源。在众多的病毒蛋白中,gE糖蛋白是其主要毒力因子之一,并作为标志基因用来区分疫苗免疫和野毒感染[13]。本研究结果显示,广西地区流行的PRV与广东Fa株、湖北HD株的gE基因核苷酸的同源性与编码氨基酸序列同源性最高,分别为99.8%和99.7%。可见,广西地区流行PRV毒株随着时间推移,其变异情况并不明显,广西PRV为较保守的毒株,与王仰杰等[14]研究的广西PRV GXBB株的gE基因核苷酸及其推导氨基酸的同源性差异变化趋势基本相同。目前PRV变异株已成为我国主要流行的病毒株,而赵鸿远等[12]研究发现,变异株均在gE蛋白的第48位和第496位各存在1个天冬氨酸的插入,该插入突变可以作为鉴定PRV变异株的分子特征。本试验研究中,4株广西PRV gE基因的48位点氨基酸均多了1个天冬氨酸的插入,其中的2株GXNN1、GXBH1在496位点氨基酸亦增加了1个天冬氨酸的插入。遇秀玲等[15]也发现于北京、山东及河北分离的PRV株在这两个位点附近也各存在1个氨基酸的插入,与本试验的结果相一致。GXNN1、GXBH1与近年国内分离的部分伪狂犬病病毒株如HB-HS、HB-LF、NY、QBA、MZ1在496氨基酸位点相对国外的分离株增加了1个天冬氨酸的插入,在核苷酸上表现为在1488-1490位点上存在连续3个碱基CGA的插入,这一分子特性与An T Q等[16]发现的PRV新毒株氨基酸变异位点具有相似之处,表明广西当前流行的PRV毒株与之前分离的毒株相比,发生了一定程度的变异,广西近期分离的PRV毒株属于PRV变异株。至于这些位点的变异对病毒的毒力及抗原性有何影响,是否为导致目前疫苗免疫失败的原因,仍需进一步研究。
从PRV的遗传进化树可以看出,广西4株PRV毒株与近年国内分离的毒株ZK、NY、QBA、HNXX、MZ1处于同一分支上,遗传关系较近;而与国内经典株Ea、GDSH遗传关系稍远,与国外分离株Yangsan、NiA3、Becker、Rice明显处于不同的遗传分支,具有较远的亲缘关系。与刘芳等[17]研究的广西5株PRV gE基因的进化分析结果基本相同,表明广西近期PRV流行毒株的变异趋势大体一致,与当前我国主要流行的病毒株遗传关系较近。根据遗传进化分析可以发现,本研究的4株毒株GXNN1、GXBH1、GXYL1、GXYL2与国内河南株ZK、NY、QBA、MZ1株处于同一分支上,遗传关系也最为接近,推测本研究的4株PRV流行毒株与河南毒株可能有共同的祖源,这可能与当前频繁的农产品交易有关。因此,要减少和根除PRV,首先要做好本地防疫工作;其次要全面对猪场进行定期的血清学监测,根据监测结果,及时调整免疫计划;最后对于新引进的后备猪及精液必须为来自PRVgE抗体阴性的猪群。
广西地区流行的PRV毒株属于目前我国主要流行的变异株,与国内近期分离的毒株同源性较高,与国外分离株的同源性较低,与河南毒株可能有共同的祖源。gE蛋白第48位和第496位各有1个天冬氨酸的插入,这些分子特征将对变异株的分子流行病学调查提供重要的参考。因此,在今后应进一步研究该变异是否会改变PRV的毒力和抗原性,以更好地对猪伪狂犬病的诊断和防控提供科学依据。
[1] Straw B E,Zimmerman J J,Allaire S D.猪病学[M].9版.赵德明,张仲秋,沈建忠,译.北京:中国农业大学出版社,2008:399-406.
[2] 宋宏晓,李葱晓,王 慧,等.河南省部分地区猪伪狂犬病病毒、猪圆环病毒和猪瘟病毒核酸检测分析[J].动物医学进展,2013,34(2):117-121.
[3] 杨庆芳,宁官保,李俊达.猪伪狂犬病病毒的分离鉴定[J].山西农业科学,2011,39(8):886-889.
[4] Barbara G K,Ralf N,Thomas C M.Pseudorabies virus glycoprotein M inhibits membrane fusion[J].J Virol,2000,74(15):6760-6768.
[5] 白丽丽,王旭荣,刘建营,等.伪狂犬病毒GDSH株的分离鉴定及gE基因的序列分析[J].中国动物检疫,2008,25(1):23-25.
[6] 姚敬明,王娟萍,韩一超,等.猪伪狂犬病病毒gE基因缺失苗免疫试验[J].中国畜牧兽医,2011,38(2):184-186.
[7] 占松鹤,殷冬冬,姜安安,等.猪伪狂犬病毒安徽株gE基因的克隆和序列分析[J].中国动物传染病学报,2013,21(5):63-97.
[8] 周松峰,吴健敏,关忠宜,等.伪狂犬病病毒主要抗原表位基因KgE的表达及纯化[J].动物医学进展,2011,32(11):6-9.
[9] 张文通,魏 凤,李 峰,等.一例猪伪狂犬病的PCR诊断[J].动物医学进展,2013,34(11):122-125.
[10] 付 薇,胡晓静,朱 伟,等.广西猪伪狂犬病毒感染状况调查报告[J].广东畜牧兽医科技,2008,33(6):12-14.
[11] 黄 夏,陆文俊,覃芳云,等.广西部分种猪场免疫猪伪狂犬病野毒感染情况调查[J].广西畜牧兽医,2005,21(5):207-208.
[12] 赵鸿远,彭金美,安同庆,等.猪伪狂犬病病毒变异株的分离鉴定及其gE基因的分子特征[J].中国预防兽医学报,2014,36(7):506-509.
[13] Ferrari M,Brack A,Romanelli M G,et al.A study of the ability of a TK-negative and gI/gE-negative pseudorabies virus (PRV) mutant inoculated by different routes to protect pigs against PRV infection[J].Vet Microbiol,Vet Med B:Infect Dis Vet Public Health,2000,47(10):753-762.
[14] 王仰杰,刘 芳,华 俊,等.猪伪狂犬病病毒GXBB株的分离鉴定及gE基因的克隆分析[J].中国畜牧兽医,2008,35(11):32-34.
[15] Yu X,Zhou Z,Hu D,et al.Pathogenic pseudorabies virus,China,2012[J].Emerg Infect Dis,2014,20:102-104.
[16] An T Q,Peng J M,Tian Z J,et al.Pseudorabies virus variant in Bartha-K61-vaccinated pigs,China,2012[J].Emerg Infect Dis,2013,19(11):1749-1755
[17] 刘 芳,薛 辉,秦树英,等.广西猪伪狂犬病病毒的分离鉴定及gE基因序列分析[J].养猪,2014(5):105-108.
Sequence Analysis of gE Gene of Pseudorabies Virus in Guangxi
QIN Yu-yang1,LI Xue-mei1,MA Jun1,WU Jun1,FENG Shu-ping2,XIONG Yi2,HE Qi-song2
(1.CollegeofAnimalScienceandTechnology,GuangxiUniversity,Nanning,Guangxi,530005,China;2.GuangxiCenterforAnimalDiseasePreventionandControl,Nanning,Guangxi,530001,China)
The gE genes of pseudorabies virus (PRV) in Guangxi were analyzed to understand the genetic variation and the differences with other reference strains,and to provide scientific basis for prevention and control the PR.The gE genes of positive PRV samples collected from various regions of Guangxi were amplified,cloned and sequenced.The nucleotide and amino acid sequences were compared with the other reference strains from GenBank and the phylogenetic tree was constructed.The homologies of nucleotide sequences of Guangxi strains to Fa strain (Guangdong) and HD strain(Hubei) both were 99.8% and amino acid sequences both were 99.7%.The homologies of nucleotide and amino acid sequences of the Guangxi strains were 99.5%-99.8% and 98.8%-99.7% which show that the variations of Guangxi strains were not obvious in genetic levels.Phylogenetic analysis indicated that all the Guangxi strains had a closer relationship with those domestic isolates strains (ZK,NY,QBA,HNXX,MZ1) than that with foreign reference strains (Yangsan,NiA3,Becker,Rice).Guangxi strains and the domestic strains (ZK,NY,QBA,HNXX,MZ1) belong to the same evolution branch but differ with the foreign reference strains (Yangsan,NiA3,Becker,Rice).Insertions of Asp at site 48of gE genes of Guangxi strains and insertions of Asp at site 496of gE genes of GXNN and GXBH1strains suggested that these strains possess the characteristics of the variant PRV strains prevailing in China.Guangxi strains were the major epidemic strains in China and the amino acid insertion would provide important reference for variant stains in molecular epidemiology investigation.
Pseudorabies virus; gE gene; sequence analysis; homology comparison; pig
2014-12-18
广西科技攻关项目(桂科攻0815009-3-7)
覃雨阳(1987-),女,广西贵港人,硕士研究生,主要从事动物传染病与分子病毒学研究。*通讯作者
S855.3;Q785
A
1007-5038(2016)01-0017-05
