尼帕病毒与猪流感病毒双重荧光定量RT-PCR方法的建立
2016-12-16王建华赵祥平董志珍王玉玲张俊哲陈小金王乃福陈本龙
王建华,赵祥平,董志珍,肖 妍,王玉玲,张俊哲,陈小金,王乃福,陈本龙,赵 丹
(天津出入境检验检疫局动植物与食品检测中心,天津 300456)
尼帕病毒与猪流感病毒双重荧光定量RT-PCR方法的建立
王建华,赵祥平*,董志珍,肖 妍,王玉玲,张俊哲,陈小金,王乃福,陈本龙,赵 丹
(天津出入境检验检疫局动植物与食品检测中心,天津 300456)
根据尼帕病毒(NiV)M基因和猪流感病毒(SIV)M基因序列设计引物和TaqMan-MGB探针,通过优化反应条件建立了一种鉴别NiV和SIV的双重实时荧光定量RT-PCR检测方法,对该方法的定量线性范围、敏感性、重复性和特异性进行了评价及初步应用。结果显示,用该方法检测NiV M基因的RNA标准对照(NiV-M-RNA)和SIV M基因的RNA标准对照(SIV-M-RNA),定量线性范围分别为4.6×101copies /μL~4.6×108copies /μL和5.8×101copies /μL~5.8×108copies /μL,检出限分别为46个拷贝和58个拷贝。该方法的组内试验和组间试验的变异系数均小于1.6%,显示其良好的可重复性。该方法仅对NiV-M-RNA和SIV呈现特异性扩增曲线,不与猪瘟病毒(CSFV)、猪流行腹泻病毒(PEDV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪细小病毒(PPV)、猪圆环病毒2型(PCV-2)和伪狂犬病病毒(PRV)发生交叉反应。用该方法对236份猪的鼻拭子样品进行NiV和SIV的同时检测,所有样本的NiV检测结果均为阴性,有1份样本的SIV检测结果为阳性。本研究建立的方法可为猪临床样本中NiV和SIV的鉴别检测提供了一种快速、敏感和特异的技术手段。
尼帕病毒;猪流感病毒;TaqMan-MGB探针;双重荧光定量RT-PCR
20世纪90年代末,在马来西亚确定了一种以侵害人和猪的神经系统和呼吸系统为主要特征的新病毒——尼帕病毒(Nipah virus,NiV)[1]。该病毒的基因组为不分节段的单股负链RNA,全长约18.2kb,含有6个转录单位,依次编码核蛋白(N)、磷蛋白(P)、基质蛋白(M)、融合蛋白(F)、受体结合蛋白(G)和大蛋白(L)等6个结构蛋白[2]。流行病学研究表明,狐蝠是尼帕病毒的自然宿主,尼帕病毒对蝙蝠不致病,对猪有一定的致病性,但对人的致病力很强,病死率可达40%~70%[3]。尼帕病毒可在感染猪体内大量繁殖,病毒血症持续时间较长,通过呼吸道、尿液、粪便等途径向外界散播病原,人类通过与病猪及其样本接触可以感染尼帕病毒[3]。因此,对猪尼帕病毒感染的监测是防控人类尼帕病毒感染的重要措施。在我国的华南地区和东南部沿海岛屿有着广泛的果蝠分布且与人畜有重叠活动范围,因此,在理论上我国存在自然发生人和猪的尼帕病毒感染的可能性[4-5]。猪流感 (Swine influenza,SI)是由猪流感病毒(Swine influenza virus,SIV)引起的一种猪的急性、热性和高度接触性呼吸道传染病,该病不仅给畜牧养殖造成了严重的经济损失,而且具有重要的公共卫生意义[6-8]。SIV属于正黏病毒科A型流感病毒属,为单股负链RNA病毒,其基因组约为13.6kb,由大小不等的8个独立片段组成[6]。在我国猪群中存在H1N1、H1N2、H3N2、H5N1和H9N2等SIV感染,其中以H3N2和H1N1亚型流行和危害比较严重[9-10]。由于猪的尼帕病毒感染与猪流感病毒感染有相似的症状表现,仅凭临床症状无法准确区分这2种动物疫病。在当前我国猪群普遍存在SIV感染的背景下,一旦出现疑似猪尼帕病毒感染疫情时,需要对临床疑似发病猪进行NiV和SIV的鉴别检测,为及早发现和迅速控制猪及人的尼帕病毒感染提供病原学依据。近年来,国内外针对NiV和SIV建立了常规RT-PCR和荧光定量RT-PCR方法[11-14]。本研究以NiV M基因和SIV M基因为靶序列,建立了一种鉴别NiV和SIV的双重荧光定量RT-PCR检测方法。
1 材料与方法
1.1 材料
1.1.1 病毒、菌株及质粒载体 猪瘟病毒(CSFV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪流行性腹泻病毒(PEDV)、猪流感病毒(SIV)、伪狂犬病病毒(PRV)、猪细小病毒(PPV)和猪圆环病毒2型(PCV2)及E.coliDH5α,均由天津出入境检验检疫局动植物与食品检测中心反刍动物检疫国家重点实验室保存;克隆载体PCR2.1为Invitrogen公司产品。
1.1.2 主要试剂 TRIzol LS Reagent 为Invetrogent公司产品;TaKaRa ExTaqRDNA 聚合酶、PstⅠ 限制性内切酶、One Step PrimeScriptTMRT-PCR Kit(Perfect Real Time)为宝生物工程(大连)有限公司产品;质粒快速提取试剂盒为北京庄盟国际生物基因科技有限公司产品;Wizard SV Gel and PCR Clean-Up System 、RiboMAXTMLarge Scale RNA Production System T7为Promega公司产品。
1.1.3 临床样本 总计为236份鼻拭子样品,其中210份样品采自进境隔离检疫期间的美国进口种猪,26份样品采自国内某猪场的育肥猪。
1.2 方法
1.2.1 引物及探针的设计与合成 选取NiV M基因和SIV M基因序列的保守区,用Beacon Designer7.0软件设计分别引物和TaqMan-MGB探针,然后在GenBank数据库(http://www.ncbi.nlm.nih.gov/)上用Blast进行特异性和保守性的比较分析,最终确定的引物和探针序列见表1,预期扩增片段长度分别为70bp和74bp,由上海英骏生物技术有限公司合成,针对NiV M基因的探针序列5′端用FAM标记,3′端用MGB标记,针对NiV M基因的探针序列5′端用VIC标记,3′端用MGB标记。
1.2.2 RNA标准对照的制备 根据NiV UMMC2株的M基因序列(AJ564623)和A/swine/Guangxi/NS1402/2012(H3N2)株(KM028482.1)各自设计4条寡核酸链,用于RNA标准对照的制备,序列见表2。以NIPAH-M -F1/ NIPAH-M -R1为模板、NIPAH-M -F2/ NIPAH-M -R2为引物按常规PCR方法进行扩增,将扩增产物用胶回收试剂盒回收,与PCR2.1克隆载体连接,转化至E.coliDH5α感受态细胞,挑选阳性重组克隆,由上海英骏生物技术有限公司测序鉴定。以经PstⅠ酶切线性化的阳性重组质粒DNA为模板,采用RiboMAX Large Scale RNA Production System-T7试剂盒按说明书进行体外转录,对获得的体外转录产物进行RQ1DNA酶消化及纯化后即制备成含有NiV M基因靶序列的RNA标准对照,命名为NiV-M-RNA。用核酸蛋白分析仪测定NiV-M-RNA的浓度,按公式y(copies/μL)= [x(g/μL)RNA/(transcript length in nucleotides × 340)]×6.02× 1023,换算其拷贝数为4.6×108/μL。以SIV-M-F1/ SIV-M-R1为模板、SIV-M-F2/ SIV-M-R2为引物按常规PCR方法进行扩增,按上述方法同样制备含有SIV M基因靶序列的RNA标准对照,命名为SIV-M-RNA,拷贝数为5.8×108/μL。

表1 用于检测NIV和SIV的引物与探针序列Table 1 Sequences of primers and probes for the detection of NIV and SIV

表2 用于制备RNA标准对照的寡核酸链Table 2 Oligonucleotides for preparation of RNA standard
1.2.3 双重荧光定量RT-PCR反应条件的优化 试验采用One Step PrimeScriptTMRT-PCR Kit(Perfect real-time)试剂,在Light Cycler○R480荧光PCR(Rochi)仪上,在确定对NiV-M-RNA(4.6×106copies/μL)和SIV-M-RNA(5.8×106copies/μL)的单一荧光定量RT-PCR反应的最适引物和探针浓度的基础上,主要对25μL双重荧光定量RT-PCR反应体系下的混合引物和探针浓度,以及56℃~61℃范围内的退火延伸温度做进一步优化试验,以确定最适的反应条件。
1.2.4 标准曲线的绘制 对NiV-M-RNA和SIV-M-RNA进行10倍系列稀释,使其浓度范围分别为4.6×101~4.6×107copies/μL和5.8×101~5.8×107copies/μL。在优化的25μL双重荧光定量RT-PCR反应条件下,对每个稀释度的NiV-M-RNA吸取1μL为模板进行RT-PCR扩增,反应结束后以Ct值为横坐标、NiV-M-RNA模板起始拷贝数浓度的对数为纵坐标绘制定量标准曲线,按同样方法绘制SIV-M-RNA的定量标准曲线。
1.2.5 敏感性、重复性和特异性试验 对浓度范围为4.6×101~4.6×108copies/μL的NiV-M-RNA和5.8×101~5.8×108copies/μL的SIV-M-RNA,分别吸取1μL为模板按优化的双重荧光定量RT-PCR反应条件进行试验,以确定该方法可以检测NiV-M-RNA和SIV-M-RNA的最低拷贝数。对5个浓度的NiV-M-RNA和SIV-M-RNA分别取1μL为模板,分别进行组内试验和组间试验,以确定该方法的重复性。以NiV-M-RNA、CSFV、PRRSV和SIV的基因组RNA以及PRV、PPV和PCV2的基因组DNA为模板,按优化的双重荧光定量RT-PCR反应条件进行检测,以确定该方法的特异性。
1.2.6 临床样本检测 对2012年-2014年保存的210份进口猪和26份国内某猪场猪的鼻拭子样品,用常规的样本处理和Trizol试剂方法提取样品RNA,采用本研究建立的双重荧光定量RT-PCR方法进行NIV和SIV核酸检测,以评价该方法的适用性。
2 结果
2.1 双重荧光定量RT-PCR反应条件的优化
以NiV-M-RNA(4.6×106copies /μL)和SIV-M-RNA(5.8×106copies /μL)为模板,通过对不同浓度组合的引物和标记探针及对56℃~61℃范围的退火延伸温度的优化试验,最终确定的双重荧光定量RT-PCR反应体系为:在25μL反应体系中,依次加入2×One Step RT-PCR bufferⅢ 12.5μL,TaKaRa ExTaqHS (5U /μL) 0.5μL,PrimeScript RT Enzyme MixⅡ 0.5μL,NIPHA-M-F(15pmmol/μL)、NIPHA-M-R(15pmmol/μL)、NIPHA-M-P(5pmmol/μL) SIV-M-F(12pmmol/μL)SIV-M-R(12pmmol/μL)和SIV-M-P(5pmmol/μL)各0.5μL,模板适量,补足水至25μL 。反应参数为:95℃ 2min ;95℃ 10s,56℃ 10s ,60℃ 30s,45个循环;在每次循环的60℃延伸扩增结束前采集FAM通道和VIC通道荧光信号。在最适反应条件下,对4.6×106copies /μL 浓度的NiV-M-RNA和5.8×106copies /μL 浓度的SIV-M-RNA进行扩增,呈现典型的S型荧光定量PCR反应动力学扩增曲线,见图1。
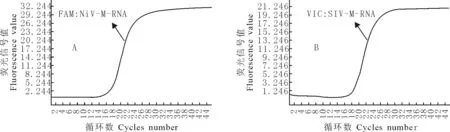
图1 NiV-M-RNA(4.6×106copies /μL) (A)和SIV-M-RNA(5.8×106copies /μL)(B)的双重荧光定量RT-PCR动力学曲线
Fig.1 The duplex real-time PCR dynamic curve of the NiV-M-RNA(4.6×106copies /μL) (A)and SIV-M-RNA(5.8×106copies /μL)(B)
2.2 标准曲线的绘制
对10倍系列稀释的NiV-M-RNA和SIV-M-RNA,按优化后的双重荧光定量RT-PCR反应条件进行检测,扩增曲线见图2A和图2B,以起始模板浓度的对数为X轴,Ct值为Y轴绘制成的标准曲线见图2C图2D。对NiV-M-RNA的定量检测的线性范围为4.6×101~4.6copies/μL×108copies/μL,线性关系表达式为y=-3.417x+37.526,相关系数(R2)为0.9995。对SIV-M-RNA的定量检测的线性范围为5.8×101copies /μL~5.8×108copies /μL,线性关系表达式为y=-3.2618x+37.649,R2为0.9983。
2.3 方法的敏感性
对浓度范围为4.6×101copies /μL~4.6×108copies /μL的NiV-M-RNA和5.8×101copies /μL~5.8×108copies /μL的SIV-M-RNA,按优化后的双重荧光定量RT-PCR反应条件进行检测,扩增曲线见图2A和图2B,由图2可知该方法最低可检出46拷贝数的NiV-M-RNA分子和58拷贝数的SIV-M-RNA分子。
2.4 方法的重复性
分别选取3个浓度的NiV-M-RNARNA (4.6×103copies /μL~4.6×105copies /μL)和SIV-M-RNA (5.8×103copies /μL~5.8×105copies /μL)的标准对照为模板,进行双重荧光定量RT-PCR的组内试验和组间重试验,每个稀释度的Ct值的平均值(Mean±SD)及变异系数(CV)见表3,Ct值变异系数均小于1.6%,表明本试验所建立的双重荧光定量RT-PCR检测体系稳定,具有良好的重复性。
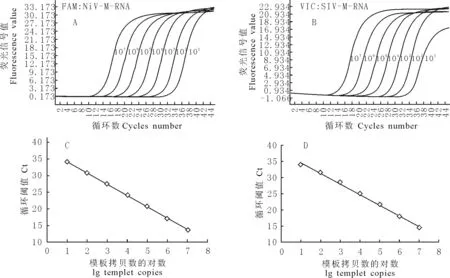
A.NiV-M-RNA(4.6×101copies/μL~4.6×107copies /μL)的扩增曲线;B.SIV-M-RNA(5.8×101copies/μL~5.8×107copies /μL)的扩增曲线;C.NiV-M-RNA(4.6×101copies/μL~4.6×107copies /μL)的标准曲线;D.SIV-M-RNA(5.8×101copies/μL~5.8×107copies /μL)的标准曲线
A.The dynamic curve of NiV-M-RNA(4.6×101copies/μL-4.6×107copies /μL);B.The dynamic curve of SIV-M-RNA(5.8×101copies/μL-5.8×107copies /μL);C.The linear range of NiV-M-RNA(4.6×101copies/μL-4.6×107copies /μL);D.The linear range of NiV-M-RNA(5.8×101copies/μL-5.8×107copies /μL)
图2 NiV-M-RNA和SIV-M-RNA的双重荧光定量RT-PCR的敏感性试验和线性范围
Fig.2 Sensitivity and linear range of the duplex real-time RT-PCR assay for detection of NiV-M-RNA and SIV-M-RNA

表3 双重荧光定量RT-PCR重复性试验结果Table 3 Reproducibility of the duplex real-time RT-PCR
2.5 方法的特异性
应用本试验建立的双重荧光定量RT-PCR方法对NiV-M-RNA、CSFV、PRRSV和SIV的基因组RNA及PRV、PPV和PCV2的基因组DNA进行检测,结果见图3。由图3可知,仅NiV-M-RNA和SIV出现典型的扩增曲线,而CSFV、PRRSV、PEDV和PRV、PPV和PCV-2均无扩增曲线出现,表明该方法检测NiV和SIV核酸有良好的特异性。
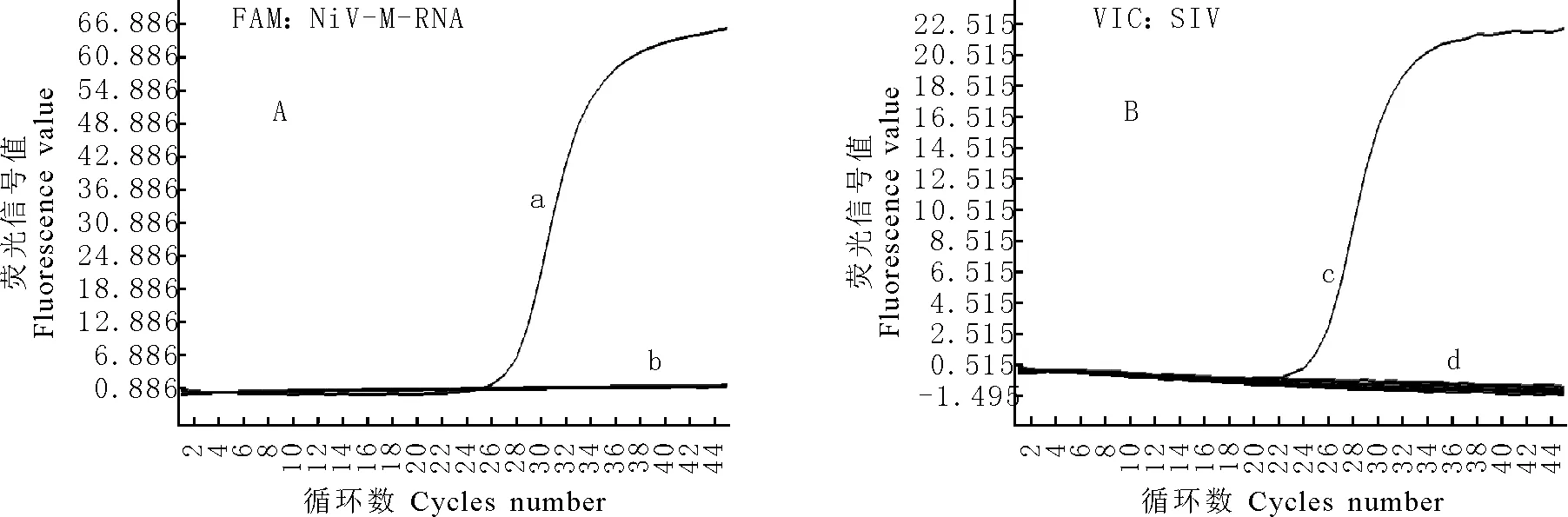
A.NiV-M-RNA的特异性,a.NiV-M-RNA的扩增曲线;b.CSFV、PRRSV、PEDV、PRV、PPV和PCV2的扩增曲线
B.SIV的特异性,c.SIV的扩增曲线;d.CSFV,PRRSV、PEDV、PRV、PPV和PCV2的扩增曲线
A.Specficity of NiV-M-RNA.a.The dynamic curve of NiV-M-RNA; b.The dynamic curves of CSFV,PRRSV,PEDV,PRV,PPV and PCV2
B.Specficity of the SIV.c.The dynamic curve of SIV; d.The dynamic curves of CSFV,PRRSV,PEDV,PRV,PPV and PCV2
图3 双重荧光定量RT-PCR检测NiV-M-RNA和SIV RNA的特异性
Fig.3 Specficity of the duplex real-time RT-PCR for detection of NiV-M-RNA and SIV RNA
2.6 临床样本检测结果
对进口种猪和国内某猪场的猪鼻拭子样品,采用本研究建立的双重荧光定量RT-PCR方法进行NIV和SIV核酸检测,结果210份进口猪鼻拭子样品的NIV和SIV核酸检测结果均为阴性,26份国内某猪场的猪鼻拭子样品(B组)的NIV核酸检测结果均为阴性,其中有1份鼻拭子样品的SIV核酸检测结果为阳性,其余25份样品的SIV核酸检测结果均为阳性。
3 讨论
NiV感染是一种严重危害人类健康和养猪业发展的自然疫源性疾病[1-3],尽管我国目前尚无人和猪的NiV感染的报道,但存在自然发生人和猪的NiV感染疫情的风险[4-5],应引起足够的重视。猪的尼帕病毒感染主要表现为神经症状和呼吸道症状[3],与猪的其他常发传染病如猪流感等具有相似的临床表现,不易从临床症状上加以区分。此外,人通过密切接触感染猪可发生高致死率的NiV感染[1,3],一旦发生猪尼帕病毒感染疫情未被及时发现而扩散的情况,不仅给我国养猪业带来严重冲击,也会给我国社会公众安全带来巨大威胁。因此,建立一种能够快速、敏感和特异地鉴别NiV与SIV方法,对于防范尼帕病毒感染的传入及传播具有重要意义。多重荧光定量PCR方法可同时检测多种病原核酸,具有一次扩增反应就能快速、经济、敏感地鉴别检测多种病原的优点。鉴于此,本研究建立了一种鉴别NiV与SIV的双重TaqMan-MGB荧光定量RT-PCR方法,为临床样本中NiV与SIV的鉴别检测、流行病学调查与监测提供技术手段。
引物及探针序列的特异性及保守性是决定荧光定量RT-PCR方法特异性和准确性的关键因素,本研究对基于NIV M基因和SIV M基因保守性较高的区域设计多套引物和探针,并通过GenBank数据库的Blast序列比对选择特异性及保守性最高的两套引物和探针,其中针对NIV M基因的引物及探针完全覆盖目前已公布的13条NIV毒株序列,尽管SIV存在众多亚型且公布的毒株序列数量巨大,但针对SIV M基因设计的引物及探针仍可覆盖绝大部分SIV毒株,具有很高保守性。特异性试验结果表明,该方法仅对NIV M基因和SIV M基因的RNA标准对照呈现特异性扩增,不与PRRSV、PEDV、CSFV、PRV、PPV和PCV2发生交叉反应,具有良好的特异性。该方法对NIV M基因和SIV M基因的RNA标准对照的定量检测显示良好的线性范围,检出限分别为46个拷贝和58个拷贝,两套引物和探针之间无干扰,而且重复性也很好,批内试验和批间试验的变易系数均小于2.5%。通过体外转录获得病毒RNA模板,是目前在没有病原条件下建立实时荧光RT-PCR方法的常用手段。由于NiV为生物安全4级水平(BSL-4)的病原体,凡是涉及操作NiV活毒的试验活动均须在BSL-4实验室条件下进行。采用寡核苷酸链PCR扩增、PCR产物克隆和DNA体外转录策略,本研究制备了包含靶序列的NIV M基因和NIV M基因的RNA标准对照。用这种方法制备的RNA标准对照具有高稳定性并可以定量,完全可以用于最适引物及探针的筛选、反应条件优化和标准曲线建立等试验。本研究采用的是TaqMan-MGB探针,在保证高退火温度和降低本地荧光反应的条件下,该型探针允许使用较短序列长度的探针,从而可以提高探针对检测靶序列的特异性和保守性。此外,受样本和毒株来源的限制,本研究仅对部分临床样本和毒株进行了检测,需要在今后工作中进一步扩大对临床样本与毒株的检测数量,以期对该方法做进一步的验证和改进。
[1] Escaffre O,Borisevich V,Rockx B,et al.Pathogenesis of hendra and nipah virus infection in humans[J].J Infect Dev Ctries,2013,7(4):308-311.
[2] Liu Qian,Birgit Bradel-Tretheway A,Abrrey I A,et al.Nipah virus attachment glycoprotein stalk C-terminal region links receptor binding to fusion triggering[J].J Virol,2015,89(3):1838-1850.
[3] Luby S P.The pandemic potential of Nipah virus[J].Antiviral Res,2013,100(1):38-43
[4] 张海林.我国蝙蝠携带新发现病毒的研究进展[J].中国媒介生物学及控制杂志,2015(3):223-227.
[5] 仇松寅,林祥梅,刘 建,等.尼帕病毒病的风险分析与防控措施[J].畜牧兽医科技信息,2013(9):7.
[6] 杨 帅,朱闻斐,舒跃龙.猪流感病毒概述[J].病毒学报,2013(3):330-336.
[7] Zu Rongqiang,Dong Libo,Qi Xian,et al.Virological and serological study of human infection with swine influenza A H1N1virus in China[J].Virology,2013,446(1-2):49-55.
[8] Piralla A,Moreno A,Orlandi M E,et al.Swine influenza A(H3N2) virus infection in immunocompromised man,Italy,2014[J].Emerg Infect Dis,2015,21(7):1189-1191.
[9] 陈 樱,於庆雄,银凤桂,等.2009-2013年广西H1N1和H3N2亚型猪流感病毒血清学调查[J].南方农业学报,2015(1):155-159.
[10] 孟慧芝,孙 涛,岳志芹,等.一株H1N1亚型猪流感病毒全基因克隆及遗传特性分析[J].动物医学进展,2015,36(6):48-53.
[11] Guillaume V,Lefeuvre A,Faure C,et al.Specific detection of Nipah virus using real-time RT-PCR (TaqMan)[J].J Virol Meth,2004,120(2):229-237.
[12] Zhang J,Harmon K M.RNA extraction from swine samples and detection of influenza A virus in swine by real-time RT-PCR[J].Meth Mol Biol,2014,1161:277-293.
[13] 刘好朋,胡京京,唐 续,等.H1亚型猪流感病毒一步法实时荧光定量RT-PCR检测方法的建立及应用[J].中国畜牧兽医,2014(11):63-68.
[14] 陈胜锋,徐振娜,王丙云,等.SIV、PCV-2、PRRSV 三重 PCR 检测方法的建立[J].动物医学进展,2013,34(12):42-45.
Development of a Duplex Real-time RT-PCR for the Differential Detection of Nipha Virus and Swine Influenza Virus
WANG Jian-hua,ZHAO Xiang-ping,DONG Zhi-zhen,XIAO Yan,WANG Yu-ling,ZHANG Jun-zhe,CHEN Xiao-jin,WANG Nai-fu,CHEN Ben-long,ZHAO Dan
(AnimalandPlantandFoodInspectionCenterofTianjinEntry-ExitInspectionandQuarantineBureau,Tianjin,300456,China)
By optimization of reacting conditions,a duplexTaqMan-MGB probe real-time RT-PCR was developed with specific primers and probes targeting the Nipha virus(NiV)M gene and swine influenza virus (SIV) M gene.The linear range,diagnostic sensitivity and specificity,inter- and intra-assay variation were evaluated for the assay.The performance of the assay was linear ranging from 4.6×101copies /μL to 4.6×108copies /μL for the RNA standard contol of NiV M (NiV-M-RNA) and from 5.8×101copies /μL to 5.8×108copies /μL for the RNA standard control of SIV M gene (SIV-M-RNA),and detection limits of the assay were 46copies for the NiV-M-RNA and 58copies for the SIV-M-RNA ,respectively,The coefficients of variation (CVs) of both inter-assay and intra-assay reproducibility were less than 1.6%,showing good reproducibility.The assay was capable of NiV and SIV-specific detection without cross-reaction with classical swine fever virus (CSFV),porcine reproductive and respiratory syndrome virus (PRRSV),porcine epidemic diarrhea virus (PEDV),pseudorabies virus(PRV),porcine parvovirus(PPV) and porcine circovirus type 2(PCV2).236samples from pigs tested for both NiV and PRRSV detection by the assay,all the samples were negative for NiV,1was SIV positive.In short,the development of this assay offers a useful approach for the differential detection of NiV and SIV in clinical specimens from the pigs.
Nipha virus; Swine influenza virus;TaqMan-MGB probe; duplex real-time RT-PCR
2015-07-31
天津市滨海新区科技计划项目(2013-BK15H013);天津市科技支撑项目(13ZCZDNCO1300)
王建华(1965-),男,黑龙江林口人,高级兽医师,农学博士,主要从事动物疫病检测与诊断试剂研制。*通讯作者
S855.3
A
1007-5038(2016)01-0011-06
