IL-11调控gp130/JAK2/STAT3信号通路促进Wistar大鼠雪旺细胞中PMP22的表达
2016-12-15郭巍李岩段会全孙超冯世庆徐云强
郭巍,李岩,段会全,孙超,冯世庆,徐云强
(天津医科大学总医院骨科,天津300052)
论著
IL-11调控gp130/JAK2/STAT3信号通路促进Wistar大鼠雪旺细胞中PMP22的表达
郭巍,李岩,段会全,孙超,冯世庆,徐云强
(天津医科大学总医院骨科,天津300052)
目的:探索白介素-11(IL-11)对大鼠雪旺细胞分泌髓鞘蛋白的调节作用及相关机制。方法:取成年Wistar大鼠坐骨神经,分离纯化培养雪旺细胞。加入重组大鼠IL-11,分别采用Realtime RT-qPCR和Western boltting检测雪旺细胞髓鞘蛋白的表达情况,进一步检测IL-11调控髓鞘蛋白表达的相关通路的激活情况。结果:Realtime RT-qPCR和Western boltting结果均提示IL-11可以显著提高雪旺细胞中周围神经髓鞘蛋白22(PMP22)的表达水平,而对雪旺细胞中髓鞘碱性蛋白和髓鞘蛋白零的表达水平则没无明显影响,该生理作用可被JAK特异性抑制剂AG490所抑制。在经过IL-11处理的雪旺细胞中可以观察到pJAK2(Y1007+Y1008)和pSTAT3(Y705)含量明显高于对照组且伴随着gp130表达的上调。结论:IL-11可通过调剂gp/30/ JAK2/STAT3信号通路以促进雪旺细胞中PMP22的表达。
白介素-11;雪旺细胞;周围神经髓鞘蛋白22;JAK2/STAT3信号通路;大鼠
髓鞘为周围神经系统中雪旺细胞(SCs)膜多次缠绕包裹轴突构成的鞘状结构,在神经纤维的跳跃式传导过程中提供绝缘保护作用及结构支持[1]。在脊椎动物中,髓鞘的厚度和所包裹的神经纤维是成比例的,当g比例(轴突直径/有髓神经纤维直径)为0.71时神经的传导速率最高。周围神经脱髓鞘病变或髓鞘形成不良会降低神经纤维的传导速率,常常表现为肌肉无力和感觉缺失等典型临床症状并最终导致进行性的轴突变性[2]。因此SCs形成髓鞘的能力对于周围神经的发育和损伤后的再生过程至关重要[1,3]。SCs形成髓鞘的过程受到多种内源性因素的调节,如细胞外基质蛋白、神经营养因子、细胞因子等,其中以白介素-11(IL-11)和IL-6最为重要[4-5]。研究显示IL-11在周围神经元的发育、分化、再生及变性过程中发挥重要作用[6],并且在周围神经病变患者体内可检测到IL-11 mRNA表达水平的显著提高[7]。大鼠坐骨神经损伤后可以观察到其背跟神经节及损伤远端华勒氏变性部位IL-11含量及其受体表达上调[8]。近期研究表明,IL-11可通过结合gp130参与周围神经的再生过程,并且促进神经元中GAP-43的表达[6],但IL-11在髓鞘形成过程中的作用及相关机制仍有待进一步研究。相关研究证实SCs膜上存在IL-11受体gp130[9],敲除编码白介素家族受体亚单位的gp130基因的小鼠表现出髓鞘退化的现象[10]。这表明IL-11可能通过gp130传递髓鞘形成的相关信号,但其下游效应分子仍有待进一步确认。为进一步阐明IL-11对外周神经髓鞘化的影响,本实验在体外培养的SCs中加入IL-11,检测其对SCs中周围神经髓鞘蛋白22(PMP22)等表达的影响并进一步探索相关机制。
1 材料与方法
1.1 材料及试剂 雌性Wistar大鼠(150~200 g)、重组大鼠IL-11、胎牛血清、DMEM/F12细胞培养基、II型胶原酶、AG490、PD98059兔抗大鼠PMP22、兔抗大鼠MBP、兔抗大鼠MPZ、兔抗大鼠pJAK2、兔抗大鼠pSTAT3、兔抗大鼠GAPDH、羊抗兔HPR、羊抗兔 IgG(Dylight488)、GoScriptTM逆转录试剂盒(Promega)、GoTaq®qPCR试剂盒(Promega)、罗氏LightCycler 480荧光定量PCR仪等。
1.2 方法
1.2.1 SCs培养和纯化 大鼠5只,颈椎脱臼处死后取双侧坐骨神经约1.5 cm,采用酶消化法培养SCs[11]。大致步骤为:解剖显微镜下仔细剥除神经外膜。将神经剪碎,体积约1 mm3。加入II型胶原酶,浓度0.1%,体积约为神经组织体积20倍。在二氧化碳培养箱中充分混合消化35~45 min至无明显组织块。1 000 r/min离心5 min,弃上清。加入含10%胎牛血清的DMEM/F12培养基重悬细胞,轻轻吹打使细胞充分混匀,接种于层黏连蛋白包被的25 cm2细胞培养瓶中,密度为(3.1±0.17)×105个/mL。采用低浓度胶原酶差速消化法提纯SCs[12]。大致步骤为:体外培养48 h后,移除未贴壁的细胞及组织碎片,加入0.05%Ⅱ型胶原酶(0.1 mL/cm2)37℃消化35~40 min后水平轻轻晃动培养瓶使SCs与瓶底分离,收集细胞悬液于15 mL离心管中,1 000 r/min离心5 min,弃上清。加入含有10%胎牛血清的DMEM/F12培养基重悬细胞,接种于培养瓶中,密度为(1.8±0.12)×105个/ mL。48h后,重复上述过程,进行SCs第二次纯化。
1.2.2 S100β染色鉴定SCs 4%多聚甲醛固定细胞30 min,磷酸盐缓冲液(pH=7.4)漂洗3次,每次5 min。加入0.3%Triton X-100透膜。加入兔抗大鼠S100β(1∶200),4℃过夜。磷酸盐缓冲液漂洗3次,每次5 min;加入荧光二抗(羊抗兔IgG,1∶300,Dylight488),室温下避光孵育2 h,磷酸盐缓冲液漂洗3次,每次5 min。DAPI甘油封片。共聚焦显微镜观察及拍照。
1.2.3 Real time RT-qPCR 取纯化后的SCs,将其培养基换为含0.1%FBS的DMEM/F12培养12 h。随后加入相应浓度的IL-11(0、0.5、1.0、1.5 μg/mL)继续培养12 h。Trizol法提取细胞总mRNA,利用GoScriptTM逆转录试剂盒得到cDNA。采用GoTaq® qPCR Master Mix试剂盒和罗氏LightCycler 480荧光定量PCR仪定量分析目的基因的表达量。相应引物序列为:MBP,F:5′-AGAGTCCGACGAGCTTCAG A-3′,R:5′-CAGGTACTTGGATCGCTGTG-3′;MPZ, F:5′-TCTCAGGTCACGCTCTATGTC-3′,R:5′-GCCA GCAGTACCGAATCAG-3′;PMP22,F:5′-CCCAACT CCCAGCCACCA-TG-3′,R:5′-TCATTCGCGTTTCC GCAGGATC-3′;gp130 F:GCCCTTGGGAATGTCTCC TCAGAG R:TCTTCCATATG-AGCCGTGCAGACC GAPDH,F:5′-GTATGTCGTGGAGTCTACTGGCGT-3′, R:5′-TACTCCTTGGAGGCCATGTA-GGCC-3′。各目的基因的表达量由GAPDH基因表达量校准,采用2(-DeltaDeltaC(T))法计算各目的基因的相对含量[13]。
1.2.4 Western blotting 取纯化后的SCs,将其培养基换为含0.1%FBS的DMEM/F12培养12 h进行饥饿处理。随后加入相应浓度的IL-11于细胞培养基中培养12 h。在应用信号通路抑制剂的实验中,分别在加入 IL-11之前 6 h和 2 h用 AG490和PD98059预处理SCs。用含有蛋白酶抑制剂和磷酸酶抑制剂的裂解液裂解细胞。4℃,12 000 r/min离心20 min后取上清液,与上样缓冲液按5∶1混合后100℃变性10 min。10%SDS-PAGE凝胶电泳,每空上样15 μg。电泳完成后,将凝胶上的蛋白电转至PVDF膜上,加入5%的脱脂牛奶室温封闭30 min。随后加入相应的一抗(兔抗,工作浓度1∶3000,4℃过夜)及二抗(HRP标记的羊抗兔IgG,1∶6000,室温1 h)。设GAPDH内参照,洗膜后用ECL化学发光法检测结果,采用Image J凝胶分析软件分析结果。
1.3 统计学处理 SPSS22.0统计软件进行数据处理。Real time RT-qPCR结果和Western blotting灰度值均由GAPDH校正,分析结果均以平均值±标准误表示。各组间数据采用独立样本t检验比较,差异有统计学意义为*P<0.05,**P<0.01。NS,无明显差别。
2 结果
2.1 SCs的观察和鉴定 体外培养的SCs包体呈梭形,向两端发出双极或三级突起。SCs特异性标记物S100β免疫荧光染色显示,经过上述培养和纯化过程,最终SCs的纯度在95%以上。见图1。
2.2 IL-11上调SCs中PMP22 mRNA含量并促进PMP22蛋白表达 在经纯化后得到的SCs的培养基中加入不同浓度的IL-11(0、0.5、1.0、1.5μg/mL),12h后检测SCs中髓鞘碱性蛋白(MBP)、髓鞘蛋白零(MPZ)、PMP22的mRNA和蛋白含量变化。Real time RT-qPCR结果显示与对照组相比经IL-11处理的SCs中MBP和MPZ mRNA的含量并没有明显变化;但当IL-11浓度为1.0 μg/mL和1.5 μg/mL时,可以观察到SCs中PMP22 mRNA含量明显提高(n=3,P=0.002;n=3,P=0.011)(图 2A)。Western blotting结果同样显示当IL-11浓度为1.0 μg/mL和1.5μg/mL时,SCs中PMP22蛋白含量显著升高(n=3, P=0.001;n=3,P=0.001)(图2B)。

图2 IL-11上调SCs中PMP22的表达水平Fig 2 IL-11 up-regulated the expression level of PMP22 in SCs
2.3 JAK2/STAT3通路在 IL-11促进 SCs合成PMP22过程中的重要作用 本研究中分别用JAK抑制剂AG490(50 μmol,6 h)和MAPKK抑制剂PD98059(25 μmol,2 h)预处理SCs,随后再向培养基中加入IL-11(1.0 μg/mL,12 h)。观察SCs中PMP22的表达情况。结果见图3A,Real time RT-qPCR结果提示:PD98059并没有抑制IL-11对SCs中PMP22表达的促进作用,而在经AG490预处理的SCs中,IL-11对PMP22表达的促进作用被显著抑制(n=3,P=0.005);Western blotting(图3B)结果进一步证实AG490可有效抑制IL-11对PMP22表达的促进作用(n=3,P=0.007)。

图3 JAK2特异性抑制剂(AG490)和MAPKK特异性抑制剂(PD98059)对IL-11促进SCs中PMP22表达的影响Fig 3 Effects of JAK2 and MAPK inhibitors on IL-11 induced PMP22 expression
为进一步证实上述结果,本研究检测了IL-11处理过的SCs中pJAK2(Y1007+Y1008)和pSTAT3(Y705)含量的变化。Western blotting结果分析显示与对照组相比经过IL-11(1.0 μg/mL,12 h)处理的SCs中pJAK2和pSTAT3含量明显提高(n=3,P=0.011;n=3,P=0.002),而总JAK2和STAT3含量则无明显变化(图4)。提示IL-11可以通过激活 SCs胞中 JAK2/STAT3通路促进PMP22的合成。
2.4 gp130在IL-11促进SCs中PMP22表达的作用 为了进一步验证IL-11是否也是通过结合gp130来激活JAK2/STAT3信号通路以增强SCs中PMP22的合成,本研究通过Real time RT-qPCR和Western blotting的方法检测经过IL-11处理的SCs中gp130的表达变化。Real time RT-qPCR结果(A)和Western blotting分析结果(B)均显示在经过IL-11处理的SCs中gp130的表达量呈现明显提高(n=3,P=0.001;n=3,P=0.020)(图5)。结果提示,IL-11可通过结合gp130以激活JAK2/STAT3信号通路促进SCs中PMP22的表达。
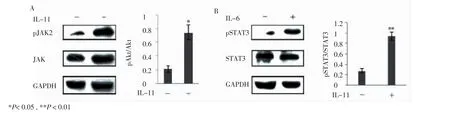
图4 经IL-11处理后,SCs中JAK2和STAT3磷酸化情况Fig 4 Levels of JAK2 and STAT3 phosphorylation examined by Western blotting analysis
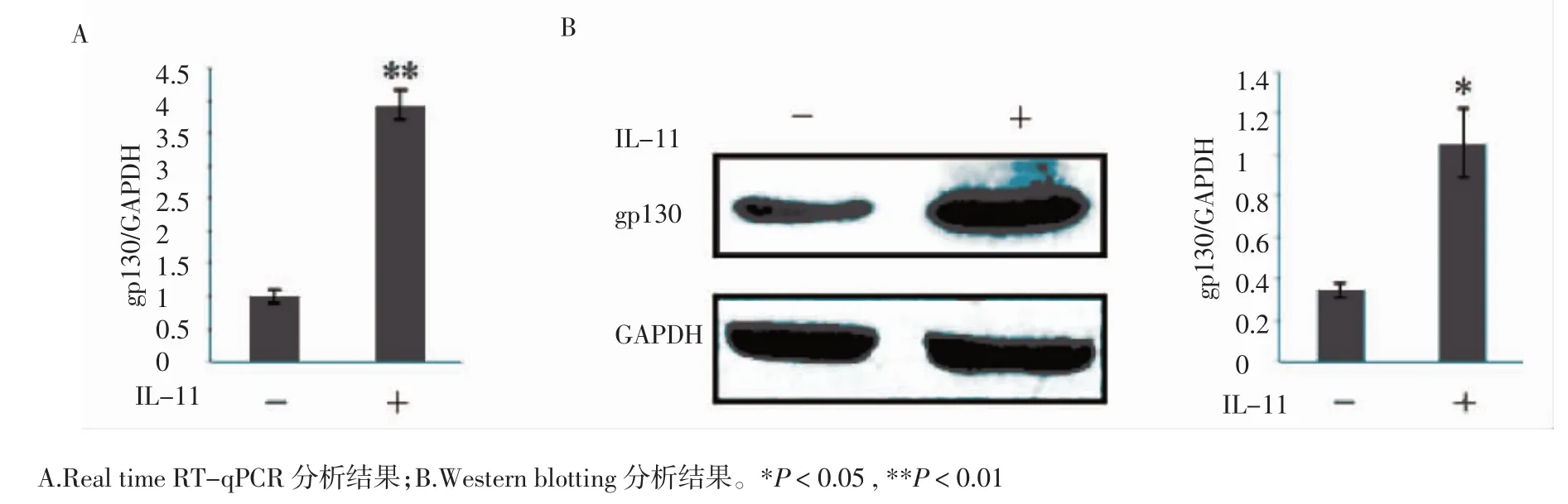
图5 经IL-11处理后SCs中gp130的表达情况Fig 5 The expressional level of gp130 in SCs treated with IL-11
3 讨论
本研究证实,IL-11可以显著提高 SCs中PMP22的表达而对MBP和MPZ的表达无明显作用。在非神经组织中,IL-11主要通过JAK2/STAT3通路和RAS/MAPK通路发挥作用[14-15]。本研究发现IL-11对SCs中PMP22表达的促进作用可被JAK特异性抑制剂AG490所抑制,并且在经过IL-11处理的SCs细胞中pJAK2(Y1007+Y1008)和pSTAT3(Y705)含量明显高于对照组。上述实验结果表明IL-11可通过激活JAK2/STAT3通路上调SCs中PMP22的表达,但IL-11是如何激活JAK2/STAT3信号的具体机制仍不明确。近来有研究表明IL-6家族(包括白血病抑制因子、IL-6、IL-11、抑瘤素M、睫状神经生长因子等)可通过结合其共同受体gp130激活JAK/STAT通路以促进视网膜神经节细胞轴突生长[16]。本实验结果显示经过IL-11处理的SCs中gp130表达明显上调。因此我们认为IL-11可通过结合gp130激活JAK2/STAT3信号通路以促进SCs中PMP22的表达。
PMP22是一种由SCs分泌的糖蛋白四聚体,是构成外周神经髓鞘的重要组成部分。尽管PMP22在髓鞘中含量丰富,但其生理作用尚未完全阐明。作为髓鞘形成过程中的重要部分,小鼠出生后和神经再生的过程中PMP22含量会明显上调[17]。研究显示PMP22基因缺陷与许多遗传性神经系统病变有关,如腓骨肌萎缩症1A型、遗传性压力敏感性周围神经病变等[18]。Amici等[19]研究发现PMP22可与整合α6β4、层粘连蛋白形成复合体参与SCs与细胞外基质的相互作用,敲除IL-11受体gp130基因也将导致小鼠外周神经髓鞘退化[10]。结合以上实验结果可得出IL-11很有可能通过gp130/JAK2/STAT3信号通路调节SCs中PMP22的表达进而形成和稳定外周神经髓鞘。
早期研究证实cAMP和microRNA-29a分别可以在转录层面和转录后层面调节PMP22的表达[20]。但这两种调节过程与本实验结果之间的关系仍有待进一步研究。坐骨神经横断后,背跟神经节中IL-11 mRNA和IL-1的含量在1 d之内快速升高,在随后的1~2周内逐渐降低[8,21];Sheu等[22]发现在神经断端的近端和远端STAT3的磷酸化作用也在1 d之内达到峰值,并且持续时间超过2周;而PMP22 mRNA含量在神经损伤后则迅速下降,1周后逐渐上升[23]。因此IL-11可能是通过gp130/JAK2/STAT3信号通路参与PMP22在外周神经损伤后期表达的上调,但关于外周神经损伤后PMP22表达迅速下降的机制尚不明确。关于IL-11和gp130/JAK2/STAT3信号通路在外周神经再生中的具体作用仍有待进一步研究。
综上所述,本研究证实IL-11可通过gp130/ JAK2/STAT3信号通路调节SCs中PMP22的表达。如果该通路在生物体内的髓鞘形成过程中也具有重要作用,则可将gp130作为药物靶点[24],研制新型药物调控gp130的信号以提高治疗外周神经髓鞘病变的效果。同样,在SCs移植修复神经损伤的治疗中,也可将gp130/JAK2/STAT3作为关键通路,以调控髓鞘的形成。
[1] Nave K A.Myelination and support of axonal integrity by glia[J]. Nature,2010,468(7321):244
[2] Nave K A,Sereda M W,Ehrenreich H.Mechanisms of disease: inherited demyelinating neuropathies-from basic to clinical research[J].Nat ClinPract Neurol,2007,3(8):453
[3] Stassart R M,Fledrich R,Velanac V,et al.A role for Schwann cellderived neuregulin-1 in remyelination[J].Nat Neurosci,2013,16 (1):48
[4] Chen Z L,Yu W M,Strickland S.Peripheral regeneration[J].Annu Rev Neurosci,2007,30:209
[5] Richner M,Ulrichsen M,Elmegaard S L,et al.Peripheral nerve injury modulates neurotrophin signaling in the peripheral and central nervous system[J].Mol Neurobiol,2014,50(3):945
[6] Elsaeidi F,Bemben M A,Zhao X F,et al.Jak/Stat signaling stimulates zebrafish optic nerve regeneration and overcomes the inhibitory actions of Socs3 and Sfpq[J].J Neurosci,2014,34(7):2632
[7] Uceyler N,Riediger N,Kafke W,et al.Differential gene expression of cytokines and neurotrophic factors in nerve and skin of patients with peripheral neuropathies[J].J Neurol,2015,262(1):203
[8] Ito Y,Yamamoto M,Li M,et al.Temporal expression of mRNAs for neuropoietic cytokines,interleukin-11(IL-11),oncostatin M(OSM), cardiotrophin-1(CT-1)and their receptors(IL-11Ralpha and OSMRbeta)in peripheral nerve injury[J].Neurochem Res,2000,25 (8):1113
[9] Ozaki A,Nagai A,Lee Y B,et al.Expression of cytokines and cytokine receptors in human Schwann cells[J].Neuroreport,2008,19 (1):31
[10]Steelman A J,Zhou Y,Koito H,et al.Activation of oligodendroglial Stat3 is required for efficient remyelination[J].Neurobiol Dis, 2016,91:336
[11]Tao Y.Isolation and culture of Schwann cells[J].Methods Mol Biol, 2013,1018:93
[12]Jin Y Q,Liu W,Hong T H,et al.Efficient schwann cell purification by differential cell detachment using multiplex collagenase treatment[J].J Neurosci Methods,2008,170(1):140
[13]Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-DeltaDeltaC(T))Method[J]. Methods,2001,25(4):402
[14]Ernst M,Thiem S,Nguyen P M,et al.Epithelial gp130/Stat3 functions:an intestinal signaling node in health and disease[J]. SeminImmunol,2014,26(1):29
[15]Winship A L,Van Sinderen M,Donoghue J,et al.Targeting interleukin-11 receptor-α impairs human endometrial Cancer cell proliferation and invasion in vitro and reduces tumor growth and metastasis in vivo[J].Mol Cancer Ther,2016,15(4):720
[16]Pernet V,Joly S,Dalkara D,et al.Long-distance axonal regeneration induced by CNTF gene transfer is impaired by axonal misguidance in the injured adult optic nerve[J].NeurobiolDis,2013,51:202
[17]Notterpek L,Snipes G J,Shooter E M.Temporal expression pattern of peripheral myelin protein 22 during in vivo and in vitro myelination[J].Glia,1999,25(4):358
[18]vanPaassen B W,van der Kooi A J,van Spaendonck-Zwarts K Y,et al.PMP22 related neuropathies:Charcot-Marie-Tooth disease type 1A and Hereditary Neuropathy with liability to Pressure Palsies[J]. Orphanet J Rare Dis,2014,9:38
[19]Amici S A,Dunn W A,Murphy A J,et al.Peripheral myelin protein 22 is in complex with alpha6beta4 integrin,and its absence alters the Schwann cell basal lamina[J].J Neurosci,2006,26(4):1179
[20]Verrier J D,Lau P,Hudson L,et al.Peripheral myelin protein 22 is regulated post-transcriptionally by miRNA-29a[J].Glia,2009,57 (12):1265
[21]Saab C Y,Shamaa F,El Sabban M E,et al.Transient increase in cytokines and nerve growth factor in the rat dorsal root ganglia after nerve lesion and peripheral inflammation[J].J Neuroimmunol,2009, 208(1/2):94
[22]Sheu J Y,Kulhanek D J,Eckenstein F P.Differential patterns of ERK and STAT3 phosphorylation after sciatic nerve transection in the rat[J].Exp Neurol,2000,166(2):392
[23]Jung J,Coe H,Michalak M.Specialization of endoplasmic reticulum chaperones for the folding and function of myelin glycoproteins P0 and PMP22[J].FASEB J,2011,25(11):3929
[24]Fischer P,Hilfiker-Kleiner D.Role of gp130-mediated signalling pathways in the heart and its impact on potential therapeutic aspects [J].Br J Pharmacol,2008,153(Suppl 1):S414
(2016-05-11收稿)
IL-11 enhances expression of PMP22 in cultured Schwann cells via gp130/JAK2/STAT3 signaling pathway
GUO Wei,LI Yan,DUAN Hui-quan,SUN Chao,FENG Shi-qing,XU Yun-qiang
(Department of Orthopaedics,General Hospital,Tianjin Medical University,Tianjin 300052,China)
Objective:To examine the effect of IL-11 on the expression of myelin proteins in cultured Schwann cells.Methods:Schwann cells were cultured and purified from sciatic nerves of adult Wistarrats.IL-11 was used to treat purified Schwann cells.The expression level of myelin proteins was examined with Real time RT-qPCR and Western boltting.Results:IL-11 significantly increased the expression level of PMP22 in Schwann cells,but not those of MPZ and MBP.And this effect was significantly inhibited by AG490,anspecificinhibitor of JAK.And the levels of JAK2 and STAT3 phosphorylation were significantly increased in the presence of IL-11 stimulated Schwann cells compared with the absence of IL-11,which was accompanied with the up-regulation of gp130.Conclusion:IL-11 can enhance the production of PMP22 in Schwann cells via gp130/JAK2/STAT3 signaling pathway and thus may contribute to myelination.
interleukin-11;Schwann cells;PMP22;JAK2/STAT3 signaling pathway;rat
R68
A
1006-8147(2016)06-0478-05
郭巍(1989-),男,硕士在读,研究方向:髓鞘再生;通信作者:徐云强,E-mail:docxu@sina.com。
