氨基噻唑酮Cu(II)核酸酶的合成、结构及活性研究
2016-12-15邵佳徐靖源
邵佳,徐靖源
(1.天津市第一中心医院药学部,天津300192;2.天津医科大学药学院,天津市临床药物关键技术重点实验室,天津300070)
论著
氨基噻唑酮Cu(II)核酸酶的合成、结构及活性研究
邵佳1,徐靖源2
(1.天津市第一中心医院药学部,天津300192;2.天津医科大学药学院,天津市临床药物关键技术重点实验室,天津300070)
目的:探究氨基噻唑酮Cu(II)核酸酶的合成、晶体结构及其活性,预期得到一种高效的体外化学核酸酶试剂。方法:利用单晶衍射、琼脂糖凝胶电泳分别确定氨基噻唑酮Cu(II)核酸酶试剂的空间结构及其活性。结果:氨基噻唑酮Cu(II)核酸酶试剂为单斜晶系,空间群为P2(1)/n,由单个[Cu(TZD)Br2](1)(TZD=(Z)-3-methyl-2-((E)-(1-phenylethylidene)hydrazono)-thiazolidin-4-one)单元组成,相比原来配合物[Cu(4ML)Cl],经改造后的1在外界诱导剂的存在下30 μmol/L即可将DNA由Form I完全转变为Form II,核酸酶活性提高10倍以上,核酸酶机制以氧化切割为主。结论:该研究获得一种氨基噻唑酮配体和一个新颖的氨基噻唑酮Cu(II)配合物,并表征其晶体结构,1作为一种高效的核酸酶试剂,其能力比[Cu(4ML)Cl]提高一个数量级,可作为一种潜在的抗肿瘤药物。
氨基噻唑酮;Cu(II)配合物;晶体结构;核酸酶
化学核酸酶的研究是分子生物学科中最为活跃的领域之一,然而合成高效、专一的小分子化学核酸酶仍具有很大挑战性。人工化学核酸酶的性质一般受配体的显著影响。噻唑酮类药物,如吡格列酮、罗格列酮、恩格列酮、环格列酮等在临床中广泛应用于II型糖尿病患者的治疗。此类药物通过激动过氧化物酶体增殖物激活受体γ(PPARγ),以增强糖尿病患者对胰岛素的敏感性。在临床治疗中,研究人员发现使用噻唑酮类药物的糖尿病患者乳腺癌、肺癌等发病率显著降低[1-2]。许多临床前研究也证明噻唑酮类化合物具有潜在的抗肿瘤活性[3-4]。由于噻唑酮类化合物富含S、N等杂原子基团,因此其本身可提供电子与金属离子螯合,自身是一类优良的金属离子螯合剂,有利于化学核酸酶的合成。铜元素作为生命的必需金属元素,在体内许多关键酶,如铜蓝蛋白、细胞色素氧化酶等中发挥着不可替代的作用[5]。另外,铜元素本身具有氧化变价性质,对DNA有一定裂解作用,我们试图将具有潜在抗肿瘤活性的氨基噻唑酮类化合物与铜离子结合,预期得到一种具有潜在抗肿瘤活性的化学核酸酶试剂。
1 材料与方法
1.1 仪器与试剂 Nicolet 380红外光谱仪;Rigaku Saturn X-Ray单晶衍射仪;北京六一电泳仪;4-甲基氨基硫脲(百灵威科技);2-乙酰吡啶(安耐吉化学);氯乙酸(天津市化学试剂六厂);CuBr2(天津市化学试剂六厂);pUC19质粒DNA(TaKaRa)。
1.2 方法
1.2.1 配体TZD的合成 依据实验室前期发表文献[6],将等摩尔比例2-乙酰吡啶(3.03 g),4-甲基氨基硫脲(2.63 g)混合,放入含有乙醇/水(1∶2)60 mL的烧瓶中,回流2 h,TLC监测反应。反应结束后,将淡黄色反应液冷至室温,有黄白色晶体析出,80 mL乙醇重结晶后得到黄白色晶体H4ML。之后,将摩尔比例为1∶1.1∶1的H4ML(2.08 g),氯乙酸(1.04 g)和三乙胺(1.01 g)混合于装有30 mL的甲苯液中,回流1.5 h,停止加热,TLC监测反应,反应步骤如图1。将黄色油状液体减压除去甲苯溶剂后,氯化铵水洗得到粉棕色固体,乙醇50 mL重结晶得粉色片状晶体,冷乙醇淋洗后,过滤干燥得TZD[7]。

图1 配体TZD的合成Fig 1 Synthesis of TZD
1.2.2 配合物[Cu(TZD)Br2]的合成(1) 配体 TZD(0.099 g)、CuBr2(0.089 g)等摩尔比例共置于20 mL甲醇液中,初始浅蓝色浑浊,室温搅拌2 h后,溶液变为深绿色清液,将溶液置于滤纸中过滤,收集深绿色清液,将装有滤液的小烧杯封口并留孔,少量沉淀弃置,3~4 d后,得墨绿色块状晶体,乙醚/乙醇清洗数次,收集晶体。主要红外特征峰(KBr,cm-1): 1 728.7(C=O),1 585.1(C=N),1 366.3(CH3),1 317.6(CH3)。所测元素分析结果(%,括号中为理论值):C28.79(28.01);N11.89(11.88);H2.56(2.56)。
1.2.3 晶体衍射 在收集晶体前,首选透明墨绿色块状晶体置于仪器中,293(2)K,单晶衍射仪衍射光源(λ=0.710 73 Å)为MoKα,晶体衍射数据以ω-2θ扫描方式收集。除氢原子以外原子用SHELXTL软件初步解出坐标位置,利用最小二乘法修正其各向异性热参数,氢原子利用本软件自动加氢。配合物分子式为C11H12Br2CuN4OS,晶体学参数如下:单斜晶系,P2(1)/n空间群,a=9.098 9(18)Å,b=10.259(2) Å,c=16.469(3)Å,R1(I>2σ(I))=0.041。
1.2.4 化学核酸酶活性研究 取适量经高压灭菌的离心管,每管中加入等量pUC19质粒DNA,除第一管作为质控组外,其余各管依次加入递增浓度的铜配合物溶液,均用缓液补齐体积。将此混合液离心混匀,放入37°C恒温水浴锅中,恒温3 h。反应结束后,各管加入一定体积终止剂,离心混匀,将管中液体加入提前半小时预制含有EB的1%琼脂糖凝胶电泳孔槽中,开始电泳,观察指示剂溴酚蓝的前进位置,至琼脂糖凝胶约2/3位置处停止电泳,UVITEC凝胶自动成像仪拍照。一般情况下,DNA片段分子的迁移率[8]为:超螺旋(Form I)>线性(Form III)>开环(Form II)。
2 结果
2.1 合成 结合本实验室前期工作,为进一步提升铜配合物体外化学核酸酶活性,利用H4ML与氯乙酸反应得到氨基噻唑酮类化合物,增加铜离子周围易离去基团,减少配体与金属离子的结合位点。如图2所示配体引入氯乙酸后,原与铜配位的硫原子被烷基占据,配合物由三齿变为两齿配位,配合物分子为保持零价态,需结合两个卤素离子(溴离子)以平衡电位,从而得到预期的配合物[Cu(TZD)Br2]。
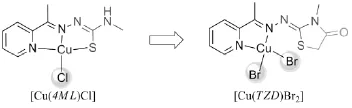
图2 结构变化Fig 2 Structural modifications
2.2 [Cu(TZD)Br2](1)的晶体结构 1为单斜晶系,空间群为P2(1)/n,此结构由单个[Cu(TZD)Br2]单元构成,外围无游离溶剂分子。如图3所示,配体TZD以二齿配位与铜离子螯合,两个溴离子与铜离子配位以保持配合物的零电位。[Cu(4ML)Cl]同样为单斜晶系,但空间群为P2(1)/c。两者的配位构型因引入氯乙酸的缘故,配位构型有所不同,配合物由原来的平面结构,变为现在的非平面结构,经Diamond计算得到的噻唑酮环偏离由吡啶环与N1-C5-C6-N2-Cu1组成的基础平面47.803°。Cu1与两个卤素原子间的距离分别为Cu1-Br1=2.336 6(8)Å和Cu1-Br2=2.344 3(9)Å;Cu1-N1=1.981(3)Å比[Cu (4ML)Cl]中的铜与相应配位氮原子键长(Cu1-N4= 2.015(2)Å)略短,Cu1-N2=2.019(3)Å中的铜与相应氮原子键长(Cu1-N1=1.958(2)Å)略长,这主要由于配体中S原子未参与配位,造成Cu-N键长的改变。配合物1主要键角如表1所示。

图3 配合物1的晶体结构Fig 3 Crystal structure of complex 1

表1 配合物1的主要键角[°]Tab 1 The main angles[°]for 1
2.3 配合物1的化学核酸酶活性 在电场作用下,pH值近中性缓冲液中,超螺旋质粒DNA作为一种带负电的多聚阴离子,由负极向正极移动。DNA在化学核酸酶的作用下,会裂解为不同分子量的DNA片段,如开环DNA、线性DNA等,随着电场强度的增加,DNA片段的迁移速率有所不同,由于凝胶在制备前加入EB荧光染料,EB嵌入到不同分子量的DNA片段(包括超螺旋双股DNA)中,在紫外灯下会产生强烈的荧光,以此观察不同分子量DNA片段的电泳迁移率。在pH为7.2,温度37°C的条件下,反应3 h后,观察1的化学核酸酶活性。

图4 增加配合物1的浓度来观察切割pUC19 DNA的凝胶电泳图Fig 4 Gel electrophoresis diagram showing the cleavage of pUC19 DNA by increasing the concentration of 1
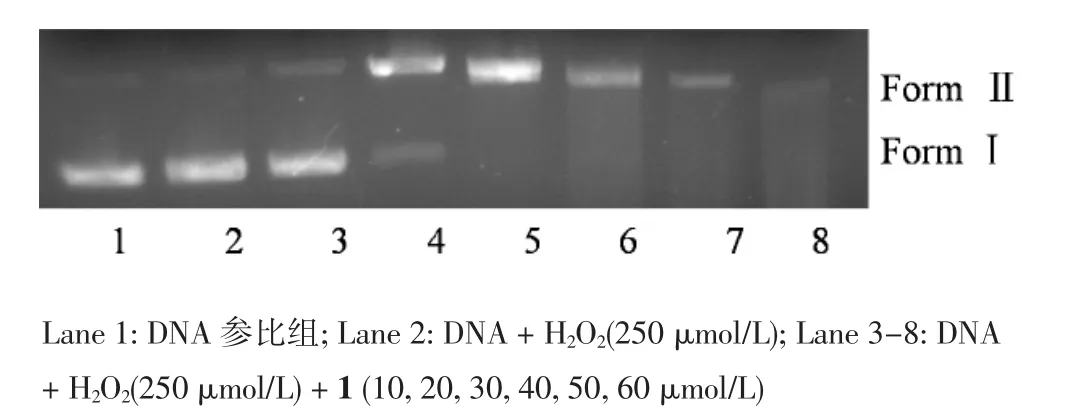
图5 在H2O2的条件下,配合物1切割pUC19 DNA的凝胶电泳图Fig 5 Gel electrophoresis diagrams showing the cleavage of pUC19 DNA with complex 1 with H2O2.
图4示,在没有外加H2O2的情况下,DNA在250 μmol/L的浓度1的作用下,超螺旋结构几乎被破坏,1明显比三齿配位的[Cu(4ML)Cl]核酸酶活性高。在加入H2O2(250 μmol/L)的条件下,1的切割活性进一步提升,在30 μmol/L的浓度下超螺旋DNA完全转化为Form II,通过观察Lane 8发现DNA呈弥散状态,说明在诱导剂存在下,核酸酶活性极强。而[Cu(4ML)Cl]在400 μmol/L的浓度下借助高浓度的H2O2(1.2 mmol/L),才出现与1类似的DNA切割效果。在H2O2存在的条件下,如图5所示,1的切割能力为[Cu(4ML)Cl]的10倍以上。由此可以推得,在相同浓度条件下,改造后的缩氨基硫脲及其衍生物二齿铜配合物比相应三齿铜配合物核酸酶活性高出一个数量级。为了深入探讨1的化学核酸酶机制,选择6种化学核酸酶抑制剂:DMSO(羟基自由基淬灭剂)、SOD(超氧态阴离子自由基淬灭剂)、EDTA(金属离子螯合剂)、KI(H2O2清除剂)、NaN3和L-his(单线态氧抑制剂)来观察对配合物核酸酶活性的影响。如上图6所示,只有Lane 5(SOD)未产生抑制作用,这表明超氧态阴离子自由基在核酸酶活性中不发挥重要作用;Lane 3(DMSO)产生抑制,说明羟基自由基可能在核酸酶活性中起重要作用;Lane 6(EDTA)处发生明显的抑制,表明在金属离子螯合剂EDTA存在下,1对DNA的断裂活性减弱,暗示铜离子在1断裂DNA过程中起重要作用。Lane 4和8都是作为单线态氧(1O2)抑制剂,且都发生了抑制作用,表明1O2在DNA切割过程中发挥着重要作用。
3 讨论
化学核酸酶可以用来模拟天然核酸酶断裂DNA,性质又比天然核酸酶稳定且易于长期保存,是分子生物学家调控DNA的重要手段,有望作为化疗药物用于恶性肿瘤以及遗传疾病的治疗。铜作为一种生命微量元素,在生命体中扮演着重要角色,并且铜配合物本身具有相对水溶性好、配位模式多变、具有氧化还原电位等优点,通常表现出比其它金属配合物更好的化学核酸酶活性,其可以有效地抑制肿瘤细胞增殖,并促使肿瘤细胞凋亡。研究还发现某些铜配合物的抗肿瘤活性优于顺铂类抗癌药物,而且两类金属药物的抗肿瘤机制明显不同,因此,激发了科研工作者们研发更多具有生物功能铜化学核酸酶试剂的研究兴趣,以期望能得到高效、低毒的抗肿瘤药物。
以H4ML为配体的[Cu(4ML)Cl]核酸酶和抗肿瘤活性数据已经整理成文发表在 Journal of Coordination Chemistry中[6]。在前期研究中发现,[Cu (4ML)Cl]体外核酸酶活性不高,只有在高浓度外界诱导剂的存在下(1.2 mmol/L H2O2),才会具有相应核酸酶切割活性。结合本实验室前期工作,本文以氨基噻唑酮为配体,设计得到了[Cu(TZD)Br2]核酸酶试剂,解析其晶体结构,利用琼脂糖凝胶电泳研究了配合物与DNA之间的核酸酶活性。结果显示,1能够将超螺旋双股DNA切割,且其切割DNA的能力比[Cu(4ML)Cl]高出一个数量级,是同浓度下[Cu (4ML)Cl]核酸酶活性的10倍以上。研究结果显示,该配合物是一类高效的体外化学核酸酶试剂,具有成为抗肿瘤药物的潜质,也为研究小分子物质与DNA的相互作用机制提供了重要的信息。
[1] Chen S W,Tsan Y T,Chen J D,et al.Use of thiazolidinediones and the risk of colorectal cancer in patients with diabetes[J].Diabetes Care,2013,36(2):369
[2] Colmers I N,Bowker S L,Johnson J A.Thiazolidinedione use and cancer incidence in type 2 diabetes:a systematic review and metaanalysis[J].Diabetes Metab,2012,38(6):475
[3] Havrylyuk D,Mosula L,Zimenkovsky B,et al.Synthesis and anticancer activity evaluation of 4-thiazolidinones containing benzothiazole moiety[J].Eur J Med Chem,2010,45(11):5012
[4] Gududuru V,Hurh E,Dalton J T,et al.Synthesis and antiproliferative activity of 2-aryl-4-oxo-thiazolidin-3-yl-amides for prostate cancer[J].Bioorg Med Chem Lett,2004,14(21):5289
[5] Wierzbicka D,Gromadzka G.Ceruloplasmin,hephaestin and zyklopen:the three multicopper oxidases important for human iron metabolism[J].Postepy Hig Med Dosw,2014,68:912
[6] Ma Z Y,Shao J,Bao W G,et al.A thiosemicarbazone copper(II) complex as potential anticancer agent[J].J Coord Chem,2015,68 (2):277
[7] Castiñeiras A,García-Santos I,Saa M.Synthesis,structural characterization and properties of the palladium(II)and platinum(II) complexes of 2-{2-[(pyridin-2-yl)aminomethylene]hydrazono}-thiazolidin-4-oneandthe3-methylderivative[J].ZAnorgAllgChem, 2008,634:2281
[8] Shao J,Ma Z Y,Li A,et al.Thiosemicarbazone Cu(II)and Zn(II) complexes as potential anticancer agents:Syntheses,crystal structure,DNA cleavage,cytotoxicity and apoptosis induction activity[J].J Inorg Biochem,2014,136:13
(2016-06-08收稿)
Nuclease of amino-thiazolidinone Cu(II):synthesis,structure and activity
SHAO Jia1,XU Jing-yuan2
(1.Department of Pharmacy,Tianjin First Central Hospital,Tianjin 300192,China;2.School of Pharmacy,Tianjin Medical University, Tianjin Key Laboratory on Technologies Enabling Development of Clinical Therapeutics and Diagnostics,Tianjin 300070,China)
Objective:To study the synthesis,crystal structure and nuclease activity of the amino-thiazolidinone Cu(II)nuclease reagent, and to obtain an efficient chemical nuclease reagent in vitro.Methods:The crystal structure and nuclease acticity of Cu(II)nuclease reagent were discussed by X-ray and agarose gel electrophoresis.Results:The Cu(II)complex was monoclinic,space group P2(1)/n,and it consisted of a[Cu(TZD)Br2](1)(TZD= (Z)-3-methyl-2-((E)-(1-phenylethylidene)hydrazono)-thiazolidin-4-one)unit;the nuclease activity of 1(30 μmol/L)could make most of Form Itransform into Form IIwith inducer,and it was increased over 10-fold compared with[Cu (4ML)Cl];its nuclease mechanism was oxidative cleavage.Conclusion:An amino-thiazolidinone ligand and a novel amino-thiazolidinone Cu(II)nuclease reagent could be acquired.Cu(TZD)Br2capability is on a higher magnitude compared with[Cu(4ML)Cl],which can be used as a potential anti-tumor drug.
amino-thiazolidinone;Cu(II)complex;crystal structure;nuclease
R9
A
1006-8147(2016)06-0474-04
国家自然科学基金资助项目(21371135)
邵佳(1987-),男,博士,研究方向:抗肿瘤药物合成及药理学活性研究;通信作者:徐靖源,E-mail:xujingyuan@tmu.edu.cn。
