大鼠脑缺血再灌注后线粒体损伤及p-STAT3表达
2016-12-15陈爽赵亚倩苟芸黄国伟张绪梅
陈爽,赵亚倩,苟芸,黄国伟,张绪梅
(天津医科大学公共卫生学院营养与食品卫生学系,天津300070)
论著
大鼠脑缺血再灌注后线粒体损伤及p-STAT3表达
陈爽,赵亚倩,苟芸,黄国伟,张绪梅
(天津医科大学公共卫生学院营养与食品卫生学系,天津300070)
目的:研究大鼠脑缺血再灌注后脑组织线粒体中信号转导和激活子3(STAT3)的表达情况,探讨线粒体中磷酸化STAT3(p-STAT3)与脑缺血后线粒体损伤的关系。方法:线栓法制作大鼠脑局部缺血再灌注模型,大鼠随机分为假手术(SHAM)组和大脑中动脉栓塞再灌注(I/R)组。透射电镜观察皮质区神经元内的线粒体损伤情况。Western blotting及免疫荧光双标法检测线粒体中STAT3及p-STAT3表达。结果:与SHAM组比较,大鼠脑缺血再灌注后,皮质区神经元内的线粒体损伤严重;线粒体中存在STAT3表达,且在脑缺血再灌注后表达量无变化,差异没有统计学意义(P>0.05),而p-STAT3表达显著增加,差异具有统计学意义(P<0.05)。结论:STAT3在大鼠脑组织线粒体中表达,脑缺血再灌注后被显著激活,推测脑缺血再灌损伤后,线粒体中STAT3的激活可能参与了脑缺血再灌注病理生理过程中线粒体的损伤和修复。
缺血再灌注;脑组织线粒体;信号转导和转录激活子3;大鼠
脑卒中具有发病率高、致残率高、死亡率高等特点,是一类危害严重的神经系统疾病。研究表明脑缺血再灌注损伤的病理生理机制极为复杂。其中一些信号通路,如Janus激酶-信号转导子和转录激活子(Janus kinase-signal transducer and activator of transcription,JAK-STAT)参与了脑损伤的过程。信号转导和转录激活子 (signal transducer and activators of transcriptions,STATs)是一类可与JAKs信号偶联,与靶基因调控区DNA结合调控转录的胞浆蛋白。目前在哺乳动物中已经发现7种,分别是STAT1、STAT2、STAT3、STAT4、STAT5a、STAT5b和STAT6[1-2]。STAT3是STATs家族的重要成员,大量研究表明脑缺血损伤后,磷酸化 STAT3(phosphorylated STAT3,p-STAT3)在皮质、海马、纹状体等区域的神经细胞核内表达增加[3-4],脑缺血再灌注24h,STAT3基因表达量增加92%[5]。最近研究发现,在心肌、肝脏等组织的线粒体中也存在STAT3表达[6],心肌缺血等损害过程中,它通过作用于线粒体呼吸链复合酶和抑制线粒体膜通透性转换孔的开放而发挥对线粒体的保护作用[7-8]。但大鼠脑组织线粒体中是否存在 STAT3表达以及脑损伤后STAT3活化情况尚不明确,本研究拟采用大鼠局灶性脑缺血再灌注模型,研究脑组织线粒体中p-STAT3及总STAT3在缺血损伤后的表达情况,为研究STAT3在脑缺血损伤中的作用机制提供线索。
1 材料与方法
1.1 实验动物及分组 SPF级雄性SD大鼠40只,体质量180~200 g,由北京维通利华实验动物技术有限公司提供[许可证号:SCXK(京)2012-0001]。动物按体质量分层,再随机分为假手术组(SHAM)、脑缺血再灌注组(I/R),每组20只。大鼠适应1周后造模。再灌注24 h后处死大鼠取材。
1.2 主要试剂 脑组织线粒体提取试剂盒(碧云天生物技术研究所);小鼠抗大鼠STAT3单克隆抗体、兔抗大鼠p-STAT3(Tyr705)单克隆抗体、β-actin购自CST(Cell Signaling Technology)公司,小鼠抗大鼠Cytochrome C单克隆抗体、小鼠抗大鼠SOD2单克隆抗体购自Abcam公司,DAPI(索莱宝生物),FITC标记山羊抗兔IgG、TRICT标记山羊抗小鼠IgG(北京中杉金桥科技有限公司),柠檬酸钠抗原修复液(碧云天生物技术研究所),即用型山羊血清封闭液(博士德生物技术有限公司)。
1.3 实验方法
1.3.1 动物模型的制备 采用改良Longa法[9]制备大鼠大脑局灶性脑缺血再灌注模型。实验动物用标准饲料喂养,自由饮水,适应1周后随机分组,进行造模,腹腔注射10%水合氯醛(0.30 mL/100 g)麻醉大鼠,仰卧位固定,颈部正中纵向切口,逐层分离。暴露左侧颈总动脉(common carotid artery,CCA)和迷走神经。钝性分离CCA和迷走神经。找到左侧颈外动脉(external carotid artery,ECA)和颈内动脉(internal carotid artery,ICA)分叉,分离ECA,ICA,缝线结扎左侧CCA近心端和ECA,以动脉夹夹闭ICA;用1 mL注射器针头于CCA结扎的远心端(距颈总动脉分叉处约2~3 mm)刺一小口入栓塞线,松开ICA动脉夹,调整栓线方向及角度,栓线经颈总动脉进入颈内动脉,遇阻力不能再进为止,插线长度约18~20 mm,缝合线固定栓线,确认无出血后缝合皮肤,缺血1 h时将栓线拔出10 mm,形成再灌注。缺血过程中采用烤灯维持大鼠体温。假手术组除不插栓线外,其余过程同模型组。
1.3.2 脑组织线粒体的提取 按照试剂盒说明书提取脑组织线粒体,取新鲜大鼠脑组织约200 mg,用PBS洗组织1次。将组织置于冰上的玻璃匀浆器中,随后加入10倍体积预冷的线粒体分离试剂A(临用前加PMSF),在冰上进行匀浆,匀浆10次左右。获得的匀浆在1 000×g,4℃离心5 min。然后把上清液转移到另一离心管,在3 500×g,4℃离心10 min。随即获得的上清为除线粒体的细胞浆蛋白,沉淀即为分离得到的线粒体。
1.3.3 线粒体超微结构观察 再灌注24 h,每组随机取3只大鼠断头取脑,置于冰上,分离出梗死侧皮层,将皮层切成1 mm3的小块,迅速置于2.5%戊二醛中固定过夜,1%锇酸后固定,磷酸盐缓冲液冲洗漂洗,酒精和丙酮梯度脱水后,环氧树脂包埋,半薄切片选区,超薄切片,再经醋酸和柠檬酸铝双重染色后于透射电子显微镜下观察脑神经细胞及线粒体的损伤情况,并拍照。
1.3.4 线粒体损伤评分 通过基于线粒体的超微结构特征的评分系统进行线粒体损伤程度评估[10](表1)。对于每个样本,从两个不同的网格,随机选择3个相隔较远的区域进行线粒体超微结构观察。选择2位观察者进行盲法评分,线粒体超微结构损伤严重程度的量化通过确定一个总分,最后每组线粒体损伤程度得分取两位观察者得分的均值。
1.3.5 Western blotting检测线粒体蛋白纯度 提取脑组织线粒体蛋白,用BCA法进行蛋白定量。线粒体蛋白纯度检测方法参照之前的研究[6],Western blotting检测逐渐递增量的线粒体蛋白中的STAT3,β-actin,Cytochrome C的含量。

表1 基于细胞损伤阶段的线粒体评分[10]Tab 1 Mitochondrial injury scoring system based on the stages of cellular injury
1.3.6 Western blotting检测磷酸化 STAT3及总STAT3表达 取各组线粒体蛋白20 μg,进行SDSPAGE电泳,湿转法将蛋白质转移至NC膜,5%BSA室温封闭1 h后,分别加入一抗(p-STAT3 1∶2 000,STAT3 1∶2 000),4℃孵育过夜,TBST洗膜3次,加入HRP标记的二抗,室温孵育1 h,TBST洗膜3次,用化学发光底物试剂呈色,蛋白条带用ImageJ 2.0软件进行定量分析。
1.3.7 免疫荧光双标法检测脑缺血再灌注后线粒体中磷酸化STAT3表达 石蜡切片脱蜡、水化、3% H2O2室温封闭10 min、柠檬酸钠-EDTA抗原修复、山羊血清37℃封闭30 min~1 h、滴加一抗(p-STAT3 1∶100,SOD2 1∶100)4℃孵育过夜。PBS洗3次,滴加荧光二抗混合液(山羊抗兔FITC 1∶100,山羊抗小鼠TIRTC 1∶100)25℃避光孵育1 h,抗荧光衰减猝灭剂封片。阴性对照片不加一抗,采用PBS代替,其余步骤相同。荧光倒置显微镜(Olympus BX51,日本)拍片,图像结果采用Image-Pro-Plus6.0软件进行分析。
1.4 统计学处理 应用SPSS 19.0统计软件对数据进行统计学处理,以±s表示,两组间比较采用t检验,P<0.05表示差异有统计学意义。
2 结果
2.1脑缺血再灌注后线粒体超微结构的变化 SHAM组神经元细胞核核膜清晰完整,染色质呈颗粒状,均匀分布在细胞核中,胞浆中线粒体呈椭圆形或杆状,大小正常,嵴结构清晰,排列整齐有序,基质浓密。I/R组胞浆中线粒体肿胀,嵴断裂,排列不整齐,甚至出现空泡化,见图1。

图1 大鼠脑缺血再灌注24 h后线粒体电镜观察Fig 1 Cerebral mitochondria in rats observed by electromicroscopy at 24 h after ischemia-reperfusion
2.2 脑组织线粒体损伤评分 SHAM组:(0.16±0.11)分,I/R组:(2.33±0.58)分,两组比较差异有统计学意义(P<0.05)。
2.3 线粒体蛋白的纯度验证 β-actin主要存在于胞浆蛋白中,在线粒体蛋白中,β-actin的含量极少,如果线粒体蛋白中含有胞浆蛋白,总STAT3与β-actin比值应该接近1,本文结果显示在提取的脑组织线粒体蛋白中,STAT3与β-actin的比值为11~18,故所提线粒体蛋白纯度较高。STAT3与β-actin,Cytochrome C检测结果见图2。

图2 脑组织线粒体蛋白纯度检测Fig 2 The detection of the cerebral mitochondrial purity
2.4脑缺血再灌注后线粒中p-STAT3与总STAT3的表达水平 脑缺血再灌注后,线粒体中STAT3的活性与SHAM组相比显著升高,差异有统计学意义(P<0.05)。此外总STAT3两组间比较差异无统计学意义(P>0.05)。见图3A、3B。

图3 大鼠脑缺血再灌注后线粒体中p-STAT3和总STAT3的表达Fig 3 The protein expressions of phosphorylated and total STAT3 in the mitochondria of rat brain after ischemia-reperfusion
2.5 脑缺血再灌注后皮质区线粒体中p-STAT3表达情况 SOD2是免疫组化中识别脑组织线粒体的特异性标记物。SOD2与p-STAT3免疫荧光双标记结果显示,患侧皮质区SOD2与p-STAT3双标阳性数显著增加(图4),说明梗塞可导致皮质区线粒体中p-STAT3表达升高。
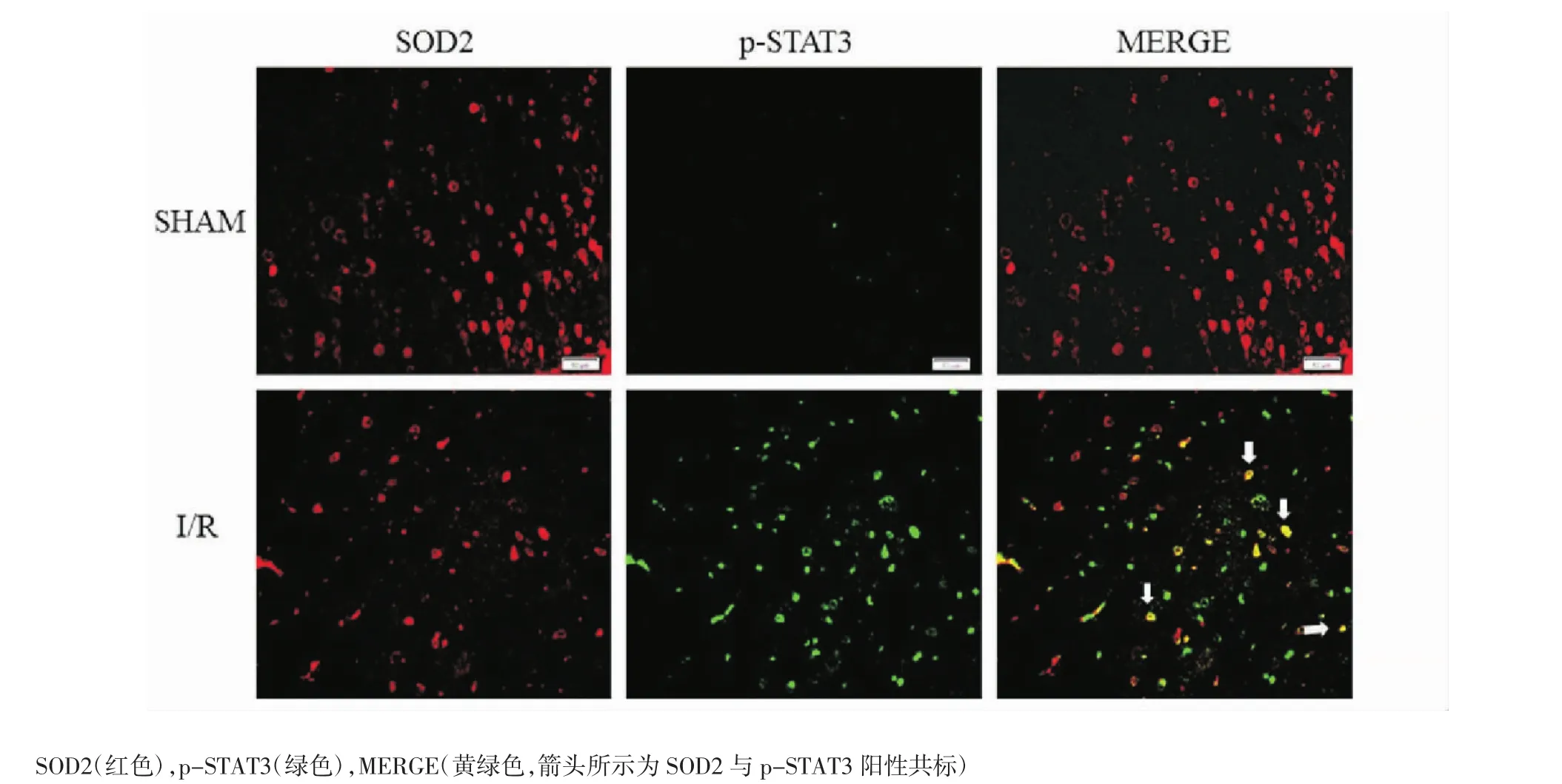
图4 脑缺血再灌注后线粒体中p-STAT3表达情况Fig 4 The expressions of mitochondrial p-STAT3 after cerebral ischemia-reperfusion
3 讨论
脑缺血再灌注损伤是一个复杂的病理过程,包括诸多环节如自由基生成、能量障碍、细胞酸中毒、兴奋性氨基酸释放增加、细胞内钙稳态失调、凋亡基因激活等的级联反应,这些环节互为因果,彼此重叠,并互相联系,形成恶性循环,最终导致细胞凋亡或细胞坏死性死亡[11-12]。研究表明,线粒体是缺血后细胞凋亡及细胞坏死性死亡的关键靶区,也是神经细胞存活的关键因素[11]。脑缺血再灌注通过各种途径造成线粒体结构和功能异常,进而导致线粒体数量减少以及功能障碍,最终诱发神经细胞凋亡或坏死性死亡。因此,研究脑缺血再灌注后线粒体损伤及功能障碍的机制,可能会给缺血性脑病的治疗提供新思路。
以往大量研究证据表明,STAT3作为一种信号传导和转录因子,能够调节细胞增殖、分化和存活等重要生物学效应[2,13]。在脑缺血再灌注模型研究中,亦发现在不同脑区域神经细胞核中p-STAT3的表达显著增加,且抑制p-STAT3的表达对脑缺血损伤起到一定的保护作用[14-15]。然而,目前关于大鼠脑组织线粒体中是否存在STAT3及在脑缺血损伤后其表达是否发生变化尚未见文献报道。本研究发现,大鼠脑组织线粒体中存在STAT3的表达,脑缺血再灌注损伤对线粒体中总STAT3蛋白水平无影响,但可显著上调线粒体p-STAT3的表达及其磷酸化活性(p-STAT3/STAT3)。同时观察到脑缺血损伤后,脑组织中线粒体发生明显损伤,故推测脑组织线粒体中p-STAT3表达的升高可能与线粒体本身的损伤有关。研究p-STAT3在线粒体中的表达变化,为脑缺血损伤病理机制的研究提供了新的线索,也对STAT3信号通路作为非转录因子的功能有了更深入的认识。
既往已有报道显示:STAT3存在于大鼠的心脏及小鼠的肝脏等组织的线粒体内。如在心肌缺血过程中,线粒体中p-STAT3能够维持线粒体复合物Ⅰ的活性,并减少ROS的产生,起到保护心肌的作用[16],此外STAT3活性(p-STAT3/STAT3)的下调会导致线粒体呼吸链复合物Ⅰ、Ⅱ、Ⅲ和Ⅴ活性的降低,使活性氧水平升高,ATP能量合成减少,进而诱导心肌细胞的凋亡和(或)细胞坏死[17]。故心肌线粒体内的p-STAT3可通过直接作用于线粒体呼吸链复合物,降低活性氧的生成,对线粒体及缺血心肌起到保护作用[16,18]。由于pSTAT3所执行的具体功能与其所在的组织及细胞种类密切相关,故脑缺血再灌注后线粒体STAT3的激活是否通过调控复合酶的活性或ROS的生成对线粒体的损伤造成影响,尚有待于进一步研究。
综上所述,大鼠脑组织中存在STAT3,并且脑缺血再灌注后线粒体中p-STAT3表达水平显著升高,线粒体中STAT3磷酸化水平的升高可能与脑缺血后线粒损伤有关。研究将为磷酸化STAT3在脑缺血后线粒体中的具体作用机制的探讨及脑缺血再灌注病理过程的研究奠定基础。
[1]张克英,唐君,方相春,等.JAK-STAT信号转导通路在神经系统疾病中作用的研究进展[J].神经解剖学杂志,2014,30(2):237
[2]赵金兵,杭春华.JAK-STAT通路及其在神经系统疾病中的研究进展[J].中华神经外科疾病研究杂志,2011,10(4):379
[3] Justicia C,Gabriel C,Planas A M.Activation of the JAK/STAT pathway following transient focal cerebral ischemia:signaling through Jak1 and Stat3 in astrocytes[J].Glia,2000,30(3):253
[4]李洪春,张光毅.脑缺血大鼠海马信号转导与转录激活子-3的激活及其调控(英文)[J].生理学报,2003,55(3):311
[5]方舒东,姜虹,朱也森.全脑缺血-再灌注鼠STAT3基因的表达[J].临床麻醉学杂志,2008,24(1):52
[6] Wegrzyn J,Potla R,Chwae Y J,et al.Function of mitochondrial Stat3 in cellular respiration[J].Science,2009,323(5915):793
[7] Szczepanek K,Xu A,Hu Y,et al.Cardioprotective function of mitochondrial-targeted and transcriptionally inactive STAT3 against ischemia and reperfusion injury[J].Basic Res Cardiol,2015, 110(6):53
[8] Szczepanek K,Chen Q,Larner A C,et al.Cytoprotection by the modulation of mitochondrial electron transport chain:the emerging role of mitochondrial STAT3[J].Mitochondrion,2012,12(2):180
[9] Longa E Z,Weinstein P R,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke, 1989,20(1):84
[10]Crouser E D,Julian M W,Blaho D V,et al.Endotoxin-induced mitochondrial damage correlates with impaired respiratory activity [J].Crit Care Med,2002,30(2):276
[11]李强,翟宇,张婷,等.脑缺血再灌注后线粒体氧化应激损伤的动态变化[J].中国临床神经科学,2014,22(3):241
[12]王玉梅,商亚珍.线粒体与脑缺血再灌注损伤的关系[J].承德医学院学报,2009,26(4):430
[13]Li Q,Zhang R,Guo Y L,et al.Effect of neuregulin on apoptosis and expressions of STAT3 and GFAP in rats following cerebral ischemic reperfusion[J].J Mol Neurosci,2009,37(1):67
[14]韦家俊,廖小明,王耀辉,等.JAK2/STAT3信号转导通路在大鼠脑缺血再灌注损伤中的作用[J].临床神经病学杂志,2015,28(4): 281
[15]Satriotomo I,Bowen K K,Vemuganti R.JAK2 and STAT3 activation contributes to neuronal damage following transient focal cerebral ischemia[J].J Neurochem,2006,98(5):1353
[16]Szczepanek K,Chen Q,Derecka M,et al.Mitochondrial-targeted Signal transducer and activator of transcription 3 (STAT3)protects against ischemia-induced changes in the electron transport chain and the generation of reactive oxygen species[J].J Biol Chem,2011, 286(34):29610
[17]张明,魏瑾,潘晓青,等.低硒大鼠心肌线粒体STAT3的活性变化及其与心肌损伤的关系[J].南方医科大学学报,2013,33(7): 967
[18]Heusch G,Musiolik J,Gedik N,et al.Mitochondrial STAT3 activation and cardioprotection by ischemic postconditioning in pigs with regional myocardial ischemia/reperfusion[J].Circ Res,2011, 109(11):1302
(2016-05-07收稿)
Mitochondrial damage and p-STAT3 protein expression following focal cerebral ischemia-reperfusion in rats
CHEN Shuang,ZHAO Ya-qian,GOU Yun,HUANG Guo-wei,ZHANG Xu-mei
(Department of Nutrition and Food Hygiene,School of Public Health,Tianjin Medical University,Tianjin 300070,China)
Objective:To assess the expression and activation of signal transducer and activator of transcription 3 (STAT3)in mitochondria of rat brain cortex,and explore the role of phosphorylated STAT3 (p-STAT3)in mitochondrial injury and repair following cerebral ischemia-reperfusion.Methods:The model of focal cerebral ischemia-reperfusion was established by suture method.The rats were randomly divided into the sham-operated(SHAM)group and the middle cerebral occlusion-reperfusion(I/R)group.The ultrastructure of cortex mitochondria was observed under transmission electronic microscope.The expressions of total STAT3 and p-STAT3 were detected by western blotting and immunofluorescent double-staining.Results:A significant mitochondrial ultrastructural injury was found in I/R group,compared with the SHAM group.STAT3 immunoreactivity was observed in the mitochondria of rat brain cortex.No significant difference in total STAT3 level was detected in both experimental groups(P>0.05),whereas the level of p-STAT3 in the mitochondria of brain cortex was elevated after ischemia injury(P<0.05).Conclusion:STAT3 localizes in mitochondria.The activity of mitochondrial STAT3 is elevated during cerebral ischemia-reperfusion.STAT3 activation may be involved in mitochondrial injury and repair in the pathophysiological process of cerebral ischemia-reperfusion injury.
ischemia-reperfusion;cerebral mitochondria;signal transducer and activator of transcription 3;rat
R743.3
A
1006-8147(2016)06-0469-05
国家自然科学基金资助项目(81373003);中国博士后科学基金资助项目(2014M550148)
陈爽(1990-),女,硕士在读,研究方向:营养与神经退行性疾病;通信作者:张绪梅,E-mail:zhangxumei@tijmu.edu.cn。
