宫颈腺癌细胞中HPV18-E7与上皮间质转化的关系研究
2016-12-15米合日尼沙买买提阿比丹吐尔汗江韩莉莉
米合日尼沙·买买提,阿比丹·吐尔汗江,韩莉莉
(新疆维吾尔自治区人民医院妇科,乌鲁木齐830000)
论著
宫颈腺癌细胞中HPV18-E7与上皮间质转化的关系研究
米合日尼沙·买买提,阿比丹·吐尔汗江,韩莉莉
(新疆维吾尔自治区人民医院妇科,乌鲁木齐830000)
目的:探究宫颈腺癌细胞中HPV18-E7与上皮间质化(EMT)之间的关系。方法:针对HPV18-E7的siRNA转染入人宫颈腺癌HeLa细胞,观察细胞形态变化,并运用Real-time PCR技术、免疫印迹实验和细胞免疫荧光染色实验在mRNA水平和蛋白水平检测E7、EMT相关的标记因子的表达及定位变化;应用细胞划痕愈合实验及Transwell细胞体外侵袭实验检测细胞迁移和侵袭能力。结果:特异性沉默HPV18-E7表达后HeLa-SIE7细胞间连接变得疏松,细胞中E7与间质性标记物的mRNA及蛋白表达水平较对照组细胞显著下降,上皮性标记因子较对照组细胞明显增加(P<0.01);随着HeLa细胞E7表达的下调,E-cadherin在细胞膜上的表达增加,间质性标记因子在细胞质内的表达随之下降。HeLa-SIE7细胞迁移及侵袭能力明显低于对照组(P<0.01);沉默HPV18-E7表达的HeLa细胞其增殖能力也明显减弱。结论:宫颈腺癌细胞中HPV18-E7能够引起EMT,促进肿瘤发生侵袭转移。
宫颈腺癌;上皮-间质转化;HPV18-E7
宫颈癌是女性生殖系统常见的恶性肿瘤之一。在发展中国家,由于高危型人乳头瘤病毒(human papilloma virus,HPV)感染增多、筛查程序混乱,宫颈癌的发病率和病死率增加并出现年轻化倾向[1]。目前,虽然早期筛查和手术联合放化疗的防治模式已有效改善早期宫颈癌的预后,然而对于发生宫旁浸润和远处转移的宫颈癌的治疗和预后的改善仍是棘手问题[2]。因此寻找肿瘤进展过程中的关键因子有助于我们建立肿瘤进展的预测体系,开展个体化诊治和靶向干预,从而为晚期宫颈癌患者争取治疗时机、改善预后。上皮-间质转化(Epithelial to Mesenchymal Transition,EMT)是指上皮细胞失去极性及细胞间连接,获得浸润迁移的能力,成为具有间质细胞形态和特性的细胞[3]。目前越来越多的研究证实EMT是肿瘤进展及发生侵袭转移的重要过程[4]。近年来,在宫颈癌中也有研究证实其浸润转移过程与EMT相关[5]。目前没有文献证实宫颈癌最主要的病因HPV感染与EMT的具体关系。直到2009年及2013年分别在人正常上皮细胞及鼻咽癌细胞中有研究指出HPV16-E6/E7能够诱导EMT[6-7],但是这些研究只是简单的证明HPV16-E6/E7可以诱导EMT,并没有指出其诱导EMT后是否会促进肿瘤的侵袭转移。关于宫颈腺癌的最重要致癌基因HPV18-E6/E7至今仍无相关研究。为此,本研究以HPV18型阳性的宫颈腺癌细胞HeLa为基础,用针对HPV18-E7的小干扰RNA特异性的沉默E7的表达,运用实时定量PCR,免疫印迹实验,细胞免疫荧光技术,细胞划痕愈合实验,Transwell细胞体外侵袭实验及检测EMT特异性标记因子的表达及定位变化,观察其细胞迁移、侵袭能力,从而探索HPV18-E7与EMT的关系。
1 材料与方法
1.1 实验材料
1.1.1 细胞来源 HPV18阳性的宫颈癌HeLa细胞购自美国ATCC公司。
1.1.2 主要试剂 LipofectamineTM2000(Invitrogen,美国);逆转录酶试剂盒(Fermentas公司,美国);Realtime PCR Master Mix(TOYOBO,日本);HPV18-E7单克隆抗体(Santa Cruz Biotechnology,Inc.公司,美国);E-cadherin单克隆抗体(EPITOMICS公司,美国);Vimentin多克隆抗体(Proteintech公司,中国武汉);N-cadherin单克隆抗体(EPITOMICS公司,美国);FN1多克隆抗体(Proteintech公司,中国武汉);GAPDH单克隆抗体(Anbo biotechnology,美国);小干扰RNA(siRNAi)由广州市锐博生物科技有限公司设计合成;引物由上海英骏公司合成。
1.2 实验方法
1.2.1 细胞培养与转染
1.2.1.1 细胞培养:用含10%胎牛血清的DMEM完全培养基培养人宫颈癌细胞系HeLa细胞,倒置显微镜下观察细胞的状态,按照细胞密度、状态及实验安排进行具体操作。一般2 d换液1次,4 d传代1次。处理后的细胞放置于37℃、含5%CO2的恒温细胞培养箱中进行培养。
1.2.1.2 siRNA的转染:待处于对数生长期且状态良好的HeLa细胞密度达到80%时用上述细胞传代的方法以每孔1×106个细胞接种于6孔板中进行培养。孔板中细胞汇合度达40%~50%面积时,分别用SIE7及对照SINC转染HeLa细胞,具体操作步骤按照脂质体lipofectamine2000及siRNA使用说明书进行。
1.2.2 Real-time PCR检测mRNA的表达 Trizol法提取细胞总RNA,将mRNA逆转录为cDNA。在BIO-RAD荧光定量PCR仪上进行PCR反应。反应条件:95℃30 s;95℃5 s,59℃5 s,39个循环;65℃5 s,95℃,读取每个样品相应的CT值,采用荧光相对定量计算公式为:样品/对照=2-ΔΔCт,计算出各基因的mRNA的表达量,选择GAPDH作内参,本实验重复3次。
1.2.3 蛋白免疫印迹杂交技术(western blot)检测蛋白表达 12%SDS-PAGE分离上述蛋白质,湿转至PVDF膜后,5%脱脂牛奶室温封闭PVDF膜1 h,4℃一抗孵育过夜,HRP标记二抗室温孵育1 h,ECL检测目的蛋白条带。
1.2.4 细胞划痕愈合实验 待孔板中的细胞长到几近完全融合时,用10 μL的小枪头在孔板的底面上沿直线轻轻划痕,枪头要垂直,不能倾斜;加入含2%胎牛血清的DMEM培养基置于37℃5%CO2培养箱继续培养,分别于0、12、24、36、48 h在倒置显微镜下观察细胞划痕愈合情况并拍照片记录。记录完成后,用Image J软件测量细胞的迁移距离,SPSS13统计分析并应用sigmaplot软件作图,用细胞划痕愈合百分比判断细胞的运动能力(0 h的细胞划痕愈合为0)。
1.2.5 Transwell细胞体外侵袭实验 收取细胞后用含2%胎牛血清的DMEM培养基重悬。调整细胞密度至1×105/mL。取细胞悬液200μL加入Transwell小室(1×104个细胞)。孔板下室加入600 μL趋化因子(趋化因子:胎牛血清=9∶1),37℃,5%CO2培养,48 h后结晶紫溶液染色,400倍显微镜下随意挑选5个视野观察细胞,并记数,取平均数。
1.2.6 细胞免疫荧光染色技术 胰酶消化细胞,按照细胞传代的方法将细胞悬液加入事先备好的含有玻璃爬片的24孔板中。24 h后转染siRNA,并置于37℃,5%CO2细胞培养箱培养48 h。每孔内加入适量4%多聚甲醛室温固定细胞,用0.1%triton-X-100室温通透细胞膜5min。1%BSA室温封闭30min,4℃一抗孵育过夜。次日取出室温复温30 min,避光滴加二抗,37℃温箱避光孵育30 min。DAPI染料避光染细胞核5 min,洗去染核液后,每孔加入1×PBS,荧光显微镜或激光共聚焦扫描显微镜观察拍照。
2 结果
2.1 沉默HeLa细胞HPV18-E7基因表达并检测EMT标记物的表达变化 为证实HPV18-E7基因与EMT的诱导有相关性,本实验用针对HPV18-E7的siRNA转染入HeLa细胞并应用real-time PCR技术与免疫印迹实验分别在mRNA和蛋白水平检测EMT相关标记物的表达变化。如图1A示,SIE7转染入HeLa细胞后细胞间连接变得更加紧密;图1B示SIE7转染入HeLa细胞后48 h,细胞中E7与间质性标记物N-cadherin,Vimetin及fibronectin的mRNA表达水平较对照组细胞显著下降,其下降幅度分别为(82.97±4.90)%、(66.58±1.78)%、(42.34±1.89)%和(32.47±1.67)%,差异有统计学意义(P<0.01);然而上皮性标记物E-cadherin mRNA表达水平较对照组细胞明显增加,其增加幅度为(95.25±3.40)%,差异有统计学意义(P<0.01)。采用Western印迹法检测各指标蛋白水平的表达变化,结果显示,HeLa-SIE7细胞E7和Vimentin表达与对照组相比显著下降,降幅分别为(91.25±11.97)%和(61.09±3.40)%,差异有统计学意义(P<0.01);E-cadherin与对照组相比增加幅度为(85.27±2.35)%,差异有统计学意义(P<0.01,图1C)。如图1D示,随着HeLa-SIE7细胞E7表达的下调,E-cadherin在细胞膜上的表达增加,然而间质性标记因子vimentin细胞质内的表达随之下降。以上数据表明,在HPV18阳性的人宫颈腺癌细胞HeLa中特异性下调E7基因的表达可以导致EMT发生逆转,即发生MET。
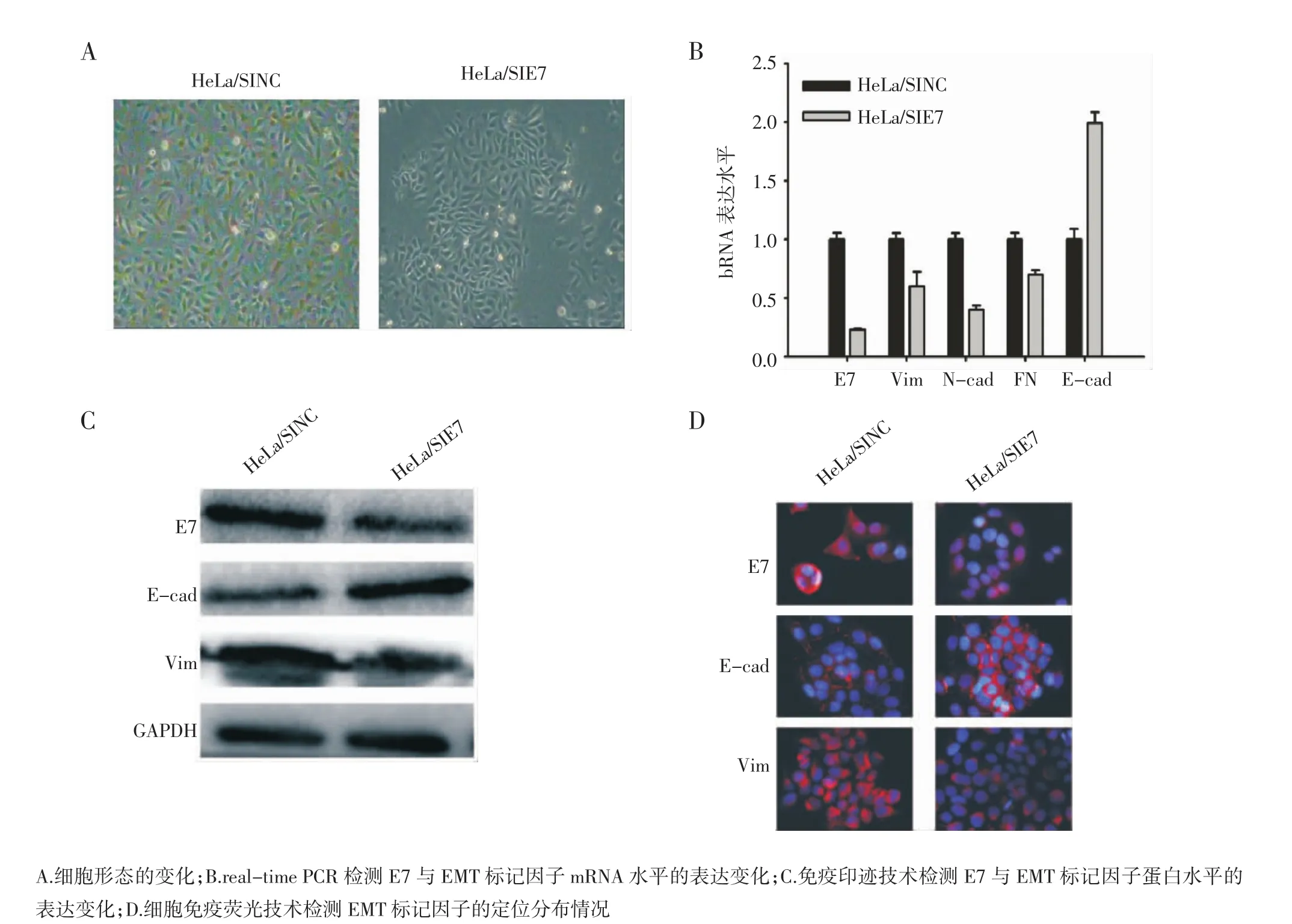
图1 HeLa细胞沉默HPV18-E7表达后细胞形态及EMT标记因子的表达变化Fig 1 HPV18-E7 depletion induced MET in HeLa cells
2.2 特异性沉默HeLa细胞HPV18-E7基因表达对细胞侵袭迁移能力的影响 运用细胞划痕愈合实验及Transwell细胞体外侵袭实验检测特异性沉默HeLa细胞HPV18-E7基因(HeLa-SIE7细胞)后细胞迁移及侵袭能力的变化。在0、24、48 h时点对细胞迁移情况进行对比显示,HeLa-SIE7细胞迁移能力明显低于对照组,且具有统计学意义(P<0.01)(图2 A,B)。行Transwell细胞体外侵袭实验48 h后,对发生侵袭转移的细胞进行染色计数,发现穿透Transwell小室基底膜的HeLa-SIE7细胞数较对照组少,且差异有统计学意义(P<0.01)(图2 C,D)。以上结果表明,在HPV18阳性的人宫颈腺癌细胞HeLa中特异性下调E7基因的表达可使细胞侵袭迁移能力明显下降。
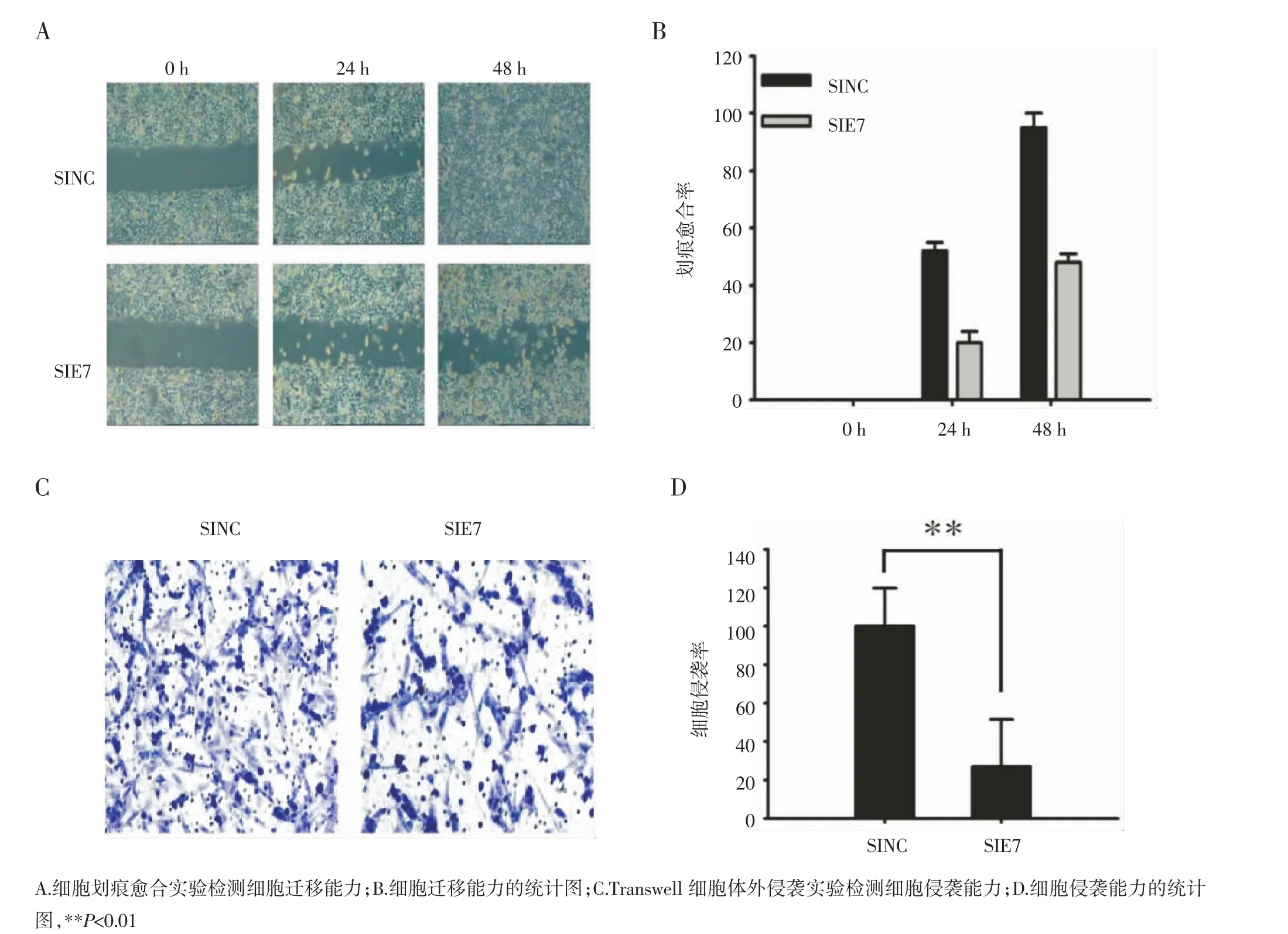
图2 HeLa细胞下调HPV18-E7表达对细胞侵袭迁移能力的影响Fig 2 Down-regulation of HPV18-E7 inhibited invasion and migration of HeLa cells
3 讨论
宫颈癌是女性生殖系统常见的恶性肿瘤之一,我国宫颈癌的发病率和死亡率持续增加并出现了年轻化趋势。现有的流行病学及分子生物学研究证实,HPV病毒(human papillomavirus,HPV)的感染是导致宫颈癌发生的最主要病因,约97%的宫颈癌均伴有HPV的感染。临床最为常见的宫颈癌有宫颈鳞状细胞癌和宫颈腺癌两大类,所占比例分别为75%~90%,10%~25%。近年来多项研究指出宫颈腺癌的发病率有上升及年轻化趋势。宫颈腺癌易发生局部浸润、淋巴结转移及远处转移,且病程进展迅速,预后较鳞癌差。对3 471例宫颈癌患者进行分类研究,指出宫颈腺癌发生卵巢转移的比例较鳞癌高,分别是5.31%,0.79%。两种病理类型的宫颈癌其感染HPV的类型也不同。流行病学显示,宫颈鳞状细胞癌多以HPV16、HPV58型感染为主,宫颈腺癌以HPV18、HPV45型感染为主,其中HPV18型所占比例高达34%~50%。在宫颈癌发生发展过程中,HPV的两个重要癌蛋白E6/E7起着关键作用。现有研究表明E6/E7蛋白可分别与抑癌蛋白p53和pRb结合,使p53通路和Rb通路失去活性,导致其对细胞周期的调控发生异常,最终引起细胞增殖失控,抑癌基因对DNA的损伤修复功能丧失,导致癌前病变及癌症的发生,与宫颈癌的发生发展密切相关。因此可以针对HPV18-E6/E7为靶点来研究宫颈腺癌发生侵袭转移的机制,从而解释其预后差的原因,并以此找到改善其不良预后的治疗方法。
EMT是哺乳动物胚胎发育过程中的生理现象,也是维持生命体组织平衡的基本生理事件。现在越来越多的证据证实EMT可以抑制细胞凋亡、促进肿瘤耐药性发生、促使肿瘤细胞具有干细胞特性、促进肿瘤细胞发生浸润转移等[8]。EMT是上皮标记性物质表达下调并发生再定位的同时间质标记性物质表达上调最终导致细胞获得侵袭迁移能力的一个动态过程[9],这一过程需细胞内特定的因子及通路的协助与调控。目前证实的参与调控EMT过程的因子包括转录因子(Snail,Slug,ZEB1,ZEB2, Twist1,Twist2等),miRNAs(miR-200家族)及一些生长因子(PDGF-D)等。近期,对人正常包皮细胞,犬肾上皮细胞(MDCK细胞),HPV16阳性的SiHa细胞及头颈部鳞状细胞癌细胞中的研究证实HPV16-E6/E7能够诱导EMT发生,然而HPV18阳性表达的宫颈腺癌HeLa细胞中无相关研究。
本次研究首次在人宫颈腺癌HeLa细胞中探讨HPV18-E7与EMT的关系。研究证实,宫颈腺癌中HPV18-E7能够诱导EMT发生并使细胞处于间质化状态从而促进肿瘤细胞发生侵袭转移。诱导EMT是HPV18-E7新发现的功能,此结果为HPV18-E7在宫颈腺癌中的作用添加了另一个标签:HPV18-E7不仅在宫颈腺癌发生中起作用,其还在宫颈腺癌的发展即侵袭迁移方面起重要作用,HPV18持续感染可诱导宫颈腺癌细胞发生侵袭转移,影响其预后及治疗效果。
[1] Zhao F H,Tiggelaar S M,Hu S Y,et al.A multi-center survey of age of sexual debut and sexual behavior in Chinese women:suggestions for optimal age of human papillomavirus vaccination in China[J]. Cancer Epidemiol,2012,36(4):384
[2]冯淑瑜,张彦娜,刘建刚.宫颈癌淋巴结转移的高危因素及预后分析[J].癌症,2005,24(10):1261
[3] Grigore A D,Jolly M K,Jia D,et al.Tumor budding:the Name is EMT.partial EMT[J].J Clin Med,2016,5(5):pii:E51
[4] Brivio S,Cadamuro M,Fabris L,et al.Epithelial-to-Mesenchymal transition and cancer invasiveness:what can we learn from cholangiocarcinoma[J].J Clin Med,2015,4(12):2028
[5]Li Y,Wang W,Wang W,et al.Correlation of TWIST2 up-regulation and epithelial-mesenchymal transition during tumorigenesis and progression of cervical carcinoma[J].Gynecol Oncol,2012,124(1): 112
[6] Hellner K,Mar J,Fang F,et al.HPV16 E7 oncogene expressionin normal human epithelial cells causes molecular changes indicative ofepithelial to mesenchymal transition[J].Virology,2009,391(1):57 [7] Jung Y S,Kato I,Kim H R.A novel function of HPV16-E6/E7 in epithelial-mesenchymal transition[J].Biochem Biophys Res Commun,2013,435(3):339
[8] Micalizzi D S,Ford H L.Epithelial-mesenchymal transition in Cancer:parallels between normal development and tumor progression[J].J Mammary Gland Biol Neoplasia,2010,15(2):117
[9] Hugo H,Ackland M L,Blick T,et al.Epithelial-mesenchymal and mesenchymal-epithelial transitions in carcinoma progression[J].J Cell Physiol,2007,213(2):374
(2016-04-30收稿)
Study on the relationship between HPV18-E7 and epithelial-mesenchymal transition in cervical adenocarcinoma cells
Miherinisha Maimaiti,Abidan Tuerhanjiang,HAN Li-li
(Department of Gynecology,People’s Hospital of Xinjiang Uygur Autonomous Region,Wulumuqi 830000,China)
Objective:To determine the role of HPV18-E7 oncogene in the epithelial to mesenchymal transition(EMT)like process. Methods:HPV18-E7 siRNAs were transfected in human cervical cancer HeLa cells.Real-time PCR,western blot and immunofluorescence technique were performed to examine the localization and expression of E7 and EMT markers,respectively.Furthermore,the wound healing assay and matrigel invasion assay were used to evaluate the invasion and migration ability.Results:On the mRNA and protein levels,E7 depletion significantly induced the expression of E-caderin.Furthermore,N-caderin,Vimetin,and fibronectin expression were decreased in HeLa-SIE7 cells.E-cadherin was up-regulated and mainly observed in contact areas between cells in HeLa/SIE7 cells,while the mesenchymal markers such as N-caderin,and fibronectin were reduced and detected mainly in the cytoplasm.Down-regulation of HPV18-E7 by transient transfection of HPV18-E7 siRNAs in HeLa cells caused significant inhibition of cell invasion and migration compared with the siNC transfected cells.Conclusion:In HeLa cells HPV18-E7 can enhance invasion and migration by inducing EMT.
cervical adenocarcinoma;EMT;HPV18-E7
R737.33
A
1006-8147(2016)06-0487-05
米合日尼沙·买买提(1976-),女,副主任医师,硕士,研究方向:妇科肿瘤的诊治;通信作者:韩莉莉,E-mail:hanliliabcd@163. com。
