基于Fe3O4/乙二胺四乙酸磁性粒子的集成化蛋白质组学方法
2016-12-14郭凯珠陈文东宋培培胡巢凤许瑞莲田瑞军
唐 君, 郭凯珠, 陈文东, 宋培培,封 顺, 胡巢凤, 许瑞莲, 田瑞军,4*
(1. 深圳市人民医院肿瘤研究所, 广东 深圳 518020; 2. 南方科技大学化学系, 广东 深圳 518055;3. 西南交通大学生命科学与工程学院, 四川 成都 610031; 4. 深圳市细胞微环境重点实验室,广东 深圳 518055; 5. 暨南大学基础医学院病理生理学系, 广东 广州 510632)
基于Fe3O4/乙二胺四乙酸磁性粒子的集成化蛋白质组学方法
唐 君1,2,5#, 郭凯珠2#, 陈文东2, 宋培培3,封 顺3, 胡巢凤5, 许瑞莲1*, 田瑞军2,4*
(1. 深圳市人民医院肿瘤研究所, 广东 深圳 518020; 2. 南方科技大学化学系, 广东 深圳 518055;3. 西南交通大学生命科学与工程学院, 四川 成都 610031; 4. 深圳市细胞微环境重点实验室,广东 深圳 518055; 5. 暨南大学基础医学院病理生理学系, 广东 广州 510632)
建立了基于Fe3O4/乙二胺四乙酸(EDTA)磁性粒子的集成化蛋白质组学研究方法。首先用共沉淀法合成EDTA负载的Fe3O4/EDTA磁性粒子。在优化的溶液条件下(95%乙腈-1%三氟乙酸,体积分数), 100 μg Fe3O4/EDTA磁性粒子可吸附12.4 μg牛血清白蛋白(BSA),吸附容量是商品化磁珠的10倍左右。以BSA作为标准蛋白质,对所合成的Fe3O4/EDTA磁性粒子作为蛋白质组学反应器的酶解时间进行了优化,发现Fe3O4/EDTA磁性粒子处理BSA酶解1、8和16 h的肽段序列覆盖率和特征肽段结果相当。因此,可以将复杂的蛋白质样品前处理时间缩短至2 h内。最后,将所合成的Fe3O4/EDTA磁性粒子应用于血清的蛋白质组学研究,成功地鉴定出218种蛋白质,其中包含了41种美国食品药品管理局(FDA)认证的生物标志物。所发展的基于Fe3O4/EDTA磁性粒子的蛋白质组学样品前处理方法将蛋白质样品预富集、还原、烷基化、酶解、多肽除盐和洗脱等步骤集成到一起,减少了样品转移和处理所造成的损失。这种技术具有快速、灵敏和易于操作的特点,可用于临床蛋白质组学研究。
Fe3O4/乙二胺四乙酸(Fe3O4/EDTA);磁性粒子;蛋白质组学;样品前处理
近几年来,基于质谱的蛋白质组学技术已经成为系统水平上高通量蛋白质鉴定和定量研究的主要分析方法[1,2],并已成功地应用于基础生物学研究的各个领域[3-5]。样品前处理是整个蛋白质组学分析流程中至关重要的一步,决定着整个样品分析的灵敏度、精确度和稳定性[6]。由于样品前处理步骤复杂,包括样品预富集、缓冲液置换、蛋白质还原、烷基化、酶解和多肽除盐,在样品量有限的情况下样品损失不可避免[7-12]。因此,越来越多的研究人员专注于发展新的样品前处理方法以提高蛋白质组学研究的整体性能和灵敏度。其中一个很重要的切入点是将样品前处理步骤集成到一起,以减少样品的损失,进而提高处理效率[13-16]。例如,Ethier等[17]发展了基于强阳离子交换(strong cation exchange,SCX)填料填充的毛细管柱的蛋白质组反应器,该方法通过将样品前处理步骤集成到一起显著地提高了样品处理效率。Wisniewski等[18]发展了超滤管辅助的样品处理方法FASP(filter-aided sample preparation)。该方法将去除表面活性剂过程和蛋白质酶解过程集成到一个超滤管中进行,大大降低了样品损失并提高了系统的整体效率。田瑞军等[14]发展了微流控蛋白质组反应器法,把样品前处理操作步骤集成到一个微流控芯片上,实现了多个蛋白质样品的同时处理。陈文东等[16]发展了简单集成的、基于填充了SCX填料和C18膜的移液枪枪头的样品前处理技术(simple and integrated spintip-based proteomics technology,SISPROT),以离心力作为驱动力实现了蛋白质预富集、还原、烷基化、酶解、多肽除盐和高pH值反相分级过程在一个枪头中的无缝衔接,大大减少了样品的损失并显著提高了样品的处理效率。
基于磁性纳米复合材料的蛋白质组学样品前处理方法已经得到广泛应用[19,20]。磁性纳米复合材料是由氧化铁(Fe3O4/γ-Fe2O3)的超顺磁核和核外包覆的活性半体组成[21-23]。这种材料具有超顺磁性、高稳定性、较好的生物相容性和较大的比表面积[19]。Ng等[24]发展了基于磁性粒子在微流控设备上的免疫分析方法,这种新奇的芯片上的磁性粒子分离方法可以对90%以上未结合的试剂实现一步分离。2014年Hughes等[12]发展了基于磁珠技术的集成化样品处理技术SP3(single-pot solid-phase-enhanced sample preparation)。该方法的原理是有机溶剂的加入促使蛋白质和多肽通过亲水作用富集在羧基包覆的磁性粒子上,该方法可将大部分样品前处理步骤集成到一个小管中,确保了蛋白质样品的高灵敏度分析。
本文在SP3方法的基础上发展了基于Fe3O4/乙二胺四乙酸(EDTA)磁性微球的简单、快速、集成化的蛋白质组分析方法。EDTA修饰的磁性微球同样是通过亲水相互作用富集溶液中的蛋白质和多肽,由于EDTA包覆的磁性粒子比羧基包覆的磁性粒子多3个功能化的羧基官能团,预期EDTA包覆的磁性粒子具有更好的蛋白质富集效果。本文基于Fe3O4/EDTA磁性微球的方法原理,将溶液中的蛋白质通过亲水作用富集在磁珠上,除去其他杂质成分后进行蛋白质的还原、烷基化以及在小体积溶液中的快速酶解,然后将溶液中酶解后的多肽通过亲水相互作用再次富集在磁珠上,进行除盐,最后用洗脱剂将多肽从磁珠上洗脱下来。本文系统地研究了Fe3O4/EDTA磁性粒子的蛋白质富集效率和酶解效率。并将所发展的基于Fe3O4/EDTA磁性粒子的蛋白质组分析方法应用于血清的蛋白质组分析中。
1 实验部分
1.1 仪器、试剂与材料
EASY-nLC 1000液相色谱分离系统配1.9 μm/12 nm ReproSil-Pur C18树脂(德国Dr. Maisch公司)填充的带有喷雾头的毛细管分析柱(20 cm×100 μm),Q-Exactive质谱仪(美国Thermo Fisher Scientific公司); Discovery TGA(热解重量分析)器(美国TA仪器公司); Smart Lab 9 KW X-射线衍射(XRD)仪(美国Rigaku公司)。
氯化铁(FeCl356H2O,分析纯)、硫酸亚铁(FeSO457H2O,分析纯)、氨水(体积分数为25%)均购于永华化学科技有限公司;EDTA(分析纯)购于上海Sangon Biotech公司;胰蛋白酶(trypsin,纯度≥99%)、甲酸(FA,HPLC级)、三氟乙酸(TFA,HPLC级)、乙腈(ACN,HPLC级)、碘乙酰胺(IAA,纯度≥99%)和三(2-羰基乙基)磷酸(tris(2-carboxyethyl)phosphine,TCEP,纯度≥99%)均购于美国Sigma公司;牛血清白蛋白(BSA,纯度>98%)购于加拿大BBI lifesiences公司;商品化的磁性粒子SiMAG-Carboxyl(M-COO-beads)(1 μm, 50 g/L)购于美国Chemicell公司。血液样品来自深圳市人民医院。超纯水(18.2 MΩ5cm)由Milli Q设备(美国Millipore公司)制得。
1.2 Fe3O4/EDTA磁性粒子的合成和表征
Fe3O4/EDTA磁性粒子的合成路线如图1所示。将1.53 g FeCl356H2O和1.05 g FeSO457H2O分别溶于25 mL蒸馏水中制备成FeCl3溶液和FeSO4溶液。将0.31 g EDTA溶于12.5 mL 1.5%(体积分数)氨水中制备成EDTA溶液。在三口瓶中依次加入FeCl3溶液和FeSO4溶液,加热至90 ℃,在不断搅拌下向混合液中加入5 mL氨水(体积分数为25%)和EDTA溶液,搅拌反应30 min后将反应体系冷却至室温。用磁铁收集黑色沉淀物,将得到的磁性粒子用水(除氧)洗3遍,用乙醇(除氧)洗3遍,即可得到Fe3O4/EDTA磁性粒子。将合成的磁性粒子存储于25 mL的除氧乙醇中,置于4 ℃冰箱保存。Fe3O4磁性粒子的合成过程与Fe3O4/EDTA磁性粒子的合成过程相比,未向混合液中加入EDTA溶液。

图 1 Fe3O4/EDTA磁性粒子的合成路线图Fig. 1 Synthesis of Fe3O4/ethylenediaminetetraacetic acid (EDTA) magnetic beads
热重分析于N2保护下在Discovery TGA分析器上进行。Fe3O4和Fe3O4/EDTA磁性粒子热重分析起始温度为50 ℃,以10 ℃/min的速度升到700 ℃。XRD测定在Smart Lab 9 KW X-射线衍射仪上进行,射线为CuKα(λ=0.154 06 nm)。
1.3 Fe3O4/EDTA磁性粒子作为蛋白质反应器的溶液条件优化
以BSA为标准蛋白对Fe3O4/EDTA磁性粒子在不同有机相含量下的吸附容量进行测定。将BSA溶于超纯水中配制成为4 g/L的储备液,分别用50%(体积分数,下同)ACN-1%TFA、60%ACN-1%TFA、70%ACN-1%TFA、80%ACN-1%TFA、90%ACN-1%TFA和95%ACN-1%TFA溶液稀释成0.2 g/L的BSA溶液。取6份5 μL Fe3O4/EDTA(20 g/L)磁性粒子,分别用50 μL 50%ACN-1%TFA、60%ACN-1%TFA、70%ACN-1%TFA、80%ACN-1%TFA、90%ACN-1%TFA和95%ACN-1%TFA溶液清洗两遍,再分别加入6种不同乙腈含量的BSA溶液,上样量均为21 μg,等待15 min后收集上清液。将上清液冻干后用25 μL水复溶,用BCA(bicinchoninic acid)法对上清液中的BSA浓度进行测定。上样量减去上清液中BSA的量即可得到吸附的BSA的量。商品化的M-COO-磁性粒子结合容量的测定方法同上。
1.4 Fe3O4/EDTA磁性粒子作为蛋白质反应器的酶解时间优化
取100 μg Fe3O4/EDTA磁性粒子,用100 μL 95%ACN-1%TFA溶液洗两遍,然后向磁珠中加入95%ACN-1%TFA稀释的10 μg BSA标准品(0.2 g/L),等待15 min后置于强磁铁上2 min,弃去上清液,加入50 μL 95%ACN-1%TFA溶液清洗样品,弃去上清液。加入5 μL 100 mmol/L TCEP,反应15 min,打开蛋白质的二硫键,然后加入95 μL ACN,使蛋白质重新结合到磁珠上,置于强磁铁上2 min,弃去上清液。加入10 μL酶解溶液(10 mmol/L碘乙酰胺-100 mmol/L pH 8 tris-HCl-2 g/L胰蛋白酶),在避光条件下酶解1、8和16 h。然后加入190 μL ACN和5 μL 20%TFA,15 min后弃去上清液。加入50 μL 95%ACN-1%TFA溶液清洗多肽,除盐,弃去上清。最后用50 μL水将磁珠上吸附的多肽洗脱下来。洗脱液加甲酸酸化后进行LC-MS/MS分析。
1.5 Fe3O4/EDTA磁性粒子用于血清样品中的蛋白质组学研究
取200 μg Fe3O4/EDTA磁性粒子,用100 μL 95%ACN-1%TFA溶液洗两遍。将血液样品以4 000 r/min的速度离心10 min,取上清血清,用酶标仪对血清进行蛋白质浓度测定后,将血清用水稀释为4 g/L,再用95%ACN-1%TFA溶液稀释为0.2 g/L的溶液。取10 μg 0.2 g/L的血清溶液加入200 μg磁珠中,15 min后置于强磁铁上2 min,弃去上清液。二硫键还原、酶解、除盐、洗脱步骤同1.4节。洗脱液加甲酸酸化后进行LC-MS/MS分析。
1.6 LC-MS/MS分析
所有样品均在由EASY-nLC 1000系统和Q-Exactive质谱仪组成的LC-MS/MS系统上分析。液相色谱分离系统使用1.9 μm/12 nm ReproSil-Pur C18树脂填充的带有喷雾头的毛细管分析柱(20 cm×100 μm)。分离采用了双流动相系统:A相为体积分数为0.1%的FA水溶液,B相为体积分数为0.1%的FA乙腈溶液。将样品的一半体积上样到分析柱中,然后以250 nL/min的流速在分析柱上分离。分析血清样品的梯度设置如下:0~2 min, 3%B~7%B; 2~52 min, 7%B~22%B; 52~62 min, 22%B~35%B; 62~64 min, 35%B~90%B; 64~70 min, 90%B; 70~72 min, 90%B~3%B; 72~80 min, 3%B。分析BSA时的有效梯度缩短至30 min,梯度设置为:0~2 min, 3%B~7%B; 2~27 min, 7%B~22%B; 27~32 min, 22%B~35%B; 32~34 min, 35%B~90%B; 34~40 min, 90%B。全质谱扫描在Q-Exactive质量分析器上完成,扫描范围是m/z350~1 550,质谱分辨率为1.2×105。MS/MS数据通过高能碰撞裂解的数据依赖性采集获取。参数设置如下:最大离子注入时间:50 ms;分离窗口:m/z2.0;归一化的碰撞能:27%;选取丰度最高且离子峰强度高于2.0×104的前10个离子进行MS/MS分析;动态排除时间:60 s。
1.7 数据分析
质谱原始数据由Sequest HT(Proteome Discoverer,Version 1.4)直接对human Uniprot fasta数据库(包含68 485个蛋白质,下载于2015年4月14日)进行搜索。参数设置如下:母离子的质量容忍度设置为10 ppm(10×10-6),碎片离子设置为0.02 Da,胰蛋白酶酶切,最大漏切位点设为2个,半胱氨酸脲基甲基化设置为固定修饰,甲硫氨酸氧化、天冬酰胺和谷氨酰胺脱氨基设置为可变修饰,肽段鉴定的错误发现率(FDR)控制在1%以内。
2 结果与讨论
2.1 Fe3O4/EDTA磁性粒子的合成和表征
本文合成了EDTA修饰的Fe3O4磁性粒子,合成路线见图1。将该磁性粒子的储备液置于磁场下,15 s即可实现材料与溶液完全分离,结果见图2。Fe3O4/EDTA和Fe3O4磁性粒子的XRD表征见图3,表明Fe3O4与EDTA结合过程没有改变Fe3O4的晶型。Fe3O4/EDTA磁性粒子的热重表征如图4所示,Fe3O4/EDTA磁性粒子的TGA曲线中有两个阶段的质量丢失。第一阶段是50~150 ℃,合成材料中残留水分丢失;第二阶段是200~500 ℃,主要是合成材料中EDTA分解。由Fe3O4和Fe3O4/EDTA磁性粒子的热重曲线对比可得合成材料上的EDTA质量分数为1.4%。

图 2 Fe3O4/EDTA磁性粒子在磁铁作用15 s后的磁场响应Fig. 2 Fe3O4/EDTA magnetic beads responded in 15 s with a magnet

图 3 Fe3O4和Fe3O4/EDTA磁性粒子的XRD图Fig. 3 X-ray diffraction (XRD) patterns of Fe3O4and Fe3O4/EDTA magnetic beads
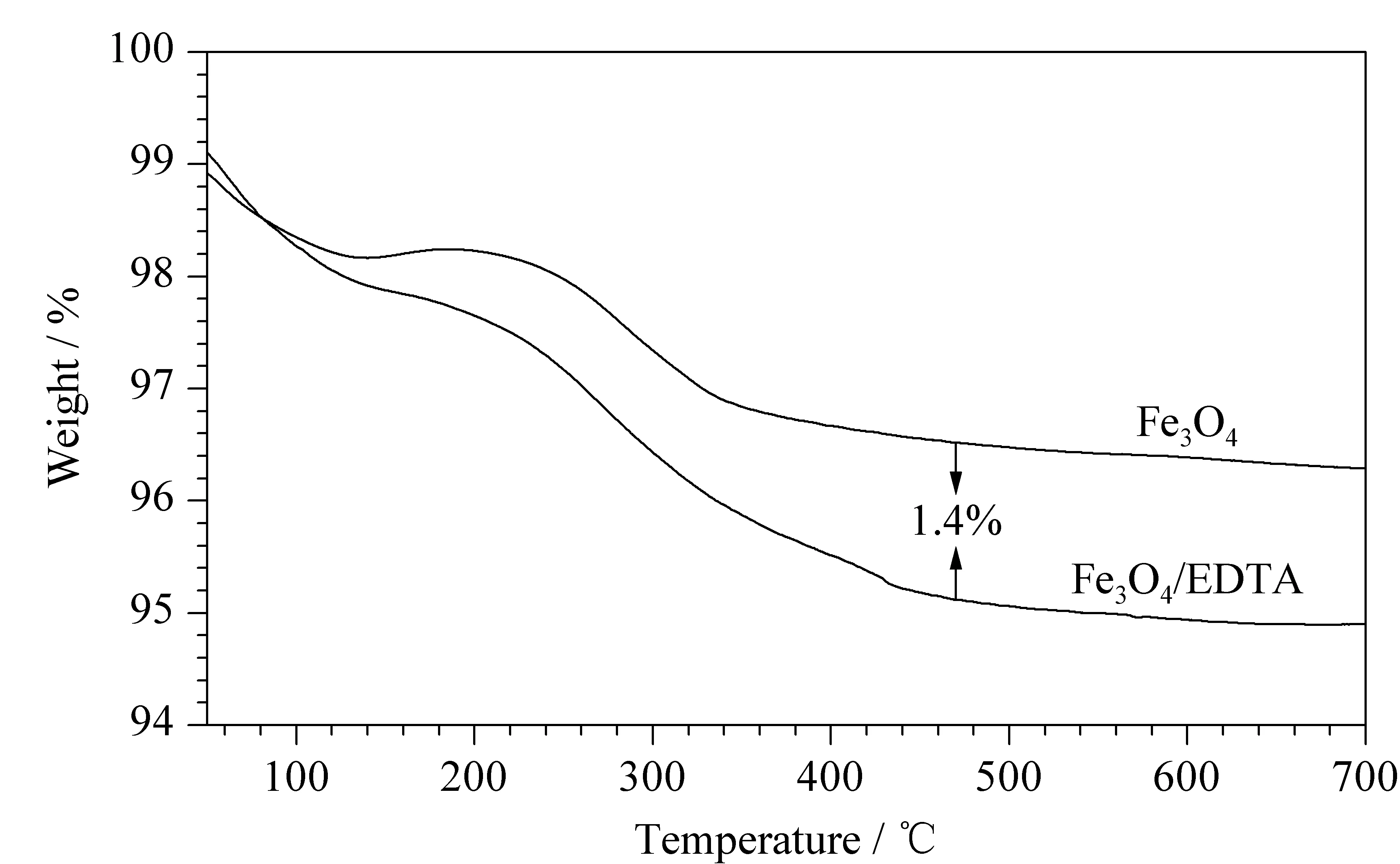
图 4 Fe3O4和Fe3O4/EDTA磁性粒子的热重曲线图Fig. 4 Thermogravimetric analysis (TGA) curves of Fe3O4 and Fe3O4/EDTA magnetic beads
2.2 溶液条件的优化
Fe3O4/EDTA磁性粒子中EDTA的羧基通过亲水相互作用吸附溶液中的蛋白质,溶液中高比例的有机溶剂有利于Fe3O4/EDTA磁性粒子吸附蛋白质[25]。但是蛋白质在高比例的有机相中容易沉淀聚集,会影响蛋白质的富集过程。以BSA为标准蛋白质,研究了不同比例有机相中Fe3O4/EDTA磁性粒子对蛋白质的吸附量。结果如图5所示,在50%~80%(体积分数,下同)乙腈含量范围内,随着乙腈含量的增加,Fe3O4/EDTA磁性粒子的BSA结合量缓慢增加;而在80%~95%范围内,随着乙腈含量的增加,Fe3O4/EDTA磁性粒子的结合量迅速升高,在95%ACN-1%TFA下,100 μg Fe3O4/EDTA磁性粒子可结合12.4 μg BSA,所以在以后的试验中均采用95%ACN-1%TFA。

图 5 100 μg Fe3O4/EDTA磁性粒子在50%~95%(体积分数) 乙腈的1% (体积分数)TFA溶液中对BSA的吸附量Fig. 5 Bovine serum albumin (BSA) binding capacities of Fe3O4/EDTA magnetic beads in solutions of 1% (v/v) TFA with ACN contents from 50% to 95% (v/v)
在优化的乙腈浓度条件下,分别对合成的Fe3O4/EDTA磁性粒子和商品化的M-COO-磁性粒子的吸附容量进行了对比研究,发现100 μg M-COO-磁性粒子的吸附容量为(1.2±0.4) μg,而100 μg Fe3O4/EDTA磁性粒子的吸附容量为(12.4±0.9) μg,是M-COO-磁性粒子的10倍,并且商品化M-COO-磁性粒子的BSA上样容量随乙腈含量的升高无明显变化(数据未给出)。商品化M-COO-磁性粒子吸附蛋白质的机理和合成的Fe3O4/EDTA一样,均为亲水相互作用,两者的不同之处在于商品化的羧基磁性粒子只带有一个羧基,而合成的Fe3O4/EDTA带有4个羧基。这可能是导致两者之间吸附容量差异显著的主要原因。
2.3 酶解时间的优化
以BSA为标准蛋白质对所合成的Fe3O4/EDTA磁性粒子做蛋白质反应器的酶解时间进行优化,试验流程图如图6所示。将3份10 μg BSA分别加入3份100 μg Fe3O4/EDTA磁性粒子中,BSA通过亲水相互作用吸附在Fe3O4/EDTA磁性粒子上,经过还原、烷基化、酶解(1、8和16 h)、脱盐和洗脱步骤后,质谱检测结果如表1所示。酶解1 h可检测出BSA的89条特征多肽,覆盖率为86.66%, PSMs(peptide spectrum matches)为297;而酶解8 h可检测出105条特征多肽,覆盖率为85.83%, PSMs为244;酶解16 h可检测出97条特征多肽,覆盖率为86.16%, PSMs为239。在误差范围内,酶解1、8和16 h的效果相当。因此,优化的酶解时间选择为1 h。本试验中胰蛋白酶与蛋白质的质量比为2∶1,将胰蛋白酶与BSA的质量比降低对特征肽段、PSMs和覆盖度的检测结果没有显著影响(数据未给出)。基于Fe3O4/EDTA磁性粒子的蛋白质反应器将酶解时间缩短至1 h,将整个蛋白质样品前处理时间缩短至2 h,大大提高了样品前处理效率。

图 6 Fe3O4/EDTA作为蛋白质反应器的实验流程图Fig. 6 Workflow of Fe3O4/EDTA as the proteomic reactor

Digestiontime/hUniquepeptideCoverage/%PSMs18986.66297810585.83244169786.16239
PSMs: peptide spectrum matches.
2.4 基于Fe3O4/EDTA磁性粒子的蛋白质反应器处理血液样品
最后将合成的Fe3O4/EDTA磁性粒子应用于血清的蛋白质组学研究。将10 μg血清蛋白质溶液加入200 μg Fe3O4/EDTA磁性粒子中,血清中的蛋白质通过亲水作用与Fe3O4表面的EDTA相互作用而被富集在Fe3O4/EDTA磁性粒子的表面。在优化的样品前处理条件下将得到的多肽样品引入质谱进行检测,共鉴定到218个蛋白质,其中包含41个美国食品药品管理局(FDA)认证的生物标志物,如表2所示。Geyer等[26]运用单针进样鸟枪法蛋白质组学工作流程可鉴定出约280个蛋白质,其中包含40多个FDA通过的生物标志物。本文得到的血清中蛋白质鉴定量与Geyer等[26]用单针进样鸟枪法得到的血清中蛋白质鉴定量结果相当,说明Fe3O4/EDTA磁性粒子作为蛋白质反应器是一种可靠的蛋白质组学研究方法。

表 2 从血清中鉴定到的41个FDA认证的生物标志物
3 结论
本文合成了表面修饰有EDTA的Fe3O4磁性粒子。在95%ACN-1%TFA条件下,磁性粒子的蛋白质结合容量最高,每100 μg Fe3O4/EDTA可以吸附12.4 μg BSA,是商品化M-COO-磁性粒子的10倍。优化了Fe3O4/EDTA用作蛋白质反应器的酶解时间,实现了1 h的高效溶液酶解。将此合成材料应用于血清的蛋白质组学研究可检测到218个蛋白质,其中包含41个FDA认证的蛋白质生物标志物。本文所发展的基于Fe3O4/EDTA磁性粒子的蛋白质组学技术将蛋白质组学样品前处理步骤集成到一起,方法易于操作,有效节省了样品处理时间,减少了样品损失,为蛋白质组学研究提供了方法学参考。
[1] Cravatt B F, Simon G M, Yates J R. Nature, 2007, 450: 991
[2] Mann M. Clin Chem, 2016, 62(1): 293
[3] Bensimon A, Heck A J, Aebersold R. Annu Rev Biochem, 2012, 81: 379
[4] Choudhary C, Weinert B T, Nishida Y, et al. Nature Rev Mol Cell Biol, 2014, 15(8): 536
[5] Scott J D, Pawson T. Science, 2009, 326: 1220
[6] Altelaar A F, Heck A J. Curr Opin Chem Biol, 2012, 16(1/2): 206
[7] Tian R J. Proteomics, 2014, 14(4/5): 498
[8] Lin L, Luo S S, Wang L J, et al. Chinese Journal of Analytical Chemistry, 2015, 43(10): 1479
林琳, 罗树生, 王灵珏, 等. 分析化学, 2015, 43(10): 1479
[9] Zhang Y, Liu R J, Hu Y L, et al. Anal Chem, 2009, 81(3): 967
[10] Kishikawa N, Kuroda N. J Pharm Biomed Anal, 2014, 87: 261
[11] Saito Y, Ueta I, Ogawa M, et al. J Pharm Biomed Anal, 2007, 44(1): 1
[12] Hughes C S, Foehr S, Garfield D A, et al. Mol Syst Biol, 2014, 10(10): 757
[13] Craft D, Li L. Anal Chem, 2005, 77(8): 2649
[14] Tian R J, Hoa X D, Lambert J P, et al. Anal Chem, 2011, 83(11): 4095
[15] Tian R J, Wang S, Elisma F, et al. Mol Cell Proteomics, 2011, 10(2): M110.000679-1
[16] Chen W D, Wang S, Adhikari S, et al. Anal Chem, 2016, 88(9): 4864
[17] Ethier M, Hou W, Duewel H S, et al. J Proteome Res, 2006, 5(10): 2754
[18] Wisniewski J R, Zougman A, Nagaraj N, et al. Nat Methods, 2009, 6(5): 359
[19] Li Y, Zhang X, Deng C. Chem Soc Rev, 2013, 42(21): 8517
[20] Gao M, Deng C, Zhang X. Expert Rev Proteomics, 2011, 8(3): 379
[21] Wu W, He Q, Jiang C. Nanoscale Res Lett, 2008, 3(11): 397
[22] Lu A H, Salabas E L, Schüth F. Angew Chem Int Ed Engl, 2007, 46(8): 1222
[23] Veiseh O, Gunn J W, Zhang M. Adv Drug Deliv Rev, 2010, 62(3): 284
[24] Ng A H, Choi K, Luoma R P, et al. Anal Chem, 2012, 84(20): 8805
[25] Zhu J, Wang F J, Chen R, et al. Anal Chem, 2012, 84 (11): 5146
[26] Geyer P E, Kulak N A, Pichler G, et al. Cell Syst, 2016, 2 (3): 185
Fe3O4/ethylenediaminetetraacetic acid magnetic beads-based integrated method for proteomic analysis
TANG Jun1,2,5#, GUO Kaizhu2#, CHENG Wendong2, SONG Peipei3,FENG Shun3, HU Chaofeng5, XU Ruilian1*, TIAN Ruijun2,4*
(1.InstituteofOncology,ShenzhenPeople’sHospital,Shenzhen518020,China;2.DepartmentofChemistry,SouthUniversityofScienceandTechnologyofChina,Shenzhen518055,China;3.SchoolofLifeScienceandEngineering,SouthwestJiaotongUniversity,Chengdu610031,China;4.ShenzhenKeyLaboratoryofCellMicroenvironment,Shenzhen518055,China;5.DepartmentofPathophysiology,SchoolofBasicMedicine,JinanUniversity,Guangzhou510632,China)
A Fe3O4/EDTA (ethylenediaminetetraacetic acid) magnetic beads-based integrated method for proteomic analysis was developed. Fe3O4magnetic beads loaded with EDTA were prepared firstly via co-precipitation method. One hundred μg Fe3O4/EDTA magnetic beads could adsorb 12.4 μg BSA (bovine serum albumin) in the optimized solution (95% acetonitrile-1% trifluoracetic acid, v/v). The binding capacity was about 10 times higher than that of the commercialized magnetic beads. The digestion time of Fe3O4/EDTA magnetic beads as the proteomic reactor was also optimized using BSA as the standard protein. The results indicated that the peptide coverage and unique peptides obtained from Fe3O4/EDTA magnetic beads with digestion time of 1, 8 and 16 h were comparable. We then applied the Fe3O4/EDTA magnetic beads for the serum proteome analysis. A total of 218 proteins were identified successfully, including 41 biomarkers approved by Food and Drug Administration (FDA). Protein preconcentration, reduction, alkylation, digestion, peptide desalting, and elution can be achieved in an integrated manner by the Fe3O4/EDTA magnetic beads-based proteomics sample preparation, which reduced the sample loss during sample transfering and processing. The developed method is fast, sensitive and easy to operate, which has prospective application for the clinic proteomics research.
Fe3O4/EDTA (ethylenediaminetetraacetic acid); magnetic beads; proteomics; sample preparation
10.3724/SP.J.1123.2016.09033
2016-09-15
国家自然科学基金项目(21575057);深圳市科技计划项目(JCYJ20150901153557178,JSGG20160301103415523).
Foundation item: National Natural Science Foundation of China (No. 21575057); Shenzhen Innovation of Science and Technology Commission (Nos. JCYJ20150901153557178, JSGG20160301103415523).
O658
A
1000-8713(2016)12-1263-07
邹汉法研究员纪念专辑(上)·研究论文
# 共同第一作者.
* 通讯联系人.Tel:(0755)88018905,E-mail:tianrj@sustc.edu.cn(田瑞军);Tel:(0755)25617019,E-mail:xuruilian@126.com(许瑞莲).
