胃癌腹膜转移转化性治疗的临床意义
2016-12-14朱正纲
朱正纲
作者单位: 200025 上海, 上海交通大学医学院附属瑞金医院 外科;上海消化外科研究所
晚期胃癌转化治疗
胃癌腹膜转移转化性治疗的临床意义
朱正纲
作者单位: 200025 上海, 上海交通大学医学院附属瑞金医院 外科;上海消化外科研究所
胃癌; 转化治疗; 腹膜转移
胃癌属全球高发的恶性肿瘤,每年约新增病例近100万;在我国其发病率与死亡率均居前列,分别占所有恶性肿瘤的第三与第二位[1-2];严重影响国人的健康。我国胃癌病例众多,但早期胃癌仅占10%左右,少数胃癌临床中心达到20%~25%,仍远低于日本、韩国50%~70%的水平。因此,对于大量的进展期或晚期胃癌患者,如何采取积极、合理的治疗策略并进一步改善其生存率将是我们面临的长期挑战。近年来,人们对胃癌腹膜转移的诊疗给予了高度的重视,并将此作为胃癌转化性治疗的重点领域,故具有十分重要的临床现实意义。
1 胃癌腹膜转移的现状与临床后果
综合大宗临床报告,(1)对T3或T4胃癌患者,当施行根治性手术时,约有10%~20%的患者已存在肉眼难以识别的腹膜微小转移灶;(2)进展期胃癌中约有40%~60%的患者术后首发且唯一复发灶是腹膜转移;(3)腹膜转移是导致约20%~40%胃癌患者死亡的直接原因;(4)年青胃癌患者相比于中老年患者更容易发生腹膜转移,特别是年青女性,就诊时往往伴有腹膜转移、Krukenberg’s 肿瘤,甚至腹水;此外,浆膜受侵犯、Borrmann’s 4型胃癌、低分化腺癌或印戒细胞癌、淋巴结广泛转移等胃癌都具有腹膜转移的明显倾向[3]。据文献报道,在日本每年约有4万余胃癌患者死于肿瘤复发,其中约70%系与腹膜的转移复发有关。Nashimoto等[4]回顾性分析了自2002年至2009年日本208家医院共计13 626例原发性胃癌患者的临床随访数据,内容覆盖手术方式、病理学诊断及生存结果等53个项目,患者的5年随访率高达83.3%。该研究结果显示:可切除胃癌患者与不可切除患者术后直接死亡原因中,腹膜转移分别占36%与56%;腹膜转移居胃癌患者致死原因的首位,已成为危害患者最重要的临床事件。胃癌一旦发生腹膜转移并呈进行性发展,最终可导致顽固性癌性腹水、肠道梗阻、恶液质, 成为胃癌死亡的主要原因。
2 胃癌腹膜转移转化性治疗的可能性
转化性治疗的临床应用始于针对结直肠癌肝转移的成功治疗,结直肠癌一旦发生肝转移,单纯手术切除难以达到根治的目的,且术后常易导致肝内转移灶复发。Bismuth等率先开展术前化疗,使原发癌灶与肝脏转移灶得到有效控制,达到降期目的后再施行根治性手术,从而明显提高了临床疗效[5]。按照国际抗癌联盟(UICC)或日本胃癌研究会(JGCA)有关胃癌临床病理分期法,胃癌一旦发生腹膜转移则属于远处转移,失去了手术根治的机会,预后极差,通常中位生存期在6个月左右。对此,转化性治疗的目的,旨在通过有效的化疗等手段,使得胃原发癌灶降期的同时,腹膜转移灶获得有效控制,并进而争取施行根治性胃癌切除术(R0术),以提高此类晚期胃癌患者的生存率。根据腹膜转移的程度,通常可以分为二种情况:(1)除腹膜(包括卵巢)与胃周淋巴结转移外,无肝、肺、骨或腹主动脉旁淋巴结等远处转移,腹膜转移灶较为局限,以胃旁区域腹膜转移为主(P1),或腹腔内散在性种植(P2),无或少量腹水;或Surgabaker’s 腹膜转移指数(PCI)<15;经过积极的转化性治疗,并经CT与腹腔镜等评估,原发胃癌与腹膜转移灶均得到控制(P0)或腹腔内游离癌细胞转为阴性(CY0),对其中转化性治疗效果明显者可以实行根治性胃癌切除术;或者争取作肿瘤减负荷手术(cytoreductive surgery或volume-reduction surgery),此类手术虽然难以完全达到R0切除,术后仍有腹膜复发可能,但若术后继续维持化疗,大多数患者可以明显延长生存期。(2)除弥漫性腹膜转移外, PCI>15(P3),还伴有其他脏器或广泛的淋巴结转移,对此类患者转化性治疗的效果仍相当有限,手术已不可能达到治愈目的,仅为避免诸如胃原发癌灶大出血、穿孔、梗阻等时,才考虑进行姑息性手术;反之,应维持姑息性化疗或给予最佳支持治疗等。
3 胃癌腹膜转移转化性治疗方法与药物的选择
胃癌腹膜转移转化治疗的主要手段仍是化疗,通常有两种给药方式:(1)经口服与静脉全身性化疗;(2)全身性+腹腔内区域性联合化疗。根据近年来对胃癌腹膜转移研究的进展,进行全身性+腹腔内区域性联合化疗较之单纯全身性化疗具有一定的优势,其主要机理为:(1)体内存在“血浆-腹膜屏障”(peritoneal-plasma barrier),经全身性治疗时,分子量较大的化疗药物难以透过该屏障而作用于腹膜转移灶;(2)药代动力学研究证实经腹腔内给药,其药物浓度及其有效维持时间明显优于全身性给药,腹腔内化疗不但对腹膜转移灶甚至对胃原发癌灶、转移淋巴结等均可产生直接的抑制效应,并且药物经门脉吸收也可预防肝脏等转移;(3)同样是“血浆-腹膜屏障”作用,腹腔内药物吸收入血过程缓慢,不会增加全身性毒副反应。适合于腹腔内化疗理想的药物应能够保持腹腔内较高的药液浓度,药物被吸收入血缓慢,以保持腹腔内与血浆较大的药物浓度梯度差,临床上常以腹腔内药物浓度与外周血药物浓度时间曲线下面积的比值(area under the curve ratios, AUC)来表示(表1)[6-7]。用于腹腔内化疗的药物应在腹腔内清除率较低,分子量较大,可水溶性,易溶解,易离子化,AUC比值较高。近年来,紫杉醇及多西他赛等药物在腹腔内化疗的作用受到普遍重视,该两种药物的腹腔液AUC与血浆AUC的比值分别为1 000和550,它们的药代动力学优势更为明显,各家临床试验也表明紫杉醇(paclitaxel,PTX)、多西他赛(docetaxel)与替吉奥胶囊(S-1)或奥沙利铂(oxaliplatin)等联合应用,在胃癌腹膜转化治疗中表现出了较好的临床效果[8]。
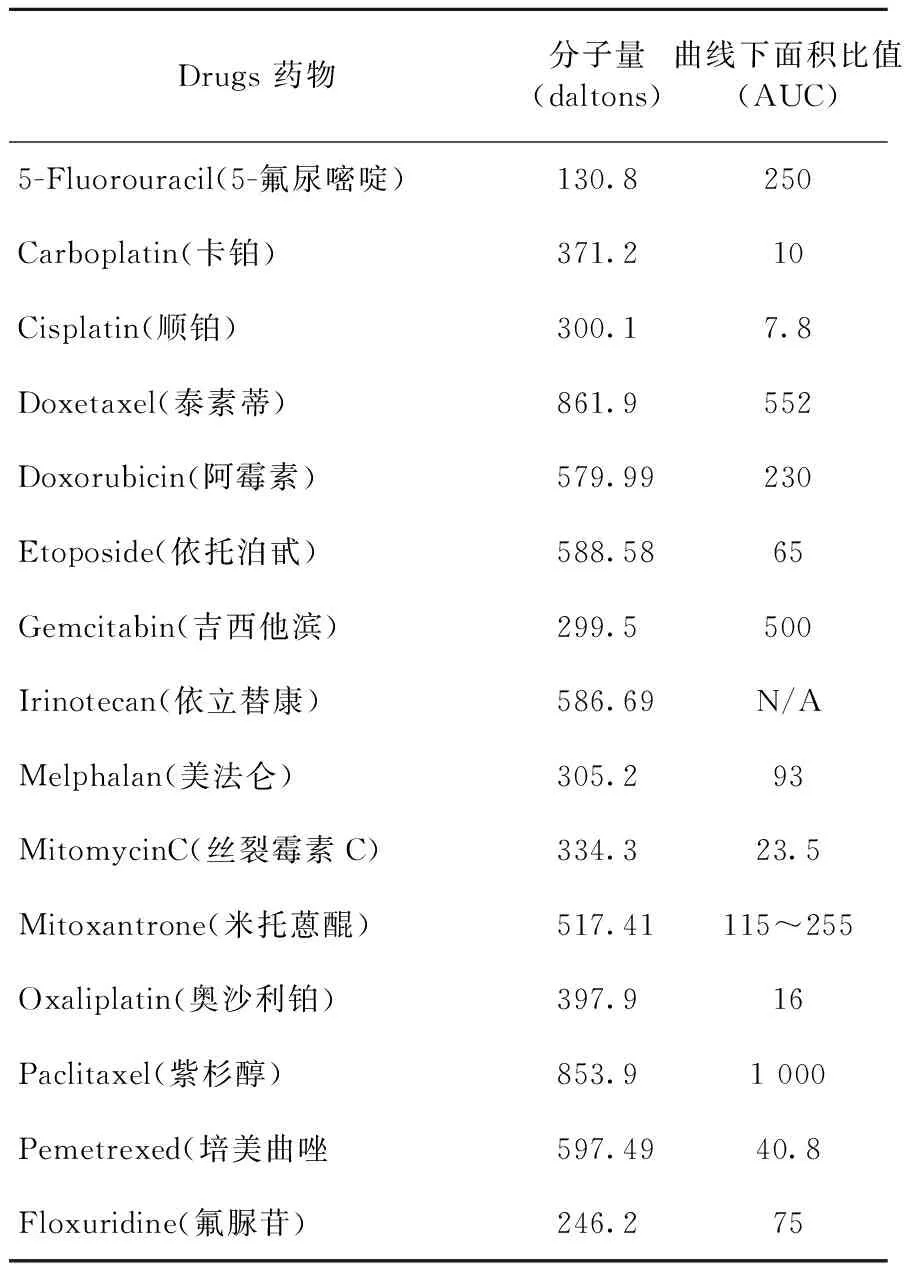
表1 腹腔内与外周血药物浓度时间曲线下面积比值(AUC值)
4 胃癌腹膜转移转化性治疗的临床疗效
目前,诊断胃癌腹膜转移首先可通过胃镜、MDCT等进行术前分期,对于浸润至浆膜外或伴有腹水的胃癌,应该进行腹腔镜探查以明确有无腹腔内游离癌细胞(free cancer cells,FCCs)或腹膜转移,并针对原发肿瘤、转移淋巴结与腹膜转移灶进行积极的转化治疗。由于既往单纯全身性化疗治疗腹膜转移的疗效不佳,故近年来多采取联合腹腔与全身性的新辅助化疗(neoadjuvant intraperitoneal-systemic chemotherapy, NIPS)[9-10]。Yonemura等[11]对96例晚期胃癌患者采用三药联合NIPS方案,以S-1连续口服(60 mg/m2)21天;泰素蒂(Taxotere)30 mg/m2、顺铂(Cisplatinum)30 mg/m2分别在第1、8、15天经腹壁皮下埋置的化疗泵行腹腔内给药,21天为一疗程,休息1周后重复给药。结果显示NIPS治疗前,腹腔内FCC阳性者68例(70.8%),治疗后降为21例(22.9%);NIPS治疗后对82例患者施行了肿瘤去负荷手术(cytoreductive surgery,CRS), 其中肉眼未见肿瘤残留(CC-0)为58例(70.8%);中位数生存期(median survival time, MST)为14.4 个月,术后1、3、5年生存率分别为61%、16%与16%,较对照组疗效有明显改善。日本东京大学率先进行的PHOENIX系列研究,对NIPS在胃癌腹膜转移的转化治疗结果进行了客观的评价。Kitayama等[12]在PHOEXIX II期研究中, 对64例术前经腹腔镜探查证实为腹膜转移伴腹水的胃癌患者予以口服S-1、并静脉与腹腔内给予PTX的NIPS(IP PTX 20 mg/m2, IV PTX 50 mg/m2on days 1 and 8, PO S-1 80 mg/m2/day on days 1~14, q3wks)方案,平均治疗5个疗程,有34例经NIPS治疗后因无其他远处转移,复查腹腔内FCCs转阴,胃癌原发灶与腹膜转移灶缩小或得到有效控制而分别施行了胃癌D1或D2切除术,其中22例(65%)获得R0切除,该组中位数生存时间(MST)为26.4个月,1年生存率达到82%;另30例未作手术者MST与1年生存率分别为12.1个月与26%。该研究结果提示应用S-1与紫杉醇联合的NIPS方案,并给予积极的手术治疗仍然能够有效地延长腹膜转移伴癌性腹水等晚期胃癌的生存期。NIPS疗法的主要优点在于通过术前全身性用药,可望抑制原发肿瘤灶与淋巴结转移灶的增殖,达到降期效果;同时,利用了腹膜-血浆屏障(peritoneal-plasma barrier, PPB)现象,进行腹腔内化疗(intraperitoneal chemotherapy, IPC),使得腹膜转移癌灶能直接受到较高浓度抗癌药物的作用,且由于药物分子被吸收入血过程缓慢,在腹腔内作用持续时间明显延长,有利于减少腹膜转移灶,增加手术切除率。
在今年的ASCO会议上,由日本腹腔内化疗课题组(Japan Intraperitoneal Chemotherapy Study Group,JIPG)发布的PHOENIX Ⅲ期临床试验报告引起广泛关注。在日本共计20个医疗中心参加了HPOENIX Ⅲ期临床研究,旨在对Ⅱ期研究中确定的以口服S-1、并静脉与腹腔内给予PTX(IP PTX + S-1/PTX,简称IP组)的NIPS方案进行进一步验证,并与常规全身性化疗方案S-1/CDDP(IV CDDP 60 mg/m2on day 8,PO S-1 80 mg/m2/day on days 1~21, q5wks,简称SP组)进行对照,将两组病例随机以2∶1分别入组,共计183例,最终IP组胃癌腹膜转移病例114例,SP组50例可供有效性分析。由于众多医疗中心的参与,故两组患者的腹膜转移程度与所致腹水程度有所偏差,IP组(114例)与SP组(50例)中无腹水者分别为42例(37%)与29例(58%);少量腹水者(腹水局限在盆腔内)分别为34例(30%)与14例(28%);中等量腹水者(腹水平面高出盆腔)分别为38例(33%)与7例(14%)(P=0.015); 两组腹膜癌指数(Peritoneal Cancer Index,PCI)分别为平均9.5(1~39)与4(1~25)。疗效结果显示IP组与SP组的中位数生存时间(median survival time, MST)为17.7个月与15.2个月(P=0.081)。若将治疗过程中改变方案的6例患者除外分析,则两组的MST分别为17.7个月与14.3个月(P=0.022); 依据患者腹水情况分析MST,在IP组中无腹水者为25.4个月、少量腹水者16.1个月、中等量腹水者13.0个月, 在SP组分别为21.8、12.0与6.8个月, 经Cox回归分析两组间具有显著差异(P=0.007 9); 在IP组与SP组分别有99例与34例患者经过腹腔镜探查证实了腹膜转移灶PCI评分,结合疗效分析结果为PCI为1~9分者,IP组与SP组的MST分别为19.9个月(50例)与15.6个月(25例),10~19分者MST分别为21.3个月(27例)与14.8个月(7例),20~29分者MST分别为10.6个月(12例)与9.4个月(2例),IP组有10例PCI为30~39分,其MST为11.7个月。该Ⅲ期临床研究还发现对于女性、组织学呈弥漫性生长或伴有明显腹水的腹膜转移胃癌患者,采用腹腔内与全身性联合化疗(IP方案)能取得较好的疗效[13]。由JIPG报道的一项多中心RCT报告,共计60例腹膜转移胃癌患者入组,采用SOX + IP PTX(IP PTX 40 mg/m2on day 1 and 8, IV L-OHP 100 mg/m2on days 1 , PO S-1 80 mg/m2/day on days 1~14, q3wks )方案进行转化性治疗,平均治疗10个疗程,总的反应率(overall response rate, ORR)为67%,全组获转化手术治疗21例(35%),其中R0切除11例(18%)、R1与R2切除分别为8例(13%)与2例(3%), 1年OS达71.5%,表明该腹腔内与全身性联合转化治疗方案对伴腹膜转移的胃癌具有较好的疗效[14]。近年来的研究认为,对腹膜转移的胃癌患者通常已不具有直接手术的指征,而应予以积极的转化性治疗,从而争取手术治疗,尤其是R0切除术。根据腹膜转移的程度,转化手术成功率可达41.9%~78%不等,其中R0切除率约为55.6%~68.8%,术后MST为37~43.2个月, 3年OS为50%~55.3%;非R0切除率为31.2%~44.4%,术后MST也能达到18~31.2个月; 而未作转化性手术患者的MST仅约8~10.3个月,再次说明对此类晚期胃癌患者进行转化性治疗的重要意义[15-18]。
5 结语
胃癌腹膜转移治疗是临床面临的极具挑战性的难题,虽然该患者总体预后仍然不佳,但应用转化治疗的理念与方案,积极开展联合腹腔与全身性的新辅助化疗(NIPS),使整体疗效有所改善,延长生存期;其中一部分患者可以获得转化手术治疗,甚至达到R0切除,疗效可获进一步提高。
[1] CHEN W, ZHANG R, BAADE PD, et al. Cancer statistics in China, 2015[J].CA Cancer J Clin,2016,66(2):115-132.
[2] 邹小农,孙喜斌,陈万青,等.2003—2007年中国胃癌发病与死亡情况分析[J].肿瘤,2012,32(2):109-114.
[3] LEE J H, SON S Y, LEE C M, et al.Factors predicting peritoneal recurrence in advanced gastric cancer: implication for adjuvant intraperitoneal chemotherapy[J].Gastric Cancer,2014,17(3):529-536.
[4] NASHIMOTO A,AKAZAWA K,ISOBE Y, et al. Gastric cancer treated in 2002 in Japan:2009 annual report of the JGCA nationwide registry[J]. Gastric Cancer,2013,16(1):1-27.
[5] BISMUTH H, ADAM R.Reduction of nonresectable liver metastasis from colorectal cancer after oxaliplatin chemotherapy[J]. Semin Oncol,1998,25(5):40-46.
[6] FUSHIDA S,OYAMA K,KINOSHITA J,et al.Intraperitoneal chemotherapy as a multimodal treatment for gastric cancer patients with peritoneal metastasis[J]. J Cancer Therapy,2013, 4(9):6-15.
[7] YONEMURA Y, CANBAY E, ENDOU Y,et al.Peritoneal cancer treatment[J]. Expert Opin Pharmacother,2014,15(5): 623-636.
[8] 朱正纲. 紫杉醇与替吉奥联合防治胃癌腹膜转移的临床疗效[J].中华胃肠外科杂志,2015,18(10):979-982.
[9] COCCOLINI F, COTTE E, GLEHEN O, et al. Intraperitoneal chemotherapy in advanced gastric cancer. Meta-analysis of randomized trials[J]. Eur J Surg Oncol,2014,40(1):12-26.
[10] IMANO M,YASUDA A, ITOH T, et al. Phase II study of single intraperitoneal chemotherapy followed by systemic chemotherapy for gastric cancer with peritoneal metastasis[J]. J Gastrointest Surg,2012,16(12):2190-2196.
[11] YONEMURA Y,ELNEMR A, ENDOU Y, et al.Effects of neoadjuvant intraperitoneal/systemic chemotherapy (bidirectional chemotherapy) for the treatment of patients with peritoneal metastasis from gastric cancer[J].Int J Surg Oncol,2012,2012:Article ID 148420.
[12] KITAYAMA J,ISHIGAMI H,YAMAGUCHI H, et al. Salvage gastrectomy after intravenous and intraperitoneal paclitaxel (PTX) administration with oral S-1 for peritoneal dissemination of advanced gastric cancer with malignant ascites[J]. Ann Surg Oncol,2014,21(2):539-546.
[13] ISHIGAMI H, FUJIWARA Y, FUKUSHIMA R, et al.Phase III study of intraperitoneal paclitaxel plus S-1/paclitaxel compared with S-1/cisplatin in gastric cancer patients with peritoneal metastasis: HPOENIX-GC trial[C]. ASCO,2016, Abstract No. 4014.
[14] Japan intraperitoneal chemotherapy study group (JIPG).The intraperitoneal paclitaxel plus S-1/oxaliplatin for gastric cancer with peritoneal metastasis: SOX + IP PTX trial ( Phase II study ) [C]. ASCO,2016, Abstract No. 4040.
[15] BAE J M,YEO K J,KIM S W, et al. Clinical outcomes according to primary treatment in gastric cancer patients with peritoneal seeding[J]. J Gastric Cancer,2011,11(3):167-172.
[16] KIM S W. The result of conversion surgery in gastric cancer patients with peritoneal seeding[J]. J Gastric Cancer,2014,14(4):266-270.
[17] OKABE H,UEDA S,OBAMA K, et al.Induction chemotherapy with S-1 plus cisplatin followed by surgery for treatment of gastric cancer with peritoneal dissemination[J].Ann Surg Oncol,2009,16(12):3227-3236.
[18] KITAYAMA J,ISHIGAMI H,YAMAGUCHI H,et al.S-1 plus intravenous and intraperitoneal paclitaxel for gastric cancer with peritoneal metastasis[J].Gastrointest Cancer Res,2012,5(3 Suppl 1):s10-s13.
朱正纲,男,研究生学历,教授,博士生导师,瑞金医院院长,兼任中国医师协会常委理事,全国胃癌专业委员会主任委员,上海市抗癌协会副理事长,上海市胃肠肿瘤专业委员会主任委员,上海市医院管理委员会副主任委员,中华医学会上海外科学会委员、普外科学会委员等。E-mail:zzg1954@hotmail.com
10.3969/j.issn.1674-4136.2016.04.001
1674-4136(2016)04-0213-04
2016-07-28][本文编辑:李筱蕾]
