放射治疗在胃癌中的应用现状
2016-12-14张楠,尹丽,何侠
张 楠,尹 丽,何 侠
作者单位: 210000 江苏 南京, 南京医科大学第四临床医学院(张 楠,尹 丽); 210009 江苏 南京, 江苏省肿瘤医院 放疗科(何 侠)
晚期胃癌转化治疗
放射治疗在胃癌中的应用现状
张 楠,尹 丽,何 侠
作者单位: 210000 江苏 南京, 南京医科大学第四临床医学院(张 楠,尹 丽); 210009 江苏 南京, 江苏省肿瘤医院 放疗科(何 侠)
胃癌是最常见的恶性肿瘤之一,手术治疗是其主要治疗方式,放射治疗作为一种重要的局部治疗方式在多种肿瘤治疗中受到越来越多的关注。2001年,里程碑式的INT0116研究结果发表之后,放射治疗在胃癌治疗中的作用受到广泛重视,并取得了令人瞩目的成果。该文就目前胃癌中放射治疗应用现状进行综述。
胃癌; 放射治疗; 靶区; D1/D2清扫术
尽管全球范围内胃癌总体发生率已经下降,但其仍然是最常见的恶性肿瘤之一,居癌症相关死亡的首位:2012年全球新发病例约100万人次,死亡病例超过72 000人次[1]。由于缺乏典型的临床前驱症状,超过75%的胃癌患者初诊时即为中晚期,肿瘤已侵犯肌层或淋巴结,5年生存率仅为20%~50%[2]。对于进展期胃癌患者,约50%失去了手术机会,因此,以放化疗为基础的综合治疗显得尤为重要。
近年来,随着放射治疗学的发展,放疗在胃癌中的应用受到越来越多的重视。由于胃特殊的解剖位置及病理形态,传统放疗2D-RT技术在胃癌中的应用受到很大程度的限制,胃正常黏膜以及邻近的肝、肾、小肠等器官(尤其是肾及肝),放射耐受量低,而胃癌多为腺癌,放射治疗剂量需达45~50.4 Gy,毒副反应严重。2001年,JOHN等人[3]在新英格兰杂志上发表了INT0116研究成果之后,放疗在胃癌治疗中的作用受到日益关注,实现由传统的姑息治疗向重要辅助治疗角色的转变。
2 胃癌围手术期的放疗
2.1 术前放疗 术前放疗主要应用于局部进展期胃癌患者以降低肿瘤负荷,使不能手术或手术无法完全切除的患者能够获得手术机会,并且术前放疗可能对于控制微转移病灶有独特的作用,与术后放疗相比更易耐受[4],且术前放疗后病理反应可提供重要的预后预测信息[5]。主要临床试验结果显示,食管交界癌与胃癌相比术前放疗显示出较好的疗效(表1)。
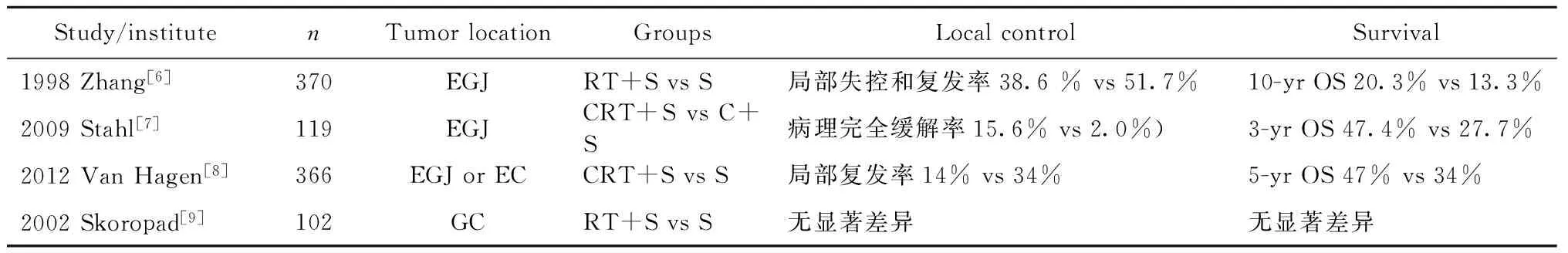
表1 术前放疗Ⅲ期临床试验结果
1998年北京中科院肿瘤医院的一项研究报道[6],370例胃食管交界癌患者接受术前放疗与单纯手术相比可提高肿瘤切除率(74.9%和89.5%),局部失控在两组分别为39%和55%(P<0.05),10年生存率分别为13.3%和20.3%(P=0.009)。术前放疗在提高胃食管交界癌局控率及总生存显示出益处。Stahl等[7]研究显示术前放化疗显著提高了胃食管交界腺癌的病理完全缓解率(15.6%和2.0%),并且有提高总生存率的趋势(3年OS 47.4%和27.7%,P=0.07)。同样,Hagen等[8]对366例胃癌或胃食管交界癌的研究发现,术前放化疗(卡铂+紫杉醇,5周;41.4 Gy/23 f,5天/周)与单纯手术的患者相比完全切除率(92%和69%,P<0.001)及总生存率(中位生存期49.4个月和24个月)明显提高,并且降低了局部复发率(34%和14%,P<0.001)及远处转移(35%和29%,P=0.025)。正是由于此项研究,上述治疗方案成为美国胃食管交界腺癌的推荐治疗方案。
相比于术前放化疗在胃食管交界癌中获得的肯定,局部进展期或可切除胃癌患者接受术前放疗目前尚缺乏大规模Ⅲ期临床试验证据。Skoropad等[9]的研究纳入了102例可切除的胃癌病例,术前放疗20 Gy/5 f与单纯手术相比未能显著提高胃癌患者的局控率及长期生存率(20年生存率分别为32%和18%,P=0.555)。一些单臂前瞻性试验及回顾性分析证实了局部进展期或可切除胃癌患者术前放化疗的安全性及获益[10-14]。Ajani[10]等报道,33例胃腺癌患者接受术前放化疗后原发灶切除率和完全缓解率分别为70%和30%,中位生存期33.7个月。一些荟萃分析研究结果也支持胃癌术前放疗可以使患者生存获益[15-16]。Kumagai等[15]研究结果显示术前放疗或放化疗与单纯手术相比,能使胃癌或胃食管交界癌患者生存获益,同时增加术前放疗之后,并没有明显提高术后复发率或死亡率。
既往关于局部进展期或可手术胃癌术前放化疗疗效的文献多为单臂试验或回顾性分析,Skoropad等[9]的研究入组患者为1974-1978年的患者,治疗手段及放疗技术尚不完善,且病例数较少,虽有20年随访结果,仍具有较大的缺陷。目前胃癌治疗已从传统的单一治疗向多学科治疗发展,目前手术及放化疗综合治疗已成为多种实体肿瘤的治疗方法,胃癌中术前化疗的疗效已得到公认[17-19],而术前同步放化疗与术前单纯化疗相比是否获益尚不明确。目前正在进行的TOPGEAR临床试验[20]正是为了解决此问题,在该试验中,研究对象为胃食管交界癌或者胃癌,术前化疗组采用3个疗程ECF方案(表柔比星+顺铂+氟尿嘧啶);而术前放化疗组,先给予2个疗程ECF方案,随后给予45 Gy放疗,或者同步给予5-FU为基础的放疗;两组患者均在术后予以3个疗程ECF巩固化疗。中国医学科学院正在进行的一项Ⅱ期临床试验(NCT02301481),旨在明确术前放化疗对于局部进展期胃腺癌的疗效是否优于术前单纯化疗。另外,中山大学也开展了类似临床研究(NCT01815853)[21],主要观察患者的总生存率、无进展生存率及治疗的安全性。这些临床试验的结果令人期待。
2.2 术后放疗 众所周知,里程碑式的研究INT0116[3]发现同步放化疗能显著提高胃癌根治术后患者的生存率,该结果奠定了术后辅助放疗在胃癌辅助治疗的重要地位。但是该研究也有许多不足之处,如手术方式缺乏严格控制(接受D2手术的病例仅有10%)、照射技术的缺陷以及总体依从性不高等等。尽管如此,INT0016仍是胃癌术后辅助放化疗重要依据。2010年柳叶刀杂志发表了D1、D2术后15年的随访研究成果之后[22],D2手术在降低局部区域复发方面的优势使其逐渐成为可手术切除局部进展期胃癌的标准术式。下文主要就D2术后放疗现状进行阐述,近年来主要的Ⅲ期临床试验结果如表2所示。
作为胃癌术后辅助放疗里程碑的INT0116研究,2012年其10年随访结果显示同步放化疗组延续了其生存获益[23],并且D1或D2亚组均可以从术后同步放化疗中获益。同年,韩国的ARTIST研究[24]结果显示,增加放疗后并没有显著延长患者无病生存期,但对于有淋巴结转移的患者,术后放疗显示出其生存优势,遗憾的是差异无统计学意义(P=0.38)。对于ARTIST试验7年最终结果也同样显示OS及DFS相似,而淋巴结阳性的患者可以明显从同步放化疗中获益[25]。2012年,来自韩国和中国的另外2项Ⅲ期临床试验结果显示D2术后放疗尽管不能提高OS,但是可以提高患者无局部区域复发生存(LRRFS)[26-27]。

表2 胃癌术后放疗Ⅲ期临床试验结果
通过对近期Ⅲ临床试验结果的分析,笔者认为来自东方的3项研究得出阴性结果的原因在于主要是由于D2手术及术后化疗的广泛采用, D2手术淋巴清扫范围大,辅之以术后化疗,对于部分患者治疗以D2手术+化疗是足够的,INT-0016的研究主要为D1手术,淋巴清扫范围小,放疗在局部控制方面可以起到更大的作用,因此得出阳性结果。这也提示对于D2术后放疗适应人群筛选的必要性。
放射治疗作为一种重要的局部治疗方式,在局部控制方面具有独特的作用,然而,并不是所有分期的患者均需要辅以放射治疗。ARTIST研究[24]中Ⅲ~Ⅳ期患者仅占41%,淋巴结阳性患者DFS优于淋巴结阴性患者,NCC试验[26]中入组全部为Ⅲ~Ⅳ期患者,5年LRRFS 84.4% vs 62.7%(P=0.121),DFS 60.9% vs 50.0%(P=0.246),亚组分析Ⅲ期患者5年LRRFS 93.2% vs 66.8%(P=0.006),DFS 73.5% vs 54.6%(P=0.056),Ⅲ期患者5年接受放疗LRRFS获益明显。此外,对于单纯术后化疗预后结果的分析也支持Ⅲ期患者术后放疗的必要性。Sasako等[28]报道对于D2术后S-1化疗与单纯手术患者,Ⅱ期5年RFS为79.2%和64.4%,ⅢA期5年RFS 为61.4%和50.0%,ⅢB期RFS为37.6和34.4%,该研究亚组分析显示对于分期更高患者单纯化疗并不能更好的提高RFS,因此对于Ⅲ期胃癌患者D2术后增加放疗是有必要的。
我们认为,D2术后是否需要放疗应该根据疾病分期来决定,ARTIST研究中Ⅲ~Ⅳ期患者仅占41%,对于Ⅰ~Ⅱ期患者仅仅依靠D2术后化疗或许就可获得较好的治疗效果,术后放化疗可能是一种过度治疗,因此ARTIST 淋巴结阳性患者DFS获益并不十分明显。而对于更高分期患者,尤其是Ⅲ期患者,放疗在肿瘤局部控制上独特的优势将更受到重视。Datta等[29]对于23 461例早期胃癌(IB-Ⅱ)患者的回顾性大数据分析显示,早期胃癌各个分期均可从术后放疗中获益,但是其研究不能确定患者手术方式为D1或者D2,目前仍然需要设计严谨的前瞻性随机临床试验来验证不同分期淋巴结阳性胃癌患者是否可以从放射治疗中受益。
由于西方D2术式尚未像东方那样普及,暂没有大型Ⅲ期临床试验证实D2术后放化疗的疗效。最新的胃癌NCCN指南(2016.V1)仍然推荐D2淋巴结清扫术后进行术后化疗,对于小于D2切除范围的患者,应首选术后放化疗。近期来自亚洲的3项Ⅲ期临床试验证实了D2术后进行放化疗在提高局部控制率方面的有效性及安全性,提示对于D2术后部分患者,尤其是Ⅲ期患者进行同步放化疗的可行性。目前正在进行的相关Ⅲ期临床试验多是从具体的放化联合模式来探讨放疗的可行性及有效性,包括卡培他滨+顺铂为基础的同步放化疗与单纯化疗的疗效比较[30]、卡培他滨+奥沙利铂为基础的同步放化疗与单纯化疗的比较[31]。正在进行的ARTIST Ⅱ试验[32]则采用复方替加氟奥替拉西胶囊(S-1)+奥沙利铂为基础的同步放化疗方案,入组患者则针对淋巴结阳性的患者。值得一提的是同样基于S-1及顺铂治疗的一项Ⅱ期临床试验结果显示同步放化疗组与单纯术后化疗组相比提高了3年DFS,并且毒性可接受[33]。ARTIST Ⅱ试验结果值得期待。近年来一些荟萃分析的结果也肯定了围手术期放疗在胃癌治疗中的作用[34-36]。其中,Pang等[35]分析发现术前放疗对于长期总生存率(>10年)有显著提高,而术后放疗则是提高了3年和5年无进展生存。
由此可见,在可手术切除局部晚期胃癌的围手术期,尤其是在D2术后的综合管理中,针对部分特定人群,放疗可作为重要的辅助治疗手段,有效降低局部复发率,提高患者的无进展生存。而胃癌术前放疗的价值仍需要进一步的论证,已有学者认为术前放疗可提高肿瘤的完整切除率,同时,为部分患者赢得手术机会,期待相关随机对照研究的结果。另外,肿瘤放射敏感性的筛选近年来受到越来越多的重视。比如,E2F-1阳性[37]以及HER2表达缺失[38]可能成为胃癌术后放化疗反应的较好的预测指标。此外,体外试验证明CHK1过表达可能与放射抵抗有关[39]。那么,这些标志物是否可作为新的危险因素对患者进行亚组分层,从而来筛选临床中可能从胃癌放疗获益的那部分人群,这一问题也值得深入探讨。
3 不可手术Ⅳ期胃癌的放射治疗
根据AJCC 第七版胃癌分期,Ⅳ期是指出现远处转移。一项基于美国流行病学数据库SEER的统计报道[40],约34%的胃癌患者初诊时即为Ⅳ期,已丧失手术的机会,5年生存率仅为13.1%[41]。目前,Ⅳ期胃癌治疗以放化综合治疗为主,或行姑息性手术(胃切除或旁路术)以及胃支架等姑息治疗[42]。对于这部分人群,放疗主要是作为姑息治疗手段,目标是减轻出血、胃狭窄、疼痛等系统症状,尤其是一般状况较差不能接受姑息手术及全身化疗的患者胃出血的控制。
Asakura等[43]报道30例胃癌出血的患者有22例对放疗(剂量30 Gy/10 f)有反应,其中,有11例再发出血,中位再出血时间为3.3个月。类似的研究也多有报道。随着显著提高生存率的有效化疗药物的发展,局部症状的控制变得更加重要。因此,姑息性放疗对于终末期、不可切除的进展期胃癌是一种有效的治疗手段。
4 放疗靶区范围的进展
4.1 术前放疗靶区勾画 由于缺乏大规模随机对照研究来定义照射野,既往术前放疗靶区多为全胃和大范围淋巴区域(淋巴结照射区包括食管旁,上达气管分叉及胃小弯,下至第二腰椎水平[13])。2009年EORTC-ROG(欧洲癌症治疗研究组放疗协作组)对胃食管交界处腺癌和胃腺癌术前放疗专家意见为未来临床试验定义靶区范围及减少误差提供了参考[44]。由于术前胃癌放疗疗效尚未达成共识,笔者仅就胃食管交界癌或近端胃癌放疗靶区进行阐述。
由于胃是一个特殊的空腔器官,其位置容易受到体位及呼吸运动的影响,既往报道显示约35%的治疗方案存在或大或小的误差[3],如何减少摆位及呼吸所造成的误差成为现代放射治疗不断努力的方向。Stahl的研究[7]中,临床靶区(CTV)范围包括治疗前所有原发肿瘤及其近端以上5 cm和远端以下3 cm的范围,所有肉眼可见受累淋巴结1 cm以外的区域。计划靶区PTV包括CTV以及CTV之外8 mm以纠正设置及器官移动误差。而Hagen等研究[8]中,PTV包括原发肿瘤近端及远端以外4 cm,肿瘤侵犯胃体时远端为3 cm,GTV以外1.5 cm以纠正设置及器官移动误差。2009年,EORTC-ROG专家意见[44]中指出,尽管没有充足的证据来提出靶区设置标准,如果没有更好的识别器官移动时,CTV近端以外1 cm,远端以外1.5 cm,横向以外1 cm以减少误差,上述两项研究基本与之相符。目前仍需要进一步随机对照试验优化胃癌术前放疗靶区。
EORTC-ROG专家意见(2009)中给出了根据Siewert’s分类EGJ不同类型相关淋巴引流区域(table 1)供临床医师靶区勾画时参考。但是,该意见仅仅从解剖学上给予了相关淋巴区域分布,未能给予CT等影像学图示,更重要的一点,该意见未提及胃癌局部区域复发规律相关研究,未能明确不同复发高危人群的复发风险和失败部位。
2014年,Oppedijk等基于Hagen的研究提出了术前放化疗后食管癌或胃食管交界处癌的不同复发风险模式[45]。该研究报道在至少24个月的随访之后,手术组和手术+CRT组的总复发率分别为58%和35%,术前放化疗组局部区域复发率(LRR)由34%较少至14%。术前放化疗组有5%LRR发生在照射野内,2%LRR位于照射野边缘,而野外LRR达到6%。该研究中腹腔干淋巴结、腹主动脉旁、腹膜种植占了很大比重(S Arm复发161例,三者占50例;CRT+S组 复发122例,三者占31例),此3处复发多与远端食管及EGJ有关,尽管EGJ仅占总病例数约1/4,仍对EGJ复发高危区域提供了参考价值。
Oppedijk等研究显示野外LRR发生率仍然较高,术前放疗靶区进一步扩大是需要的。目前来说,胃食管交界腺癌仍缺乏可靠数据及指南来指导临床靶区勾画,尤其是基于大规模前瞻性临床试验区域淋巴结复发及失败模式的研究,以指导靶区范围的优化。
4.2 术后放疗靶区勾画 由于胃癌原发肿瘤部位、分期、淋巴转移各不相同,加之手术方式不同、术后切缘情况的不一致,目前胃癌术后放射治疗靶区勾画尚无统一标准。最早的术后靶区勾画指南于2002年由Smalley[46]和Tepper等[47]提出,其主要依据是“原发肿瘤部位不同,淋巴结转移规律也不同”的原理,对不同手术方式后的靶区分别进行了定义。但是该指南为基于二维时代图像前后对穿野设计,不良反应多,局控率仍较低,而现代放疗技术的发展越来越向低损伤、高控制的方向发展,更多关注于胃癌局部区域复发规律及高危人群的确定。
Nam等[48]通过对291例胃大部切除术D2术后的患者回顾性分析,其中83例照射野包括残胃,208例照射野不包括残胃,结果显示两组5年总生存率及无疾病进展生存率无显著差异,但3~4度腹泻在以残胃作为照射野的患者中更加多见,因此Nam建议在进行胃大部切除D2术后患者放疗时放射野应排除残胃。ARTIST研究根据既往研究成果,也将“残胃”从照射野中排除。与暂时的治疗不良反应相比,我们更应关注患者长期生存结局,尤其是残胃癌的发生。Ohira等[49]报道胃癌术后发生残胃癌的平均间隔为6.8~18.8年,Nam的研究随访时间仅为5年,尽管目前尚无术后放疗与残胃癌发生关系的报道,术后残胃复发也应该受到重视。另一方面,该研究入组患者为1995-2001年,其放疗方式多为传统的2D-RT,不良反应大,而现代放疗技术的发展在降低不良反应方面已具有独特的优势。入组患者为Ⅲ~Ⅳ的NCC试验中除外左肾剂量过高的情况,照射野仍将残胃包括在内。来自中国的IMRT研究也将残胃包括在靶区内,结果显示毒性可以接受。研究支持基于IMRT等精确放疗技术,照射残胃所导致的毒副反应可以控制。
近期几项大型Ⅲ期临床试验除了ARTIST研究淋巴结靶区范围多包括全部1~16组淋巴结(表3),ARTIST试验靶区仅包括第7~9组及12~16组淋巴结,降低了肠道的照射剂量,不良反应与单纯化疗相比无显著差异。这也提示了传统胃癌淋巴结靶区范围或许是过大的,对于高危淋巴结区域选择性照射应该基于所有D2术后患者不同区域淋巴结的复发情况,确定高危风险淋巴区域,优化靶区。2012年韩国Chang等[50]通过对357例D2或D3术后Ⅲ期患者回顾性分析结果显示腹膜是最常见的复发部位,最常见的淋巴结复发区域位于D2手术野之外(12~16),无论肿瘤位置,No.16a和No.16b是最常见的淋巴结复发部位。

表3 Ⅲ期临床试验术后靶区设计及毒性反应
Yoon等[51]基于以上研究中91例D2术后N3患者淋巴结复发模式的分析提出了以血管结构为参照的靶区勾画范围建议。该研究结果显示,对于任何肿瘤部位,No.16a和No.16b均有很大的复发风险。复发高危部位依次为腹主动脉旁(No.16b 61.5%,No.16a 58.2%),肝十二脂肠韧带(No.12 28.6%),肠系膜上血管周围(No.14 19.8%),胰头后(No.13 15.4),腹腔干(No.9 15.4%),近端脾动脉周围(No.11 7.0%),肝总动脉周围(No.8 3.0%),左心包旁(No.2 2.0%),脾门(No.10 1.0%)。无论原发肿瘤位置如何,No.16a/b是最常见的淋巴结复发部位,上段胃癌常见淋巴结复发部位依次是No.9,10,13;中段胃癌常见部位依次是No.12,14;远端胃癌常见部位依次为No.12,13,14,9,11;当原发肿瘤超过2/3胃体时,常见复发部位依次是No.14,12,11,9,2。该研究结果显示胃周(No.1~6)、脾门(No.10)及肠系膜上动脉以下淋巴结复发相当罕见。由此可见,所有原发肿瘤部位CTV必须包括No.16a和No.16b,肿瘤仅位于上段胃时,CTV可以不包括胃周(No.1~6)、肝门(No.12)和前一段的肠系膜上动脉血管(No.14)淋巴结,而脾门(No.10)及前段脾动脉(No.11)应该包括在内。当原发肿瘤位于中段或下段1/3胃时,除了胃周(No.1~6),近端脾动脉及脾门(No.10,11)其他淋巴结区域均应在靶区中,超过2/3胃癌CTV应该包括左心包旁(No.2)。
就目前研究报道而言,术后放疗靶区范围基本覆盖了所有可能局部区域复发的淋巴结区域,由于术后极低的复发率,对于胃周淋巴结(No.1~6)和脾门淋巴结(No.10,11),靶区勾画时可考虑将其排除在外。值得一提的是Datta等[52]从术后复发模式及靶区定义方面对于ARTIST研究进行了重新评价,其研究发现ARTIST失败模式与Yoon等研究结果相似,而放化疗组与单纯化疗组相比,明显降低了No.16a/b,13,14组肠系膜上血管淋巴结区域的复发率(Group 3 XP arm 21例,XRT arm 4例,P<0.001),放射治疗在控制高危淋巴结复发方面优势明显。Yoon等[51]的研究是目前仅有的关于术后复发淋巴区域靶区勾画的研究,根据淋巴结区域的不同为优化靶区提出了意见,但是该研究仅仅是针对N3且标准D2术后得到的结果,对于胃癌其他分期及手术方式,仍需要进一步的研究来优化靶区。
5 现代放疗技术进展
由于INT0116研究采用的均是2D-RT技术,照射范围大,邻近正常组织和危及器官剂量控制不佳,治疗相关不良反应多,Ⅲ度和Ⅳ度不良反应发生率高达41%和32%。随着现代放射物理学及放射生物学的不断发展,放疗技术也有了革命性的飞跃,相继出现了三维适形放疗(3D-radiation therapy,3D-RT)、适形调强放疗(intensity modulated radiation therapy,IMRT)、影像引导放疗(image-guided radiotherapy,IGRT)和质子放疗技术等,关键性的技术革命体现在提高了靶区剂量分布的适应性。其中,3D-RT可以较好的保护敏感的正常组织,减少放射毒性,是目前胃癌放疗的常用手段。韩国的ARTIST 研究开始了2D到3D-RT 技术的应用转变,Ⅲ度和Ⅳ度非血液学不良反应发生率仅为1%~12%,明显低于INT0116研究。基于3D-RT技术发展的IMRT在脊髓、肾、肝等危及器官的保护显示出更好的效果,对于二者的优劣也有相关的研究[53],该研究结果显示2年总生存率无显著差异,2度及以上急性胃肠毒性反应相似(61.5%和61.2%),值得关注的是,IMRT明显减少了肝脏靶区剂量。Trip等[54]研究则显示IMRT与3D-RT相比减少了肾毒性。因此,IMRT对于肝肾功能的保护优于3D-RT,胃癌放疗中涉及危及器官和正常组织减量时需选择IMRT技术。近年来,对于胰腺的放射损伤越来越受到重视,有文献报道胰腺应该作为OAR[55]。另外,作为目前国际最先进的放射治疗技术,容积弧形调强放射治疗技术(volumetric intensity modulated arc therapy,VMAT)也有较好的临床获益,使得高剂量区与肿瘤区域高度适形,达到在灭杀肿瘤组织的同时有效地保护周围正常组织[56-57]。但其在胃癌治疗中的应用价值仍有待证实。
姑息性放疗对于晚期胃癌患者的治疗具有重要的临床意义,与根治性放疗相比,短周期姑息性放疗相对简单,且更强调治疗方式的有效性,在几周甚至几天的时间内改善症状,且尽可能减少副反应的发生,改善患者的生活质量,基于IMRT发展的IGRT技术能很好的满足这些要求[58]。
随着精准医学时代的到来,未来放射治疗发展的方向是在肿瘤治疗上逐步走向高精度、高剂量、高疗效和低损伤(三高一低)的现代放疗模式。以生物影像、生物靶区、生物剂量为基础的新型放疗设备和技术将使包括胃癌在内的肿瘤放射治疗技术进入一个新的时期。
6 总结与展望
根据NCCN(2016 V1)指南,笔者对其胃癌放疗适应证进行了总结(表4)。围手术期的放疗已被证实可有效降低胃癌患者的局部复发率,改善生存。对于那些无法保证切缘阴性和D2根治术的患者,术前同步放化疗可提高肿瘤完全切除率或增加手术机会,但缺乏相关的多中心随机对照研究,术前放疗的价值仍需深入探讨。D1手术术后放疗是必要的,而对于D2手术的患者,对于高分期患者、尤其是Ⅲ期患者也是需要的。另外,姑息性放疗的价值在Ⅳ期胃癌中明确,放疗技术的进步可进一步提高其疗效,同时减轻治疗相关毒副反应。
放疗作为重要的局部治疗手段拥有广阔的应用前景,肿瘤综合治疗中最佳联合方案、靶区设计及优化和放疗技术的提高,是未来放射治疗重要的研究发展方向。除此之外,新的放疗敏感性标志物的筛选将使胃癌患者更能从个体化治疗中获益,未来的研究需要关注适用人群筛选及与其他治疗的有机结合。

表4 胃癌放射治疗适应证(NCCN 2016.V1)
[1] FERLAY J, SOERJOMATARAM I, DIKSHIT R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer,2015,136(5):E359-386.
[2] EDGE S B, COMPTON C C. The American Joint Committee on Cancer: the 7th edition of the AJCC cancer staging manual and the future of TNM[J]. Ann Surg Oncol,2010, 17(6):1471-1474.
[3] MACDONALD J S, SMALLEY S R, BENEDETTI J, et al. Chemoradiotherapy after surgery compared with surgery alone for adenocarcinoma of the stomach or gastroesophageal junction[J]. N Engl J Med,2001,345(10):725-730.
[4] TORMO FERRERO V, ANDREU MARTINEZ F J, CARDENAL MACIA R, et al.Evaluation of the toxicity of the combined treatment of chemoradiotherapy, according to the scheme of Macdonald, after radical surgery in patients diagnosed of gastric cancer[J]. Clin Transl Oncol,2006,8(8):611-615.
[5] YAO J C, MANSFIELD P F, PISTERS P W, et al. Combined-modality therapy for gastric cancer[J]. Semin Surg Oncol,2003,21(4):223-227.
[6] ZHANG Z X, GU X Z, YIN W B, et al. Randomized clinical trial on the combination of preoperative irradiation and surgery in the treatment of adenocarcinoma of gastric cardia (AGC) e report on 370 patients[J]. Int J Radiat Oncol Biol Phys,1998,42(5):929-934.
[7] STAHL M, WALZ M K, STUSCHKE M,et al. Phase III comparison of preoperative chemotherapy compared with chemoradiotherapy in patients with locally advanced adenocarcinoma of the esophagogastric junction[J]. J Clin Oncol,2009,27(6):851-856.
[8] VAN HAGEN P, HULSHOF M C, VAN LANSCHOT J J, et al. Preoperative chemoradiotherapy for esophageal or junctional cancer[J]. N Engl J Med,2012,366(22):2074-2084.
[9] SKOROPAD V, BERDOV B, ZAGREBIN V. Concentrated preoperative radiotherapy for resectable gastric cancer: 20-years follow-up of a randomized trial[J]. J Surg Oncol,2002,80(2):72-78.
[10] AJANI J A, MANSFIELD P F, JANJAN N, et al. Multiinstitutional trial of preoperative chemoradiotherapy in patients with potentially resectable gastric carcinoma[J]. J Clin Oncol,2004,22(14):2774-2780.
[11] AJANI J A, MANSFIELD P F, CRANE C H, et al. Paclitaxel-based chemoradiotherapy in localized gastric carcinoma: degree of pathologic responseand not clinical parameters dictated patient outcome[J]. J Clin Oncol,2005,23(6):1237-1244.
[12] BALANDRAUD P, MOUTARDIER V, GIOVANNINI M,et al. Locally advanced adenocarcinomas of the gastric cardia: results of pre-operative chemoradiotherapy[J]. Gastroenterol Clin Biol,2004,28(8-9):651-657.
[13] KLAUTKE G, FOITZIK T, LUDWIG K, et al. Neoadjuvant radiochemotherapy in locally advanced gastric carcinoma[J]. Strahlenther Onkol,2004,180(11):695-700.
[14] LOWY A M, FEIG B W, JANJAN N, et al. A pilot study of preoperative chemoradiotherapy for resectable gastric cancer[J]. Ann Surg Oncol,2001,8(6):519-524.
[15] KUMAGAI K, ROUVELAS I, TSAI J A, et al. Survival benefi and additional value of preoperative chemoradiotherapy in resectable gastric and gastro-oesophageal junction cancer: a direct and adjusted indirect comparison meta-analysis[J]. Eur J Surg Oncol,2015,41(3):282-294.
[16] FIORICA F, CARTEI F, ENEA M, et al. The impact of radiotherapy on survival in resectable gastric carcinoma: a meta-analysis of literature data[J]. Cancer Treat Rev,2007,33(8):729-740.
[17] CUNNINGHAM D, ALLUM W H, STENNING S P, et al. Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer[J]. N Engl J Med,2006,355(1):11-20.
[18] YCHOU M, BOIGE V, PIGNON J P, et al. Perioperative chemotherapy compared with surgery alone for resectable gastroesophageal adenocarcinoma: an FNCLCC and FFCD multicenter phase III trial[J]. J Clin Oncol,2011,29(13):1715-1721.
[19] SCHUHMACHER C, GRETSCHEL S, LORDICK F, et al. Neoadjuvant chemotherapy compared with surgery alone for locally advanced cancer of the stomach and cardia: European Organisation for Research and Treatment of Cancer randomized trial 40954[J]. J Clin Oncol,2010,28(35):5210-5218.
[20] AUSTRALASIAN GASTRO-INTESTINAL TRIALS GROUP. Trial of preoperative therapy for gastric and esophagogastric junction adenocarcinoma (TOPGEAR) [OL]. http://clinicaltrials.gov/show/NCT01924819.
[21] ZHOU Z. Pre-operative chemoradiotherapy or chemotherapy following surgery and adjuvant chemotherapy in patients with gastric cancer[OL]. http://clinicaltrials.gov/ct2/show/NCT01815853.
[22] SONGUN I, PUTTER H, KRANENBARG E M, et al. Surgical treatment of gastric cancer: 15-year follow-up results of the randomized nationwide Dutch D1D2 trial[J]. Lancet Oncol,2010,11(5):439-449.
[23] SMALLEY S R, BENEDETTI J K, HALLER D G, et al. Updated analysis of SWOG-directed intergroup study 0116: a phase III trial of adjuvant radiochemotherapy versus observationafter curative gastric cancer resection[J]. J Clin Oncol,2012,30(19):2327-2333.
[24] LEE J, LIM D O H, KIM S, et al. Phase Ⅲ trial comparing capecitabine plus cisplatin versus capecitabine plus cisplatin with concurrent capecitabine radiotherapy in completely resected gastric cancer with D2 lymph node dissection: the ARTIST trial[J]. J Clin Oncol,2012,30(3):268-273.
[25] PARK S H, SOHN T S, LEE J,et al. Phase III Trial to Compare Adjuvant Chemotherapy With Capecitabine and Cisplatin Versus Concurrent Chemoradiotherapy in Gastric Cancer: Final Report of the Adjuvant Chemoradiotherapy in Stomach Tumors Trial, Including Survival and Subset Analyses[J]. J Clin Oncol,2015,33(28):3130-3136.
[26] KIM T H, PARK S R, RYU K W,et al.Phase 3 trial of postoperative chemotherapy alone versus chemoradiation therapy in stage III-IV gastric cancer treated with R0 gastrectomy and D2 lymph node dissection[J]. Int J Radiat Oncol Biol Phys,2012,84(5):e585-592. [27] ZHU W G, XUA D F, PU J, et al. A randomized, controlled, multicenter study comparing intensitymodulated radiotherapy plus concurrent chemotherapy with chemotherapy alone in gastric cancer patients with D2 resection[J]. Radiother Oncol,2012,104(3):361-366.
[28] SASAKO M, SAKURAMOTO S, KATAI H, et al.Five-year outcomes of a randomized phase III trial comparing adjuvant chemotherapy withS-1 versus surgery alone instage II or III gastric cancer[J]. J Clin Oncol,2011,29: 4387-4393.PMID: 22010012.DOI: 10.1200/JCO.2011.36.5908.
[29] DATTA J, MCMILLAN M T, RUFFOLO L,et al. Multimodality Therapy Improves Survival in Resected Early Stage Gastric Cancer in the United States[J]. Ann Surg Oncol,2016,PMID: 27090793.
[30] KANG W K. Phase III randomized trial of adjuvant XP chemotherapy and XP/RT for resected gastric adenocarcinoma[OL]. http://clinicaltrials.gov/ct2/show/NCT00323830.
[31] XIE C. Trial of adjuvant XELOX chemotherapy and concurrent capecitabine and radiotherapy for resected gastric carcinoma[OL]. http://clinicaltrials.gov/ct2/show/NCT01711242.
[32] KANG W K. Phase III randomized trial of adjuvant chemotherapy with S-1 vs. S-1/oxaliplatin ± radiotherapy for completely resected gastric adenocarcinoma: the ARTIST II trial (ARTIST-II) [OL]. http://clinicaltrials.gov/ct2/show/NCT01761461.
[33] SHIM H J, KIM K R, HWANG J E, et al. A phase II study of adjuvant S-1/cisplatin chemotherapy followed by S-1-based chemoradiotherapy for D2-resected gastric cancer[J]. Cancer Chemother Pharmacol,2016,77(3):605-612.
[34] OHRI N, GARG M K, APARO S,et al. Who benefits from adjuvant radiation therapy for gastric cancer? A meta-analysis[J]. Int J Radiat Oncol Biol Phys,2013,86(2):330-335.
[35] PANG X, WEI W, LENG W, et al. Radiotherapy for gastric cancer: a systematic review and meta-analysis[J]. Tumour Biol,2014,35(1):387-396.
[36] SOON Y Y, LEONG C N, TEY J C, et al.Postoperative chemo-radiotherapy versus chemotherapy for resected gastric cancer: A systematic review and meta-analysis[J]. J Med Imaging Radiat Oncol,2014,58(4):483-496.
[37] LEE J, PARK C K, PARK J O,et al. Impact of E2F-1 expression on clinical outcome of gastric adenocarcinoma patients with adjuvant chemoradiation therapy[J]. Clin Cancer Res,2008,14(1):82-88.
[38] GORDON M A, GUNDACKER H M, BENEDETTI J, et al. Assessment of HER2 gene amplification in adenocarcinomas of the stomach or gastroesophageal junction in the INT-0116/SWOG9008 clinical trial[J]. Ann Oncol,2013,24(7):1754-1761.
[39] BARGIELA-IPARRAGUIRRE J,PRADO-MARCHAL L, FERNANDEZ-FUENTE M, et al.CHK1 expression in Gastric Cancer is modulated by p53 and RB1/E2F1: implications in chemo/radiotherapy response[J].Sci Rep,2016,6:21519.
[40] HOWLADER N, NOONE A M, KRAPCHO M,et al. SEER Cancer Statistics Review, 1975-2011, National Cancer Institute[OL]. http://seer.cancer.gov/csr/1975_2011/, based on November 2013 SEER data submission, posted to the SEER web site, April 2014.
[41] FANG W L, HUANG K H, CHEN J H, et al. Comparison of the survival difference between AJCC 6th and 7th editionsfor gastric cancer patients[J]. World J Surg,2011,35(12):2723-2729.
[42] HASHIMOTO K, MAYAHARA H, TAKASHIMA A, et al. Palliative radiation therapy for hemorrhage of unresectable gastric cancer: a single institute experience[J]. J Cancer Res Clin Oncol,2009,135(8):1117-1123.
[43] ASAKURA H, HASHIMOTO T, HARADA H, et al. Palliative radiotherapy for bleeding from advanced gastric cancer: is a schedule of 30 Gy in 10 fractions adequate? [J].J Cancer Res Clin Oncol,2011,137(1):125-130.
[44] MATZINGER O, GERBER E, BERNSTEIN Z, et al. EORTC-ROG expert opinion: radiotherapy volume and treatment guidelines for neoadjuvant radiation of adenocarcinomas of the gastroesophageal junction and the stomach[J]. Radiother Oncol,2009,92(2):164-175.
[45] OPPEDIJK V, VAN DER GAAST A, VAN LANSCHOT J J, et al.Patterns of recurrence after surgery alone versus preoperative chemoradiotherapy and surgery in the CROSS trials[J]. J Clin Oncol,2014,32(5):385-391.
[46] SMALLEY S R, GUNDERSON L, TEPPER J, et al. Gastric surgical adjuvant radiotherapy consensus report: rationale and treatment implementation[J]. Int J Radiat Oncol Biol Phys,2002,52(2):283-293.
[47] TEPPER J E, GUNDERSON L L. Radiation treatment parameters in the adjuvant postoperative therapy of gastric cancer[J]. Semin Radiat Oncol,2002,12(2):187-195.
[48] NAM H, LIM D H, KIM S,et al. A new suggestion for the radiation target volume after a subtotal gastrectomy in patients with stomach cancer[J]. Int J Radiat Oncol Biol Phys,2008,71(2):448-455.
[49] OHIRA M, TOYOKAWA T, SAKURAI K, et al.Current status in remnant gastric cancer after distal gastrectomy[J].World J Gastroenterol,2016,22(8):2424-2433.
[50] CHANG J S, LIM J S, NOH S H, et al. Patterns of regional recurrence after curative D2 resection for stage III (N3) gastric cancer: implications for postoperative radiotherapy[J]. Radiother Oncol,2012,104(3):367-373.
[51] YOON H I, CHANG J S, LIM J S, et al. Defining the target volume for postoperative radiotherapy after D2 dissection in gastric cancer by CT-based vessel-guided delineation[J]. Radiother Oncol, 2013,108(1):72-77.
[52] DATTA J, MCMILLAN M T, RUFFOLO L,et al. Multimodality Therapy Improves Survival in Resected Early Stage Gastric Cancer in the United States[J]. Ann Surg Oncol,2016,PMID: 27090793.
[53] MINN A Y, HSU A, LA T,et al.Comparison of intensity-modulated radiotherapy and 3-dimensional conformal radiotherapy as adjuvant therapy for gastric cancer[J]. Cancer,2010,116(16):3943-3952. [54] TRIP A K, NIJKAMP J, VAN TINTEREN H, et al.IMRT limits nephrotoxicity after chemoradiotherapy for gastric cancer[J].Radiother Oncol,2014,112(2):289-294.
[55] WYDMANSKI J, POLANOWSKI P, TUKIENDORF A,et al. Radiation-induced injury of the exocrine pancreas after chemoradiotherapy for gastric cancer[J]. Radiother Oncol,2016,118(3):535-539.
[56] WANG X, LI G, ZHANG Y, et al.Single-arc volumetric-modulated arc therapy (sVMAT) as adjuvant treatment for gastric cancer: dosimetric comparisons with three-dimensional conformal radiotherapy (3D-CRT) and intensity-modulated radiotherapy (IMRT)[J].Med Dosim,2013,38(4):395-400.
[57] ZHANG T, LIANG Z W, HAN J, et al. Double-arc volumetric modulated therapy improves dose distribution compared to static gantry IMRT and 3D conformal radiotherapy for adjuvant therapy of gastric cancer[J]. Radiat Oncol,2015,10:114.
[58] SAMANT R, GERIG L, MONTGOMERY L, et al.The emerging role of IG-IMRT for palliative radiotherapy: a single-institution experience[J].Curr Oncol,2009,16(3):40-45.
张 楠,男,硕士研究生在读,研究方向:放射敏感性的提高,E-mail:411181042@qq.com
何 侠,男,主任医师,肿瘤学博士,教授,博士研究生导师,江苏省临床重点专科肿瘤放射治疗科学科带头人、首批卫生拔尖人才,江苏省六大高峰人才。对各种恶性肿瘤的放疗技术有深入的研究,主持及参与国自然及省级以上科研项目多项。E-mail: 13601458518@139.com
10.3969/j.issn.1674-4136.2016.04.003
1674-4136(2016)04-0223-08
2016-07-28][本文编辑:李筱蕾]
