MMS2和P53基因对结肠癌细胞增殖与凋亡的影响①
2016-12-13马琳园李元杰
马琳园 隋 御 马 璐 李 昕 李元杰 徐 方
(宁夏医科大学宁夏回族自治区生殖与遗传重点实验室,银川750004)
MMS2和P53基因对结肠癌细胞增殖与凋亡的影响①
马琳园 隋 御 马 璐 李 昕 李元杰 徐 方
(宁夏医科大学宁夏回族自治区生殖与遗传重点实验室,银川750004)
目的:探讨MMS2 siRNA 与P53 siRNA 对人高分化结肠癌细胞(THC-8307)的增殖与凋亡的相互调控作用。方法:以实时定量聚合酶链反应(qRT-PCR)、蛋白印迹法(Western blot)分析检测细胞转染效率,选择沉默效率具有统计学意义的THC-8307细胞作为实验组,同时将未作处理的THC-8307作为空白对照,转染空质粒细胞作为阴性对照。采用qRT-PCR及Western blot分别检测干扰各组目的基因后其两基因相互关系及表达量。采用流式细胞术检测各组细胞的凋亡率,以明确其对结肠癌细胞增殖与凋亡的作用。结果:实验组与对照组相比,分别沉默MMS2基因与P53基因的结肠癌细胞内P53与MMS2的 mRNA与蛋白水平显著升高(P<0.05)。沉默MMS2实验组其早期凋亡与晚期凋亡率增加(P<0.05)。结论:MMS2和P53在结肠癌细胞增殖与凋亡方面起反向调控作用。
MMS2;P53;RNA干扰;人结肠癌细胞;细胞凋亡
结肠癌(Colorectal cancer,CRC)是常见的恶性肿瘤之一。据最新统计学分析显示,全球范围内,结肠癌的发病率和死亡率均位列第三位[1],新增病例以每年超过100万例的速度递增[2]。在我国,结肠癌是最常见的恶性肿瘤,仅次于胃癌和食道癌并且逐年来其发病率呈上升趋势 ,在部分发达城市甚至已经达到消化道肿瘤的第二位[3,4]。既往研究表明,致癌物的暴露所导致的基因突变以及由基因突变累积引起的细胞突变是结直肠癌发生的根本原因[5],机体对此会进行自我修复——DNA损伤耐受修复(DNA-damage tolerance,DDT),曾经被称为复制后修复(Post replication repair,PRR)。根据基因分析,DDT被划分为两个途径,一条是易误性修复(Error-prone),另外一个是无误性修复(Error-free)[6]。其中MMS2是无误性途径中的主要基因之一,它与肿瘤的形成和发生发展密切相关,已有实验提示在哺乳动物模型中MMS2与UBC13所形成的复合物在P53介导的DNA损伤应答中起重要作用,主要是调节癌细胞的增殖和凋亡[7]。为证实这一实验现象,并阐明机理,本实验拟用RNA干扰技术分别靶向降低MMS2基因和P53基因在结肠癌细胞THC-8307中的表达,观测其相互关系,检测其对结肠癌细胞增殖和凋亡的影响,为结肠癌的临床治疗提供前期理论依据。
1 材料与方法
1.1 主要仪器与试剂 实时荧光定量PCR仪(上海风岭,中国);电泳仪、凝胶成像仪(Bio-Rad,美国);DNA提取试剂盒(TIAN-GEN);超敏型二步法免疫细胞化学试剂(一抗 Abcam,美国);HRP 标记二抗(中杉金桥生物技术有限公司,北京);全蛋白提取试剂盒;lipo3000(Invitrogen,美国);Annexin V-FITC/PI双染细胞凋亡检测试剂盒(BestBio 中国)等。
1.2 方法
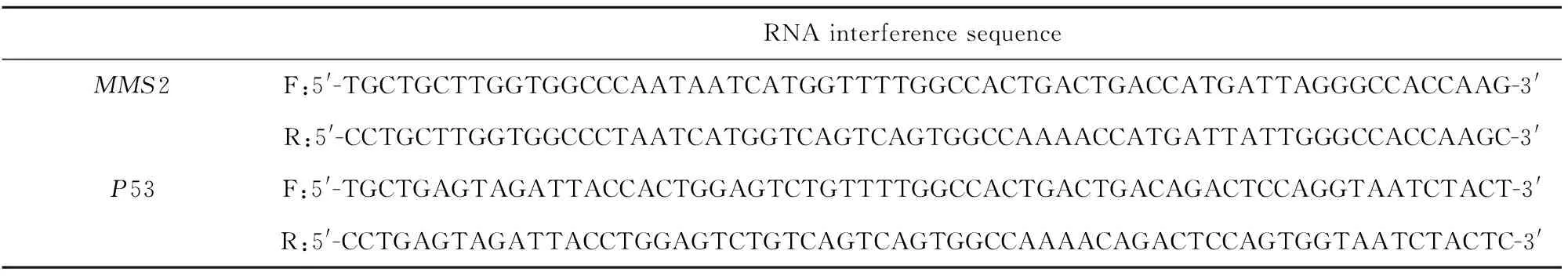
1.2.1 质粒构建 人高分化结肠癌细胞(THC-8307)由天津医科大学生命科学中心实验室汤华教授惠赠。根据Genebank查阅MMS2和P53基因已知基因序列,设计siRNA序列(表1)。重组质粒由上海松正生物科技有限公司构建完成。
1.2.2 细胞培养及分组处理 将THC-8307细胞用含10%胎牛血清的RPMI1640培养液,传代培养。取对数生长期的细胞进行转染,按照Lipofecta mineTM3000 试剂盒(Invitrogen)说明书进行操作。实验分为三组,将含有MMS2干扰片段的质粒(pcDNA6.2-GW/EmGFP-miR-MMS2)含有P53干扰片段的质粒(pcDNA6.2-GW/EmRFP-miR-P53)转染至THC-8307细胞中作为实验组细胞,同时转染相应阴性质粒作为对照组,不做任何处理的THC-8307细胞作为空白对照组。同样条件下培养48 h,进行后续实验。
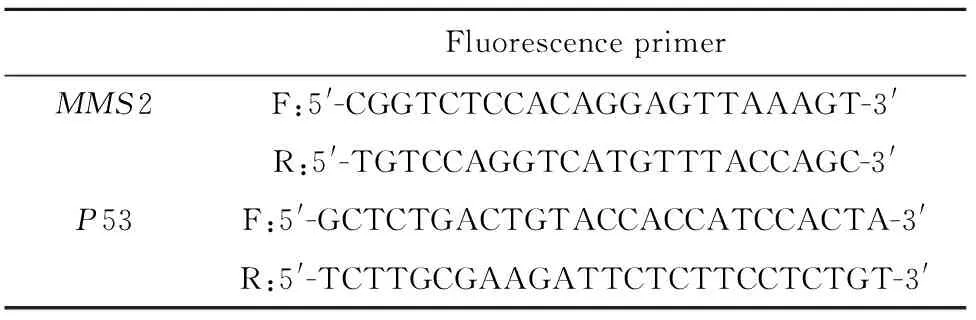
1.2.3 荧光定量PCR法检测MMS2、P53 mRNA的表达 在Pubmed数据库中查询MMS2和P53基因以得到其编码序列,采用Premier 5.0设计相关引物(表2)。为避免基因组DNA污染,引物设计原则为上下游引物跨两个外显子[8]。将提取的各组细胞总RNA,按照逆转录试剂盒说明书反转录为cDNA,逆转录反应条件为:42℃ 60 min,70℃ 5 min。再以cDNA为模板进行荧光定量PCR,反应条件为:95℃10 min;95℃ 15 s;58℃ 30 s;72℃ 30 s,40个循环。3次实验结果通过比较CT值法(2-△△CT)进行相对定量分析。
1.2.4 Western blot 检测MMS2、P53蛋白的表达 采用蛋白裂解液提取细胞的全蛋白,取20 μl进行SDS-PAGE凝胶电泳,PVDF膜转膜1 h后,用5%脱脂奶粉37℃封闭1 h。将膜与anti-MMS2和anti-P53于4℃孵育过夜,HRP标记二抗室温孵育1 h,于凝胶成像仪上成像分析,以β-actin为内参,计算MMS2和P53与内参β-actin灰度值的比较,进行分析。
1.2.5 流式细胞术检测细胞凋亡 各处理组细胞按照Annexin V-FITC/PI双染细胞凋亡检测试剂盒操作说明收集细胞并进行染色操作后,迅速用流式细胞仪进行凋亡率检测。经FCM分析结果。
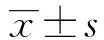
2 结果
2.1siRNA-MMS2和siRNA-P53转染效率检测 用LipofectamineTM3000 转染siRNA-MMS2和siRNA-P53于THC-8307细胞,24h后用倒置显微镜观察可分别见绿色和红色荧光分散在细胞质中说明转染成功(图1)
2.2siRNA-MMS2干扰效能鉴定
2.2.1 MMS2基因在细胞中mRNA表达量的变化qRT-PCR结果显示:siRNA-MMS2转染进入THC-8307细胞48h后,细胞中MMS2基因量明显低于空白对照组和阴性对照组(P<0.05,图2),而两对照组之间则无统计学意义(P>0.05)。结果表明:小RNA干扰片段成功抑制实验组细胞MMS2基因的表达,而阴性质粒对MMS2基因的表达无多少影响。
表1 RNA干扰序列
Tab.1 RNA interference sequence
RNAinterferencesequenceMMS2F:5'-TGCTGCTTGGTGGCCCAATAATCATGGTTTTGGCCACTGACTGACCATGATTAGGGCCACCAAG-3'R:5'-CCTGCTTGGTGGCCCTAATCATGGTCAGTCAGTGGCCAAAACCATGATTATTGGGCCACCAAGC-3'P53F:5'-TGCTGAGTAGATTACCACTGGAGTCTGTTTTGGCCACTGACTGACAGACTCCAGGTAATCTACT-3'R:5'-CCTGAGTAGATTACCTGGAGTCTGTCAGTCAGTGGCCAAAACAGACTCCAGTGGTAATCTACTC-3'
表2 荧光引物
Tab.2 Fluorescence primer
FluorescenceprimerMMS2F:5'-CGGTCTCCACAGGAGTTAAAGT-3'R:5'-TGTCCAGGTCATGTTTACCAGC-3'P53F:5'-GCTCTGACTGTACCACCATCCACTA-3'R:5'-TCTTGCGAAGATTCTCTTCCTCTGT-3'
2.2.2MMS2基因在细胞中蛋白表达量的变化 细胞转染48 h后,Western blot检测THC-8307细胞中MMS2蛋白的表达(图3),显示实验组细胞MMS2表达量明显低于两对照组(P<0.05),而两对照组之间则无统计学意义(P>0.05)。本实验结果说明:在蛋白水平上MMS2基因成功被沉默,而阴性质粒对其表达无影响。
2.3 siRNA-P53干扰效能鉴定
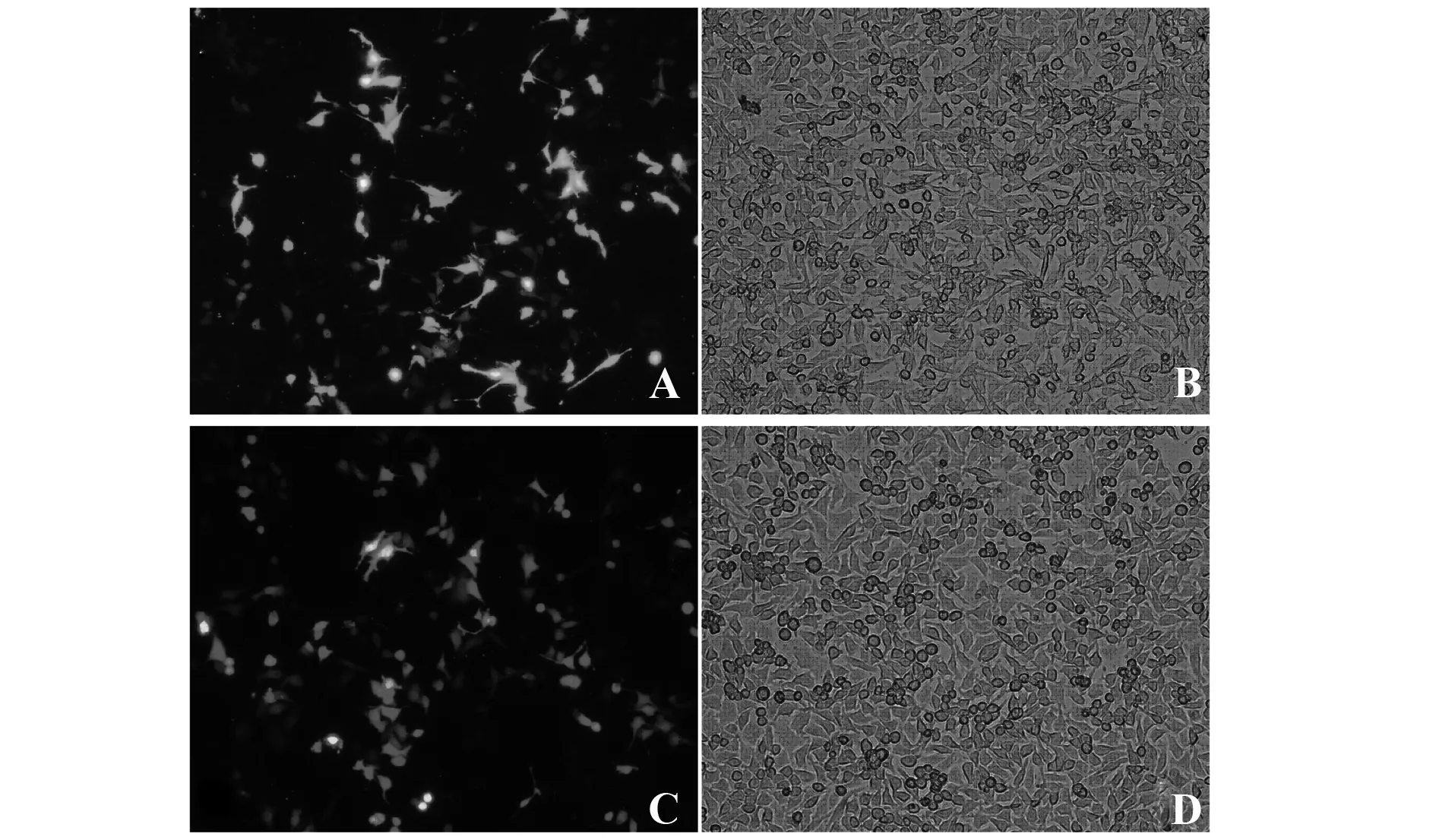
图1 siRNA-MMS2与siRNA-P53荧光显微镜下观察转染效率(10×20)Fig.1 Observed transfection efficiency under fluorescence micriscope(10×20)Note: Figure A and B were transfected into siRNA-MMS2 cells by fluorescence inverted microscope and ordinary optical field of vision.Figure C and D were transfected into siRNA-P53 cells by fluorescence inverted microscope and ordinary optical field of vision.Figure A and C,the white arrow indicates that the THC-8307 cells were transfected successfully.
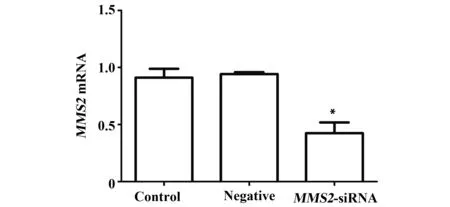
图2 siRNA干扰MMS2 mRNA 的相对表达水平Fig.2 Relative expression of MMS2 mRNA after silenced by siRNA determined by RT-qPCRNote: Control.Blank control group;Negative.Conditional control group;MMS2-siRNA.Experimental group; *.P<0.05,vs control group.
2.3.1P53基因在细胞中mRNA表达量的变化 qRT-PCR结果表明:siRNA-P53转染进入细胞48 h后,细胞中P53基因量明显低于两对照组(P<0.05,图4),而阴性对照组与空白对照组之间则无统计学意义(P>0.05)。结果表明:小RNA干扰片段成功抑制实验组细胞P53基因mRNA表达,而阴性质粒对P53 mRNA的表达并无多少影响。
2.3.2P53基因在细胞中蛋白表达量的变化 细胞转染48 h后,Western blot检测THC-8307细胞中P53蛋白的表达(图5),显示实验组细胞P53表达量明显低于两对照组(P<0.05),而两对照组之间的差异则无统计学意义(P>0.05)本实验说明:在蛋白水平上P53基因下调成功,而阴性质粒对其表达无影响。
2.4 下调MMS2对THC-8307细胞P53表达量的影响
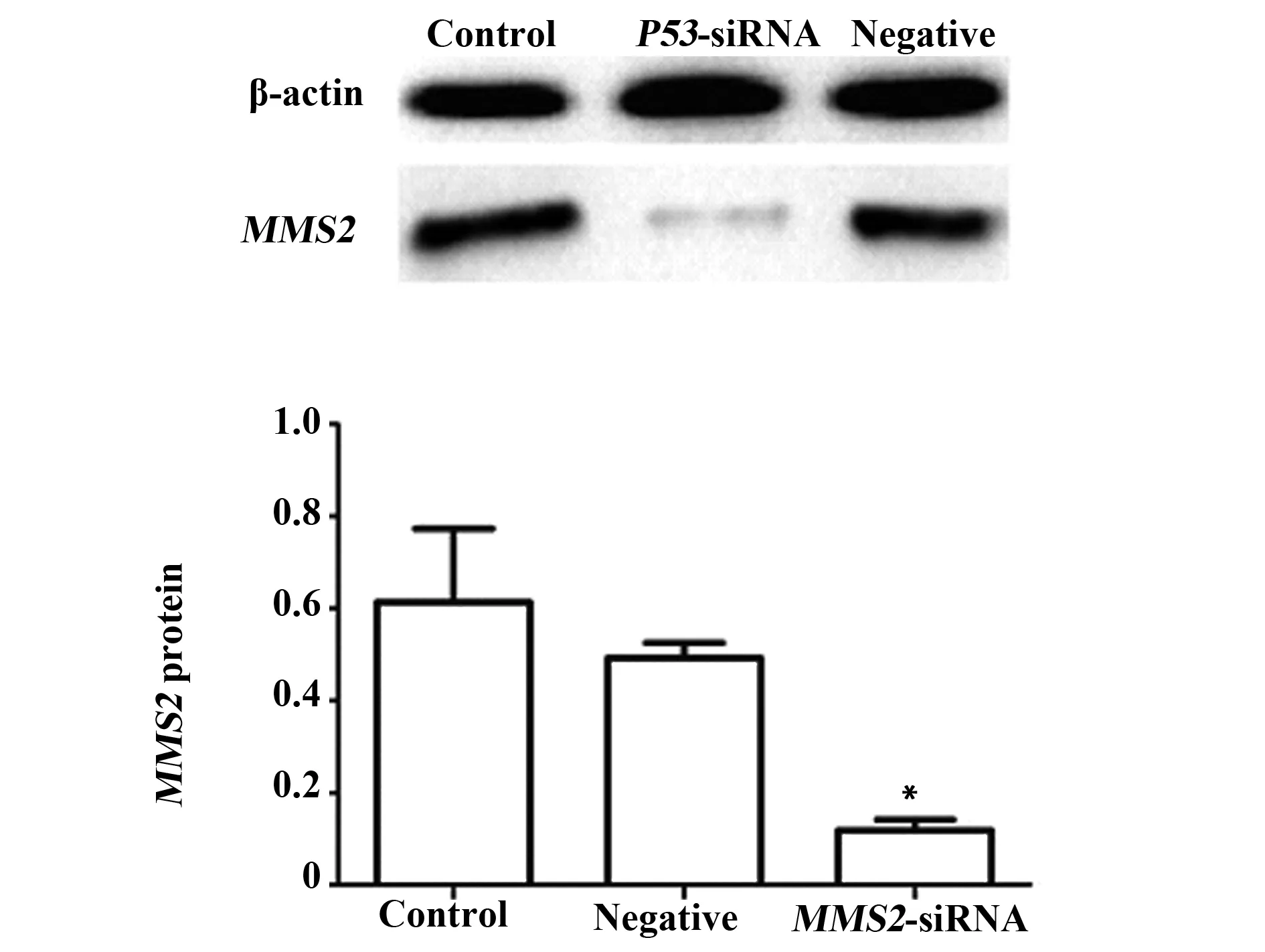
图3 siRNA干扰MMS2蛋白的相对表达水平Fig.3 Relative expression of MMS2 protein after silenced by siRNA determined by Western blotNote: Control.Blank control group;Negative.Conditional control group;MMS2-siRNA.Experimental group; *.P<0.05,vs control group.

图4 siRNA干扰P53 mRNA 的相对表达水平Fig.4 Relative expression of P53 mRNA after silenced by siRNA determined by RT-qPCRNote: Control.Blank control group;Negative.Conditional control group;P53-siRNA.Experimental group; *.P<0.05,vs control group.
2.4.1 下调MMS2的实验组细胞培养48 h后,用qRT-PCR检测THC-8307细胞P53 mRNA表达量,显示实验组P53 mRNA表达量明显高于空白对照组与阴性对照组(P<0.05),而两对照组之间则无统计学差异(P>0.05),见图6。
2.4.2 以Western Blot检测下调MMS2 48 h之后THC-8307细胞中P53蛋白表达量,结果显示,实验组P53蛋白表达量显著高于空白对照组和阴性对照组(P<0.05),而两对照组之间则无统计学差异(P>0.05),见图7。
2.5 下调P53对THC-8307细胞MMS2表达量的影响
2.5.1 用下调P53之后继续培养48 h的THC-8307细胞作为实验对象,以qRT-PCR检测细胞中MMS2 mRNA的表达量,结果显示,实验组MMS2mRNA表达显著高于空白对照组与阴性对照组(P<0.05),而两对照组之间则无统计学差异(P>0.05)(见图8)。
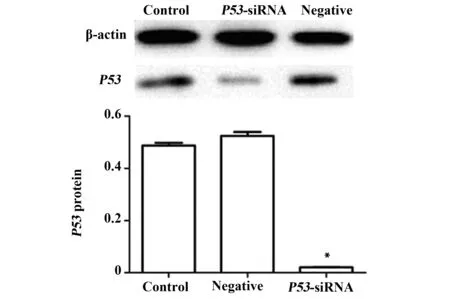
图5 siRNA干扰P53蛋白的相对表达水平Fig.5 Relative expression of P53 protein after silenced by siRNA determined by Western blotNote: Control.Blank control group;Negative.Conditional control group;P53-siRNA.Experimental group;*.P<0.05,vs control group.
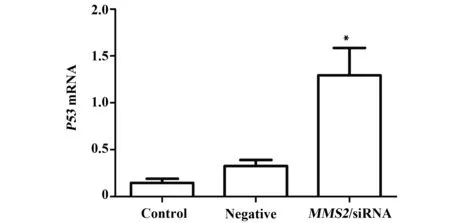
图6 siRNA干扰MMS2后,P53 mRNA 的相对表达水平Fig.6 Relative expression of P53 mRNA after silenced by MMS2-siRNA determined by RT-qPCRNote: Control.Blank control group;Negative.Conditional control group MMS2-siRNA.Experimental group; *.P<0.05,vs control group.
2.5.2 以Western blot检测下调P53 48 h之后THC-8307细胞中MMS2蛋白表达量,结果显示,实验组MMS2蛋白表达量显著高于空白对照组和阴性对照组(P<0.05),而两对照组之间则无统计学差异(P>0.05),见图9。
2.6 下调MMS2基因对细胞增殖和凋亡的影响
2.6.1 流式细胞术分析Annexin V-FITC/PI 荧光染色结果 经转染48 h后,将THC-8307细胞置入流式细胞分析仪中,结果显示,与两对照组相比,实验组早期凋亡率和晚期凋亡率均增高,差异有统计学意义(P<0.05),空白对照组与阴性对照组之间则无显著性差异(P>0.05),见图10。
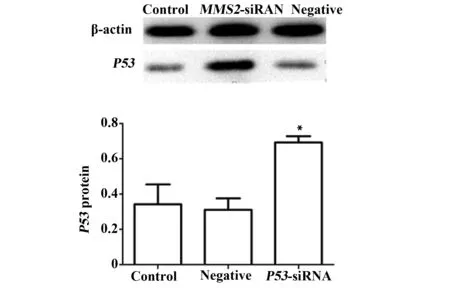
图7 siRNA干扰MMS2后,P53蛋白的相对表达水平Fig.7 Relative expression of P53 protein after silenced by MMS2-siRNA determined Western blotNote: Control.Blank control group;Negative.Conditional control group MMS2-siRNA.Experimental group;*.P<0.05,vs control group.
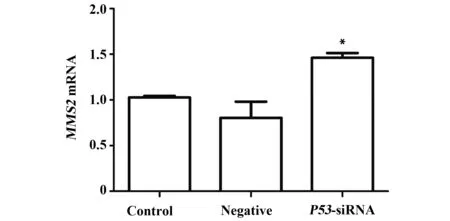
图8 siRNA干扰P53后,MMS2 mRNA 的相对表达水平Fig.8 Relative expression of MMS2 mRNA after silenced by P53-siRNA determined by RT-qPCRNote: Control.Blank control group;Negative.Conditional control group;P53-siRNA.Experimental group;*.P<0.05,vs control group.
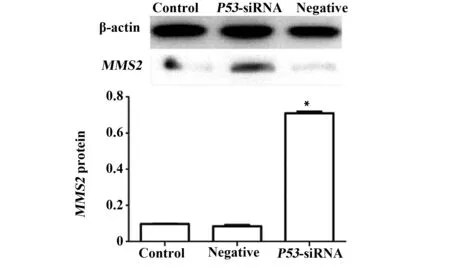
图9 siRNA干扰P53后,MMS2蛋白的相对表达水平Fig.9 Relative expression of MMS2 protein after silenced by P53-siRNA determined by Western blotNote: Control.Blank control group;Negative.Conditional control group;P53-siRNA.Experimental group;*.P<0.05,vs control group.

图10 流式细胞仪检测THC-8307各组细胞凋亡率(%)Fig.10 Quantitative analysis of THC-8307 cells apoptotic determined by FACS(%)Note: A and C represent apoptosis of cells after silencing MMS2;B and D represent apoptosis of cells after silencing P53.Control.Blank control group;Negative.Conditional control group;MMS2-siRNA.Experimental group;P53-siRNA.Experimental group; *.P<0.05,vs control group.
3 讨论
结肠癌的传统治疗方法是以手术加放/化疗为主,由于其对患者机体损伤较大,且不能从本质上根治结肠癌,有约40%~50%的患者会出现术后复发或转移,其中大多数患者失去再治愈的机会[9]。因此以RNA干扰为主的生物技术手段就成为临床治疗的主攻方向。MMS2是一种泛素结合酶样蛋白基因,在结构上,MMS2对UBC13介导的lys63连接聚泛素化链的长度的调节作用,在功能上,UBC13-MMS2复合物作用于DNA损伤修复,即DNA损伤耐受通路DDT(DNA damage tolerate)通路中的无误性(error-free)修复途径[10]。损伤耐受可以发生在复制叉或者复制叉后,以防止复制叉崩溃和潜在的细胞死亡,因为它的主要作用是保证复制的进行而不是等待损坏的模板进行修复[11]。同时,我们发现UV损伤引起嘧啶二聚体导致单链DNA缺口,经过复制后修复这些缺口依然长期存在,表明PRR只是绕过损伤而不是修复它[12],DNA损伤途径与细胞突变及肿瘤的发生发展密切相关[13]。其分子机制可能与下游基因的同源重组有关[14,15]。研究发现,人类MMS2与酵母MMS2同源,定位于人染色体8p,MMS2是正常细胞生长所必需的[16]。本实验室前期实验已经发现,沉默MMS2基因表达可以促进结肠癌细胞自发凋亡,抑制增殖,提示TLS介导的肿瘤细胞损伤后修复过程可能有凋亡机制的参与[17]。这与Knobel[18]发现TLS可以对P53凋亡信号通路中的调控分子表达和功能失常引起肿瘤细胞凋亡的报道相一致。推测,在沉默MMS2诱导结肠癌细胞THC-8307凋亡过程中P53发挥重要作用。
本研究通过开展qRT-PCR、Western blot等实验研究和相关文献分析,发现下调MMS2之后,结肠癌细胞中P53表达量显著升高,细胞在早期与晚期凋亡量增加,提示P53所在的凋亡信号通路在该过程中发挥一定作用。与此同时,我们还发现下调P53之后,结肠癌细胞THC-8307中MMS2在转录水平与蛋白水平表达量会显著上升,但是结肠癌细胞THC-8307的早期凋亡与晚期凋亡却没有明显的改变。这些实验现象提示,下调MMS2诱导结肠癌细胞THC-8307凋亡或许就是通过激活P53实现的。这也与Wen和 Li等[7]在2012年研究发现脊椎动物的MMS2基因具有高度保守性,并且指出斑马鱼DrMMS2基因是一个与哺乳动物MMS2基因真正同源的基因,在以斑马鱼为脊椎动物代表的实验研究中发现,在斑马鱼细胞中P53介导的DNA损伤反应,需要DrMMS2和UBC13形成稳定的络合物,且发现敲除DrMMS2基因的细胞,P53的表达量显著上升,并得出结论斑马鱼DrMMS2基因在反向调控P53基因活性方面起重要作用的报道相一致。同时,另有报道指出[19],MMS2与UBC13复合物介导K63连接聚泛素化的P53,有利于单体P53的形成,还可以降低P53的转录活性,而这种调控作用在DNA损伤时减弱,使P53激活,且MMS2编码产物在大多正常组织中表达量极低,但是在一些肿瘤组织中呈不同水平的高表达[13]。有实验指出P53低表达可能参与了结肠癌的形成过程,其低表达的结肠癌细胞更具有恶性分化潜能[20]。本课题组前期研究发现MMS2不但参与DNA损伤修复,而且还与遗传不稳定性及其肿瘤的发生有关[16,21],而P53在基因稳定性方面又被称作是“基因守护卫士”[22],同时,周期检测位点与TLS通路密切相关,其对于无论是无误性修复通路还是易误性修复通路都非常重要[23]。以上研究一定程度上证实,在结肠癌细胞凋亡中,MMS2和P53基因在转录水平和蛋白水平其相互间似乎是起反向调控作用,该作用可能与TLS对细胞周期检测位点的调控有关,具体机制尚需后续实验进一步研究。
[1] Siegel R,Naishadham D,Jemal A.Cancer statistics[J].CA Cancer J Clin,2012,62(1):10-29.
[2] Cunningham D,Atkin W,Lenz HJ,etal.Colorectal cancer[J].Lancet,2010,375(9719):1030-1047.
[3] 罗胜兰,胡如英,龚巍巍,等.浙江省2005~2010年结直肠癌生存率分析[J].中华流行病学杂志,2013,,3(12):1194-1197.
[4] 李泓澜,高玉堂,郑 莹,等.上海市区居民1973~2005年结直肠癌发病趋势分析[J].中华预防医学杂志,2009,43(10):875-879.
[5] 韩 英,李峻岭.基质金属蛋白酶及其抑制剂在结直肠癌中的作用研究进展[J].中华临床医师杂志(电子版),2013,7(14):6637-6639.
[6] Stacey Broomfield,Todd Hryciw,Wei Xiao.DNA postreplication repair and mutagenesis in Saccharomyces cerevisiae[J].Mutation Research,2001,486(3):167-184.
[7] Wen R,Li J,Xu X,etal.Zebrafish Mms2 promotes K63-linked polyubiquitination and is involved in p53-mediated DNA-damage response[J].DNA Repair(Amst),2012,11(2):157-166.
[8] Yuan B,Xu Y,Woo JH,etal.Increased expression of mitotic checkpoint genes in breast cancer cells with chromosomal instability[J].Clin Cancer Res,2006,12(2):405-410.
[9] 王代科,夏 峰.大肠癌术后的复发和转移[J].中国实用外科杂志,1995,15(12):714-716.
[10] Andersen PL,Zhou H,Pastushok L,etal.Distinct regulation of Ubc13 functions by the two ubiquitin-conjugating enzyme variants Mms2 and Uev1A[J].J Cell Biol,2005,170(5):745-755.
[11] Massimo Lopes,Marco Foiani,José M,etal.Multiple mechanisms control chromosome integrity after replication fork uncoupling and restart at irreparable UV lesions[J].Mol Cell,2006,21(1):15-27.
[12] Xu X,Blackwell S,Lin A,etal.Error-free DNA-damage tolerance in Saccharomyces cerevisiae[J].Mutation Res,2015,764(print):43-50.
[13] Xiao W,Lin SL,Broomfield S,etal.The products of the yeast MMS2 and two human homologs(hMMS2 and CROC-1)define a structurally and functionally conserved Ubc-like protein family[J].Nucleic Acids Res,1998,26(17):3908-3914.
[14] Sale JE.Competition,collaboration and coordination-deter mining how cells bypass DNA damage[J].J Cell Science,2012,125(Pt 7):1633-1643.
[15] Félix Prado.Homologous recombination maintenance of genome integrity during DNA damage tolerance[J].Mol Cellular Oncol,2014,1(2):1-11.
[16] 王 婷,隋 御,张 蕾,等.hMMS2siRNA联合抗癌药对结肠癌细胞SW480增殖与凋亡的影响[J].中国免疫学杂志,2014,30(4):480-485.
[17] 张 蕾,隋 御,王 婷,等.hMMS2基因对结肠癌细胞耐药逆转的影响[J].遗传,2014,36(04):346-353.
[18] Knobel PA,Kotov IN,Felley-Bosco E,etal.Inhibition of REV3 expression induces persistent DNA damage and growth arrest in cancer cells[J].Neoplasia,2011,13(10):961-970.
[19] Laine A,Topisirovic I,Zhai D,etal.Regulation of p53 localization and activity by Ubc13[J].Mol Cell Biol,2006,26(23):8901-8913.
[20] 苏 冬,周冬枝,贾宗良,等.结肠癌脾虚证p53,Bcl-2和Bax的表达[J].第四军医大学学报,2003,24(12):1111-1113.
[21] 李元杰,张 蕾,隋 御,等.RNA干扰联合阻断MMS2和REV3基因表达减轻结肠癌细胞系THC8307/L-OHP对奥沙利铂的耐药性[J].基础医学与临床,2014,34(12):1623-1628.
[22] VogelsteinB,LaneD,LevineAJ.Surfing the p53 network[J].Nature,2000,408(6810):307-310.
[23] Barbour L,BallL G,Zhang K,etal.DNAdamage checkpoints are involved in postreplication repair[J].Genetics,2006,174(4):1789-1800.
[收稿2015-10-20 修回2015-12-10]
(编辑 张晓舟)
Interaction between MMS2 and P53 on proliferation and apoptosis of colon cancer cells
MA Lin-Yuan,SUI Yu,MA Lu,LI Xin,LI Yuan-Jie,XU Fang.Ningxia Medical University,Ningxia Key Laboratory of Reproductive and Genetic,Yinchuan 750004,China
Objective:To explore the regulatory effects of proliferation and apoptosis on THC-8307 byMMS2 siRNA andP53 siRNA. Methods: We experimentally suppressed theMMS2 andP53 expression in human colon cancer cells by the interference RNA technology(RNAi)as monitored by Real-time qRT-PCR and Western blot.THC-8307 cells that express rate significantly reduced were collected as case group,while using untreated cells as the blank control group,and mock-treated cells as the negative control group.After separately interfering the target genes in each group,test the relationship and expression level of the two genes.Utilizing flow cytometry techniques to test cells proliferation and apoptosis rate of each group.Results: Compared to the control group,colon cancer cells in whichMMS2 andP53 were silenced displayed significant increase ofP53,MMS2 mRNA and protein levels(P<0.05).MMS2-depleted cells displayed increase in apoptosis rates,for both early and later stages(P<0.05). Conclusion:MMS2 andP53 negatively regulate each other in colon cancer cells proliferation and apoptosis.
MMS2;P53;RNA-interference;Human colon cancer cells;Apoptosis
10.3969/j.issn.1000-484X.2016.04.014
①本文为国家自然科学基金资助项目(No.313602501)。
马琳园(1990年-),女,在读硕士,主要从事DNA损伤修复和肿瘤发生发展的研究。
及指导教师:徐 方(1962年-),女,博士生导师,主要从事DNA损伤修复与肿瘤发生发展的研究。
R735.35
A
1000-484X(2016)04-0513-06
