急性ST段抬高心肌梗死溶栓后TIMI血流Ⅲ级患者经皮冠状动脉介入治疗时机
2016-12-12叶国红关贤颂戴海鹰蒋路平
叶国红 关贤颂 戴海鹰 蒋路平
·临床研究·
急性ST段抬高心肌梗死溶栓后TIMI血流Ⅲ级患者经皮冠状动脉介入治疗时机
叶国红 关贤颂 戴海鹰 蒋路平
目的 比较急性ST段抬高心肌梗死(ST-segment elevation myocardial infarction,STEMI)溶栓后TIMI血流Ⅲ级患者早期经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)和择期PCI的临床疗效。方法 入选153例在外院行溶栓治疗成功后转入长沙市中心医院行冠状动脉造影(coronary angiography,CAG)示梗死相关血管TIMI血流Ⅲ级的STEMI患者,根据处理措施分为早期PCI组(即溶栓后24 h内行PCI者,74例)和择期PCI组(起病7~9 d后行择期PCI者,79例)。比较两组患者30 d死亡率、再发心肌梗死、再发心肌缺血症状、新发心力衰竭或心力衰竭加重、心源性休克,6个月和12个月再发心肌梗死、死亡,以及住院期间出血并发症的发生情况。结果 早期PCI组行PCI的患者共70例(70/74,94.6%),择期PCI组行PCI的患者共67例(67/79,84.8%),两组患者PCI所占比例比较,差异有统计学意义(P=0.048)。早期PCI组血栓抽吸[17.1%(12/70)比6.0%(4/67),P=0.024]、PCI术中及术后使用替罗非班[81.4%(57/70)比64.2%(43/67),P=0.003]患者所占比例均显著高于择期PCI组,差异均有统计学意义;术中慢血流无复流[8.6%(6/70)比1.5%(1/67)]患者比例在早期PCI组中亦有升高趋势,但差异无统计学意义(P=0.117)。早期PCI组和择期PCI组患者终点事件发生率在随访30 d[12.2%(9/74)比13.9%(11/79),P=0.747]、6个月[8.1%(6/74)比7.7%(6/78),P=0.924]、12个月[10.8%(8/74)比11.5%(9/78),P=0.887]时分别比较,差异均无统计学意义。早期PCI组住院期间出血事件较择期PCI组[17.6%(13/74)比12.7%(10/79)]升高,但差异无统计学意义(P=0.396)。结论 STEMI溶栓成功后CAG示梗死相关血管TIMI血流Ⅲ级的患者,早期PCI不能降低30 d死亡、再发心肌梗死及心力衰竭发生率,对长期死亡率及再发心肌梗死发生率亦无明显改善,且可能增加手术并发症。
急性ST段抬高心肌梗死; 溶栓; 经皮冠状动脉介入治疗
急性心肌梗死治疗的关键是梗死相关血管的快速开通,早期有效的心肌再灌注是改善患者预后及降低病死率的关键。直接经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)急性ST段抬高心肌梗死(ST-segment elevation myocardial infarction,STEMI)已取得显著疗效,且有研究结果显示直接PCI优于溶栓治疗[1]。但是,目前我国能进行直接PCI的医院不足20%,大部分急性心肌梗死患者在首诊医院接受溶栓治疗后转到有PCI条件的医疗中心。《2013年美国心脏病学会基金会(ACCF)/美国心脏协会(AHA)STEMI管理指南》[2]认为,STEMI患者即使溶栓成功仍建议3~24 h内行PCI,但其证据均来源于国外大型随机临床试验的研究对象为STEMI高危人群[2-3]。本研究旨在探讨STEMI患者溶栓成功后如冠状动脉造影(coronary angiography,CAG)示梗死相关血管心肌梗死溶栓治疗(TIMI)血流Ⅲ级,择期PCI与早期PCI对临床预后的影响及其安全性。
1 对象与方法
1.1 研究对象
2010年8月至2014年7月在外院诊断为STEMI且溶栓成功后转入长沙市中心医院心内科的患者共233例。入院后在药物溶栓3~24 h内行CAG,入选梗死相关血管TIMI血流Ⅲ级的患者153例,分为早期PCI组(即溶栓后24 h内行PCI者,74例)和择期PCI组(起病7~9 d后行择期PCI者,79例)。STEMI诊断标准、溶栓成功标准和TIMI血流标准依照已有参考文献[2-4]。排除标准:(1)心源性休克;(2)1年内有PCI史及既往有冠状动脉旁路移植术(coronary artery bypass graft,CABG)史;(3)严重肝肾功能不全;(4)严重心律失常。起病即有心搏骤停,室性心律失常,高度房室传导阻滞需行起搏治疗者;(5)恶性肿瘤患者;(6)CAG示病变轻不需要血运重建,三支病变或合并左主干病变等需行CABG者[3]。所有患者均获得知情同意,并通过医院伦理委员会审核。
1.2 方法
所有患者均在溶栓后3~24 h内常规行CAG检查,CAG检查前常规口服阿司匹林300 mg和氯吡格雷300 mg(年龄>75岁患者给予氯吡格雷75 mg),采用Tig管经桡动脉入径(如桡动脉穿刺失败再改经股动脉)行CAG;根据CAG及心电图(electrocardiogram,ECG)结果确定梗死相关动脉。早期PCI组CAG后即刻均置入药物洗脱支架,PCI指征为:狭窄≥70%、50%~70%合并血栓形成、自发夹层、溃疡形成且可行PCI[3]。术中使用普通肝素抗凝(70~100 U/kg,如联合使用替罗非班则50~70 U/kg),根据术中情况使用替罗非班12~24 h。择期PCI组标准用药7~9 d后行PCI术,如7 d内出现再梗死或顽固性缺血症状及血流动力学不稳定则行急诊PCI。
1.3 随访及评价指标
所有患者经门诊或电话进行随访,随访及评估指标包括30 d死亡、再发心肌梗死、再发心肌缺血症状、新发心力衰竭或心力衰竭加重、心源性休克;6个月和12个月再发心肌梗死、死亡;以及住院期间出血并发症(使用TIMI分级法[5])。心源性休克定义为严重持续低血压[收缩压<90 mmHg(1 mmHg=0.133 kPa)或平均动脉压较基础值下降≥30 mmHg]伴低灌注状态,同时排除其他原因引起的低血压。再发心肌梗死定义为24 h内再发ST段抬高伴胸痛持续>30 min,24 h后为肌酸激酶同工酶(creatine kinase-MB,CK-MB)升高至正常上限3倍以上(其中PCI术后3倍,CABG术后5倍)或新出现的Q波。再发心肌缺血定义为≥5 min的胸痛伴有ST段或T波改变。新发心力衰竭或心力衰竭加重定义为入院6 h后出现需要治疗的肺水肿[胸片提示肺水肿、肺部啰音、肺动脉楔压(pulmonary artery wedge pressure,PAWP)>18 mmHg]。
1.4 统计学分析
使用SPSS 18.0统计软件进行统计学分析。计量资料以中位数(四分位数)或均数±标准差表示,组间比较采用单因素方差分析;分类变量使用例数和百分率表示,组间比较采用χ2检验或Fisher精确概率法检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者的一般资料比较
两组患者的年龄、性别构成、心力衰竭史、心肌梗死史、PCI史、短暂性脑缺血发作(transient ischemic attack,TIA)及脑梗死史、吸烟、高血压病、2型糖尿病、血脂异常、体重指数(body mass index,BMI)、右肱动脉血压、心率、Killip分级、ST段抬高部位、发病至溶栓时间等资料比较,差异均无统计学意义(均P>0.05,表1)。

表1 两组患者的一般资料比较
注:PCI,经皮冠状动脉介入治疗;TIA,短暂性脑缺血发作;BMI,体重指数;1 mmHg=0.133 kPa
2.2 两组患者的医疗干预情况比较
两组患者溶栓用药、CAG前用药、出院后用药、溶栓至CAG时间、单支病变、罪犯血管部位等资料比较,差异均无统计学意义(均P>0.05)。早期PCI组有3例血栓抽吸后狭窄不明显而未行PCI术,1例尝试PCI未成功后择期行CABG,行PCI的患者共70例(70/74,94.6%);择期PCI组有7例复查CAG发现血管病变较前明显减轻而未行PCI,4例血栓抽吸后病变减轻未行PCI,择期PCI前死亡1例,行PCI的患者共67例(67/79,84.8%);两组患者PCI所占比例比较,差异有统计学意义(P=0.048)。早期PCI组血栓抽吸[17.1%(12/70)比6.0%(4/67),P=0.024]、PCI术中及术后使用替罗非班[81.4%(57/70)比64.2%(43/67),P=0.003]患者所占比例均显著高于择期PCI组,差异均有统计学意义;术中慢血流无复流[8.6%(6/70)比1.5%(1/67)]患者比例在早期PCI组中亦有升高趋势,但差异无统计学意义(P=0.117,表2)。

表2 两组患者的医疗干预情况比较
注:PCI,经皮冠状动脉介入治疗;t-PA,组织型纤溶酶原激活剂;CAG,冠状动脉造影;ACEI,血管紧张素转化酶抑制药;ARB,血管紧张素Ⅱ受体拮抗药;LAD,左前降支;RCA,右冠状动脉;LCX,左回旋支;a,早期PCI组和择期PCI组住院期间均死亡1例;b,早期PCI组患者3例血栓抽吸后未行PCI,1例PCI未成功,故PCI共70例;c,择期PCI组患者7例复查CAG发现血管病变较前明显减轻而未行PCI,4例血栓抽吸后病变减轻未行PCI,择期PCI前死亡1例,故PCI共67例
2.3 两组患者的不良事件比较
随访6个月时,择期PCI组有1例患者失访。早期PCI组和择期PCI组患者终点事件发生率在随访30 d[12.2%(9/74)比13.9%(11/79),P=0.747]、6个月[8.1%(6/74)比7.7%(6/78),P=0.924]、12个月[10.8%(8/74)比11.5%(9/78),P=0.887]时分别比较,差异均无统计学意义。早期PCI组住院期间出血事件[17.6%(13/74)比12.7%(10/79)]较择期PCI组升高,但差异无统计学意义(P=0.396);其中早期PCI组有1例颅内出血(表3)。
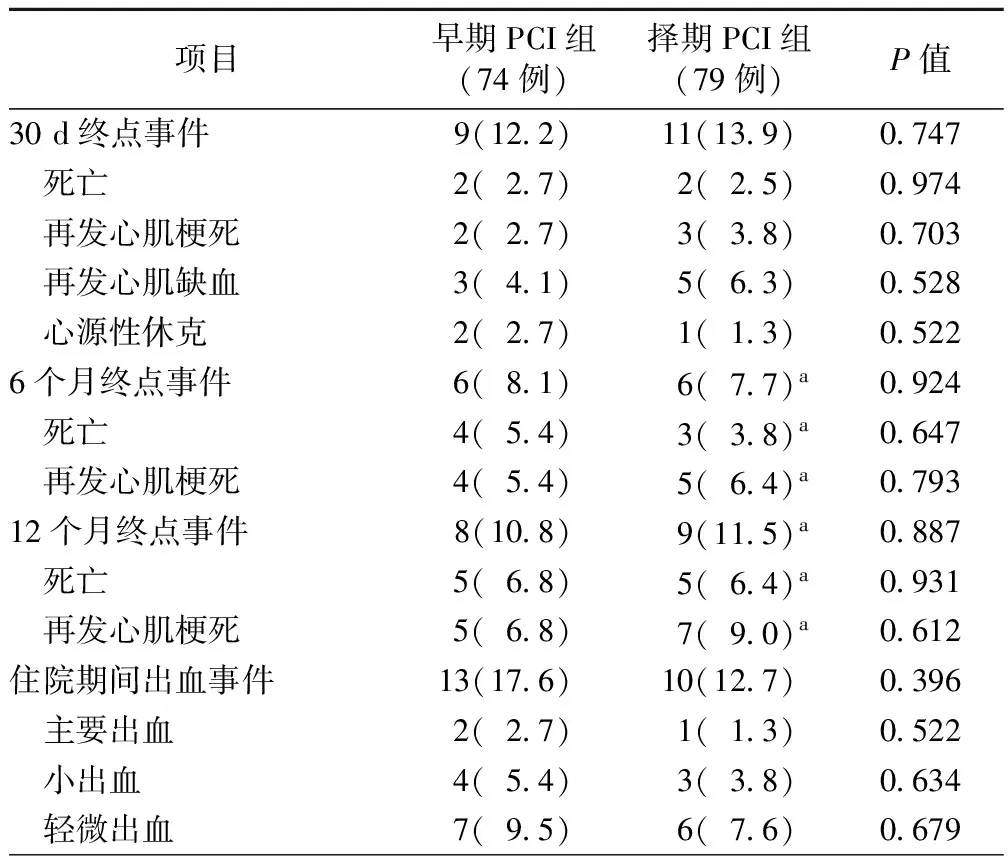
表3 两组患者的不良事件比较[例(%)]
注:PCI,经皮冠状动脉介入治疗;a,择期PCI组有1例失访,故总例数为78例
3 讨论
药物溶栓作为最早使用的再灌注治疗措施,由于其快速、简便、易操作及早期血管开通率较高等优点,目前仍是STEMI患者,尤其是我国广大农村及偏远地区患者的重要治疗手段。近年来,国内外针对已经采取溶栓治疗患者的PCI治疗疗效及时机开展了一系列研究。支架时代以前对溶栓治疗后STEMI行即刻经皮腔内冠状动脉成形术(percutaneous transluminal coronary angioplasty,PTCA)的研究结果并未改善临床预后,且主要出血事件发生率明显升高[6],导致其预后不佳的原因为球囊扩张后的血管急性再闭塞发生率高[7],以及出血事件的增加抵消了PTCA可能带来的益处。近年来随着支架置入、血小板糖蛋白Ⅱb/Ⅲa抑制药以及噻吩吡啶类抗血小板药物的广泛使用,PCI后再梗死率明显下降[8-9]。而且随着介入器械的发展、小管径鞘管的使用及较早拔除、桡动脉入径的普及、溶栓药物的发展,出血风险已大大下降[10-11]。使溶栓治疗后早期PCI更安全有效。近年来国外一系列关于溶栓治疗后早期PCI的临床研究取得了令人鼓舞的结果[12-14]。其中以TRANSFER-AMI研究[3]规模最大,该研究结果证实早期PCI组较择期PCI组30 d总终点事件(包括死亡、再发心肌梗死、再发心肌缺血症状、新发心力衰竭等)明显减少,且出血事件无明显增加。
本研究在153例诊断为STEMI且溶栓成功后转院行CAG示TIMI血流Ⅲ级的患者中分别采取早期PCI与择期PCI两种治疗策略并做了比较。两组间30 d主要终点事件的差异无统计学意义,住院期间出血事件的差异无统计学意义,但早期PCI组出血事件发生率升高。
本研究结果显示,溶栓后早期PCI组与择期PCI组30 d死亡、心力衰竭、心源性休克的差异无统计学意义;而不同的是,早期PCI组心肌缺血事件及再发心肌梗死虽有所下降,但差异无统计学意义。这与TRANSFER-AMI研究[3]结果不一致,导致与国外研究结果不同的原因考虑为:(1)本研究入选患者均为溶栓成功,且经CAG证实梗死相关血管TIMI血流Ⅲ级的相对稳定患者,预后相对较好[15];而国外相关研究如CARESS-in-AMI[12]、TRANSFER-AMI[3]等入选的患者均为高危STEMI。(2)本研究中即使择期PCI组患者入院后CAG前亦给予氯吡格雷300 mg负荷剂量,抗血小板加强可能导致心肌缺血及再发心肌梗死下降[8]。(3)本研究入选患者主要使用非选择性溶栓剂亦可能导致结果不同。
另外值得注意的是,本研究中早期PCI组患者PCI术中慢血流无复流发生率升高,可能与急性心肌梗死患者溶栓后使血小板活化、聚集性增加有关。国外曾有研究表明,急性心肌梗死患者使用药物溶栓后其血小板活性明显增加,且持续时间>12 h,而联合使用血小板糖蛋白Ⅱb/Ⅲa抑制药可抑制该作用[16]。国内亦有研究表明,AMI时纤溶酶原激活物抑制因子(plasminogen activator inhibitor,PAI)明显升高,而尿激酶(urokinase,UK)可以显著降低PAI,但停止UK后,PAI活性迅速升高,纤溶酶原激活物(plasminogen activator,PA)及纤溶酶活性随之降低,UK结束后5 h PAI活性与治疗前已无显著差异,且高峰期持续>24 h[17]。溶栓后早期PCI时,术中开始使用血小板糖蛋白Ⅱb/Ⅲa抑制药可减少无复流及支架内血栓形成[18]。同时本研究显示,择期PCI组行PCI的比例较早期PCI组明显减少,与TRANSFER-AMI研究[3]一致。因为择期PCI前复查CAG有相当一部分患者血管病变情况改善,避免了一些不必要的干预治疗。可能与充分抗凝、抗血小板治疗后血栓减少及斑块稳定、血管痉挛减轻等有关。
本研究结果显示,早期PCI组患者的出血事件发生率较择期PCI组升高,但差异无统计学意义,与既往研究基本一致。不同的是,本研究中早期PCI组包括颅内出血在内的主要出血事件发生率升高,可能与本研究患者大多采用非选择性溶栓剂UK有关[11],另外早期PCI组中更多地使用血小板糖蛋白Ⅱb/Ⅲa抑制药亦可能导致出血增加[9,12]。这提示非选择性溶栓剂溶栓后联合使用血小板糖蛋白Ⅱb/Ⅲa抑制药的患者早期PCI虽能减少PCI术中无复流及急性血栓等缺血事件的发生,但可能导致出血风险增加。目前尚无有效的方法兼顾两者,需进一步临床探索。
本研究存在的缺陷:(1)本研究样本量较小,且为单中心临床观察;(2)未能就溶栓后早期PCI的具体时间窗进一步研究;(3)择期PCI组中有部分患者因再发心肌梗死及心肌缺血而提前PCI,可在下一步研究中单独设定一组进行比较;(4)由于基层医院条件受限,溶栓药物不同,可能影响结果判断。
综上所述,无条件行直接PCI的STEMI患者采取溶栓治疗后如梗死相关血管TIMI血流Ⅲ级,早期PCI较择期PCI虽可能降低心肌缺血再发,但不能降低30 d死亡、再发心肌梗死及心力衰竭发生率,对长期死亡率及再发心肌梗死发生率亦无明显改善,且可能增加手术并发症。
[1] Andersen HR, Nielsen TT, Rasmussen K, et al. A comparison of coronary angioplasty with fibrinolytic therapy in acute myocardial infarction. N Engl J Med, 2003, 349(8):733-742.
[2] O′Gara PT, Kushner FG, Ascheim DD,, et al. 2013 ACCF/AHA guideline for the management of ST-elevation myocardial infarction: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation, 2013, 127(4):e362-e425.
[3] Bagai A, Cantor WJ, Tan M, et al. Clinical outcomes and cost implications of routine early PCI after fibrinolysis: one-year follow-up of the Trial of Routine Angioplasty and Stenting after Fibrinolysis to Enhance Reperfusion in Acute Myocardial Infarction (TRANSFER-AMI) study. Am Heart J, 2013, 165(4):630-637.e2.
[4] TIMI Study Group. The Thrombolysis in Myocardial Infarction (TIMI) trial. N Engl J Med, 1985, 312(14):932-936.
[5] Bovill EG, Terrin ML, Stump DC, et al. Hemorrhagic events during therapy with recombinant tissue-type plasminogen activator,heparin, and aspirin for acute myocardial infarction: results of the Thrombolysis in Myocardial Infarction (TIMI), Phase II Trial. Ann Intern Med, 1991, 115(4):256-265.
[6] Cantor WJ, Brunet F, Ziegler CP, et al. Immediate angioplasty after thrombolysis: a systematic review. CMAJ, 2005, 173(12):1473-1481.
[7] Arnold AE, Serruys PW, Rutsch W, et al. Reasons for the lack of benefit of immediate angioplasty during recombinant tissue plasminogen activator therapy for acute myocardial infarction: a regional wall motion analysis. J Am Coll Cardiol, 1991, 17(1):11-21.
[8] Sabatine MS, Cannon CP, Gibson CM, et al. Addition of clopidogrel to aspirin and fibrinolytic therapy for myocardial infarction with ST-segment elevation. N Engl J Med, 2005, 352(12):1179-1189.
[9] De Luca G, Suryapranata H, Stone GW, et al. Abciximab as adjunctive therapy to reperfusion in acute ST-segment elevation myocardial infarction: a meta analysis of randomized trials. JAMA, 2005, 293(14):1759-1765.
[10] Cantor WJ, Mahaffey KW, Huang Z, et al. Bleeding complications in patients with acute coronary syndrome undergoing early invasive management can be reduced with radial access, smaller sheath sizes, and timely sheath removal. Catheter Cardiovasc Interv, 2007, 69(1):73-83.
[11] Van de Werf F, Barron HV, Armstrong PW, et al. Incidence and predictors of bleeding events after fibrinolytic therapy with fibrin- specific agents: a comparison of TNK-tPA and rt-PA. Eur Heart J, 2001, 22(24):2253-2261.
[12] Di Mario C, Dudek D, Piscione F, et al. Immediate angioplasty versus standard therapy with rescue angioplasty after thrombolysis in the Combined Abciximab REteplase Stent Study in Acute Myocardial Infarction (CARESS-in-AMI): an open, prospective, randomised, multicentre trial. Lancet, 2008, 371(9612): 559-568.
[13] Fernández-Aviles F, Alonso JJ, Pea G, et al. Primary angioplasty vs. early routine post-fibrinolysis angioplasty for acute myocardial infarction with ST-segment elevation: the GRACIA-2 non-inferiority, randomized, controlled trial. Eur Heart J, 2007, 28(8):949-960.
[14] Borgia F, Goodman SG, Halvorsen S, et al. Early routine percutaneous coronary intervention after fibrinolysis vs. standard therapy in ST-segment elevation myocardial infarction: a meta-analysis. Eur Heart J, 2010, 31(17): 2156-2169.
[15] Stone GW, Cox D, Garcia E, et al. Normal flow (TIMI-3) before mechanical reperfusion therapy is an independent determinant of survival in acute myocardial infarction: analysis from the primary angioplasty in myocardial infarction trials. Circulation, 2001, 104(6):636-641.
[16] Coulter SA, Cannon CP, Ault KA, et al. High levels of platelet inhibition with abciximab despite heightened platelet activation and aggregation during thrombolysis for acute myocardial infarction: results from TIMI (thrombolysis in myocardial infarction) 14. Circulation, 2000, 101(23):2690-2695.
[17] 吴立群,戚文航,邵慧珍,等. 急性心肌梗塞尿激酶静脉溶栓治疗纤溶系统的变化及临床意义. 中华心血管病杂志,1994,2(l):46-48.
[18] Zhou SS, Tian F, Chen YD, et al. Combination therapy reduces the incidence of no-reflow after primary per-cutaneous coronary intervention in patients with ST-segment elevation acute myocardial infarction. J Geriatr Cardiol, 2015, 12(2): 135-142.
Optimal timing of percutaneous coronary intervention after fibrinolysis for acute ST-segment elevation myocardial infarction with TIMI Ⅲ flow
YE Guo-hong, GUAN Xian-song, DAI Hai-ying, JIANG Lu-ping.
Department of Cardiology, Central Hospital of Changsha, Changsha 410007, China
YE Guo-hong, Email:ygh120811@163.com
Objective To compare the clinical efficacy between Percutaneous Coronary Intervention (PCI) within 24 hours and at 1 week in acute ST elevation myocardial infarction (STEMI) patients who had achieved TIMI 3 flow after fibrinolysis. Methods The study included 153 STEMI patients who had resumed TIMI 3 flow after receiving fibrinolytic therapy at first medical consult centers that did not have the capability of performing PCI. All patients were transferred to our hospital and CAG was performed within 3-24 hours after fibrinolysis. Patients in the early PCI group (n=74) received DES inplantation within 24 hours after fibrinolysis and patients in the elective PCI group (n=79) received PCI 7-9 days after STEMI onset. The clinical features PCI and the primary end points including death, reinfarction, recurrent ischemia, new or worsening congestive heart failure, or cardiogenic shock within 30 days, the incidence of bleeding in hospital, death and reinfarction after 6 and 12 months were recorded and compared between the 2 groups. Results Patients in the early PCI group had higher utilization rates of thrombus aspiration (17.1%vs. 6.0%,P=0.024) and application rates of tirofiban (81.4%vs. 64.2%,P=0.003) as compared to the elective PCI group. The phenomena of “no reflow” and the incidence of bleeding events were similar between the 2 groups. There were no statistical differences between the 2 groups in rates of mortality, reinfarction, heart failure and cardiogenic shock at 30 days, 6 months and 1 year. Conclusions Among STEMI patients with TIMI 3 flow after fibrinolysis treatment, early PCI could not reduce the incidence of death, reinfarction and heart failure at 30 days and 1 year, and may increase the rates of complications of the surgery.
Acute ST-segment elevation myocardial infarction; Fibrinolysis; Percutaneous coronary intervention
10.3969/j.issn.1004-8812.2016.10.005
410007 湖南长沙,长沙市中心医院心内科
叶国红,Email:ygh120811@163.com
R542.22 R541.4
2016-03-21)
