导管消融与药物治疗对肥厚型心肌病合并心房颤动患者心血管原因住院率的影响
2016-12-12李景业杜昕龙德勇蒋晨曦郭雪原张婷李新董建增马长生
李景业 杜昕 龙德勇 蒋晨曦 郭雪原 张婷 李新 董建增 马长生
·临床研究·
导管消融与药物治疗对肥厚型心肌病合并心房颤动患者心血管原因住院率的影响
李景业 杜昕 龙德勇 蒋晨曦 郭雪原 张婷 李新 董建增 马长生
目的 探讨导管消融与药物治疗对肥厚型心肌病(hypertrophic cardiomyopathy,HCM)合并心房颤动(房颤)患者心血管原因住院率的影响。方法 连续入选2004年6月至2015年3月于首都医科大学附属北京安贞医院等7家医院首次接受导管消融治疗的48例HCM合并房颤患者作为导管消融组,纳入同期仅接受药物治疗的78例HCM合并房颤患者作为药物治疗组。随访观察患者房颤复发及心血管原因住院情况。结果 导管消融组48例患者均顺利完成房颤导管消融,单次术后平均随访(17.6±8.4)个月,16例(33.3%)复发房颤,32例(66.7%)维持窦性心律;药物治疗组平均随访(10.7±8.0)个月,31例(39.7%)转复为窦性心律;导管消融组患者窦性心律维持率显著高于药物治疗组,差异有统计学意义(P=0.003)。与药物治疗组相比,导管消融组的非计划性心血管原因住院率显著降低[2例(4.2%)比17例(21.8%),P=0.001]。Cox多因素分析显示,房颤治疗策略(导管消融/药物治疗,HR9.082,95%CI1.130~73.011,P=0.038)和既往心力衰竭史(HR2.860,95%CI1.072~7.633,P=0.036)是非计划性心血管原因住院的独立危险因素。结论 HCM合并房颤组患者导管消融治疗的窦性心律维持率及非计划性心血管原因住院率均优于药物治疗组患者,房颤治疗策略和既往心力衰竭史是非计划性心血管原因住院的独立危险因素。
肥厚型心肌病; 心房颤动; 导管消融; 药物; 心血管原因住院
肥厚型心肌病(hypertrophic cardiomyopathy,HCM)是一种与基因遗传有关的心血管疾病,易发生各种心律失常,其中心房颤动(房颤)是最为常见的一种,可显著增加心力衰竭、卒中的发生率,严重影响患者的生存质量[1]。《2014年欧洲心脏病学会(European society of cardiology,ESC)HCM诊断和管理指南》[1]及《2011年美国心脏病学会基金会(American college of cardiology foundation,ACCF)/美国心脏协会(American heart association,AHA)HCM诊断和治疗指南》[2]均推荐在规律抗凝的基础上积极予以转复窦性心律或控制心室率治疗。然而,现有抗心律失常药物尚不能有效根治房颤,药物的潜在不良反应亦限制其长期应用[3]。近年来,导管消融技术在临床实践中逐步取得进展,已成为房颤治疗的重要手段[4]。HCM合并房颤患者接受导管消融治疗能否有效改善其临床预后,导管消融与药物治疗相比是否具备一定优势,目前仍无定论。本研究在分析HCM合并房颤患者导管消融与药物治疗有效性的基础上对其非计划性心血管原因住院的危险因素进行探讨。
1 对象与方法
1.1 研究对象
连续入选2004年6月至2015年3月于首都医科大学附属北京安贞医院等7家医院首次接受导管消融治疗的48例HCM合并房颤患者作为导管消融组,纳入同期仅接受药物治疗的78例HCM合并房颤患者作为药物治疗组。阵发性和持续性房颤均可入选。阵发性房颤定义为房颤发作时间小于7 d,可自行转复窦性心律。持续性房颤定义为房颤发作时间大于7 d,或7 d内需药物治疗或电复律方可转复窦性心律。HCM诊断标准[1]:经超声心动图、核磁共振成像或左心室造影证实左心室最厚室壁厚度≥15 mm;若静息状态下左心室流出道压力阶差≥30 mmHg(1 mmHg=0.133 kPa),提示流出道梗阻;同时需排除可能引起相同程度左心室肥厚的其他疾病。排除标准:(1)合并瓣膜病;(2)合并先天性心脏病;(3)左心耳血栓;(4)存在抗凝禁忌证。
1.2 电生理检查和导管消融
导管消融术前停用所有抗心律失常药物至少5个半衰期,其中胺碘酮停用4周以上。术前24 h内经食管超声心动图和(或)心脏64排CT排除左心房血栓,规律皮下注射低分子肝素抗凝。术前所有患者签署知情同意书。术中清醒状态下行局部麻醉,持续静脉泵入芬太尼和咪达唑仑镇静。研究纳入的HCM合并房颤患者近80%(38/48)来自首都医科大学附属北京安贞医院房颤中心,本中心行单导管房颤射频消融的具体方法已有详细报道[5],简述如下:阵发性房颤在CARTO三维电解剖标测系统指导下行双侧环肺静脉前庭隔离。术前、术中合并典型心房扑动(房扑)者同时行三尖瓣峡部线性消融。持续性房颤在双侧肺静脉隔离基础上进一步行左心房顶部线、二尖瓣峡部线、三尖瓣峡部线消融或碎裂电位消融。若消融未能使房颤转复为窦性心律,行体外直流电复律(200 J)。窦性心律下单导管补点,证实双侧肺静脉电隔离、消融径线双向阻滞。
1.3 术后随访
如无禁忌,导管消融术后需服用抗心律失常药物3个月,未复发者可停药。术后常规口服华法林抗凝至少3个月,维持国际标准化比值(INR)2.0~3.0。术后1、3、6个月及以后每6个月常规行标准12导联心电图和24 h动态心电图检查。随访期内若出现心悸、气短等症状,随时门诊就诊行心电图检查。术后3个月设为空白期。导管消融组房颤复发定义为空白期后未服用抗心律失常药物时,经标准12导联心电图或24 h动态心电图证实的持续时间在30 s以上的房颤、房扑、房性心动过速(房速)等快速房性心律失常。药物治疗组房颤发作即为经标准12导联心电图或24 h动态心电图证实的持续时间在30 s以上的房颤、房扑、房性心动过速(房速)等快速房性心律失常。
1.4 统计学分析
2 结果
2.1 两组患者基线资料比较
与药物治疗组相比,导管消融组患者的年龄[(55.5±9.9)岁比(66.8±13.3)岁,P<0.001]、既往心力衰竭[0比19例(24.4%),P<0.001]和卒中病史[6例(12.5%)比27例(34.6%),P=0.007]患者所占比例均显著较低,差异均有统计学意义。两组患者的性别、房颤病程、房颤类型、肥厚型心肌病病程、梗阻性肥厚型心肌病、体重指数、其他心血管疾病危险因素、超声心动图指标等临床资料比较,差异均无统计学意义(均P>0.05,表1)。

表1 两组患者的基线资料比较
2.2 两组患者窦性心律维持率比较

图1 两组患者窦性心律维持率Kaplan-Meier生存曲线
导管消融组48例患者均顺利完成房颤导管消融,单次术后平均随访(17.6±8.4)个月,共16例(33.3%)患者复发房颤,其中10例(20.8%)患者再次接受导管消融治疗。导管消融组共2例(4.2%)患者出现手术相关并发症,1例在接受二次消融时发生心脏压塞,经外科手术成功修补;另1例出现股静脉穿刺处血肿,随访至2个月时已完全吸收。药物治疗组平均随访(10.7±8.0)个月,31例(39.7%)患者转复为窦性心律。导管消融组患者窦性心律维持率[66.7%(32/48)比39.7%(31/79)]显著高于药物治疗组,差异有统计学意义(P=0.003,图1)。
2.3 两组患者药物使用情况比较
导管消融组空白期过后未复发房颤者可常规停用抗心律失常药物治疗。至随访结束时,导管消融组的β阻滞药使用率显著低于药物治疗组[8例(16.7%)比61例(78.2%),P<0.001];地高辛使用率亦显著低于药物治疗组[0比15例(19.2%),P=0.001]。非二氢吡啶类钙离子拮抗药使用率方面,导管消融组较药物治疗组呈降低趋势,但差异无统计学意义[7例(14.6%)比23例(29.5%),P=0.084]。考虑到导管消融组随访期间有16例患者复发房颤,其中11例仍需口服胺碘酮控制节律,故在此类药物的使用率上较药物治疗组差异无统计学意义[11例(22.9%)比17例(21.8%),P=1.000,表2]。
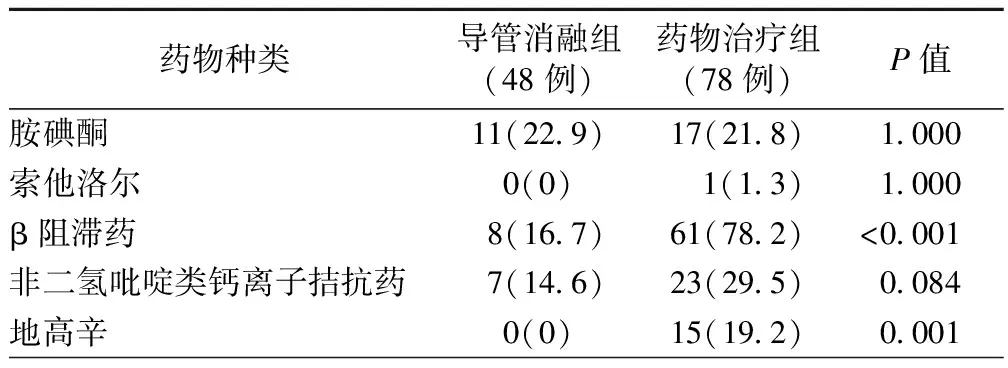
表2 两组患者的药物使用情况比较[例(%)]
2.4 两组患者心血管原因住院情况比较
随访期间,导管消融组共5例(10.4%)患者因心血管原因再住院,其中3例(6.2%)为再次行导管消融择期住院,2例(4.2%)因快速心律失常住院。药物治疗组共19例(24.4%)患者因心血管原因住院,其中2例(2.6%)择期住院治疗房颤,5例(6.4%)因快速心律失常住院,1例(1.3%)因窦性心动过缓住院,3例(3.8%)因卒中住院,1例(1.3%)因INR不达标消化道出血住院,7例(9.0%)因心力衰竭住院。虽然两组间因择期治疗房颤住院的患者比例比较,差异无统计学意义(6.2%比2.6%,P=0.368),但导管消融组的非计划性心血管原因住院率显著低于药物治疗组(4.2%比21.8%,P=0.001,图2,表3)。

图2 两组患者非计划性心血管原因住院率的Kaplan-Meier曲线

心血管原因住院导管消融组(48例)药物治疗组(78例)P值计划性住院/消融相关3(62)2(26)0368非计划性住院2(42)17(218)0001 快速心律失常2(42)5(64) 窦性心动过缓0(0)1(13) 卒中0(0)3(38) 出血0(0)1(13) 心力衰竭0(0)7(90)
2.5 非计划性心血管原因住院相关因素
Cox单因素分析显示,HCM合并房颤患者非计划性心血管原因住院与年龄、房颤类型、房颤治疗策略(导管消融/药物治疗)、既往心力衰竭和卒中病史相关(P<0.05,表4)。将上述因素逐步代入Cox多因素回归分析,结果显示,房颤治疗策略(HR9.082,95%CI1.130~73.011,P=0.038)和既往心力衰竭(HR2.860,95%CI1.072~7.633,P=0.036)是非计划心血管原因住院的独立危险因素(表5)。
3 讨论
本研究对126例HCM合并房颤患者行导管消融和接受药物治疗的临床预后进行了比较,结果发现:HCM合并房颤患者接受导管消融治疗安全可行,单次消融术后的窦性心律维持率显著高于药物治疗组;消融术后HCM患者的β阻滞药和地高辛使用率大幅减少,非计划性心血管原因住院率显著降低。本组HCM患者中,房颤治疗策略和既往心力衰竭是非计划性心血管原因住院的独立危险因素。
房颤是HCM最常见的并发症之一,患病率达20%~25%[6-7]。房颤的发生标志着临床症状恶化的开始,提示患者短期及长期预后不佳[8]。HCM合并房颤患者出现中-重度心力衰竭(NYHA分级Ⅲ~Ⅳ级)的风险是窦性心律维持者的3倍[9],其心力衰竭住院率较无房颤者显著增加(39.0%比15.4%)[10]。合并房颤后,HCM患者的卒中风险增加10~17倍[6],血栓栓塞事件发生率可高达27.09%[11]。校正年龄、心功能分级、左心房大小及左心室射血分数等影响因素后,房颤仍是HCM患者心力衰竭及卒中相关死亡的独立危险因素[6,9]。

表4 非计划性心血管原因住院的单因素Cox分析

表5 非计划性心血管原因住院的多因素Cox分析
因房颤可显著增加HCM患者的不良心血管事件和非计划住院率[12],维持窦性心律对HCM患者至关重要。抗心律失常药物虽被推荐用于此类患者[13],但长期疗效有限且存在药物相关不良反应[3]。随着导管消融技术的发展,越来越多的HCM合并房颤患者已接受导管消融治疗。据报道,HCM合并房颤患者中,单次导管消融治疗的窦性心律维持率在41.3%~66.1%[14],多次消融后可提升至47%~77%[15-17]。虽然围术期主要不良事件的发生率与普通房颤人群并无差异[18],HCM合并房颤患者消融术后的窦性心律维持率仍相对较低[19],22%~48%患者需继续接受药物治疗[15, 20]。推测其可能原因在于:(1)HCM患者的心肌细胞排列紊乱及心肌纤维化为折返性心律失常的发生提供了潜在基质[21];(2)常规导管消融释放的射频能量难以穿透增厚的心房肌,产生的热效应不足,降低了导管消融治疗的有效性[15]。本研究中,HCM合并房颤患者单次导管消融术后(17.6±8.4)个月的窦性心律维持率为66.7%,与既往研究在HCM患者中观察到的结果相似。
尽管导管消融术后窦性心律维持率存在一定波动,导管消融治疗仍可显著改善HCM合并房颤患者的临床预后。Bassiouny等[22]的研究中,HCM合并房颤者接受双侧肺静脉前庭隔离后平均心功能分级(NYHA分级)从2.17级改善至1.40级。在双侧肺静脉隔离基础上加行线性消融,患者的心功能可从(1.9±0.7)级恢复至(1.2±0.5)级[23]。与基线状态相比,导管消融术后3个月和12个月,HCM患者的生活质量也显著提高[3]。此外,消融术后患者的房颤负荷亦明显减少[22]。本研究中,导管消融组的非计划性心血管原因住院率显著低于药物治疗组,仅2例患者因快速心律失常发作住院治疗,未见心力衰竭、卒中、外周动脉栓塞等不良事件,同样证实了导管消融治疗的临床获益。
与以往研究不同的是,本研究对HCM合并房颤患者非计划性心血管原因住院的影响因素进行了探讨,结果显示,校正年龄、房颤类型和既往卒中病史后,房颤治疗策略仍是非计划性心血管原因住院的独立危险因素。导管消融组患者成功控制房颤后,房颤相关的心力衰竭、卒中及外周动脉栓塞风险均显著降低,非计划性心血管原因住院事件相应减少。
本研究虽为回顾性研究,但所有数据均为前瞻性收集,研究结果具有较好的准确性。作为一项多中心研究,各家医院采用的消融策略和随访周期长短不尽相同,可能影响房颤消融的成功率。此外,随访过程中以标准12导联心电图和24 h动态心电图为主要检测手段,可能低估了无症状性房颤的复发率。
综上所述,本研究通过比较HCM合并房颤患者导管消融与药物治疗的临床疗效,首次证实了房颤治疗策略为HCM合并房颤患者非计划性心血管原因再住院的独立危险因素。这一发现为合理选择治疗策略,改善患者临床预后提供了理论依据。
[1] Authors/Task Force M, Elliott PM, Anastasakis A, et al. 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy: the Task Force for the Diagnosis and Management of Hypertrophic Cardiomyopathy of the European Society of Cardiology (ESC). Eur Heart J, 2014, 35(39):2733-2779.
[2] Gersh BJ, Maron BJ, Bonow RO, et al. 2011 ACCF/AHA Guideline for the Diagnosis and Treatment of Hypertrophic Cardiomyopathy: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Developed in collaboration with the American Association for Thoracic Surgery, American Society of Echocardiography, American Society of Nuclear Cardiology, Heart Failure Society of America, Heart Rhythm Society, Society for Cardiovascular Angiography and Interventions, and Society of Thoracic Surgeons. J Am Coll Cardiol, 2011, 58(25):e212-e260.
[3] Bunch TJ, Munger TM, Friedman PA, et al. Substrate and procedural predictors of outcomes after catheter ablation for atrial fibrillation in patients with hypertrophic cardiomyopathy. J Cardiovasc Electrophysiol, 2008, 19(10):1009-1014.
[4] 马长生, 刘少伟. 心力衰竭合并心房颤动的治疗策略进展. 内科理论与实践, 2014, 9(1): 11-15.
[5] Dong JZ, Sang CH, Yu RH, et al. Prospective randomized comparison between a fixed ′2C3L′ approach vs. stepwise approach for catheter ablation of persistent atrial fibrillation. Europace, 2015, 17(12):1798-1806.
[6] Tian T, Wang Y, Sun K, et al. Clinical profile and prognostic significance of atrial fibrillation in hypertrophic cardiomyopathy. Cardiology, 2013, 126(4):258-264.
[7] Tani T, Yagi T, Kitai T, et al. Left atrial volume predicts adverse cardiac and cerebrovascular events in patients with hypertrophic cardiomyopathy. Cardiovasc Ultrasound, 2011, 9:34.
[8] Siontis KC, Geske JB, Ong K, et al. Atrial fibrillation in hypertrophic cardiomyopathy: prevalence, clinical correlations, and mortality in a large high-risk population. J Am Heart Assoc, 2014, 3(3):e001002.
[9] Olivotto I, Cecchi F, Casey SA, et al. Impact of atrial fibrillation on the clinical course of hypertrophic cardiomyopathy. Circulation, 2001, 104(21):2517-2524.
[10] 宋月洁, 姜腾勇, 任学军, 等. 心房颤动对肥厚型心肌病患者长期预后的影响. 中华实用诊断与治疗杂志, 2013, 27(2):126-128.
[11] Guttmann OP, Rahman MS, O′Mahony C, et al. Atrial fibrillation and thromboembolism in patients with hypertrophic cardiomyopathy: systematic review. Heart, 2014, 100(6):465-472.
[12] Kubo T, Kitaoka H, Okawa M, et al. Clinical impact of atrial fibrillation in patients with hypertrophic cardiomyopathy. Results from Kochi RYOMA Study. Circ J, 2009, 73(9):1599-1605.
[13] Nistri S, Olivotto I, Maron MS, et al. β Blockers for prevention of exercise-induced left ventricular outflow tract obstruction in patients with hypertrophic cardiomyopathy. Am J Cardiol, 2012, 110(5):715-719.
[14] Zhao DS, Shen Y, Zhang Q, et al. Outcomes of catheter ablation of atrial fibrillation in patients with hypertrophic cardiomyopathy: a systematic review and meta-analysis. Europace, 2016, 18(4):508-520.
[15] Ha HS, Wang N, Wong S, et al. Catheter ablation for atrial fibrillation in hypertrophic cardiomyopathy patients: a systematic review. J Interv Card Electrophysiol, 2015, 44(2):161-170.
[16] Ejima K, Shoda M, Arai K, et al. Impact of diastolic dysfunction on the outcome of catheter ablation in patients with atrial fibrillation. Int J Cardiol, 2013, 164(1):88-93.
[17] Santangeli P, Di Biase L, Themistoclakis S, et al. Catheter ablation of atrial fibrillation in hypertrophic cardiomyopathy: long-term outcomes and mechanisms of arrhythmia recurrence. Circ Arrhythm Electrophysiol, 2013, 6(6):1089-1094.
[18] Ganesan AN, Shipp NJ, Brooks AG, et al. Long-term outcomes of catheter ablation of atrial fibrillation: a systematic review and meta-analysis. J Am Heart Assoc, 2013, 2(2):e004549.
[19] Contreras-Valdes FM, Buxton AE, Josephson ME, et al. Atrial fibrillation ablation in patients with hypertrophic cardiomyopathy: long-term outcomes and clinical predictors. J Am Coll Cardiol, 2015, 65(14):1485-1487.
[20] Gaita F, Di Donna P, Olivotto I, et al. Usefulness and safety of transcatheter ablation of atrial fibrillation in patients with hypertrophic cardiomyopathy. Am J Cardiol, 2007, 99(11):1575-1581.
[21] Sciagra R, Sotgia B, Olivotto I, et al. Relationship between atrial fibrillation and blunted hyperemic myocardial blood flow in patients with hypertrophic cardiomyopathy. J Nucl Cardiol, 2009, 16(1):92-96.
[22] Bassiouny M, Lindsay BD, Lever H, et al. Outcomes of nonpharmacologic treatment of atrial fibrillation in patients with hypertrophic cardiomyopathy. Heart Rhythm, 2015, 12(7):1438-1447.
[23] Di Donna P, Olivotto I, Delcrè SD, et al. Efficacy of catheter ablation for atrial fibrillation in hypertrophic cardiomyopathy: impact of age, atrial remodelling, and disease progression. Europace, 2010, 12(3):347-355.
The effect of catheter ablation and pharmacologic therapy on cardiac-related hospitalization in hypertrophic cardiomyopathy patients with atrial fibrillation
LI Jing-ye, DU Xin, LONG De-yong, JIANG Chen-xi, GUO Xue-yuan, ZHANG Ting, LI Xin, DONG Jian-zeng, MA Chang-sheng.
Department of Cardiology, Beijing Anzhen Hospital, Capital Medical University, Beijing 100029, China
Correspoding author: MA Chang-sheng, Email: chshma@vip.sina.com
Objective To evaluate the effect of radiofrequency catheter ablation (RFCA) and pharmacologic therapy on cardiac-related hospitalization in hypertrophic cardiomyopathy (HCM) patients with atrial fibrillation (AF). Methods This study enrolled forty-eight HCM patients with AF who initially underwent catheter ablation. Seventy-eight subjects who only received pharmacologic therapy were selected as the control group. AF recurrence and cardiac-related hospitalization were followed-up routinely. Results After follow-up of 17.6±8.4 months, AF recurrence occurred in 16(33.3%) patients after a single procedure. In the control group, successful restoration of sinus rhythm was achieved in 39.7% patients after an average of 10.7±8.0 months. The unplanned cardiac-related hospitalization rate was significantly lower in the RFCA group (21.8%vs. 4.2%,P=0.0013). Cox regression analysis revealed that therapeutic strategy (HR9.082,95%CI1.130-73.011,P=0.038) and heart failure history (HR2.860,95%CI1.072-7.633,P=0.036) were independent risk factors of unplanned cardiac-related hospitalization. Conclusions In HCM patients with AF, catheter ablation seems to be superior to pharmacologic therapy in sinus rhythm maintenance and unplanned cardiac-related hospitalization reduction. Therapeutic strategy and heart failure history were independent risk factors of unplanned cardiac-related hospitalization.
Hypertrophic cardiomyopathy; Atrial fibrillation; Catheter ablation; Pharmacologic therapy; Cardiac-related hospitalization
10.3969/j.issn.1004-8812.2016.10.003
国家自然科学基金项目(81470464、81530016);北京市医院管理局临床医学发展专项经费资助(ZYLX201302);科技部国际合作项目(2013DFB30310)
100029 北京,首都医科大学附属北京安贞医院心内科
马长生,Email:chshma@vip.sina.com
R541
2016-06-20)
