正丁基硫代磷酰三胺对体细胞和生殖细胞的致突变性研究
2016-12-09陈丹丹荆淑芳于永生陈健恒吴纯启
原 野,陈丹丹,荆淑芳,于永生,陈健恒,吴纯启,施 畅,*
(1.军 事医学科学院毒物药物研究所国家北京药物安全评价研究中心,北京 100850;2.军 事医学科学院抗毒药物与毒理学国家重点实验室,北京 100850;3.中国食品药品检定研究院,北京 100050;4.YMS Agriculture International Corp., Torontom5X 1C7, Ontario, Canada)
正丁基硫代磷酰三胺对体细胞和生殖细胞的致突变性研究
原 野1,2,陈丹丹3,荆淑芳1,2,于永生1,2,陈健恒4,吴纯启1,2,施 畅1,2,*
(1.军 事医学科学院毒物药物研究所国家北京药物安全评价研究中心,北京 100850;2.军 事医学科学院抗毒药物与毒理学国家重点实验室,北京 100850;3.中国食品药品检定研究院,北京 100050;4.YMS Agriculture International Corp., Torontom5X 1C7, Ontario, Canada)
正丁基硫代磷酰三胺[N-(n-butyl)-thiophosphorictriamide,NBPT]是一种土壤尿素酶抑制剂,用于以尿素为基料的氮肥,通过降低尿素的氨挥发而减少氮损失,具有高效、廉价、低毒、易降解、无残留、不污染环境等优点,在农业生产有较大的应用优势[1]。澳大利亚国家工业化学物通告和评估方案(National Industrial Chemicals Notification and Assessment Scheme,NICNAS)报告显示NBPT在有或无代谢活化的Ames试验中未显示致突变性;在小鼠的体内微核试验中,在100、333和1 000mg/kg剂量下未显示致染色体断裂活性。目前对化学物遗传毒性多采用试验组合的方式从不同的遗传学终点的角度来综合评价,根据国家环保部《新化学物质环境管理办法2010》(7号令)对化学品遗传毒性评价的要求,本研究采用小鼠骨髓细胞染色体畸变试验和小鼠显性致死试验评价正丁基硫代磷酰三胺对体细胞和生殖细胞的致突变性,为其生产、注册以及出口补充遗传毒性方面的实验资料。
1 材料与方法
1.1 材料
1.1.1 受试物 NBPT,美国化学文摘社(Chemical Abstracts Service,CAS)登记号94317-64-3。由上虞盛晖化工股份有限公司提供,白色结晶固体,分子式C4h14N3PS,批号140420,含量98.0%。2~8℃避光干燥保存。
1.1.2 受试物溶媒 玉米油,购自山东三星玉米产业科技有限公司,为淡黄色或黄色的澄清油状液体,在阴凉干燥处密闭保存。
1.1.3 阳性对照品 环磷酰胺(cyclophosphamide,CP),购自Sigma公司。含量100%。批号120M1253V, 2~8℃避光、密闭保存。用自制去离子水配制。
1.1.4 实验动物 ICR小鼠,SPF/VAF级,购自北京维通利华实验动物有限公司,动物生产许可证号SCXK -(京)2012-0001。动物合格证号1140070004821 9。
1.2 剂量设计依据
NICNAS报告中显示:①NBPT在两项有或无代谢活化的Ames试验中未显示致突变性;②小鼠的体内微核试验中,NBPT在100、333和1 000mg/kg剂量下未显示致染色体断裂活性;③SD大鼠(雌雄各5只)以0、250、500、1 000和2 000mg/(kg·d)的剂量水平连续灌胃NBPT,共15 d,未见动物死亡;④NBPT口服吸收较为完全,吸收率为74.39%,半衰期为78h。
按照国家环保部《化学品毒性鉴定技术规范——啮齿类动物显性致死试验》和《化学品毒性鉴定技术规范——体内哺乳动物骨髓细胞染色体畸变试验》的相关要求,NBPT的毒性较低,使用多次染毒的高剂量组限量剂量1 000mg/(kg·d),按1∶0.5的比例下设中剂量500mg/(kg·d)和低剂量250mg/(kg·d)。
1.3 方法
国家北京药物安全评价研究中心的实验动物伦理委员会已批准本研究的实验方案,并确认实验方案符合相关的动物福利法规中相关条款的要求。
1.3.1 小鼠骨髓细胞染色体畸变试验[2-3]量效关系研究中NBPT设250、500、1 000mg/kg共3个剂量组,时效关系研究中NBPT剂量为1 000mg/kg,设24、48及72h共3个时间点,同时设溶媒对照组(玉米油),均采用单次灌胃给药。阳性对照组按40mg/kg单次腹腔注射环磷酰胺。每组雌雄动物均各5只。量效关系研究中动物于给药后24h取骨髓细胞,进行骨髓涂片,时效关系研究中动物于给药后24、48及72h取骨髓细胞,
进行骨髓涂片。动物于处死前2~4h按4mg/kg腹腔注射秋水仙素(400mg/L)。每只动物在油镜下分析100个中期相骨髓细胞,计数染色体结构畸变、数目畸变及裂隙的细胞数,计算发生率,以每只动物标本为计数单位。
1.3.2 显性致死试验[4-5]NBPT设250、500、1 000mg/kg共3个剂量组,同时设溶媒对照组(玉米油)。雌鼠与雄鼠共进行7个轮次的交配,每轮次1周,覆盖雄性大鼠整个生精周期。雄鼠每组20只,每天给药1次,连续5 d,雌鼠每组280只,每交配轮次使用40只,不给药。阳性对照组末次给药日按50mg/kg单次腹腔注射环磷酰胺。雄鼠给药结束后,于同笼开始日的16 时按2∶1将雌、雄小鼠放入交配笼内交配,5 d后取出雌鼠另行饲养。雄鼠则于2 d后再与同样数量的另一批雌鼠同笼交配,共进行7个轮次的交配。雄鼠于同笼结束后处死,雌鼠于同笼结束后第14天处死,取左右两侧子宫,分离胎仔,计数总着床数、黄体数,记录死胎、活胎和吸收胎数。计算公式如下。
受孕率=受孕雌鼠数/交配雌鼠数×100%
窝均着床数=(活胎数+死胎数+吸收胎数)/受孕母鼠总数
窝均黄体数=黄体总数/受孕母鼠总数
着床前丢失率=(黄体数-总着床数)/黄体数×100%
着床后丢失率=(死胎数+吸收胎数)/总着床数×100%
窝均活胎数=活胎总数/受孕母鼠总数
窝均非活胎数=死胎及吸收胎总数/受孕母鼠总数
显性致死突变率=死亡胚胎数/总着床数×100%
1.4 统计分析
1.4.1 小鼠骨髓细胞染色体畸变试验 采用国际体内致突变实验统计分析工作小组提出的三步分析法[6]:①确定溶媒对照组染色体畸变率是否超出4%;②采用Cochran-Armitage线性趋势检验评价溶媒对照组和各染毒处理组染色体畸变率是否存在剂量反应关系;③采用卡方检验比较各染毒处理组与溶媒对照组是否存在显著差异。
1.4.2 显性致死试验 动物体质量、着床数、黄体数、存活着床数等资料先采用Levene方差齐性检验在5%显著性水平分析各组间方差是否均等。①若各组间呈方差齐性,进行单因素方差分析;若各组间差异显著,采用Tukey检验和Dunnett’s t检验进行组间比较。②若各组间方差不齐,采用Kruskal-Willis非参数检验确定各组间有无显著性差异;若各组间经非参数检验发现有显著性差异,采用Wilcoxon秩和检验比较对照组与处理组间有无显著差异。每组受孕率、着床前丢失率、着床后丢失率等频数资料采用单侧Fisher精确检验。非存活着床数采用Wilcoxon秩和检验(Mann-Whitney U 检验)比较对照组与处理组间有无显著差异[7]。
2 结果
2.1 小鼠骨髓细胞染色体畸变试验
2.1.1 量效关系 溶媒对照组小鼠骨髓染色体畸变率为1.7%,与文献报道的小鼠骨髓细胞染色体畸变率本底值相近。阳性对照(40mg/kg环磷酰胺)组骨髓细胞染色体畸变率达14.3%,与溶媒对照组相比显著升高,表明实验系统可靠。在250、500和1 000mg/kg剂量水平下,小鼠单次灌胃NBPT 24h后,骨髓细胞染色体畸变率分别为2.4%、3.0%和2.0%,均未超出4%。经Cochran-Armitage检验未显示明显的剂量反应关系(z=-0.3406,P>0.05),卡方检验表明各剂量组染色体畸变率与溶媒对照组比较差异均无统计学意义(低、中、高剂量组χ2值分别为1.220、3.682和0.248,P均>0.05),说明NBPT无致小鼠骨髓细胞染色体畸变效应。各剂量组染色体四倍体与裂隙的发生率也未出现与NBPT相关性的变化。详见表1。

表1 小鼠单次灌胃NBPT后24h骨髓细胞染色体数目畸变和裂隙细胞率(n=10)
2.1.2 时效关系 小鼠单次灌胃NBPT 1 000mg/kg后24、48和72h的骨髓细胞染色体畸变率均未超过4%,经Cochran-Armitage检验未显示明显的时间反应关系(z=-1.2807,P>0.05),卡方检验表明各时间点染色体畸变率与溶媒对照组比较差异无统计学意义(24、48、72h组χ2值分别为1.220、2.324和3.204,P均>0.05),说明NBPT无致小鼠骨髓细胞染色体畸变效应,给药时间对染色体畸变率无明显影响。各时间点染色体四倍体与裂隙的发生率也未出现与NBPT相关性的变化。详见表2。
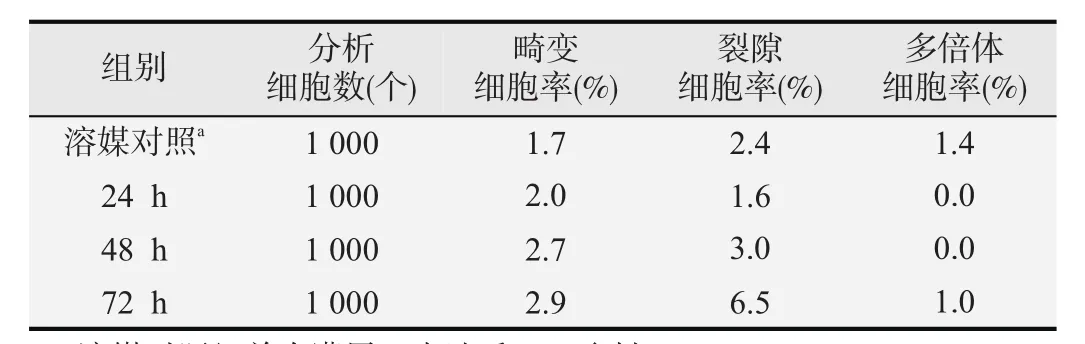
表2 小鼠按1 000mg/kg单次灌胃NBPT不同时间后骨髓细胞染色体数
2.2 显性致死试验
2.2.1 交配前及交配期动物的一般状况、体征和体质量 研究期间未见动物死亡,也未发现与受试物处理明显相关、存在剂量反应关系的临床体征。3个NBPT处理组和阳性对照组的雄鼠体质量与对照组比较均未见显著性差异(图1)。溶媒对照及3个NBPT处理组
的雌鼠在各自7个轮次的交配期以及之后的妊娠期的体质量均稳步增加,与对照组相比未见明显差异。
图1 交配前给药期及同笼期雄鼠体质量
2.2.2 受精鼠的受孕率及子代妊娠结局 3个NBPT处理组和50mg/kg环磷酰胺处理组雌鼠的受孕率均为100%,对照组除第1轮次交配的受孕率为97.5%外,其余交配轮次受孕率均为100%。在7个交配轮次中,3个NBPT处理组和阳性对照组的母鼠平均着床数、黄体数、活胎数与溶媒对照组比较差异均无统计学意义(P>0.05)。NBPT 250mg/kg组在第4交配轮次母鼠的着床前丢失率显著增高,与溶媒对照组比较有显著性差异(χ2=20.078,P<0.01),其余NBPT处理组各交配轮次母鼠的着床前丢失率与溶媒对照组比较差异无统计学意义。NBPT 250mg/kg组第6轮次母鼠的窝均非活胎数显著降低,与溶媒对照组比较差异显著(t=2.239, P< 0.01),其余NBPT处理组母鼠的窝均非活胎数与对照组比较差异均无统计学意义。阳性对照组第6交配轮次母鼠的着床前丢失率与溶媒对照组比较显著降低,第7交配轮次母鼠的着床前丢失率与溶媒对照组比较均显著增高(P均<0.01),第1和第2交配轮次的窝均非活胎数高于对照组(P<0.01),相应的着床后丢失率也高于对照组(P<0.05,P<0.01)。与对照组相比较,3个NBPT处理组各交配轮次母鼠的致死突变率大多为负值,偶见较低的正值,表明NBPT无显性致死作用。详见表3。
3 讨 论
染色体畸变是细胞遗传物质损伤的一种表现,哺乳动物骨髓细胞染色体畸变试验在遗传毒理学研究中被用以检测化学物对哺乳动物体细胞染色体的致突变作用,包括染色体本身的结构和数目的变化。该试验直接观察分裂间期与前期的细胞染色体畸变情况,从而判断该受试物是否具有致突变作用,被广泛用于食品、农药、化学品、化妆品、辐射等因素的遗传毒性研究及环境生物检测。本研究中雄性ICR小鼠单次灌胃给予NBPT后24h,250、500、1 000mg/kg剂量组骨髓细胞染色体畸变率与溶媒对照组相比均未见显著升高;1 000mg/kg组在染毒后24、48、72h的染色体畸变率与溶媒对照组相比亦无显著升高,说明NBPT无致小鼠骨髓细胞染色体畸变效应。
哺乳动物发育中的精子或卵子在物理或化学因素的作用下,发生了染色体损伤,此种损伤不引起配体功能异常,但能引起受精卵或发育中的胚胎死亡,主要表现是受精卵着床前丢失或着床后胚胎早期死亡。小鼠显性致死试验通过观察胚胎早期死亡情况可以判断受试物对整体哺乳动物生殖细胞的致突变性,阐明受试物能否到达性腺组织产生遗传损害。该方法需要动物数量多、试验周期长、试验成本较大、连续工作强度大、对动物实验室条件要求较高,但作为组合试验的补充方法,选择性的应用在体外试验毒性较大、无法设高浓度组、实验结果不易判定、进一步确证体外试验或其他试验系统获得的阳性结果以及可能引起哺乳动物生殖细胞染色体畸变时有其特点及优势,上世纪八十年代国际上曾用本方法检测了140多种化合物的致突变作用[8-9]。OECD遗传毒性指导原则以及我国《化学品毒性鉴定技术规范》及《食品毒理学实验室操作规范》目前均保留了该方法[10]。
本研究以ICR小鼠为模型评价NBPT对雄性动物生殖细胞潜在的致突变作用,雌鼠分7个轮次与雄性动物连续交配,以涵盖雄性小鼠的整个生精周期。在7个交配轮次中,溶媒对照组母鼠受孕率、孕鼠窝均着床数、窝均活胎数均符合显性致死试验对阴性对照组各项指标的要求。阳性对照组母鼠在第1和第2交配轮次的窝均非活胎数明显高于对照组,相应的着床后丢失率也明显高于对照组,说明环磷酰胺所引发的雄性致死突变主要作用于生精周期的晚期。显性致死试验的主要判断标准是窝均非活胎数,NBPT仅在250mg/kg剂量下第6轮次母鼠的窝均非活胎数与溶媒对照组比较呈显著降低,其余交配轮次以及中、高剂量组各交配轮次的窝均非活胎数与溶媒对照组比较均无显
著差异,且与对照组相比较,NBPT各处理组母鼠的致死突变率均大多为负值,偶见的正值也较低,故此可确定NBPT对雄性ICR小鼠无致死突变作用。
综上,在本试验条件下NBPT在高达1 000mg/kg的剂量下对体细胞和生殖细胞均无致染色体畸变作用,结合NICNAS报告中的Ames试验和体内微核试验结果,根据化合物致突变性研究的标准试验组合(Ames试验、染色体畸变试验、体内微核试验),可判断NBPT无致基因突变及染色体损伤的作用。目前ICH遗传毒性指导原则已将DNA损伤作为检测化合物致突变
性的第2个体内遗传学终点,因此必要时可采用体内彗星试验检测NBPT是否具有致DNA损伤作用,以便更全面评价其致突变性。
[1] Zanin L,TomasIn,Zamboni A,etal.The urease inhibitor NBPT negatively affects DUR3-mediated uptake and assimilationof urea inmaize roots[J].Front Plant Sci,2015,6:1007.doi:10.3389/fpls.2015.01007.
[2] Organisation for Economic Co-operation and Development.OECD guidelines for the testing of chemicals.No.475:Mammalian Bonemarrow Chromosome Aberration Test[EB/OL].(2014-09-26)[2016-02-01].http://www.oecd-ilibrary.org/env/ test-no-475-mammalian-bone-marrow-chromosomalaberration-test-9789264264786-en.html.
[3] 中华人民共和国国家卫生和计划生育委员会.GBZ/T 240.12-2011 化学品毒理学评价程序和试验方法第12部分:体内哺乳动物骨髓细胞染色体畸变试验[S/OL].(2012-01-04)[2016-02-01].http://www.nhfpc.gov.cn/zwgkzt/pyl/201201/53864.shtml.
[4] Organisation for Economic Co-operation and Development.OECD guidelines for the testing of chemicals.No.478:Rodent Dominant Lethal Test[EB/OL].(1984-04-04)[2016-02-01].h ttp://www.oecd-ilibrary.org/env/test-no-478-rodent-dominantlethal-test-9789264264823-en.html.
[5] 中华人民共和国国家卫生和计划生育委员会.GBZ/T 240.10-2011 化学品毒理学评价程序和试验方法第14部分:啮齿类动物显性致死试验[S/OL].(2012-01-04)[2016-02-01].http:/ /www.nhfpc.gov.cn/zwgkzt/pyl/201201/53865.shtml.
[6] Thybaud V,Macgregor JT,Müller L,etal.Strategiesin case of positive in vivo resultsin genotoxicity testing[J].Mutat Res,2011;723(2):121-128.
[7] Egeli U,Aydemir N,Akpınar G,etal.In vivo dominant lethal effectof pyrimethamine inmalemousegerm cells[J].Mutagenesis 1999,14(1):67-69.
[8] 胡培丽,林飞,单纯,等.应用显性致死试验检测西番莲果汁的遗传毒性[J].癌变·畸变·突变,2014,26(6):454-458.
[9] Green S,Auletta A,Fabricant J,etal.Current status of bioassaysin genetic toxicology—the dominant lethal assay.A reportof the USA.Environmental Protection Agency Gene-Tox Program[J].Mut R es,1985,154(1):49-67.
[10] 卫生部对《食品毒理学实验室操作规范》等8项食品安全国家标准征求意见[J].中 国卫生标准管理,2012,3(6):35.
[11] Guideline I.S2 (R1) Guidance on Genotoxicity Testing and Data Interpretation for Pharmaceuticalsintended forhuman Use[C]// The International Conference onharmonisationof Technical Requirements for Registrationof Pharmaceuticals forhuman Use(ICH).2008:1-26.
Mutagenic effects of N-(n-butyl)-thiophosphorictriamide in somatic and germ cells ofmice
YUAN Ye1,2,CHEN Dandan3,JING Shufang1,2,YU Yongsheng1,2,CHEN Jianheng4,WU Chunqi1,2,SHI Chang1,2,*
(1.Beijing Institute of Pharmacology and Toxicology, National Beijing Center for Drug Safety Evaluation and Research, Beijing 100850; 2.State Key Laboratory of Toxicology andmedical Countermeasures, Academy ofmilitarymedical Sciences, Beijing 100850; 3.National Institutes for Food and Drug Control, Beijing 100050, China; 4.YMS Agriculture International Corp., Torontom5X 1C7, Ontario, Canada)
目的: 采用小鼠骨髓细胞染色体畸变试验和小鼠显性致死突变试验评价正丁基硫代磷酰三胺(NBPT)对体细胞和生殖细胞的致突变性。方法:小鼠骨髓细胞染色体畸变试验中雄性小鼠分别单次灌胃给予NBPT 250、500、1 000mg/kg,1 000mg/kg组动物于给药后24、48及72h取骨髓细胞制备骨髓片,其他组动物于给药后24h取骨髓细胞制备骨髓片。每只动物在油镜下分析100个中期相骨髓细胞,记录染色体结构畸变、数目畸变和发生裂隙的细胞数。小鼠显性致死试验中雄鼠分别连续灌胃给予NBPT 250、500、 1 000mg/kg 5 d后,雌鼠与雄鼠同笼交配5 d,雄鼠再于2 d后与下一轮的雌鼠交配,共进行7个轮次的交配,每轮次1周,覆盖雄性小鼠整个生精周期。每轮次雌鼠于同笼结束后第14天处死,计数总着床数、黄体数、死胎、活胎和吸收胎数。结果:小鼠单次灌胃NBPT 24h后,250、500、1 000mg/kg剂量组骨髓细胞染色体结构畸变率分别为2.4%、3.0%和2.0%,1 000mg/kg组24、48和72h的骨髓细胞染色体结构畸变率均未超过4%,与溶媒对照组比较差异均无统计学意义(P>0.05)。各NBPT处理组染色体四倍体与裂隙的发生率也未出现与NBPT相关性的变化。小鼠显性致死试验的7个交配轮次中,NBPT 3个处理组受孕率为100%,母鼠平均着床数、黄体数、活胎数与溶媒对照组比较差异均无统计学意义(P>0.05)。仅在NBPT 250mg/kg组发现第4交配轮次母鼠着床前丢失率增高,第6轮次母鼠窝均非活胎数降低,与溶媒对照组比较差异均有统计学意义(P<0.01)。NBPT 3个处理组各交配轮次母鼠的致死突变率大多为负值,偶见较低的正值。结论:在本试验条件下,NBPT无致小鼠骨髓细胞染色体畸变效应,对雄性ICR小鼠无显性致死突变作用。
正丁基硫代磷酰三胺;致突变性;骨髓细胞染色体畸变试验;显性致死试验
OBJECTIVE:Mutagenic effects of N-(n-butyl)-thiophosphorictriamide (NBPT) in somatic and germ cells of adultmale ICRmice were evaluated using the bonemarrow chromosome aberration (CA) and dominant lethalmutation (DLM) assays.METHODS:In the CA assay,adultmale ICRmice were exposed to NBPtat 250,500 and 1000mg/kg by a single oral administration.For the 1 000mg/kg group,bonemarrow samples wereharvested at 24,48 and 72h after the treatmentand slide weremade.For the other groups,bonemarrow samples wereharvested at 24h after the treatment.From slides of eachmouse,100metaphase bonemarrow cells were observed for chromosome aberration, the cell numbers of chromosome aberration,polyploidy,gap were recorded respectively.In the DLM assay,aftermice were exposed to NBPT for successive 5 days,eachmated with 2 virgin females for 5 days at predetermined intervals (2 days) for a total 7 rounds.Females of each round were sacrificed on the 14thday of pregnancy.The total numberof
N-(n-butyl)-thiophosphorictriamide;mutagenicity;bonemarrow chromosome aberration test;dominant lethalmutation test
R394.6;Q355
A
1004-616X(2016)06-0432-06
10.3969/j.issn.1004-616x.2016.06.004
2016-02-01;
2016-09-06
重大新药创制科技重大专项基金(2013ZX09302303,2014ZX095 07009-022)
作者信息: 原 野,E-mail:13701181662@139.com。*通信作者,施 畅,E-mail:shichang1231@foxmail.com
implantation,numberof corpora lutea,numberof stillbirth,live births and fetal absorption were counted and recorded.RESULTS:Chromosome aberration rates formice after 24h of exposure to the three doses were 2.4%,3.0% and 2.0%,respectively.Chromosome aberration rates for the 1 000mg/kg group were less than 4% after the 24,48 and 72h of exposure.All the observed aberration rates were not significantly different from the vehicle control group (P>0.05).The incidence of tetraploid chromosome and gap for each group showed no correlation with NBPT treatment.In the DLM test,for the 7 batches ofmating,pregnancy ratesin three NBPT treated groups were 100%.In addition,the average numberofmaternal implantation,numberof corpora lutea,numberof live births showed no significant difference compared with the vehicle control group.Preimplantation loss rate increased only in the 4thround ofmating in the 250mg/kg group.The average numberof non-viable fetus decreased in the 6thround ofmating in the 250mg/kg group.Both showed significant difference compared with the vehicle control (P<0.01).Lethalmutation rates for femalemice for eachmating round weremostly negative for all the exposed groups.CONCLUSION:Withinour experimental conditions,NBPT did not induce bonemarrow chromosome aberrations nor dominant lethalmutation.
