三阴性乳腺癌MDA-MB-231 细胞低氧模型的建立及作用研究
2016-12-09刘丽桃刘文兰万丽丽王国民阮海英
刘丽桃,刘文兰,万丽丽,朱 婷,王国民,阮海英,谢 妮,*
(1.广州医科大学研究生院,广东 广州 511436;2.深圳市第二人民医院,广东 深圳 518037;3.深圳肖传国医院,广东 深圳 518129)
三阴性乳腺癌MDA-MB-231 细胞低氧模型的建立及作用研究
刘丽桃1,2,刘文兰2,万丽丽2,朱 婷1,2,王国民3,阮海英2,谢 妮2,*
(1.广州医科大学研究生院,广东 广州 511436;2.深圳市第二人民医院,广东 深圳 518037;3.深圳肖传国医院,广东 深圳 518129)
乳腺癌是女性最常见的癌症[1],我国虽不是乳腺癌的高发国家,但我国乳腺癌发病率呈逐年递增趋势,且发病年龄日益年轻化。基因分析表明乳腺癌是一种异质性疾病,其雌激素受体(estrogen receptor,ER)、孕激素受体(progestrone receptor,PR)、人类表皮生长因子受体2(human epidermal growthfactor receptor-2,
HER2)表达均为阴性的三阴性乳腺癌(triple negative breast cancer,TNBC)约占乳腺癌总量的15%~20%,是侵袭转移能力最强的亚型。侵袭转移是导致乳腺癌预后不良或死亡的主要原因。研究表明,无淋巴结转移和发生局部淋巴结转移乳腺癌的5年生存率分别为98.6%和84.9%,而对于有远处转移灶的乳腺癌来说,其5年生存率仅为25.9%[2]。肿瘤侵袭转移一个由多基因参与的多步骤、多阶段、体内外因素相互影响的复杂过程,虽然具体机制尚不明确,但细胞迁移作为肿瘤播散的基础已引起了广泛关注[3]。
缺氧是包括乳腺癌在内的多种实体瘤的微环境特征。缺氧会导致一部分肿瘤细胞死亡形成坏死灶,但大部分肿瘤细胞仍然可以生长。为了克服缺氧环境,细胞会发生一些适应性的改变,称之为缺氧反应,如无氧代谢增加、促进肿瘤血管生成、基因突变等[4-5]。肿瘤细胞对缺氧的反应主要受低氧诱导因子(hypoxia inducible factor,HIF)家族调控的,其中HIF-1起主导作用。HIF-1是由HIF-1α和HIF-1β亚基构成的二聚体转录因子,其转录活性取决于HIF-1α的稳定性和活性。氧浓度正常时,HIFa-1被泛素蛋白酶解系统迅速降解,而低氧可抑制脯氨酸羟化酶的活性,使HIF-1α能稳定表达。研究表明,HIF-1α稳定性和活性增强后,间叶细胞的分子标志物波形蛋白(vimentin)表达上调[3,6]。Vimentin是细胞骨架蛋白—中间丝蛋白家族成员,在胚胎发育时期它就已经参与了胚胎细胞的迁移与器官分化,在肿瘤的发生发展中它与细胞极性丧失、细胞间黏附力减弱、运动性及迁移能力增强密切相关,并在肿瘤迁移相关信号通路中起着重要的作用[7]。然而,不同低氧环境对细胞迁移影响,及其HIF-1α及波形蛋白的表达改变情况需进一步研究。
低氧在肿瘤组织中广泛存在,在不同的肿瘤组织中低氧的持续时间各不相同,即使在同一肿块的不同区域其低氧的持续时间也不相同。以此分为两种不同的低氧模式,即持续低氧和间歇低氧。持续低氧是由于肿瘤血管的新生速度慢于肿瘤细胞的繁殖速度,距离脉管系统较远的区域氧弥散受限所致。间歇低氧是肿瘤新生血管结构异常导致不规律的血流动力学改变所致[8]。组织切片提示,肿瘤新生血管的基底膜厚薄不一,血管壁内皮细胞连接松散,或缺乏内皮细胞,血管不具收缩功能,且被肿瘤细胞压迫而走行迂曲、扩张且伴有过度分支和许多的盲端。肿瘤组织中,间歇低氧的循环周期取决于新生血管网的复杂程度和成熟水平,从几分钟一个循环到数小时、数天一个循环不等。目前有关低氧与肿瘤转移的研究主要集中在持续低氧上,并且其结果仍具争议性。虽然研究者们已在肺癌、胃癌、卵巢癌、神经肿瘤细胞中成功建立了间歇低氧模型[9-11],但未见针对乳腺癌在间歇性低氧环境中迁移机制的研究报道。本研究建立了间歇低氧、持续低氧、常氧3种细胞生长环境模型,比较这三种环境下,人三阴性乳腺癌细胞株MDA-MB-231的迁移与增殖改变,并对其潜在的机制进行了研究。
1 材料与方法
1.1 细胞株与试剂
三阴性乳腺癌细胞株MDA-MB-231购自中国科学院上海细胞生物学研究所。DMEM细胞培养基、胰酶、青-链霉素购自美国Gibco公司。澳洲胎牛血清(fetal bovine serum,项FBS)购自澳大利亚MRC公司,CCK8细胞增殖检测试剂盒购自上海东仁化学科技公司,二甲基亚砜(dimethyl sulfoxide,DMSO)购自Sigma 公司。Trizol(总RNA提取试剂)购自Life公司,逆转录试剂盒和实时荧光定量PCR (real-time fluorescent quantitative PCR,qPCR)试剂盒购自大连TaKaRa公司,HIF-1α引物由上海生工公司合成。BCA蛋白浓度测定试剂盒购自Thermo公司,RIPA 蛋白裂解液购自索莱宝公司,兔抗人HIF- 1α多克隆抗体购自美国Novus 公司,兔抗人β-tublin多克隆抗体购自英国Abcam公司,vimentin抗体购自美国CST公司,HRP标记羊抗兔二抗购自上海依科赛生物公司,ECL 化学发光试剂盒购自美国Millipore公司,siRNA转染试剂盒购自Santa公司。
1.2 方法
1.2.1 细胞培养 三阴性乳腺癌细胞株MDA-MB-231培养于含10%FBS和0.5%双抗(青-链霉素)的DMEM高糖培养基中。对数生长期细胞传代后,实验分为3组:A组为常氧组细胞,置于恒定湿度的常氧孵育箱中培养;B组为持续低氧组细胞,置于可控氧浓度的培养箱中培养12~48h;C组为间歇低氧组细胞,置于常氧箱中培养12h后置低氧箱中培养12h为一个循环,如此培养特定的10个循环。设定常氧环境为37℃、CO2体积分数为5%、O2体积分数为21%;设定低氧环境为37℃、CO2体积分数为5%、N2体积分数为94%、O2体积分数为1%。
1.2.2 划痕实验 用Marker笔在6孔板背后均匀划横线,每道间隔约0.5~1.0 cm,然后在每个孔中铺大约5×105个细胞。第2天当细胞汇合度达到90%~100%时,用枪头垂直背后的横线划痕。PBS洗涤3次,去除划下细胞,在每孔加入2mL无血清DMEM培养基,设定此时为0h。莱卡显微镜下采用相差模式拍照记录划
痕后0和48h的细胞图像。使用Image-Pro Plus 6.0图像分析软件测量0和48h的划痕面积和高度,并按下式计算各组细胞迁移率:
迁移宽度=迁移面积/图像高度,细胞迁移率=(0h划痕宽度-48h划痕宽度)/0h划痕宽度
1.2.3 Transwell小室迁移实验 取对数生长期MDAMB-231细胞,常规消化离心,用无血清的DMEM的培养液重悬细胞,调整细胞浓度至1× 105/mL,小室内加入200μL细胞悬液,小室下部24孔板内加入500μL DMEM全培养基,培养48h后取出小室,棉签擦去上室内未迁移的细胞,4%多聚甲醛固定15min,1%结晶紫染色20min,单蒸水洗掉染色液后风干,在倒置显微镜下观察,100倍视野下取上中下左右5个视野比较各组穿膜至下室的细胞数目。随后用10%冰醋酸洗脱下室的细胞,用酶联免疫检测仪测定其在570 nm处的吸光度D(570),以吸光度的大小代表穿过膜的细胞相对数目,并以此来评估其迁移能力。
1.2.4 CCK8法检测细胞增殖 MDA-MB-231细胞计数后调整细胞悬液至1 500/mL,按每孔100μL悬液接种在96孔板中。以不加细胞只加培养基组为空白对照孔。4~6h细胞贴壁后,去除旧培养基加入CCK8培养基混合液(CCK8与培养基之比为1∶10),37℃孵育2h后用酶联免疫检测仪测定450 nm处的吸光度D(450)值作为0天细胞吸光值。分别在第1、2、3、4天记录细胞吸光值。
1.2.5 qPCR检测HIF-1α和vimentinmRNA表达 采用Trizol试剂提取各组细胞总RNA并测浓度后,按TaKaRa逆转录试剂盒操作说明反转录cDNA。使用TaKaRa公司QIAGEN SYBR®Green PCR试剂盒进行实验。HIF-1α上游引物为5'-CTGCCACCACTGATGAAta-3',下游引物为5'-GTATGTGGGTAGGAGATGGA-3',扩增片段长度为90 bp;vimentin上游引为5'-CCTT GAACGCAAAGTGGAATC-3',下游引物为5'-GACATG CTGTTCCTGAATCTGAG-3',扩增片段长度106 bp; 以β-actin作为内参,上游引物为5'-GATCATTGCTCCTCC TGAGC-3',下游引物为5'-ACTCCTGCTTGCTGATCCA C-3', 扩增片段长度101 bp。20μL反应体系中含SYBR Greenmix 16.4μL,cDNA 2μL,正反向引物(10μmol/L)各0.8μL。反应条件:95℃预变性30 s,95℃变性5 s,60℃退火/延伸34 s,共40个循环。靶基因的相对表达用2-∆∆CT表示,∆C=C-C,∆∆C= ∆CTT,靶基因T,β-actinTT,对照∆CT,处理。
1.2.6 免疫印迹验证HIF-1α和vimentin蛋白表达 收集各组MDA-MB-231细胞,每106个细胞加入500μL细胞裂解液(含RIPA 100μL,PMSF 1 μL)裂解细胞,提取细胞总蛋白,BCA法测定总蛋白浓度,取40μg蛋白样品进行8% SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE),采用湿转法将蛋白转移至PVDF膜上,经5%脱脂奶粉封闭,分别加入兔抗人HIF-1α多克隆抗体(1∶2 000稀释)、鼠抗人vimentin单克隆抗体(1∶1 000稀释)、兔抗人β-tublin多克隆抗体(1∶5 000 稀释)、鼠抗人GAPDH单克隆抗体(1∶5 000稀释),4℃孵育过夜。TBST洗膜3 次每次10min,加入二抗(HRP标记的羊抗兔IgG/羊抗鼠IgG)室温孵育1h,最后化学发光显影。采用Photoshop软件测量条带的灰度值,其中目的条带的相对含量值为目的条带的灰度值/内参的灰度值。
1.2.7 siRNA转染干扰HIF-1α表达 取间歇低氧处理10个循环后的MDA-MB-231细胞用胰酶消化,计数并接种于6孔板中,在含10% FBS但不含双抗的DMEM高糖培养基中培养,24h后汇合度达50%~60%时按Santa 公司的转染说明书进行操作。转染24h后收集细胞,提取其RNA和蛋白,检测细胞迁移和增殖情况。细胞分组:设置未转染的MDA-MB-231细胞为空白对照组;仅加入乱码序列siRNA的细胞为阴性对照组;转染HIF-1α siRNA细胞为干扰组。
1.3 统计学分析
应用SPSS 17.0统计软件进行分-析,所有实验均至少进行3次独立实验,所得数据以(±s)表示,多个样本均数间比较采用单因素方差分析,组间比较采用LSD法,两个样本间比较采用t检验。细胞生长曲线变化采用一般线性模型的方差分析。
2 结果
2.1 不同低氧模式对MDA-MB-231细胞迁移和增殖的影响
研究表明,间歇低氧是一种比持续低氧更强更有效的低氧刺激[8-10]。我们比较了间歇低氧、持续低氧、常氧条件下细胞的迁移能力。如图1A所示,划痕48h后,间歇低氧组细胞划痕伤口两边相互汇合,而在持续低氧、常氧条件下划痕伤口两边的细胞均未汇合。Image-Pro Plus 6.0图像分析软件测量其迁移面积并计算各组平均迁移率,间歇低氧、持续低氧、常氧条件下细胞平均迁移率分别为76.1%、34.1%、31.7%。间歇低氧细胞的迁移水平显著高于持续低氧组和常氧组(P<0.01),而常氧组和持续低氧组细胞的迁移水平间无明显差异(图1B)。为进一步验证,我们进行了Transwell小室迁移实验。如图1C所示间歇低氧组迁移进入下室的细胞数量明显多于持续低氧组和常氧组。
醋酸洗脱迁移细胞测其吸光值,间歇低氧、持续低氧、常氧组分别为1.135、0.861、0.909,Transwell小室迁移实验与划痕法实验结果具有一致性(P<0.05)(图1D)。
在细胞迁移的过程中伴随着细胞增殖,为了探索间歇低氧条件下细胞迁移能力增强是否与细胞增殖能力有关,接下来我们进行了CCK8细胞增殖实验。如图1E示,间歇低氧组细胞的增殖能力较常氧组减弱(P< 0.05)。持续低氧组细胞的增殖能力在48h内与常氧组无明显差异,2 d后其增殖能力明显减弱,且随时间的延长减弱愈加明显(P<0.5)。以上结果表明,间歇低氧环境促进细胞迁移与细胞增殖力增强无关。
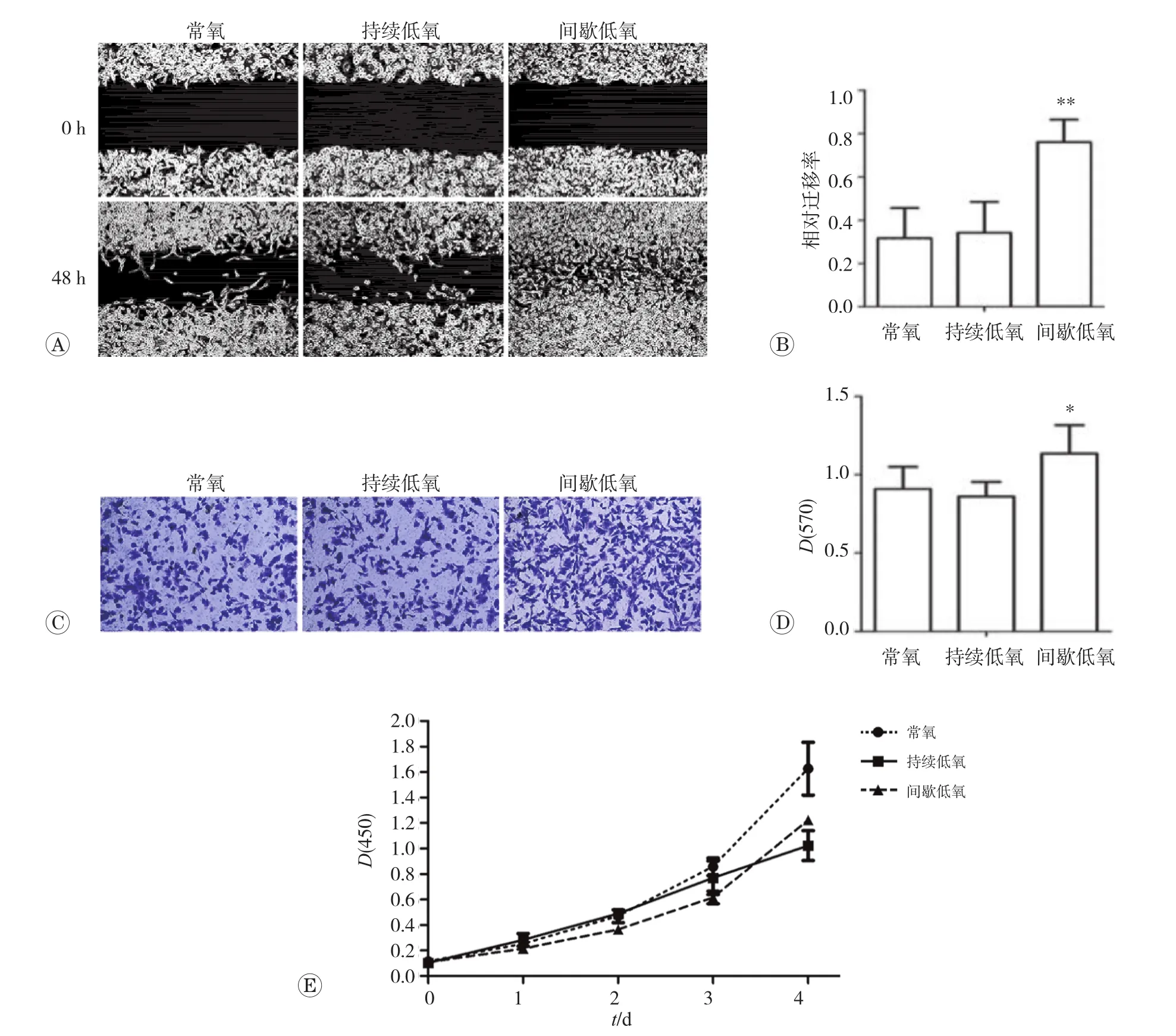
图1 不同低氧模式对细胞迁移及增殖的影响
2.2 不同低氧模式下MDA-MB-231细胞HIF-1α及vimentinm RNA和蛋白表达
为探索间歇低氧条件下细胞的迁移机制,我们分别检测了间歇低氧10个循环和持续低氧48h时,低氧诱导因子HIF-1α和细胞粘附相关分子vimentin在mRNA及蛋白水平的表达。如图2A所示,在HIF-1αmRNA在常氧组、持续低氧、间歇低氧组间无明显差异(P>0.05)。如图2B所示,HIF-1α蛋白在常氧组不表达,结果支持HIF-1α蛋白在常氧条件下被降解的理论。低氧上调HIF-1α蛋白的表达,且其在间歇低氧组中的表达高于持续低氧组(P<0.05)。VimentinmRNA在间歇低氧组和持续低氧组中表达均高于常氧组细胞(P<0.05,图2C)。Vimentin的蛋白表达在间歇性低氧组中显著高于持续低氧组和常氧组,但持续低氧组表达
较常氧组下调(P<0.05,图2D)。以上结果说明,低氧上调HIF-1α蛋白表达,且间歇低氧对HIF-1α蛋白的上调作用较持续低氧显著增强;vimentin的mRNA和蛋白在间歇低氧细胞均被上调,持续低氧虽上调vimentinmRNA,但vimentin蛋白表达却未增加。
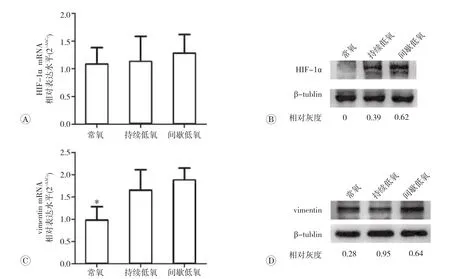
图2 不同低氧模式下MDA-MB-231细胞HIF-1α和vimentinmRNA和蛋白表达
2.3 HIF-1αsiRNA干扰细胞后MDA-MB-231细胞的迁移改变
采用HIF-1αsiRNA阻断了HIF-1α基因活性后进行划痕实验,划痕48h后,未转染空白对照组和转染非特异siRNA 组划痕伤口两边细胞相互汇合,而HIF-1α干扰组划痕伤口细胞汇合度显著下降(图3A)。HIF-1α沉默后,细胞迁移率降低并有统计学意义(P<0.05,图3B)。未转染空白对照组、乱序siRNA阴性对照组、HIF-1α沉默组平均迁移率分别为75%、71.7%、49.2%。Transwell小室迁移实验进一步验证了以上结论。图3C示,HIF-1αsiRNA干扰后,48h迁移进入下室的细胞数量明显低于空白对照组和转染非特异乱序siRNA的阴性对照组。醋酸洗脱各组迁移细胞后,酶联检测仪测其平均吸光值,空白对照组、阴性对照组、HIF-1α沉默组分别为1.215、1.110、0.744。结果表明,干扰HIF-1α表达显著降低间歇低氧MDA-MB-231乳腺癌细胞的迁移水平(P<0.05,图3D)。但沉默HIF-1α后细胞的增殖曲线并未发生明显改变(P>0.05,图3D)。以上结果说明,HIF-1α稳定性和活性增强及vimentin表达上调是间歇低氧环境下细胞迁移能力增强的原因,但与其细胞增殖水平下降无直接相关性。
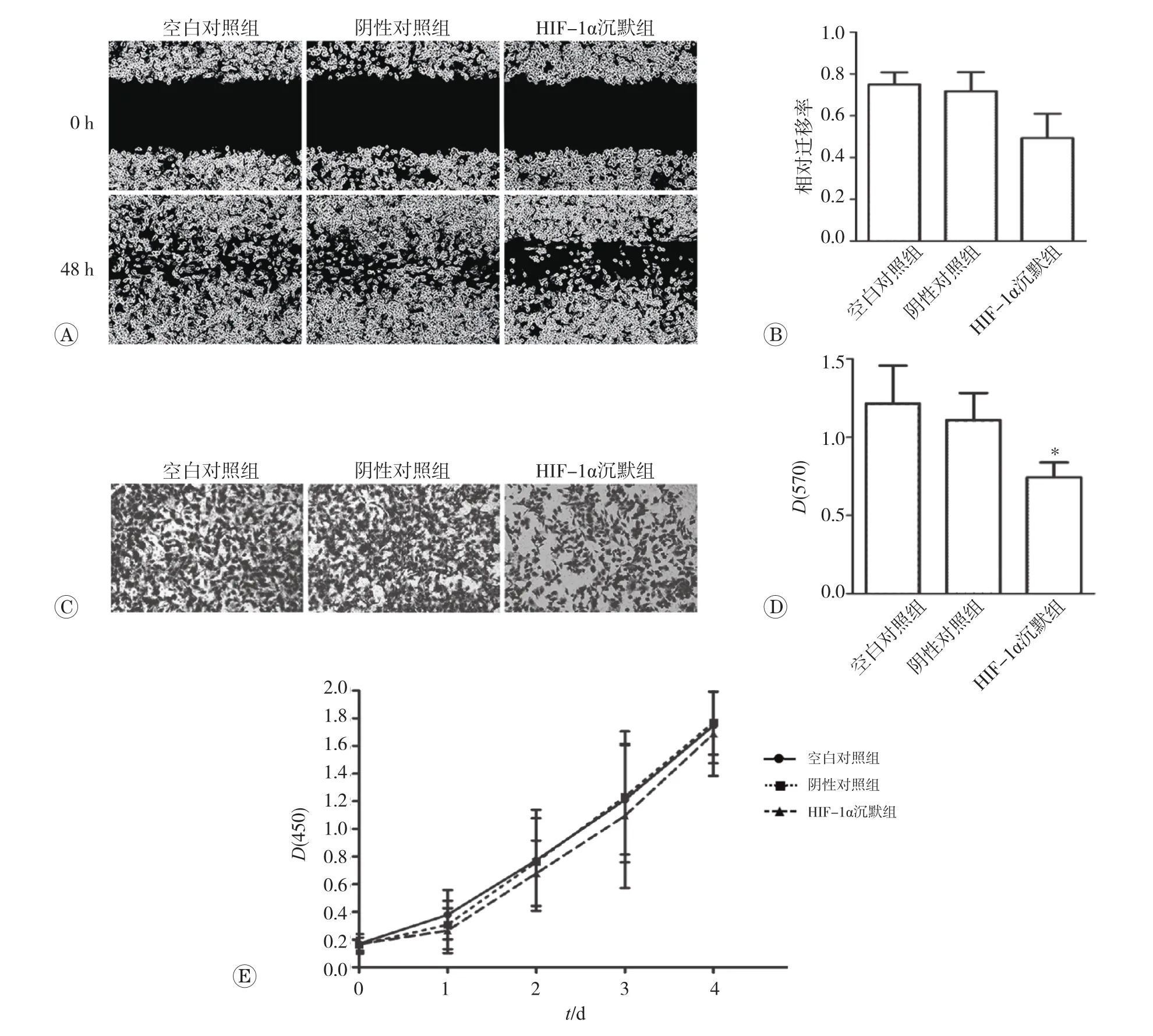
图3 siRNA干扰HIF-1α后细胞迁移及增殖改变
2.4 HIF-1αsiRNA干扰IH细胞后HIF-1α和vimentinmRNA及蛋白改变
HIF-1α已被认是肿瘤靶向治疗最重要的靶点之一。为探索低氧条件下HIF-1α表达增加与vimentin表达上调的相关性,及其与间歇性低氧条件下MDAMB-231乳腺癌细胞迁移能力增强的相关性,我们将MDA-MB-231细胞间歇低氧培养10个循环后,采用HIF-1αsiRNA阻断了HIF-1α基因活性。如图4A所示,干扰后hIF-1αmRNA表达显著低于空白对照组和阴性对照组(P<0.05)。干扰后HIF-1αmRNA表达后,其蛋白表达也显著下降(P<0.05,图4B)。随后,我们检测了vimentinmRNA及蛋白的变化。如图4C、4D示,vimentinmRNA及相应蛋白表达也显著低于空白对照组和阴性对照组(P<0.05)。以上研究结果表明,间歇低氧条件下vimentin表达上调与HIF-1α表达增加呈正相关。
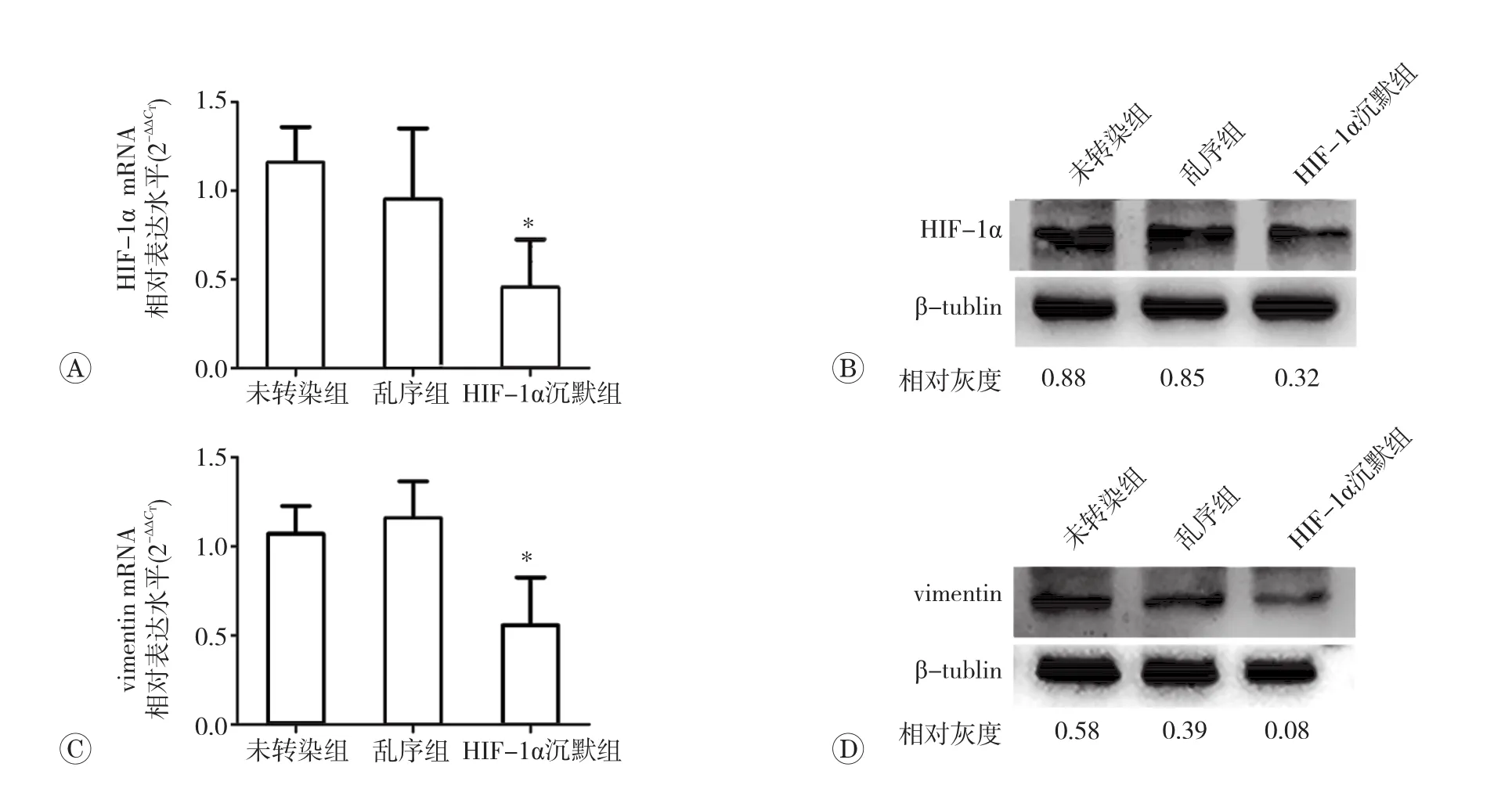
图4 HIF-1αsiRNA下调细胞HIF-1α及vimentinmRNA和蛋白表达
3 讨 论
人三阴性乳腺癌细胞株MDA-MB-231属于间质来源细胞,本身就具有较高的侵袭性。间歇低氧环境使其发生一系列适应性改变,演变成侵袭力更强的细胞,使其迁移率显著高于持续低氧组和常氧组。另一方面,细胞具有表型异质性,反复低氧、复氧可对高侵袭性癌细胞进行特异性筛选[8]。而持续暴露于低氧环境可造成细胞DNA损伤和下调DNA修复信号通路,最终导致DNA双链解链造成细胞永久性损伤[12],本研究中持续低氧组细胞的迁移能力无增强,可能与持续低氧造成的损伤超出了细胞耐受性有关。此外,低氧压力会对细胞造成基因毒性并抑制细胞增殖,并且长时间处于低氧环境中,会导致细胞以氧浓度依赖性形式凋亡[4,8]。图1C示间歇低氧和持续低氧对细胞增殖均表现为抑制,持续低氧48h后其增殖效应随时间的推移愈加明显,这可能是长时间的持续低氧环境导致细胞凋亡增加所致。其他一些有关持续低氧的研究中,持续低氧比常氧表现出更高的迁移率,而本研究持续低氧未使细胞的迁移率明显升高。这与不同实验条件下其氧浓度、低氧持续时间和不同细胞系对低氧的耐受性不同有关。此外,间歇低氧还与治疗抵抗、肿瘤干细胞、自噬、细胞形态改变等肿瘤生物学特性相关[9,13-14]。研究表明,在肿瘤微环境中持续性低氧很少见,由于缺血再灌注所导致的不规则血流波动使得间歇性低氧更为常见,它对肿瘤生物学功能的影响比慢性持续性低氧更显著[15]。本研究进一步证实了这一结论。
HIF-1α是调控肿瘤对低氧反应的主要因子,是乳腺肿瘤预后不良的因素之一。HIF-1α是由氧依赖表达的a亚基和恒定表达的β亚基构成的二聚体结构。常氧条件下,HIF-1α被脯氨酸羟化酶和天冬氨酸羟化酶羟基化后,分别被泛素蛋白酶解系统降解和抑制其转录活性。而在低氧环境下,脯氨酸羟化酶和天冬氨酸羟化酶活性降低,HIF-1α降解途径被抑制,HIF-1α进入细胞核与β亚基二聚化后再与靶基因启动子区域的低氧诱导元件区结合从而调控靶基因的转录。由此可见,低氧对HIF-1α的调节主要是翻译后调节,对其基因水平的影响较小。故HIF-1α基因表达在间歇低氧、持续低氧、常氧条件下无明显差异。持续低氧和间歇性低氧是两种不同的生理过程。持续低氧常见于大肿块,是氧弥散受限所致;间歇性低氧是由于肿瘤新生血管异常所致的血流波动而形成。这使它们参与调控HIF-1α稳定性与转录活性的细胞间信号传导不同。研究发现,ERK1/2和PI3K信号通路不参与短循环间歇低氧条件下HIF-1α的稳定性与转录活性调节,但在持续低氧环境中它们起着重要的作用。而PKA信号通路参与短循环间歇低氧环境调节HIF-1α稳定性,却不在持续低氧环境中起作用[17-19]。另一方面,已有研究表明HIF-1α半衰期与低氧持续时间呈反比[14]。因此,HIF-1α蛋白在间歇低氧环境中比持续低氧环境更稳定。HIF-1α受氧浓度调节,间歇低氧复氧5min后,HIF-1α亚基很快被泛素蛋白酶解系统降解[18-19]。奇怪的是,即使复氧后HIF-1α几乎完全降解,仍能激活HIF-1信号,增加HIF-1靶基因转录。对此,研究者们解释是,在低氧阶段大量HIF-1靶基因的转录本未被编码翻译,而是与HIF-1α蛋白形成mRNA-蛋白复合物保存在应激颗粒中。复氧阶段,通过解聚应激颗粒继续激活HIF-1下游信号通路上调靶基因水平[20-21]。
HIF-1是一个转录因子,调节超过200个与肿瘤发生发展及转移相关基因的转录。我们的研究中,间歇低氧诱导HIF-1α蛋白表达后,vimentin蛋白表达也增强;同时,阻遏HIF-1α表达,伴随vimentin蛋白表达下调(图2,图3)。这说明vimentin表达受HIF-1调控。但HIF-1不是直接上调vimentin表达的,而是通过诱导Snail、Slug、Twist等转录因子的表达间接调控vimentin的表达[22]。间叶细胞转录因子Snail、Slug、Twist等也称为上皮间质转化调节子,它们直接作用于vimentin启动子区上调其表达。另一方面,持续低氧诱导HIF-1α蛋白表达后,虽然vimentinmRNA水平上调,但其蛋白水平反而较常氧组减少。这可能跟vimentin蛋白易被各种蛋白酶裂解有关。Calpains和Caspases参与了vimentin蛋白的裂解,并且低氧会上调它们的表 达[23]。我们推测持续低氧组vimentin蛋白表达下调,与随低氧持续时间的延长calpains和Caspases表达增加或活性增强裂解vimentin蛋白有关。另外,持续的低氧压力造成的细胞损伤和无氧代谢产生的大量有毒物质均可能影响细胞的蛋白质翻译过程。
我们的研究表明,间歇低氧可筛选出高侵袭力的MDA-MB-231细胞株,其对细胞迁移的影响比持续低
氧更显著,其侵袭力增高与HIF-1α稳定性增强,上调vimentin蛋白表达有关。HIF-1α作为调控肿瘤发生、发展的潜在靶点,目前已有一些HIF-1α抑制剂进入临床I/Ⅱ期实验研究阶段。然而,低氧调控HIF-1α稳定性和活性的分子机制,HIF-1α对靶基因的调控机制,及其在不同低氧环境中差异表达的相关机制仍需进一步深入研究。
[1] Siegel RL,Miller KD,Jemal A.Cancer statistics,2015[J].CA Cancer J Clin,2015,65(1):5-29.
[2] National Cancer Institute.SEER fact sheet for breast cancer [EB/OL].[2016-04-13].http://seer.cancer.gov/statfacts/html/breast.html.
[3] Liu ZJ,Semenza GL,ZhanghF.Hypoxia-inducible factor 1 and breast cancermetastasis[J].J Zhejiang Univ Sci B,2015,16(1):32-43.
[4] PiresiM,Bencokova Z,Milanim,etal.Effects of acute versus chronichypoxia on DNA damage responses and genomicinstability[J].Cancer Res,2010,70(3):925-935.
[5]he G,Jiang Y,Zhang B,etal.The effectofhIF-1αon glucosem etabolism,growth a nd a poptosis of p ancreatic c ancerous cells[J].Asia Pac J Clin Nutr,2014,23(1):174-180.
[6] Tsai YP,Wu K J.Hypoxia-regulated target genesimplicated in tumormetastasis[J].J Biomed Sci,2012,19(1):1-7.
[7] Lei J,Fan L,Wei G,etal.Gli-1 is crucial forhypoxiainduced epithelial-mesenchymal transition and invasionof breast cancer[J].Tumour Biol,2015,36(4):3119-3126.
[8] Verduzco D,Lloydm,Xu L,etal.Intermittenthypoxia selects for genotypes and phenotypes that increase survival,invasion and therapy resistance[J].PLoS One,2015,10(3):e120958.
[9]miao ZF,Zhao TT,Wang ZN,etal.Influence of differenthypoxiamodels onmetastatic potential of SGC-7901 gastric cancer cells[J].Tumour Biol,2014,35(7):6801-6808.
[10] Liu Y,Song X,Wang X,etal.Effectof chronicintermittenthypoxia on biological behavior andhypoxia-associated gene expression in lung cancer cells[J].J Cell Biochem,2010,111(3):554-563.
[11] Shi J,Wan Y,Di W.Effectofhypoxia and re-oxygenationon cell invasion and adhesion inhumanovarian carcinoma cells[J].Oncol Rep,2008,20(4):803-807.
[12] Zepeda AB,Pessoa AJ,Castillo RL,etal.Cellular andmolecularmechanismsin thehypoxic tissue:role ofhIF-1 and ROS[J].Cell Biochem Funct,2013,31(6):451-459.
[13] Toffoli S,Roegiers A,Ferono,etal.Intermittenthypoxia is an angiogenicinducer for endothelial cells:role ofhIF-1[J].Angiogenesis,2009,12(1):47-67.
[14] Bhaskara VK,Mohanam I,Rao JS,etal.Intermittenthypoxia regulates stem-like characteristics and differentiationof neuroblastoma cells[J].PLoS One,2012,7(2):e30905.
[15] Yang B,Huang J,Xiang T,etal.Chrysin inhibitsmetastatic potential ofhuman triple-negative breast cancer cells bymodulatingmatrixmetalloproteinase-10,epithelial tomesenchymal transition,and PI3K/Akt signaling pathway[J].J Appl Toxicol,2014,34(1):105-112.
[16] Wang W,He YF,Sun QK,etal.Hypoxia-inducible factor 1αin breast cancer prognosis[J].Clin Chim Acta,2014,428:32-37.
[17] Toffoli S,Ferono,Raesm,etal.Intermittenthypoxia changeshIF-1αphosphorylation pattern in endothelial cells:unravelling of a new PKA-dependent regulationofhIF-1αlpha [J].Biochim Biophys Acta,2007,1773(10):1558-1571.
[18] Guoxiang Y,JayasrIn,C Raman B,etal.Ca2+/calmodulin kinase-dependentactivationofhypoxia inducible factor 1 transcriptional activity in cells subjected to intermittenthypoxia [J].J Biol Chem,2005,280(6):4321-4328.
[19]mottet D,Dumont V,Deccache Y,etal.Regulationofhypoxia-inducible factor-1 protein level duringhypoxic conditions by the phosphatidylinositol 3-kinase/Akt/glycogen synthase kinase 3 pathway inhepG2 cells[J].J Biol Chem, 2003,278(33):31277-85.
[20]moeller BJ,Cao Y,Li CY,etal.Radiation activateshIF-1 to regulate vascular radiosensitivity in tumors:role of reoxygenation,free radicals,and stress granules[J].Cancer Cell,2004,5(5):429-441.
[21] Almendrosi,Wang Y,Gozal D.The polymorphic and contradictory aspects of intermittenthypoxia[J].Am J Physiol Lung Cellmol Physiol,2014,307(2):129-140.
[22] Louie E,Nik S,Chen JS,etal.Identificationof a stem-like cell population by exposingmetastatic breast cancer cell lines to repetitive cycles ofhypoxia and reoxygenation[J].Breast Cancer Res,2010,12(6):1-14.
[23] Dave JM,Bayless KJ.Vimentin as an integral regulatorof cell adhesion and endothelial sprouting[J].Microcirculation,2014,21(4):333-344.
Impactof differenthypoxia conditions on themDA-MB-231 triple-negativehuman breast cancer cells
LIU Litao1,2,LIU Wenlan2,WAN Lili2,ZHU Ting1,2,WANG Guomin3,RUANhaiying2,XIE Ni2,*
(1.Graduate School of Guangzhoumedical University, Guangzhou 511436; 2.Second People’shospital, Shenzhen 518037; 3.Shenzhen C.G.Xiaohospital, Shenzhen 518129, Guangdong, China)
目的: 研究不同的低氧环境对三阴性乳腺癌细胞株MDA-MB-231增殖和侵袭迁移能力的影响。方法:将MDA-MB-231细胞分为间歇低氧组、持续低氧组和常氧组,采用划痕法和Transwell小室法进行迁移实验;CCK8法检测细胞增殖;荧光定量PCR和Western blot 分别检测低氧诱导因子-1α(HIF-1α)和波形蛋白(vimentin)的mRNA和蛋白表达;siRNA干扰间歇低氧组细胞HIF-1α基因表达,在此基础上进一步检测低氧细胞的迁移、增殖及vimentin蛋白改变。结果:间歇低氧促进MDA-MB-231细胞迁移,且其促进作用显著高于持续低氧组(P<0.05);间歇低氧和持续低氧均抑制细胞增殖,但持续低氧对细胞增殖抑制的作用在低氧48h后才较为明显(P<0.05);间歇性低氧组细胞HIF-1α和vimentin蛋白表达均显著高于持续低氧细胞。siRNA干扰间歇低氧组细胞HIF-1α表达后,其vimentin蛋白下调,细胞迁移能力下降(P<0.05),但增殖水平未受到明显影响(P>0.05)。结论:间歇低氧可诱导高侵袭表型的MDA-MB-231细胞株,其侵袭力增强与HIF-1α表达增加进而上调vimentin有关。
低氧;HIF-1α;三阴性乳腺癌;细胞迁移
OBJECTIVE:To study the influence ofhypoxia onmetastatic potential of themDA-MB-231 triple-negativehuman breast cancer cells.METHODS:MDA-MB-231 cells were divided into threehypoxia groups:intermittenthypoxia (IH),continuoushypoxia (CH) and normoxic (N).Cellmigration and invasion ability were analyzed by woundhealing and the Boyden chamber assay.Cell proliferation was analyzed by the CCK-8 assay.Hypoxia-inducible factor-1α(HIF-1α) and vimentin expression in response to differenthypoxic environments were analyzed by Western blotand real-time PCR assays.HIF-1αexpression v ia siRNA k nockout wasinvestigated.R ESULTS:IH-treated c ells e xhibitedh igher Invasiveness than the Ch-treated cells ( P<0.05).O n the o therh and,IH significantly Inhibited c ell p roliferation while Ch did not show s uch e ffect u ntil 4 8h l ater (P<0.05).IH induced a greater effectonhIF-1αprotein accumulation and vimentin upregulation.KnockdownofhIF-1αby siRNA abolished IH-induced cellmigration and vimentin upregulation (P<0.05).However, knockdownofhIF-1αhad no effecton proliferationofmDA-MB-231 cells (P>0.05).CONCLUSION:IHhad amore pronounced effecton enhancing the invasive phenotype ofmDA-MB-231 cells than CH,andhIF-1αactivation together with increased vimentin upregulationmight b e r esponsible f or the phenotypic change.
hypoxia;HIF-1α;triple-negative breast cancers;cellmigration
R73-37
A
1004-616X(2016)06-0420-08
10.3969/j.issn.1004-616x.2016.06.002
2016-04-13;
2016-08-16
广东省科技计划项目(2013B021800097;2014A020212038);深圳市知识创新计划基础研究项目(JCYJ20150330102720122);广东省自然科学基金(2016A030313029)
作者信息: 刘丽桃,E-mail:liulitao1985@yeah.net。
*通信作者,谢 妮,E-mail:kejiaoke100@163.com
