内镜下黏膜剥离术治疗胃间质瘤的有效性及安全性分析
2016-12-09宋伟杨晓钟戴伟杰
宋伟,杨晓钟,戴伟杰
(南京医科大学附属淮安第一医院 消化内科,江苏 淮安 223300)
内镜下黏膜剥离术治疗胃间质瘤的有效性及安全性分析
宋伟,杨晓钟,戴伟杰
(南京医科大学附属淮安第一医院 消化内科,江苏 淮安 223300)
目的探讨内镜下黏膜剥离术(ESD)治疗胃间质瘤的临床价值。方法回顾性分析2012年6月-2015年12月该院收治的胃间质瘤(直径≤3 cm)患者56例,所有患者均采用ESD方式治疗。分析病例的完整切除率、并发症发生率及术后有无复发等。结果54例(96.4%)成功完成ESD,2例因出血、穿孔转外科行开腹手术。术后病理以及免疫组织化学结果显示CD117阳性51例(91.1%)、CD34阳性47例(83.9%)。术后随访3~48个月,随访期间无复发病例。结论ESD是治疗相对小的胃间质瘤安全、有效的手术方式。
胃间质瘤;内镜下黏膜剥离术;治疗
胃肠道间质瘤(gastrointestinal stromal tumor,GIST)是一种常见的消化道间叶组织源性肿瘤,起源于胃肠壁黏膜肌层或固有肌层,最常见于胃(50.0%~60.0%)和小肠(30.0%~35.0%),少部分发生在结肠、直肠(5.0%),很少见于食管(<1.0%)[1]。另外,GIST也见于大网膜、肠系膜或腹膜后间隙,但不排除是转移灶[2]。间质瘤往往具有非定向分化和恶变潜能,且恶性程度与肿瘤大小有一定相关性,早期诊断和治疗具有重要意义,以往常采用外科手术切除(包括开腹手术和腹腔镜手术)的方式,近几年随着内镜技术的发展,相对较小的胃间质瘤(最大径线<3cm)逐渐应用内镜下黏膜剥离术(endoscopic subcucosal dissection,ESD)治疗。现就我院胃间质瘤治疗情况报道如下:
1 资料与方法
1.1一般资料
收集2012年6月-2015年12月我科胃间质瘤行ESD术患者56例。起源于黏膜肌层者12例,固有肌层者44例。其中,男25例,女31例,年龄28~73岁,平均55岁。主要临床表现为上腹部疼痛44例,上腹胀6例,黑便1例,无症状5例。其中,瘤体位于胃底37例,胃体11例,胃窦8例,贲门1例。1例患者胃底和胃窦各一枚瘤体,其余病例均为单发,病灶直径均小于3.0 cm,最大者3.0 cm,最小者0.2 cm,平均1.2 cm。分别于术后第3、6、12、24、36和48个月复查胃镜。通过观察瘤体完整切除率、并发症发生率和复发率3个指标来判断临床效果。术前每个患者都要进行超声胃镜检查,并测量病灶的大小、深度及回声,大于2.0 cm者完善上腹部CT平扫+增强以进一步了解瘤体腔内、腔外生长情况,以及有无侧向生长,术前3大常规、心电图、胸片,肝肾功和凝血四项检查均在全身麻醉允许范围。
1.2手术器械
Olympus GIF-H260单钳道电子胃镜、Olympus EU-M30内镜超声系统、超声探头为UM-3R,频率20 MHz、Olympus PSD-2E型高频电凝装置、德国ERBE VIO 200D型氩气刀、圈套器、KD-620LR Hook刀、KD-611L IT刀、钛夹和透明帽等。
1.3手术方法
手术均在气管插管、全身麻醉下进行,术前胃镜头端放置透明帽。首先应用氩气刀于病灶周边进行电凝标记,然后应用靛胭脂+肾上腺素+生理盐水于标记处进行黏膜下注射,随后应用Hook刀沿病灶边缘标记点切开黏膜,暴露瘤体后用IT刀小心剥离。创面用活检钳或氩离子凝固(argon plasma coagulation,APC)止血。最后,用钛夹封闭创面,术中如有穿孔,可用钛夹联合荷包缝合术缝合创面。术前影像学资料见图1。术中情况见图2。
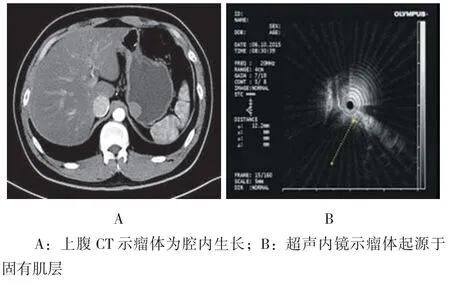
图1 术前影像学资料

图2 术中情况
1.4术后处理
切除瘤体用中性甲醛固定,送病理检查及免疫组化。术后禁食2~5 d,卧床休息,半卧位,常规给予止血、抑酸、抗感染及营养支持治疗,创面较大、术中出血较多及术中穿孔者,置入胃管。注意观察患者有无发热、腹痛、黑便及胃管中胃液颜色。
1.5GIST病理诊断依据
①组织学上,依据瘤细胞的形态通常将GIST分为3大类:梭形细胞型(70.0%)、上皮样细胞型(20.0%)和混合型(10.0%);②免疫组化检测CD117阳性率约94.0%~98.0%,多数梭形细胞GIST(特别是胃GIST)表达CD34,但在上皮样GIST中的表达不一致,在小肠GIST CD34可为阴性[3]。原发GIST切除术后危险度的评估,应该包括原发肿瘤的部位、肿瘤的大小、核分裂象以及是否发生破裂等,采用2008年JOENSUU等对美国国立卫生院(National Institutes of Health,NIH)危险度分级系统进行修订后的分类原则[4]。详见附表。

附表 原发GIST切除术后危险度分级
2 结果
54例成功完成ESD,1例因术中出血量较大转外科行开腹手术,1例术中出现穿孔,内镜下封闭创面困难,转外科行开腹手术,一次性完整切除率为96.4%。术后均未出现出血、穿孔,亦未出现其他严重并发症。术后病理以及免疫组织化学结果显示CD117阳性51例(91.1%)、CD34阳性47例(83.9%),GIST术后危险度分级,2例术中瘤体破裂者为高危,5例为低危,49例为极低危。患者分别于术后第3、6、12、24、36和48个月复查胃镜,发现患者胃黏膜愈合良好,均未发现肿瘤残留及复发。
3 讨论
GIST是胃肠道最常见的间叶源性肿瘤,在生物学行为可以从良性至恶性,免疫组化检测通常表达CD117,显示Cajal细胞分化,CD117、CD34同时阳性对疾病诊断有重要意义,大多数病例具有c-Kit或血小板源性生长因子受体α多肽(platelet—derived growth factor receptor alpha,PDGFRA)活化突变[5],对诊断困难病例,必要时应进一步行分子病理学检测,以确定是否存在c-Kit或PDGFRA基因突变。
胃间质瘤起源于黏膜下,常见于黏膜肌层或固有肌层,胃镜下表现为黏膜下隆起,超声内镜下常表现为低回声肿块,极低、低危肿瘤回声均匀、边界清楚,中高危肿瘤回声不均匀或无回声、边界欠清,内部有时可见液性暗区[6]。依据2013年版中国胃肠间质瘤诊断治疗共识,胃间质瘤的最大径线≤2.0 cm的无症状拟诊病例,应根据其超声内镜表现确定风险分级,不良因素为边界不规整、溃疡、强回声和异质性。如合并不良因素,应考虑切除;如无不良因素,可定期复查超声内镜。但是,我国胃间质瘤患者,在发现瘤体后往往选择切除肿瘤。完整切除肿瘤是最好的治疗方法,但切除风险较大或可能严重影响脏器功能者,宜先行术前分子靶向药物治疗,待肿瘤缩小后再行手术[7]。传统的开腹手术和腹腔镜手术创伤较大,手术费用较高,且住院时间较长,随着内镜器械的发展和医师内镜操作技术的成熟,直径小于3.0 cm的胃间质瘤,ESD在临床上获得广泛的应用[8]。我国学者[9]在2011年的研究表明,ESD对治疗来源于胃固有肌层的黏膜下肿瘤(肿瘤直径≤12 mm)是安全、有效的,可达到与外科手术同样的治疗效。且GIST大多为单发,瘤体界限清,极少出现淋巴结转移,无需淋巴结清扫,这些特性均为内镜下治疗提供了更加广阔的空间。
出血、穿孔是ESD的主要并发症,是限制ESD推广运用的主要因素。但由于术前患者常规都要禁食,穿孔所致的腹膜炎体征往往较轻,术后结合制酸、胃肠减压和抗生素等的应用,一般可避免外科手术修补。出血的预防和处理相对于穿孔更为重要,且胃底贲门区域血管丰富,手术过程中容易导致血管破裂从而造成大出血,止血过程耗时较长,而且影响内镜视野,盲目止血也很容易发生穿孔,这需要术前充分评估患者手术风险,风险较大的病例可考虑在手术室完成ESD治疗,必要时可用腹腔镜辅助闭合或止血。
我院胃间质瘤应用ESD治疗取得了较好的临床疗效,可基本一次性完整切除瘤体,患者术中发生出血、穿孔的概率较低,术后均未出现严重的并发症。胃间质瘤的复发转移多发生于术后2或3年以内[10],本研究术后随访3~48个月,创面愈合情况良好,胃镜检查未见复发。但是,本研究也有其不足之处,大部分患者术后随访时间较短,存在ESD治疗效果放大的可能,在以后研究中将进一步追踪患者有无复发。
综上所述,ESD治疗胃间质瘤能够取得较好的临床效果,且安全、有效,微创,并发症发生率较低。但ESD也存在一定的出血、穿孔及感染等风险。因此,应严格把握适应证,同时,娴熟的内镜操作技术是必需的。本研究认为,随着内镜技术的不断发展,内镜医师技术的不断进步,内镜下治疗将带来更大的社会及经济价值,为患者带来更大的益处。
[1]JOENSUU H, VEHTARI A, RIIHIMÄKI J, et al. Risk of recurrence of gastrointestinal stromal tumour after surgery: an analysis of pooled population-based cohorts[J]. Lancet Oncol, 2012, 13(13): 265-274.
[2]KIM K H, NELSON S D, KIM D H, et al. Diagnostic relevance of overexpressions of PKC-θ and DOG-1 and KIT/PDGFRA gene mutations in extragastrointestinal stromal tumors: a Korean sixcenters study of 28 cases[J]. Anticancer Res, 2012, 32(3): 923-937.
[3]侯英勇, 王坚, 朱雄增, 等. 胃肠道间质瘤76例的临床病理及免疫组织化学特征[J]. 中华病理学杂志, 2002, 31(1): 20-25.
[4]JOENSUU H. Risk stratification of patients diagnosed with gastrointestinal stromal tumor[J]. Hum Pathol, 2008, 39(10): 1411-1419.
[5]FLETCHER C D M, BRIDGE J A, HOGENDOORN P C W, et al. WHO Classfi cation of tumours of soft tissue and bone[M]. 4th ed. Lyon: IARC Press, 2013: 164-167.
[6]宋璇, 崔志平, 郝洪升, 等. 超声内镜对胃异位胰腺与间质瘤的鉴别诊断价值[J]. 中华超声影像学杂志, 2012, 21(9): 775-778.
[7]SUZUKI S, SASAJIMA K, MIYAMOTO M, et al. Pathologic complete response confirmed by surgical resection for liver metastases of gastrointestinal stromal tumor after treatment with imatinib mesylate[J]. World J Gastroenterol, 2008, 14(23): 3763-3767.
[8]DRAY X, GIDAY S A, BUSEAGLIA J M, et al. Omentoplasty for gastrotomy closure after natural orifice transluminal endoscopic sugery procedures (with video)[J]. Gastmintcst Endosc, 2009, 70(1): 131.
[9]余福兵, 何夕昆, 郝玲, 等. 内镜黏膜下剥离切除胃间质瘤的治疗价值探讨[J]. 中国内镜杂志, 2011, 17(5): 449-456.
[10]CASALI P G, JOST L, REICHARDT P, et al. Gastrointestinal stromal tumours: ESMO clinical recommendations for diagnosis, treatment and follow-up[J]. Ann Oncol, 2009, 20(Suppl4): 464-467.
(吴静编辑)
Endoscopic subcucosal dissection in treatment of gastric stromal tumors
Wei Song, Xiao-zhong Yang, Wei-jie Dai
(Department of Gastroenterology, the First People’s Hospital of Huai’an affi liated to Nanjing Medical University, Huai’an, Jiangsu 223300, China)
Objective To elavuate the clinical value of endoscopic subcucosal dissection (ESD) in treatment of gastric stromal tumor. Methods This is a retrospective cohort study. From June 2012 to December 2015, 56 patients with gastric stromal tumor (diameter ≤3 cm) underwent ESD were enrolled. Clinical outcomes including complete resection, postoperative complications and recurrent rate were analyzed. Results 54 patients (96.4 %) were successfully treated with ESD, while the other 2 patients (3.6 %) suffered severe complications (hemorrhage or perforation). Postoperative pathologic and immunohistochemical results showed that CD117 in 51 cases was positive (91.1 %), CD34 in 47 cases was positive (83.9 %). No recurrence was detected between 3-month and 48-month follow-up period. Conclusion This study showed that ESD was a safe and effective treatment for gastric stromal tumors.
gastric stromal tumors; endoscopic subcucosal dissection; therapy
10.3969/j.issn.1007-1989.2016.11.020
1007-1989(2016)11-0088-04
R735.2
B
2016-05-16
戴伟杰,E-mail:dwj19831016@163.com;Tel:15005239410
