酶法辅助提取山杏种皮黑色素工艺优化及其稳定性
2016-12-07李红姣李巨秀
李红姣,李巨秀*,赵 忠*
(1.西北农林科技大学林学院,西部环境与生态教育部重点实验室,陕西 杨凌 712100;
2.河北农业大学林学院,河北 保定 071000;3.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
酶法辅助提取山杏种皮黑色素工艺优化及其稳定性
李红姣1,2,李巨秀3,*,赵 忠1,*
(1.西北农林科技大学林学院,西部环境与生态教育部重点实验室,陕西 杨凌 712100;
2.河北农业大学林学院,河北 保定 071000;3.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
以山杏种皮为原料,以黑色素得率为指标,对碱性蛋白酶、纤维素酶、胃蛋白酶、中性蛋白酶4 种酶辅助提取山杏种皮黑色素的效果进行比较分析,筛选出酶解效果较好的胃蛋白酶。再通过单因素试验和正交试验,优化胃蛋白酶辅助提取山杏种皮黑色素的最佳工艺,最后对山杏种皮黑色素的稳定性进行系统的分析。结果表明,在酶解温度32 ℃、酶解pH 2.0、加酶量90 000 U/g、酶解时间5 h的条件下进行胃蛋白酶辅助提取的效果较好,黑色素得率达到7.4%。山杏种皮黑色素在碱性介质中稳定,金属离子Cu2+、Fe2+和Fe3+对其稳定性有影响,而氧化剂、还原剂、蔗糖和柠檬酸对其稳定性无影响。
酶;山杏种皮;黑色素;提取;稳定性
李红姣, 李巨秀, 赵忠. 酶法辅助提取山杏种皮黑色素工艺优化及其稳定性[J]. 食品科学, 2016, 37(10): 69-75. DOI:10.7506/spkx1002-6630-201610012. http://www.spkx.net.cn
LI Hongjiao, LI Juxiu, ZHAO Zhong. Optimization of enzyme-assisted extraction of melanin from testae of wild apricots and evaluation of its stability[J]. Food Science, 2016, 37(10): 69-75. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201610012. http://www.spkx.net.cn
植物来源的食品添加剂,特别是植物黑色素,安全性较高,应用范围广,不仅可以作为食品色素,还具有生物半导体、抗氧化、清除自由基、防紫外线辐射、螯合重金属离子等功能[1-7]。黑色素是生物界普遍存在的一
类结构复杂多样的酚类或吲哚类生物大分子色素[8],来源广泛,很多动物、植物、微生物都含并且可以合成,具有很大的应用潜力。已有研究人员对不同材料中黑色素的提取、性质等方面做了大量研究,如黑米[9]、乌骨鸡[10]、鱿鱼墨[11]、乌饭树叶[12]、黑芝麻[13]等中的黑色素。
酶法提取主要采用酶破坏细胞壁结构,具有反应条件温和选择性高的特点,而酶的专一性可避免对底物外物质的破坏。在提取热稳定性差或含量较少的化学成分时,优势更为明显[14-15]。酶法相对其他提取方法具有众多优点,可以提高有效成分产率,缩短提取时间,降低能耗,降低提取成本。由于酶法提取可以在常温和非有机溶剂条件下进行,所以得到的产物纯度、稳定性及活性都较高,无污染。酶法提取无需投入昂贵新设备,成本较低,具有成本低廉、性价比高的优势。Noveilino等[16]用酶降解法从人的头发和牛的虹膜中提取出真黑素。笔者已经探索出了山杏种皮黑色素的常规提取方法-碱溶酸沉法[17],但酶法辅助提取山杏种皮黑色素鲜见报道。
本实验采用酶法辅助碱溶酸沉淀法提取山杏种皮黑色素,利用碱性蛋白酶、中性蛋白酶、纤维素酶和胃蛋白酶的活性辅助提取黑色素,优化确定酶辅助提取山杏种皮黑色素的最佳工艺条件。以山杏种皮为原料提取黑色素,可以提高杏仁深加工产品的附加值,研究山杏种皮黑色素作为天然食用色素的稳定性,可为进一步开发利用山杏种皮黑色素提供依据,并且对促进山杏产区农村经济的发展、增加农民的收入均有重要的意义。
1 材料与方法
1.1 材料与试剂
山杏种皮:产自甘肃平凉,将杏仁手工去皮,种皮在自然条件下风干后备用。
冰乙酸、磷酸二氢钠、磷酸氢二钠、氯化亚铁(均为分析纯) 天津博迪化工有限公司;盐酸、乙醇(均为分析纯) 西安三浦化学试剂有限公司;氢氧化钠、蔗糖(均为分析纯) 四川西陇化工有限公司;碱性蛋白酶、中性蛋白酶、纤维素酶、胃蛋白酶(均为化学纯) 西安沃尔森生物技术有限公司;氨水(分析纯)成都市科龙化工试剂厂;氯化铜、氯化铁(均为分析纯) 天津市东丽区天大化学试剂厂;双氧水、硫代硫酸钠(均为分析纯) 西安化学试剂厂;柠檬酸(分析纯) 天津市大茂化学仪器供应站。
1.2 仪器与设备
EB-280-12型千分之一天平 日本岛津公司;SC-3610型低速离心机 安徽中科中佳科学仪器有限责任公司;RE-201D型旋转蒸发仪 巩义予华仪器有限责任公司;KQ-500DE型数控超声波清洗机 昆山市超声波仪器有限公司;HH-6型数显恒温水浴锅、85-2型恒温磁力搅拌器 国华电器有限公司;DZF型真空干燥箱北京科伟永兴仪器有限公司;PHS-3C型酸度计 方舟科技(北京)有限公司。
1.3 方法
1.3.1 山杏种皮黑色素的提取
称取5.00 g山杏种皮,放入150 mL锥形瓶中,加入75 mL蒸馏水煮沸5 min后过滤,以除去水溶性杂质和排除材料中的氧气。向滤渣中加入酶,在最适温度水浴保温静置2 h,分别对山杏种皮进行酶解,然后酶失活后过滤,在滤渣中加入NaOH溶液进行提取后,过滤离心,上清液用2 mol/L的HCl溶液调节pH值到2,使黑色素沉淀,室温静置2 h,离心分离,沉淀反复碱溶酸沉进行纯化,最后真空干燥得到山杏种皮黑色素颗粒。山杏种皮黑色素的提取流程见图1。

图1 山杏种皮黑色素的提取工艺流程Fig. 1 The extraction process for MTWA
1.3.2 酶的筛选

表1 加酶条件Table 1 Enzymatic hydrolysis conditions
在图1提取所得的滤渣中加入75 mL去离子水,同时按照表1加入酶,用0.1 mol/L HCl溶液调节pH值,在最适温度水浴保温静置2 h,分别对山杏种皮进行酶解,然后按照图1进行提取纯化。碱溶液的提取条件为0.5 mol/L的NaOH溶液60 ℃水浴提取2 h。以黑色素得率为指标,选择得率最高的酶用于后续实验。
1.3.3 酶法辅助提取单因素试验
以黑色素得率作为评价指标,分别对酶解pH值(1、2、3、4、5)、酶解时间(2、3、4、5、6 h)、酶解温度(27、37、47、57、67 ℃)和加酶量(22 000、44 000、66 000、88 000、120 000 U/g)进行单因素试验,以确定各因素的影响效果和适宜范围。
1.3.4 酶法辅助提取正交试验
在单因素试验基础上,以酶解温度、酶解pH值、加酶量、酶解时间作为考察因素,以黑色素得率为考察指标,通过四因素四水平正交试验,进一步优化提取工艺参数,正交试验因素与水平见表2。

表2 正交试验设计因素与水平Table 2 Factors and levels used for orthogonal experimental design
1.3.5 加酶方式对黑色素得率的影响
考察在酶解第1小时一次性加入酶22 000 U/g和分别在第1、2小时2 次各加入酶11 000 U/g对黑色素得率的影响。
1.3.6 黑色素得率计算
将有机溶剂洗涤过的黑色素块状物经真空干燥后,称质量得到黑色素的质量。黑色素得率计算公式为:

1.3.7 山杏种皮黑色素的稳定性
1.3.7.1 山杏种皮黑色素溶液的配制
称取5 mg山杏种皮黑色素,用500 mL质量分数为0.3%的氨水超声波辅助溶解5~6 h,然后用旋转蒸发仪减压抽去多余氨气,直至pH值达7.5,然后将旋转蒸发后的山杏种皮黑色素溶液以3 500 r/min离心3 min,最后用pH7.5的磷酸缓冲溶液定容至100 mL,即配制成质量浓度为50 mg/L的山杏种皮黑色素溶液。
1.3.7.2 pH值对山杏种皮黑色素稳定性的影响
分别取50 mg/L山杏种皮黑色素溶液15 mL于6 支25 mL具塞刻度试管中,然后用1.0 mol/L NaOH溶液或1.5 mol/L HCl溶液调pH值分别至1.0、3.0、5.0、7.0、9.0、11.0,室温条件下放置30 min,观察山杏种皮黑色素溶液颜色的变化,在210 nm波长处测定吸光度(A210nm)。
1.3.7.3 金属离子对山杏种皮黑色素稳定性的影响
分别配制浓度为0.0、0.1、0.5、1.0、1.5、2.0 mmol/L的NaCl、CuCl2、FeCl2和FeCl3溶液,各取该4 种金属离子溶液0.5mL,分别与4.5 mL的50 mg/L山杏种皮黑色素溶液混合,使山杏种皮黑色素溶液中的金属离子浓度为0.00、0.01、0.05、0.10、0.15、0.20 mmol/L,摇匀,室温条件下放置12 h后测定A210nm。
1.3.7.4 氧化剂、还原剂对山杏种皮黑色素稳定性的影响
分别配制质量浓度为0、0.1、1.0、10、100、1 000 mg/L的H2O2和Na2S2O3溶液,各取这2 种溶液0.5 mL,分别与4.5 mL的50 mg/L山杏种皮黑色素溶液混合,使山杏种皮黑色素溶液中的H2O2和Na2S2O3溶液质量浓度为0、0.01、0.1、1.0、10、100 mg/L,摇匀,室温条件下放置12 h后测定A210nm。
1.3.7.5 蔗糖、柠檬酸对山杏种皮黑色素稳定性的影响
分别配制质量浓度为0.1、1.0、10、100、1 000 mg/L的蔗糖和柠檬酸溶液,各取这两种溶液0.5 mL,分别与4.5 mL的50 mg/L山杏种皮黑色素溶液混合,使山杏种皮黑色素溶液中的蔗糖和柠檬酸溶液质量浓度为0、0.01、0.1、1.0、10、100 mg/L,摇匀,室温条件下放置12 h后测定A210nm。
1.4 数据分析
采用Excel 2010软件统计分析数据,采用单因素Duncan法进行多重比较,以DPS v7.55软件进行显著性分析,显著水平为P<0.05。
2 结果与分析
2.1 酶种类的选择
不同种类酶的酶活范围、最适工作温度和最适工作pH值均不同,因此对蛋白质等的提取效果有很大影响。已有研究证明酶的种类对大米蛋白得率有较大影响[18]。本研究以黑色素得率为指标,筛选出辅助提取山杏种皮黑色素最合适的酶,结果见图2。

图2 单酶提取效果比较Fig. 2 Comparison of extraction yield of melanin with single enzymes
由图2可知,在4 种酶中,胃蛋白酶和碱性蛋白酶对山杏种皮黑色素提取具有较好的辅助效果(P<0.05),黑色素得率分别达到6.8%和6.1%;中性蛋白酶水解效果最差,得率只有4.7%(P<0.05)。由于胃蛋白酶酶解条件温和(37 ℃),便于酶解操作,因而将其选为山杏种皮黑色素辅助提取所用酶。
2.2 单因素试验结果
2.2.1 酶解pH值对提取效果的影响
酶活力受pH值得影响很大,不仅能够影响酶的构象,还影响底物的解离状态[19]。因此确定酶的最适工作pH值能更加有效提取山杏种皮黑色素。在酶解温度37 ℃、酶解时间2 h、加酶量22 000 U/g条件下,分别调节酶解pH值为1、2、3、4、5,分析山杏种皮黑色素的得率,见图3。
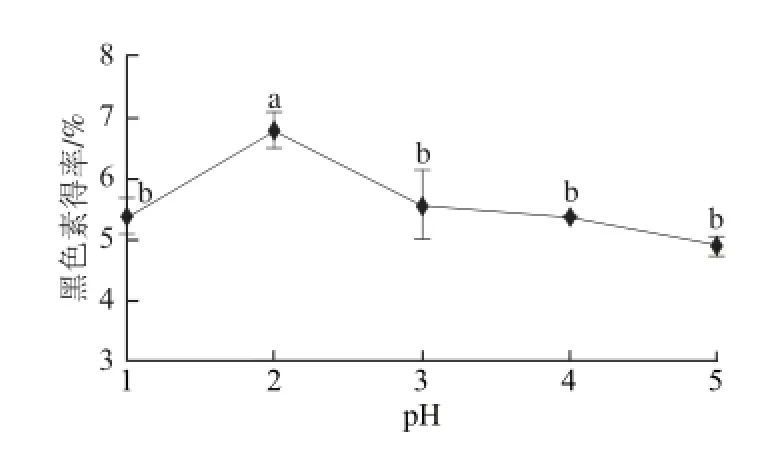
图3 酶解pH值对黑色素得率的影响Fig. 3 Effect of hydrolysis pH on melanin yield
由图3可知,溶液的pH值在1.0~2.0之间,黑色素的得率升高;pH值为2.0时,达到最大值;pH>2.0,随着pH值的升高,黑色素得率呈现下降趋势。说明pH 2.0左右对黑色素提取有较好的效果(P<0.05),在其他pH值范围内,可能由于酶变性或没有达到最大活性,致使黑色素得率较低。
2.2.2 酶解温度对提取效果的影响
在加酶量22 000 U/g、酶解pH 2.0、酶解时间2 h条件下,选择27、37、47、57、67 ℃考察酶解温度对山杏种皮黑色素提取效果的影响,结果见图4。

图4 酶解温度对黑色素得率的影响Fig. 4 Effect of hydrolysis temperature on melanin yield
由图4可知,酶解温度在37 ℃左右时黑色素得率最高(P<0.05),在其他温度范围内可能由于酶失活或没有达到最大活性,导致黑色素得率较低。
2.2.3 酶解时间对提取效果的影响
在酶解pH 2.0、酶解温度37 ℃、加酶量22 000 U/g条件下,考察酶解时间2、3、4、5、6 h对山杏种皮黑色素提取效果的影响,见图5。

图5 酶解时间对黑色素得率的影响Fig. 5 Effect of hydrolysis time on melanin yield
由图5可知,随着酶解时间延长,黑色素得率呈上升趋势,酶解时间为5 h时,山杏种皮黑色素得率最高(P<0.05),酶解6 h时得率有所下降(P<0.05),考虑到黑色素得率和成本,以5 h作为进一步试验的酶解时间。
2.2.4 加酶量对提取效果的影响
在酶解pH 2.0、酶解温度37 ℃、酶解时间2 h条件下,考察加酶量22 000、44 000、66 000、88 000、120 000 U/g对提取效果的影响,见图6。
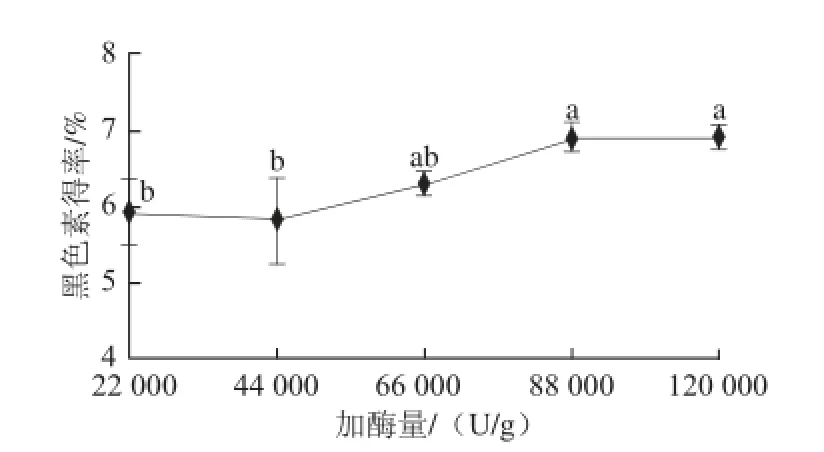
图6 加酶量对黑色素得率的影响Fig. 6 Effect of enzyme concentration on melanin yield
由图6可知,随着加酶量的加大,黑色素得率呈上升趋势,但在88 000 U/g以后趋势变得缓慢。这可能是因为在加酶量较小时,酶与底物充分接触并且结合,随着加酶量的加大,底物浓度下降,反应速度降低,导致酶的作用受到抑制[20]。考虑工业生产中的用酶成本,以88 000 U/g为最佳的加酶量(P<0.05)。
2.3 正交试验结果
在单因素试验的基础上,采用正交试验优化工艺条件。以酶解温度、酶解pH值、加酶量、酶解时间作为考察对象,优化工艺条件,每个因素选用4个水平,选用L16(45)正交表,结果见表3,方差分析结果见表4。
由表3、4可以看出,4 个因素对黑色素得率均有影响。影响大小顺序为酶解pH值>酶解温度>加酶量>酶解时间。试验最佳组合为:A2B3C3D1。组合不在16组试验内,因此进行验证实验,即酶解pH 2、加酶量90 000 U/g、酶解时间5 h、酶解温度32 ℃条件下,测得山杏种皮黑色素得率为7.4%,高于其他任何一组黑色素得率。因此,在实验条件范围内,提取山杏种皮黑色素
最佳工艺为酶解pH 2、加酶量90 000 U/g、酶解时间5 h、酶解温度在32~37 ℃范围。

表3 正交试验设计及结果Table 3 Orthogonal experimental design with experimental results

表4 正交试验方差分析Table 4 Analysis of variance for the experimental results of orthogonal array dessiiggnn
2.4 加酶方式对黑色素提取效果的影响
当底物浓度一定时,加酶量过大,可能导致酶与底物接触面积受到限制或者酶本身相互水解,使酶活力降低。在不增加加酶量的情况下,一次性加胃蛋白酶黑色素得率为6.8%,而采用分2 次加入胃蛋白酶,黑色素得率为7.0%,可见2 次加酶对山杏种皮进行酶解效果更加理想。
2.5 pH值对山杏种皮黑色素稳定性的影响
黑色素除了溶于碱溶液,微溶于二甲基亚砜外,几乎不溶于其他任何常规试剂和有机溶剂[21-22]。因此,溶液的pH值对黑色素的稳定性有很大影响。经1.0 mol/L NaOH溶液和1.5 mol/L HCl溶液调pH值,放置30 min后,测得的吸光度变化结果见图7。
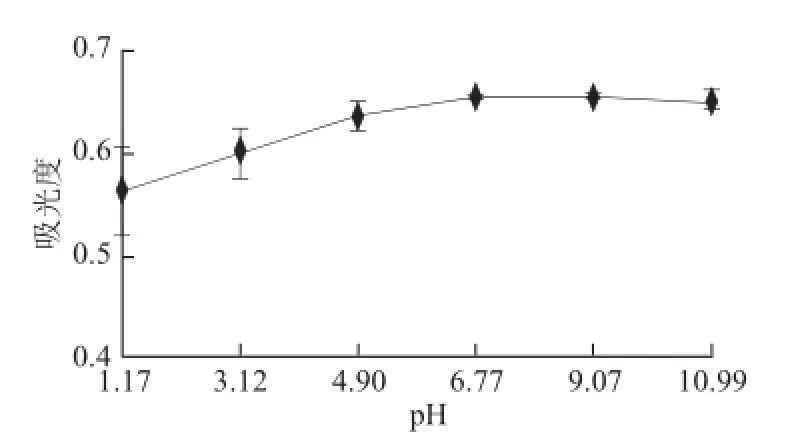
图7 pH值对山杏种皮黑色素稳定性的影响Fig. 7 Effect of pH on melanin stability
由图7可以看出,山杏种皮黑色素对酸性条件比较敏感,pH1~4时有明显沉淀,而pH>5时溶液澄清。此外,肉眼观察,pH 1~4时颜色较淡,呈现淡褐色,而pH>5时颜色较深,呈现褐色。由此说明,山杏种皮黑色素在酸性条件不稳定,而在碱性条件下比较稳定,且pH值变化黑色素溶液的色调不会发生变化。这与大多数报道的黑色素性质相同,如张金萍等[23]报道的酶法合成黑色素的稳定性研究,孙玲等[24]报道的黑芝麻黑色素提取条件和稳定性的研究。因此,在食品加工中,添加山杏种皮黑色素时应尽量在碱性环境中。
2.6 金属离子对山杏种皮黑色素稳定性的影响
黑色素对金属离子具有很高的结合能力,金属离子的结合对黑色素的抗氧化活性、团聚体结构等方面产生影响,从而影响黑色素的稳定性[25]。4 种金属离子对山杏种皮黑色素稳定性的影响如图8所示。
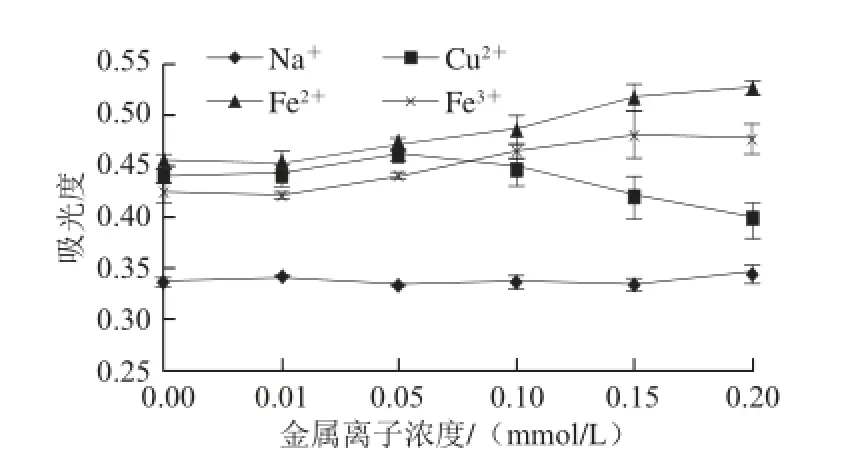
图8 金属离子对山杏种皮黑色素稳定性的影响Fig. 8 Effect of metal ions on melanin stability
由图8可以看出,Fe2+和Fe3+对山杏种皮黑色素有一定增色作用,Cu2+对山杏种皮黑色素有一定减色作用,Na+对山杏种皮黑色素稳定性无影响。此外,Fe2+和Fe3+浓度大于0.10 mmol/L时开始出现沉淀,Cu2+浓度大于0.15 mmol/L时也出现沉淀。由此说明,Na+对山杏种皮黑色素稳定性无影响,而Cu2+、Fe2+和Fe3+对山杏种皮黑色素稳定性均有影响。在食品加工中,添加或保存山杏种皮黑色素时应避免使用这些金属容器。
2.7 氧化剂和还原剂对山杏种皮黑色素稳定性的影响
黑色素是一类含有多种官能团的聚合物,在较宽的pH值范围内既可以作为电子供体,又可以作为电子受体,因此具有氧化还原特性[25]。氧化剂、还原剂对山杏种皮黑色素稳定性的影响见图9。
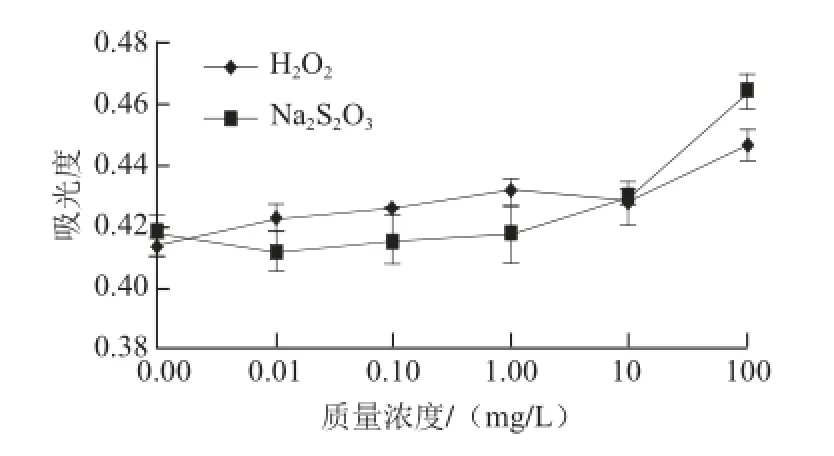
图9 H 9 H2O2和NaNa2S2O3对山杏种皮黑色素稳定性的影响Fig. 9 Effect of H2O2and Na2S2O3on melanin stability
由图9可以看出,低质量浓度(质量浓度小于10 mg/L)的氧化剂H2O2和还原剂Na2S2O3对山杏种皮黑色素稳定性无太大影响,但氧化剂和还原剂质量浓度大于10 mg/L时,吸光度显著增大(P<0.05),可能是由于山杏种皮黑色素在氧化剂、还原剂的作用下,解离或者结合了部分吲哚醌结构。这与张金萍等[23]报道的氧化剂、还原剂对酶法合成黑色素稳定性影响的结果基本一致。
2.8 蔗糖和柠檬酸对山杏种皮黑色素稳定的影响

图10 蔗糖和柠檬酸对山杏种皮黑色素稳定性的影响Fig. 10 Effect of sucrose and citric acid on melanin stability
由图10可以看出,蔗糖和柠檬酸对山杏种皮黑色素的稳定性无明显影响。在食品工业中,添加山杏种皮黑色素可以同时添加蔗糖和柠檬酸。
3 结论与讨论
本实验结果表明,酶解pH值、酶解时间、酶解温度、加酶量与加酶方式对山杏种皮黑色素得率均有影响,酶法辅助提取山杏种皮黑色素的适宜条件为酶解pH 2、加酶量90 000 U/g、酶解时间5 h、酶解温度在32~37 ℃范围,此时山杏种皮黑色素得率为7.4%。采用分2 次加入胃蛋白酶对山杏种皮进行酶解效果较好。山杏种皮黑色素在碱性介质中稳定性好,Na+、蔗糖和柠檬酸、低质量浓度的氧化剂和还原剂(质量浓度小于10 mg/L)对山杏种皮黑色素稳定性影响不大,而高于10 mg/L的氧化剂还原剂、Cu2+、Fe2+和Fe3+对山杏种皮黑色素稳定性均有影响。
虽然酶法辅助提取黑色素最高得率能达到7.4%,无需投入昂贵设备,如微波机器[12]等,但是由于酶的成本较高,与NaOH提取法(最高得率达到7.2%)[17]无显著差异,因此酶法辅助提取不是最理想的提取方式,探索一条更加经济、合理、高得率的黑色素提取方法也是后续研究的重点。天然黑色素是不溶于水和一般有机溶剂的多聚化合物,是在植物、动物和微生物细胞中合成的最广的一类色素,它的基础结构是一些共价交联的吲哚环。酪氨酸是合成黑色素的前体物,酪氨酸在酪氨酸氧化酶的催化作用下氧化生成二羟苯丙氨酸(多巴),继续氧化生成多巴醌,再进一步氧化闭环生成5,6-二羟吲哚,再转化生成5,6-吲哚二醌,在酶的作用下,最后氧化聚合而形成黑色素[23,26]。在酶法辅助提取过程中,一部分黑色素可能被酶解,因此有望通过其他方法避免酶解从而提高山杏种皮黑色素的得率。
天然黑色素具有重要的生物活性、无毒无害,具有作为天然食用色素的巨大潜力,虽然Wang Hengshan等[27]研究表明桂花种皮黑色素对紫外线和可见光非常稳定,紫外线或可见光照射15 d对桂花种皮黑色素无显著影响,但是不同来源的黑色素结构和性质差异很大,有关天然黑色素稳定性的资料相当有限。山杏种皮黑色素适用于许多领域,比如食品、化妆品、漆类或其他燃料,但其在碱性介质中稳定性好,这就局限了黑色素的应用范围,在应用过程中应该控制好pH值范围。本研究表明在210 nm波长处Na+、低质量浓度的氧化剂和还原剂(质量浓度小于10 mg/L)、蔗糖和柠檬酸对山杏种皮黑色素稳定性影响不大,但Cu2+、Fe3+、Fe2+等离子具有增色或减色作用,可能是由于这些金属离子与黑色素形成了不同的配合物,姚增玉[25]报道的山杏种皮黑色素在200 nm波长处的稳定性与210 nm波长处基本一致。总的来说,山杏种皮黑色素有望成为一种新型的天然色素,但是由于其在一些方面不甚稳定,因此必须采取一定的稳定化技术,如尽量避免加工、运输、贮藏过程中使用金属容器,控制好pH值范围等。另外,对黑色素进行适当的修饰或者改性,增大其溶解度,对进一步探索山杏种皮黑色素的功能效用有很重要的作用,也是后续研究的重点。
[1] 徐磊, 钱振明, 孙继波, 等. 短梗霉黑色素的分离纯化及结构的初步分析[J]. 氨基酸和生物资源, 2009, 31(2): 9-13. DOI:10.3969/ j.issn.1006-8376.2009.02.003.
[2] 涂勇刚, 孙亚真, 田颖刚, 等. 泰和乌骨鸡黑色素的体外抗氧化作用[J].食品与生物技术学报, 2009, 28(2): 145-149. DOI:10.3321/j.is sn:1673-1689.2009.02.001.
[3] SAVA V M, GALKIN B N, HONG M Y, et al. A Novel melaninlike pigment derived from black tea leaves with immuno-stimulating activeity[J]. Food Rresearch Intetnational, 2001, 34(4): 337-343. DOI:10.1016/S0963-9969(00)00173-3.
[4] 李红姣, 张双凤, 李巨秀, 等. 杏仁种皮黑色素对果蝇的紫外辐射保护作用[J]. 食品科学, 2012, 33(21): 285-289.
[5] 宁华. 工程菌所产黑色素对生物大分子光保护作用的研究[J]. 华中师范大学学报(自然科学版), 2001, 35(1): 124-126. DOI:10.3321/j.is sn:1000-1190.2001.01.024.
[6] GENG Jing, YU Shengbing, WAN Xia, et al. Protective action of bacterial melanin against DNA damage in full UV spectrums by a sensitive plasmid-based noncellular system[J]. Journal of Biochemical and Biophysical Methods, 2008, 70(6): 1151-1155. DOI:10.1016/ j.jprot.2007.12.013.
[7] 王哲鹏, 邓学梅, 王安如. 乌鸡黑色素对果蝇的紫外辐射保护作用[J]. 中国农业大学学报, 2007, 12(1): 17-21. DOI:10.3321/ j.issn:1007-4333.2007.01.004.
[8] BUTLER M J, DAY A W. Fungal melanins: a review[J]. Canadian Journal of Microbiology, 1998, 44(12): 1115-1136.
[9] 张吉祥, 赵文静, 白晓杰, 等. 正交试验法优化黑米黑色素的超声辅助提取工艺[J]. 食品科学, 2010, 31(4): 39-42.
[10] 李欣, 田颖刚, 谢明勇, 等. 乌骨鸡黑色素的提取分离及抗氧化活性研究[J]. 食品科学, 2009, 30(18): 117-121. DOI:10.3321/j.is sn:1002-6630.2009.18.023.
[11] 宋茹, 李厚宝, 邓尚贵. 鱿鱼墨黑色素酶解法提取工艺优化及其紫外、红外光谱特征分析[J]. 食品科学, 2011, 32(18): 63-67.
[12] 胡志杰, 蔡智慧. 微波辐射提取乌饭树叶黑色素工艺的研究[J]. 中国野生植物资源, 2007, 26(6): 52-57.
[13] 陆懋荪, 尹佩玉, 容蓉, 等. 黑芝麻黑色素的化学结构研究[J]. 食品科学, 2007, 28(11): 91-94. DOI:10.3321/ j.issn:1002-6630.2007.11.015.
[14] 韩伟, 马婉婉, 骆开荣. 酶法提取技术及其应用进展[J]. 机电信息, 2010, 6(17): 15-18.
[15] 陈栋, 周永传. 酶法在中药提取中的应用和进展[J]. 中国中药杂志, 2007, 32(2): 99-101; 119. DOI:10.3321/j.issn:1001-5302.2007.02.003.
[16] NOVELLINO L, NAPOLITANO A, PROTA G. Isolation and charaterization of mammaliam eumelanins from hair and irides[J]. Bioehemiea et Biophysiea Acta, 2000, 1475(3): 295-306. DOI:10.1016/S0304-4165(00)00080-5.
[17] 李巨秀, 李红姣, 赵忠, 等. 杏仁种皮黑色素提取工艺优化[J]. 食品科学, 2012, 33(8): 11-14.
[18] 王文高, 陈正行, 姚惠源. 不同蛋白酶提取大米蛋白质的研究[J]. 粮食与饲料工业, 2002(2): 41-42. DOI:10.3969/ j.issn.1003-6202.2002.02.017.
[19] 胡兰. 动物生物化学[M]. 北京: 中国农业大学出版社, 2007.
[20] 王华斌, 王珊, 傅力. 酶法提取石榴皮多酚工艺研究[J]. 中国食品学报, 2012, 12(6): 56-65. DOI:10.3969/j.issn.1009-7848.2012.06.009.
[21] 叶明, 朱立, 杨柳, 等. Plectania YM421 胞内黑色素提取及其生物功能[J]. 食品与生物技术学报, 2009, 28(2): 229-233.
[22] 徐磊. 短梗霉黑色素的分离提取及其结构分析[D]. 大连: 大连理工大学, 2006.
[23] 张金萍, 杜孟浩, 王敬文. 酶法合成黑色素的稳定性研究[J].氨基酸和生物资源, 2007, 29(1): 8-10. DOI:10.3969/ j.issn.1006-8376.2007.01.003.
[24] 孙玲, 张名位, 池建伟. 黑色植物天然色素的特性和利用潜力[J]. 食品研究与开发, 1998, 20(4): 39-41.
[25] 姚增玉. 山杏种皮黑色素提取及其性质研究[D]. 杨凌: 西北农林科技大学, 2008.
[26] 王玉洁, 符坚, 刘楠, 等. 重要的生物资源黑色素及其功能的机理[J]. 氨基酸和生物资源, 2003, 25(1): 12-14. DOI:10.3969/ j.issn.1006-8376.2003.01.005.
[27] WANG Hengshan, PAN Yingming, TANG Xujie, et al. Isolation and characterization of melanin from Osmanthus fragrans’ seeds[J]. LWTFood Science and Technology, 2006, 39(5): 496-502. DOI:10.1016/ j.lwt.2005.04.001.
Optimization of Enzyme-Assisted Extraction of Melanin from Testae of Wild Apricots and Evaluation of Its Stability
LI Hongjiao1,2, LI Juxiu3,*, ZHAO Zhong1,*
(1. Key Laboratory of Environment and Ecology in Western China, Ministry of Education, College of Forestry, Northwest A&F University, Yangling 712100, China; 2. College of Forestry, Agricultural University of Hebei, Baoding 071000, China; 3. College of Food Science and Engineering, Northwest A&F University, Yangling 712100, China)
Melanin, a complex, high molecula r weight substance composed of phenolic or indolic compounds, is widespread in the biosphere. In this work, we isolated melanin from the testae of wild apricots (MTWA) using an enzyme-assisted procedure. Pepsase was selected to optimize the extraction conditions. The stability of MTWA was analyzed. The results showed that the optimal conditions for MTWA extraction was found to be extraction with 0.5 mol/L NaOH after enzymatic hydrolysis with 90 000 U/g pepsase at 32 ℃ and pH 2 for 5 h. Under these conditions, the maximum yield of MTWA of 7.4% was obtained. MTWA was stable in alkaline medium. Cu2+, Fe2+and Fe3+affected its stability while oxidants, reducing agents, sucrose and citric acid had no effect on MTWA.
enzyme; testae of wild apricots; melanin; extraction; stability
10.7506/spkx1002-6630-201610012
S789.9
A
2015-07-08
国家林业局林业公益性行业科研专项(200904020)
李红姣(1987—),女,博士,研究方向为森林食品、林产品加工。E-mail:lihongjiao0103@163.com
*通信作者:李巨秀(1972—),女,副教授,博士,研究方向为食品化学和功能食品。E-mail:juxiuli@msn.com赵忠(1958—),男,教授,博士,研究方向为森林培育理论与技术。E-mail:zhaozh@nwsuaf.edu.cn
