虎杖果实中白藜芦醇与大黄素提取工艺优化及其与3 类根茎含量比较
2016-12-07董爱文姚姝凤许新军
董爱文,姚姝凤,许新军,成 江
(吉首大学 林产化工工程湖南省重点实验室,湖南 张家界 427000)
虎杖果实中白藜芦醇与大黄素提取工艺优化及其与3 类根茎含量比较
董爱文,姚姝凤,许新军,成 江
(吉首大学 林产化工工程湖南省重点实验室,湖南 张家界 427000)
目的:研究虎杖果实中白藜芦醇与大黄素提取工艺,比较其果实与雄株、未结果雌株、结果雌株3 类根茎中白藜芦醇与大黄素得率。方法:采用高效液相色谱法测定其果实与3 类根茎中白藜芦醇与大黄素含量,确定果实中白藜芦醇与大黄素提取的溶剂与方法,采用正交试验法考察微波火力档、溶剂体积分数、料液比及提取时间对提取工艺的影响,确定微波辅助提取的最佳提取工艺,比较虎杖果实、3 类根茎中二者得率。结果:正交试验与方差分析得出果实中白藜芦醇与大黄素的最佳提取条件为乙醇体积分数70%、料液比1∶20(g/mL)、额定功率800 W微波炉先40火力处理3 min冷却后60火力处理3 min、提取时间6 min,高效液相色谱法测得虎杖雄株、未结果雌株根茎中的白藜芦醇与大黄素得率均高于结果雌株根茎及果实,果实及3 类根茎中白藜芦醇与大黄素得率均超过《中国药典》(2010)规定值,提取工艺合理、稳定、可行,虎杖果实具备开发利用的价值。
虎杖;白藜芦醇;大黄素;提取工艺;高效液相色谱
虎杖(Polygonum cuspidatum Sieb.et Zucc.)为蓼科蓼属的雌雄异株植物,又名酸汤杆[1],其根茎为传统中药,具有活血、定痛、清热利湿、止咳化痰等作用[2-3],其活性成分主要有白藜芦醇为代表的二苯乙烯类与大黄素为代表的蒽醌类。白藜芦醇具有降血脂、抗肿瘤、促进健康和延长生命等多种生物活性[4-6],白藜芦醇是典型的第三代保健食品原料之一[7-8],此外还主要用作膳食补充剂[9]。日本率先将从植物中提取的白藜芦醇作为食品添加剂使用,在美国、加拿大和我国都已有与白藜芦醇相关的保健品[10],大黄素具有抗病毒、抑菌、扩张血管及利尿等多种作用[11-13]。目前国内外对虎杖中白藜芦醇与大黄素等活性成分研究主要针对的是其干燥根茎及根[14-17],甚至是其雄株、未结果雌株与结果雌株的混合根茎,鲜见从虎杖果实中提取白藜芦醇与大黄素,分析检测虎杖果实、雄株、未结果雌株与结果雌株根茎中二者含量的报道。因此本实验对虎杖果实中白藜芦醇与大黄素的最佳提取工艺进行研究并比较分类根茎中白藜芦醇与大黄素含量,旨在为虎杖的合理栽培与采收提供科学依据,并将虎杖果实开发成为食品添加剂及保健品原料资源提供技术支持。
1 材料与方法
1.1 材料与试剂
虎杖果实、3 a生的虎杖雄株、未结果雌株、结果雌株的根茎均采自吉首大学张家界校区后山植物园,50 ℃烘干,粉碎过50 目筛,阴凉与干燥处避光保存备用。白藜芦醇(自制,纯度≥99%) 林产化工工程湖南省重点实验室;大黄素(纯度≥98%)标准品 中国食品药品检定研究院;高效液相色谱检测用甲醇、乙腈均为国产色谱纯;其他试剂均为国产分析纯。
1.2 仪器与设备
LC-20A高效液相色谱仪、AEG-200万分之一天平、DP-41真空干燥干燥箱 日本岛津公司;数显恒温水浴锅 江苏金城国际实验仪器厂;RE-5205旋转蒸发器上海亚荣生化仪器厂;KQ-250E超声波清洗仪 昆山市超声仪器有限公司;D8023CTC-K4家用微波炉(额定功率800 W) 格兰仕微波电器有限公司;HY-6A空气浴摇床 江苏金坛市仪器有限公司。
1.3 方法
1.3.1 溶液制备
1.3.1.1 标准溶液的配制
称取白藜芦醇标准品0.003 0 g,用无水乙醇溶解后定容于50 mL容量瓶中,制成59.4 μg/mL标准溶液。称取纯度不小于98%大黄素标准品0.003 0 g,用无水乙醇溶解后定容于50 mL容量瓶中,制成58.8 μg/mL标准溶液,两标准溶液均避光冷藏备用。
1.3.1.2 样品溶液的制备
取虎杖3 类根茎与果实样品粉末各约1.500 0 g,3 类根茎样品制备参照文献[18-20],果实按选择的最佳提取条件提取,经处理后各提取液均蒸去溶剂,置于100 mL量瓶中,用适量无水乙醇稀释至刻度,摇匀,用 0.45 μm滤膜滤过,即得。
1.3.2 色谱条件
白藜芦醇:色谱柱Hypersil BDS C18(4.6 mm× 200 mm,5 μm);流动相:乙腈-0.05%磷酸(30∶70,V/V);检测波长306 nm;流速1.0 mL/min;柱温24 ℃;进样量20 μL;保留时间5.860 min;柱压7.0 MPa。
大黄素:色谱柱Hypersil BDS C18(4.6 mm× 200 mm,5 μm);流动相:甲醇;检测波长254 nm;流速0.6 mL/min;柱温26 ℃;进样量20 μL;保留时间5.211 min;柱压2.2 MPa。
1.3.3 方法学考察
1.3.3.1 线性关系
精密量取0、1.0、2.0、3.0、4.0、5.0 mL已配制好的2 种标准溶液分置50 mL容量瓶中,加入无水乙醇定容至刻度,摇匀,用0.45 μm滤膜过滤,分别吸取20 μL,注入高效液相色谱仪(进样3 次),按1.3.2节色谱条件测定,记录色谱图并以平均峰面积积分值为纵坐标,溶液质量浓度为横坐标,绘制相应标准曲线,并计算其回归方程与相关系数。
1.3.3.2 精密度
精密量取白藜芦醇与大黄素标准溶液各5 mL,加入无水乙醇定容至50 mL,按1.3.2节条件分别进样20 μL测定其峰面积,重复6 次,计算其相对标准偏差(relative standard deviation,RSD)。
1.3.3.3 稳定性
分别在0、2、4、6、8、10、12 h时取1.3.1.2节实验溶液,按1.3.2节条件分别进样20 μL,测定峰面积,计算其各自的RSD。
1.3.3.4 重复性
精密量取1.3.1.2节中的果实供试溶液6 份,按1.3.2节条件分别进样20 μL,测定峰面积并进行回归计算,求出平均含量与其RSD。
1.3.3.5 加样回收率
称取已处理贮藏的虎杖果粉1.500 0 g共12 份(白藜芦醇与大黄素各平行6 份),分别加入0.001 0 g的白藜芦醇与大黄素标准品,按果实供试液制备方法进行制备,按1.3.2节条件进行测定并回归计算得出回收率。
1.3.4 正交试验
根据前期单因素试验所选出乙醇体积分数、料液比(g/mL)、提取时间、火力档(表示微波炉磁控管间断工作时间分配)范围,以白藜芦醇、大黄素得率为指标,选用L16(44)正交试验表,试验因素与水平设计见表1。

表1 正交试验因素与水平Table 1 Factors and levels used for orthogonal array design
2 结果与分析
2.1 提取溶剂的确定
称取已处理虎杖果粉1.500 0 g(15 份,分成5 组),分置具塞锥形瓶中,按组分别加入水、甲醇、乙醇、乙酸乙脂、氯仿,使料液比为1∶30,于50 ℃条件下恒温水浴提取60 min,抽滤,滤液经处理后蒸去溶剂,置于100 mL量瓶中,用适量无水乙醇稀释至刻度,摇匀,用0.45 μm滤膜滤过,按1.3.2节各自色谱条件进样20 μL测定峰面积并回归计算,平均得率结果见表2。
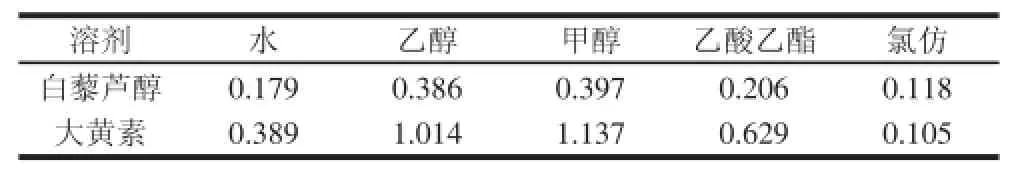
表2 不同溶剂的提取得率(n = 3)Table 2 Extraction effi ciencies of different solvents (n = 3) %
由表2可知,甲醇作为溶媒时白藜芦醇与大黄素的得率均较大,但乙醇与之相差不大,考虑到甲醇的毒性较大,故选择乙醇作为白藜芦醇与大黄素共同的提取溶剂。
2.2 提取方法的确定
称取已处理虎杖果粉1.500 0 g(12 份,分成4 组),分置具塞锥形瓶中,按料液比1∶30加入乙醇,按组用水浴法、加热回流法、超声波辅助法与微波辅助法进行提取,抽滤,滤液经处理后蒸去溶剂,置于100 mL量瓶中,用适量无水乙醇稀释至刻度,摇匀,用0.45 μm滤膜滤过,按1.3.2节各自色谱条件进样20 μL测定峰面积并回归计算,平均得率结果见表3。

表3 不同提取方法提取得率(= 3)Table 3 Extraction effi ciencies of different methods (n = 3) %
由表3可知,微波辅助提取法较其他3 种方法从虎杖果实中提取白藜芦醇与大黄素的得率要高,且该方法还能缩短提取时间,因此本研究选择微波辅助提取法作为虎杖果实中白藜芦醇与大黄素的提取方法。
2.3 方法学考察结果

图1 白藜芦醇(a)与大黄素(b)标准品高效液相色谱峰Fig. 1 HPLC profi les of resveratrol standard (a) and emodin standard (b)
图1 为2 种标准品的高效液相色谱,根据标准曲线计算得白藜芦醇的回归方程为Y=144 160X+10076,R=0.999 7;大黄素的回归方程为Y=98 079X+9 152,R=0.999 6。结果表明,白藜芦醇在0~5.940 μg/mL范围内具有良好线性关系,大黄素在0~5.880 μg/mL范围内具有良好线性关系。
精密度检测得白藜芦醇与大黄素标准品的平均峰面积的RSD分别为0.17%和0.12%,表明仪器检测的误差小精度高。稳定性检测得果实中白藜芦醇与大黄素峰面积的RSD分别为3.68%和0.12%,表明供试品溶液在12 h内稳定。重复性实验得到果实中白藜芦醇与大黄素的平均含量为0.424%和1.237%,RSD分别为0.64%和0.11%。加样回收率实验结果见表4、5。
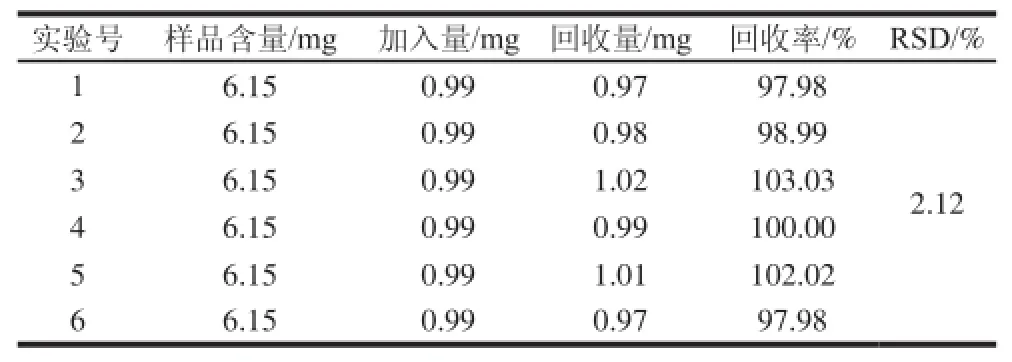
表4 白藜芦醇回收率检测结果Table 4 Recovery of resveratrol in spiked samples

表5 大黄素回收率检测结果Table 5 Recovery of emodin in spiked samples
2.4 正交试验设计及结果

表7 白藜芦醇得率正交试验方差分析Table 7 Analysis of variance for resveratrol extraction yield
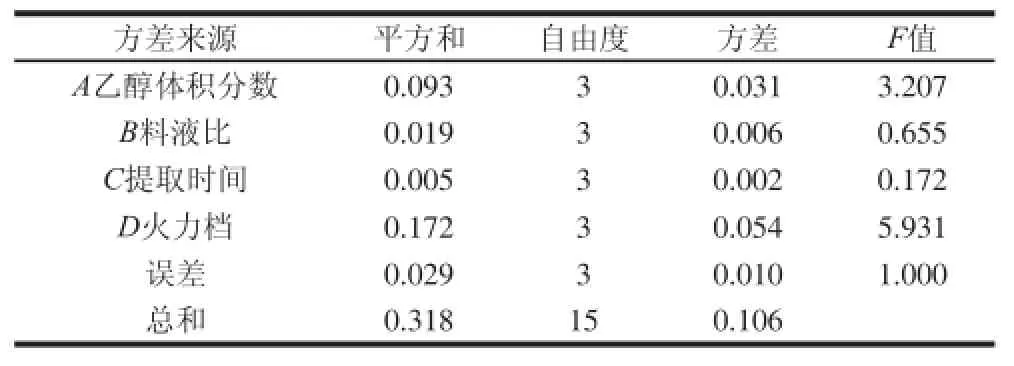
表8 大黄素得率正交试验方差分析Table 8 Analysis of variance for emodin extraction yield
由表6可知,微波辅助提取虎杖果实中白藜芦醇、大黄素的条件一致,各因素中起主导作用的是火力档,其次是乙醇体积分数、料液比,提取时间影响最小,最佳工艺条件组合为(A3B1C1D4),即40~60火力(先40火力处理3 min后60火力处理3 min)、乙醇体积分数70%、料液比1∶20、提取时间6 min。由表8、9可知,火力档对白藜芦醇与大黄素的提取效果影响最显著,乙醇体积分数影响也较显著,料液比与提取时间对提取效果影响较小。
2.5 验证实验结果
由于A3B1C1D4条件的实验未在正交表中,为验证上述结果的准确性,保证提取工艺的合理可行,分3 次取已处理虎杖果粉各1.500 0 g,按上述已确定最佳工艺条件,进行验证实验并记录色谱图(图2),结果显示,白藜芦醇与大黄素的平均得率为0.432%与1.415%。
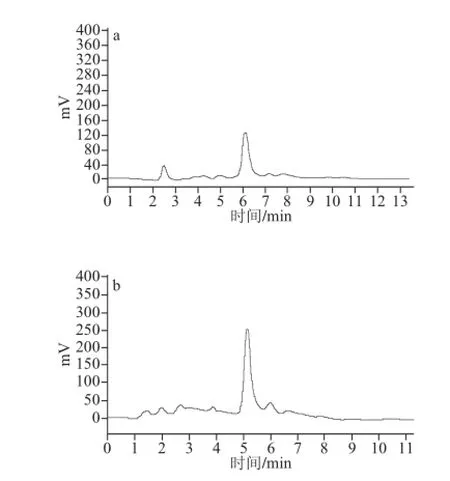
图2 样品溶液白藜芦醇(a)和大黄素(b)高效液相图谱Fig. 2 HPLC profi les of resveratrol and emodin extracted from Polygonum cuspidatum

表9 虎杖3 类根茎与果实中白藜芦醇与大黄素得率Table 9 Comparison of the contents of of resveratrol and emodin in three types of rhizomes and fruits %
如表9所示,3 类根茎及果实中白藜芦醇与大黄素得率存在较大差异,且3 a生结果雌株的根茎中白藜芦醇与大黄素得率明显低于其他2 类根茎,3 类根茎及果实均高于《中国药典》(2010)[2]中规定含量(0.15%与0.60%),表明该工艺稳定、合理、可为果实中白藜芦醇与大黄素的生产开发提供理论依据。
3 讨 论
文献[21-23]表明,虎杖中白藜芦醇与大黄素的提取都是以虎杖干燥根茎及根作为原料,本实验以虎杖果实中白藜芦醇与大黄素的提取溶剂与方法及最佳提取工艺作为考察指标,比较了虎杖果实、3 a生雄株、未结果雌株、结果雌株的根茎中白藜芦醇与大黄素得率差异,结果3 类根茎及果实中白藜芦醇与大黄素的得率存在较大差异,且3 a生结果雌株的根茎中白藜芦醇与大黄素得率明显低于其他两类根茎,但三者均高于《中国药典》(2010)[2]中规定值(0.15%与0.60%),这也与药农采收药用虎杖往往以3 a为一个生产周期相吻合[19]。因此以3 a为采收期药用虎杖最好能雌雄隔离栽培。虎杖果实中白藜芦醇与大黄素得率也明显高于《中国药典》(2010)[2]中所规定值,因此虎杖果实具备开发利用的潜能。由于白藜芦醇可以被用作添加剂加到药品、酒类或化妆品中,作为一种新型美容保健品以延缓人的衰老,保持肌肤水分,祛除疮类、黄褐斑等[24],还被运用到某些酒类中,且白藜芦醇的含量高低也成为许多厂家检测酒类品质的重要标准之一[25]。因此利用虎杖果实中白藜芦醇与大黄素含量高及其所含的营养成分开发保健食品及食品添加剂很有开发前景,也为多年生长虎杖的栽培和开发利用提供新的思路。
[1] 中国科学院植物研究所. 中国高等植物图鉴: 第一册[M]. 北京: 科学出版社, 2001: 567.
[2] 国家药典委员会. 中华人民共和国药典: 一部[S]. 北京: 中国医药科技出版社, 2010: 194-195.
[3] 李英, 黄清松, 罗建明, 等. 超临界流体萃取-HPLC法测定虎杖中大黄酸、大黄素及大黄素甲醚的含量[J]. 中药材, 2013, 36(5): 764-766. DOI:10.13863/j.issn1001-4454.2013.05.023.
[4] AGGARWAL B B, BHARDWAJ A, AGGARWAL R S, et al. Role of resveratrol in prevention and therapy of cancer: preclinical and clinical studies[J]. Anticancer Research, 2004, 24: 2783-2840.
[5] BAUR J A, PEARSON K J, PRICE N L, et al. Resveratrol improves health and survival of mice on a high-calorie diet[J]. Nature, 2006, 444: 337-342.
[6] 刘华金, 易有金, 杨建奎, 等. 转化白藜芦醇苷虎杖内生真菌的分离和鉴定[J]. 食品科学, 2012, 33(11): 172-176.
[7] 陈易彬, 陈奎. 白藜芦醇提取工艺的研究[J]. 食品科学, 2007, 28(12): 197-199. DOI:10.3321/j.issn:1002-6630.2007.12.044.
[8] 张泽生, 贺伟, 刘甜甜, 等. 白藜芦醇的体外抗氧化活性[J]. 食品科学, 2012, 33(11): 266-268.
[9] 田凤, 徐德生, 冯怡, 等. 虎杖药渣中白藜芦醇的提取和纯化[J]. 中国医药工业杂志, 2012, 43(10): 824-826.
[10] 韩晶晶, 刘伟, 毕玉萍. 白藜芦醇的研究进展[J]. 生物工程学报, 2008, 24(11): 1851-1859. DOI:10.13345/j.cjb.2008.11.017.
[11] LU Hongmei, NI Wangdong, LIANG Yizeng, et al. Supercritical CO2extraction of emodin and physcion from Polygonum cuspidatum and subsequent isolation by semipreparative chromatography[J]. Journal of Separation Science, 2006, 29: 2136-2142. DOI:10.1002/ jssc.200600012.
[12] 樊慧婷, 丁世兰, 林洪生. 中药虎杖的药理研究进展[J].中国中药杂志, 2013, 38(15): 2545-2548. DOI:10.3321/ j.issn:1001-5302.2000.11.003.
[13] 袁晓, 舒楚金, 龚二兰, 等. 虎杖蒽醌化合物的分离及抗氧化活性的研究[J]. 食品研究与开发, 2013, 32(2): 22-24.
[14] 禹珊, 郭强胜, 王会琳, 等. 定量核磁共振波谱法同时测定中药虎杖中白藜芦醇和虎杖苷的含量[J]. 分析化学, 2015, 43(1): 69-74. DOI:10.11895/j.issn.0253_3820.140654.
[15] 丘芬, 金钊, 闫守霞, 等. 虎杖五种酒制饮片水提物的活血化瘀作用研究[J]. 时珍国医国药, 2013, 24(12): 2903-2904. DOI:10.3969/ j.issn.1008-0805.2013.12.034.
[16] 刘莉, 季金苟, 唐南南, 等. 虎杖中大黄素的分离纯化工艺研究[J]. 中成药, 2013, 35(9): 2034-2037. DOI:10.3969/ j.issn.1001-1528.2013.09.051.
[17] 胡冠宇, 夏醒醒, 尹政. 不同季节虎杖根茎与茎叶中大黄素含量变化研究[J]. 中国中医药信息杂志, 2009, 16(2): 45-46. DOI:10.3969/ j.issn.1005-5304.2009.02.020.
[18] 毛春芳, 施忠, 罗琳, 等. HPLC法同时测定大黄中芦荟大黄素等11 种成分的量[J]. 中草药, 2014, 45(16): 2400-2403. DOI:10.7501/ j.issn.0253-2670.2014.16.023.
[19] 卜晓英, 董爱文, 管琼玉, 等. 荧光显微技术与HPLC联用法快速检测虎杖组织器官中白藜芦醇的分布与含量[J]. 中药材, 2012, 35(12): 1909-1913. DOI:10.13863/j.issn1001-4454.2012.12.014.
[20] 米洁, 张兴国, 程方叙, 等. 峨眉山虎杖中大黄素提取工艺及含量测定[J]. 安徽农业科学, 2010, 38(28): 15610-15611. DOI:10.13989/ j.cnki.0517-6611.2010.28.114.
[21] 朱立贤, 金征宇. 大孔吸附树脂对虎杖中白藜芦醇吸附性能的研究[J]. 食品科学, 2005, 26(3): 75-78. DOI:10.3321/ j.issn:1002-6630.2005.03.014.
[22] 李世学, 刘建利, 张楠, 等. 处理方法对虎杖不同部位白藜芦醇和虎杖苷量的影响[J]. 中草药, 2009, 40(3): 469-471. DOI:10.3321/ j.issn:0253-2670.2009.03.039.
[23] 王如峰, 王敏, 安燕南, 等. HPLC指纹图谱法评价市售虎杖饮片的质量一致性[J]. 中药材, 2013, 36(4): 549-552. DOI:10.13863/ j.issn1001-4454.2013.04.039.
[24] 张梅, 杨林. 白藜芦醇生物学作用的研究进展[J]. 华北煤炭医学院报, 2007, 9(3): 333-335. DOI:10.3969/j.issn.1008-6633.2007.03.023.
[25] 程丽英, 刘树兴. 白藜芦醇研究现状与应用展望[J]. 食品研究与开发, 2005, 26(1): 25-27. DOI:10.3969/j.issn.1005-6521.2005.01.007.
Optimization of Simultaneous Extraction of Resveratrol and Emodin from Fruits of Polygonum cuspidatum and Comparison of Their Contents with Those of Rhizomes of Male and Female Plants
DONG Aiwen, YAO Shufeng, XU Xinjun, CHENG Jiang
(Key Laboratory of Hunan Forest Products and Chemical Industry Engineering, Jishou University, Zhangjiajie 427000, China)
Objective: To investigate the simultaneous extraction of resveratrol and emodin from the fruits of Polygonum cuspidatum and to compare their contents with those of the rhizomes of male, non-bearing and bearing female plants. Methods: High performance liquid chromatography (HPLC) was used to determine the contents of resveratrol and emodin. The microwave-assisted extraction of resveratrol and emodin was carried out using aqueous ethanol as extraction solvent. Microwave fi repower, ethanol concentration, solid-to-solvent ratio and extraction time, all of which were found to infl uence extraction effi ciency, were optimized by using orthogonal array experiments. Comparison of the contents of resveratrol and emodin in the fruits and rhizomes of Polygonum cuspidatum was performed. Results: The optimal extraction conditions were obtained as follows: ethanol concentration, 70% (V/V); solid-to-solvent ratio, 1:20 (g/mL); microwave power, 800 W; microwave irradiation for 3 min at fi repower 40 and for additional 3 min at fi repower 60 after cooling; and extraction time, 6 min. The contents of resveratrol and emodin in the rhizomes of male and non-bearing female plants were signifi cantly higher than those of the rhizomes of female plants and fruits of Polygonum cuspidatum, and all these values exceeded those specifi ed in the Chinese Pharmacopoeia. The extraction process presented in this study was reasonable, stable and feasible. Differences in the contents of resveratrol and emodin existed among three types of rhizomes and fruits of P. cuspidatum. However, the fruit has the potential for development and utilization.
Polygonum cuspidatum; resveratrol; emodin; extraction process; HPLC
10.7506/spkx1002-6630-201610003
R286.022
A
1002-6630(2016)10-0012-05
董爱文, 姚姝凤, 许新军, 等. 虎杖果实中白藜芦醇与大黄素提取工艺优化及其与3 类根茎含量比较[J]. 食品科学, 2016, 37(10): 12-16. DOI:10.7506/spkx1002-6630-201610003. http://www.spkx.net.cn
DONG Aiwen, YAO Shufeng, XU Xinjun, et al. Optimization of simultaneous extraction of resveratrol and emodin from fruits of Polygonum cuspidatum and comparison of their contents with those of rhizomes of male and female plants[J]. Food Science, 2016, 37(10): 12-16. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201610003. http://www.spkx.net.cn
2015-08-15
国家自然科学基金地区科学基金项目(31260634);林产化工工程湖南省重点实验室开放项目(JDZ201404);张家界市科技计划项目(2015FJ1149);吉首大学校级科研项目(15JDY018)
董爱文(1967—),男,研究员,硕士,研究方向为植物活性成分与食品营养。E-mail:daw1999@163.com
