唑来膦酸或帕米膦酸二钠联合阿那曲唑治疗绝经后乳腺癌骨转移的疗效观察
2016-12-07单风晓任铁军
单风晓 任铁军
乳腺癌是女性常见恶性肿瘤之一,其发病率在我国某些地区已居首位,严重威胁女性的身心健康[1]。乳腺癌首发骨转移约占30%,而在复发转移性乳腺癌患者中骨转移的发生率高达65%~75%,常导致患者出现骨疼痛加剧、病理性骨折、脊髓压迫、因骨折手术、因骨疼痛加剧放疗、高钙血症等一系列骨相关事件(skeletal related evend,SRE)[2~4]。目前临床上治疗骨转移的常用药物为第二代及第三代双磷酸盐,临床研究证明,其对SRE具有预防和治疗作用,是肿瘤骨转移治疗的重要手段之一[5]。本文观察51例绝经后晚期乳腺癌骨转移患者应用唑来膦酸或帕米膦酸二钠联合阿那曲唑治疗的疗效及安全性。现报道如下。
1 资料与方法
1.1 一般资料
选择2010年1月至2014年6月本院收治的51例绝经后乳腺癌骨转移患者为研究对象,均为女性,年龄48~82岁,平均62岁。原发病灶均为乳腺癌,免疫组化检查证实雌激素或(和)孕激素受体阳性,依据患者临床表现、ECT检查显示骨放射性同位素异常浓聚、X射线片或CT检查显示骨质破坏,伴有不同程度的癌痛,肝肾功能、血尿常规正常,近3个月内均未进行化疗及放疗,既往均未使用双磷酸盐类药物,Karnofsky评分平均为60分(40~90分),ECOG评分≥2分,预计生存期≥1年,对唑来膦酸及帕米膦酸二钠无过敏。本研究经医院伦理委员会通过,患者均自愿签署知情同意书。
51例患者按入院顺序采用随机数字表法分为对照组27例,治疗组24例,两组年龄、病理学类型、骨转移灶个数等一般资料比较差异均无统计学意义(P>0.05),具有可比性。随访日期截至2015年6月30日,无因不能耐受不良反应而中途退出者。
1.2 治疗方法
对照组应用阿那曲唑1 mg口服,每日1次,同时给予帕米膦酸二钠注射液60 mg加入生理盐水500 mL静滴4 h;治疗组口服阿那曲唑1 mg,每日1次,同时给予唑来膦酸注射液4 mg加入生理盐水100 mL静滴15 min,给药前后两组均予生理盐水100 mL冲管,28 d为1个周期,至少连续应用2个周期。总计3~6个周期。用药前后查血常规、血钙、血磷、肝肾功能及心电图。
1.3 观察指标
1.3.1 骨痛缓解疗效判定[6]采用国际通用疼痛数字评分法(NRS)及WHO疼痛程度分级标准分为0级:无痛,0分;Ⅰ级:可耐受的轻度疼痛,能正常生活,睡眠不受干扰,1~3分;Ⅱ级:中度疼痛且不能耐受,影响睡眠,要求服用镇痛药物,4~6分;Ⅲ级:重度疼痛,严重影响患者日常生活,可伴有植物神经功能紊乱表现或被动体位,7~10分。治疗前和治疗后第14天、第56天各评价1次。按以下标准评价:显效:疼痛分级降低2级以上,或降为0级;有效:疼痛分级标准降低1级,且未达到0级;无效:疼痛分级无下降甚至上升。总有效率=显效率+有效率[7]。
1.3.2 骨转移灶清退治疗有效率的评价标准 依据治疗前后ECT和X射线或CT检查结果评价[8]:⑴有效:治疗后,骨转移灶的体积减少≥2/3;⑵好转:治疗后,骨转移灶的体积减少1/3~2/3;⑶无效:治疗后,骨转移灶的体积减少<1/3。
1.4 不良反应
观察有无发热、肌肉痛及血常规、肝肾功能异常等。按WHO推荐的毒性分级标准评价。
1.5 随访指标
SRE包括乳腺癌骨转移引起的骨疼痛、脊髓压迫、病理性骨折、高钙血症,以及骨转移所致的手术、放射治疗等。无SRE时间指从诊断骨转移开始到出现SRE的时间;总生存时间指从诊断骨转移开始到死亡或最后一次随访的时间。
1.6 统计学方法
采用SPSS 16.0统计学软件对数据进行处理。计数资料的比较用χ2检验,用Kaplan-Meier法计算生存率并绘制生存曲线。以P<0.05为差异有统计学意义。
2 结果
2.1 止痛疗效
两组用药7 d后,患者疼痛迅速减轻,并明显减少对止痛药物的依赖,维持时间达28 d。治疗组用药14 d后总有效率为87.5%,高于对照组的66.7%,差异具有统计学意义(χ2=6.067,P<0.05);用药56 d 后,治疗组的总有效率为91.7%,对照组为77.8%,差异无统计学意义(χ2=3.977,P>0.05)。见表1。

表1 两组乳腺癌骨转移患者治疗后相关疼痛的疗效比较(n)
2.2 骨转移灶清退情况的比较
治疗后,治疗组24例患者中骨转移灶清退有效12例,好转7例,无效5例;对照组27例中骨转移灶清退有效4例,好转14例,无效9例。治疗组的骨转移灶清退明显优于对照组,差异有统计学意义(χ2=7.325,P<0.05)。
2.3 患者无SRE生存时间及总生存时间的比较
对照组和治疗组患者中位无SRE生存时间分别为17.4个月和22.4个月(图1),中位总生存时间分别为25.8个月和35.1个月(图2),差异均具有统计学意义(P<0.05)。
2.4 不良反应
治疗组有2例患者出现轻度发热(体温<38.0℃),无寒颤,9例发生肌肉、骨酸痛等流感样症状;对照组发生发热3例,寒颤1例,流感样症状11例,主要发生在用药3 d内,部分给予吲哚美辛栓治疗后好转,无皮疹、局部红肿、肝肾功能损伤及低钙血症出现,两组比较差异无统计学意义(P>0.05)。
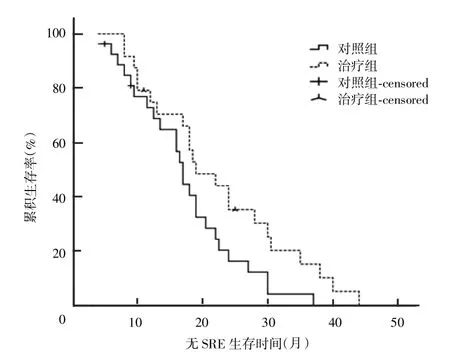
图1 两组患者无SRE生存曲线

图2 两组患者总生存曲线
3 讨论
骨转移是晚期乳腺癌最常见的并发症,可导致SRE,严重影响患者的生存质量。对于绝经后有骨转移的晚期乳腺癌患者,阿那曲唑可明显改善雌激素和(或)孕激素受体阳性者的预后,提高生存期[9],较来曲唑、依西美坦有更高的中位无进展生存时间(mPFS)和临床获益率(CBR)[10],可作为乳腺癌一线内分泌治疗药物[11]。然而对于老年患者,由于生理骨量丢失,长期应用阿那曲唑将进一步加重骨量丢失,增加 SRE 的发生[12,13]。
唑来膦酸被认为是目前作用最强的双膦酸盐,且已作为骨改良剂纳入2011年ASCO(American society of clinical oncology)发布的乳腺癌骨转移治疗共识和指南[14],再次肯定了其对骨转移的疗效。唑来膦酸抗骨转移优势如下:⑴唑来膦酸是目前公认的药理活性最强的双膦酸类药物,其在预防和治疗实体性肿瘤SRE中的疗效和适应证优于第二代双膦酸盐帕米膦酸二钠[15],抑制破骨细胞的活性比后者强50~100倍[16]。⑵国外研究证实,唑来膦酸除对溶骨性改变有治疗作用外,对于成骨性前列腺癌骨转移同样有效[17,18]。⑶抗疼痛作用迅速,在疼痛分级高的病例中用唑来膦酸,能显著改善生存质量[19]。⑷具有潜在抗肿瘤作用。多项临床前研究显示唑来膦酸可通过诱导肿瘤细胞凋亡、对抗细胞黏附侵袭、抑制肿瘤血管生成等直接和间接方式达到抗肿瘤的目的[20-23],且与放化疗及内分泌治疗有序贯协同增敏作用[24-26]。⑸唑来膦酸静脉滴注仅需15 min,患者依从性好。这些优点使其在众多双磷酸盐类药物中脱颖而出。
本研究在阿那曲唑治疗绝经后乳腺癌骨转移患者的基础上,联合骨修复剂唑来膦酸与帕米膦酸二钠进行治疗并比较,旨在观察唑来膦酸对绝经后乳腺癌骨转移患者的疗效,结果显示两组止痛总有效率差异无统计学意义(P>0.05),支持唑来膦酸和帕米膦酸二钠在缓解骨转移疼痛方面疗效相似的观点[27];其中用药14 d后,唑来磷酸有效率高于帕米膦酸二钠(P<0.05),说明唑来膦酸对疼痛缓解迅速,再次证明在疼痛分级较高的病例中应用唑来膦酸可改善患者生存质量的观点,且治疗组患者的骨转移灶清退情况明显优于对照组,差异有统计学意义(P<0.05),说明唑来膦酸控制骨转移灶有明显优势。
本研究表明,对照组与治疗组中位无SRE生存时间为17.4个月和22.4个月,中位总生存时间为25.8和35.1个月,差异均具有统计学意义(P<0.05)。说明在一定程度上,骨转移患者输注唑来膦酸可以治疗和预防癌性骨痛的发展,减少和推迟SRE发生,减少三阶梯止痛药物的使用,这与文献[28~30]报道结果一致。其中两组中位总生存时间及9.3个月的差值均更长于先前报道[31],可能是因为本研究入组人数均为雌激素或(和)孕激素受体阳性,内分泌治疗有效率高,同时也与入组人数少,且除合并骨转移以外其他脏器转移引起的致命风险较小等有关,有关方面尚待更深层次探讨。
综上所述,唑来膦酸治疗绝经后乳腺癌骨转移具有应用方便、疗效好、不良反应少的优点。但由于目前观察例数较少,观察用药的次数有限,相关药物特征有待进一步观察和研究。
[1]Fan L,Strasser-Weippl K,Li JJ,et al.Breast cancer in China[J].Lancet Oncol,2014,15(7):e279-289.
[2]Coleman RE.Adjuvant bisphosphonates in breast cancer:are we witnessing the emergence of a new therapeutic strategy?[J].Eur J Cancer,2009,45(11):1909-1915.
[3]Hagberg KW,Taylor A,Hernandez RK,et al.Incidence of bone metastases in breast cancer patients in the United Kingdom:results of a multi-database linkage study using the general practice research database[J].Cancer Epidemiol,2013,37(3):240-246.
[4]江泽飞,陈佳艺,牛晓辉,等.乳腺癌骨转移和骨相关疾病临床诊疗专家共识(2014版).中华医学杂志,2015,95(4):241-247.
[5]Henk HJ,Kaura S.Retrospective database analysis of the effect of zoledronic acid on skeletal-related events and mortality in women with breast cancer and bone metastasis in a managed care plan[J].J Med Econ,2012,15(1):175-184.
[6]周进,卢俊,石莉,等.癌性疼痛规范化治疗共识解读[J].中国医刊,2015,50(9):18-22.
[7]原凌燕,柳珂,王湛,等.羟考酮控释片作为止痛背景用药在中重度癌痛滴定中的临床观察[J].临床肿瘤学杂志,2015,20(8):722-725.
[8]杨胜利,高云,朱江红,等.帕米膦酸二钠和唑来膦酸治疗乳腺癌骨转移的临床观察[J].四川医学,2012,33(3):467-470.
[9]Howell A,Cuzick J,Baum M,et al.Results of the ATAC(Arimidex,Tamoxifen,Alone or in Combination)trial after completion of 5 years'adjuvant treatment for breast cancer[J].Lancet,2005,365(9453):60-62.
[10]张梦玮,闫敏,律慧敏,等.芳香化酶抑制剂治疗绝经后转移性乳腺癌 148 例的临床分析[J].中华医学杂志,2015,95(22):1765-1767.
[11]张敏,李春艳,郝晓甍,等.阿那曲唑治疗绝经后晚期乳腺癌的临床疗效分析[J].实用癌症杂志,2010,25(3):270-273.
[12]Bundred NJ.Aromatase inhibitors and bone health[J].Curr Opin Obstet Gynecol,2009,21(1):60-67.
[13]余昕航,党雪菲.唑来膦酸预防老年乳腺癌患者阿那曲唑所致骨质疏松的疗效[J].中国老年学杂志,2014,34(11):3162-3163.
[14]Van Poznak CH,Temin S,Yee GC,et al.American Society of Clinical Oncology executive summary of the clinical practice guideline update on the role of bone-modifying agents in metastatic breast cancer[J].J Clin Oncol,2011,29(9):1221-1227.
[15]Rosen LS,Gordon D,Kaminski M,et al.Long-term efficacy and safety of zoledronic acid compared with pamidronate disodium in the treatment of skeletal complications in patients with advanced multiple myeloma or breast carcinoma:a randomized,double-blind,multicenter,comparative trial[J].Cancer,2003,98(8):1735-1744.
[16]Pataki A,Müller K,Green JR,et al.Effects of short-term treatment with the bisphosphonates zoledronate and pamidronate on rat bone:a comparative histomorphometric study on the cancellous bone formed before,during,and after treatment[J].Anat Rec,1997,249(4):458-468.
[17]Vogel CL,Yanagihara RH,Wood AJ,et al.Safety and pain palliation of zoledronic acid in patients with breast cancer,prostate cancer,or multiple myeloma who previously received bisphosphonate therapy[J].Oncologist,2004,9(6):687-695.
[18]Lipton A,Small E,Saad F,et al.The new bisphosphonate,Zometa(zoledronic acid),decreases skeletal complications in both osteolytic and osteoblastic lesions:a comparison to pamidronate[J].Cancer Invest,2002,20(Suppl 2):45-54.
[19]李英华,赵海东,田晓峰.唑来膦酸和伊班膦酸钠治疗乳腺癌骨转移的疗效和安全性比较[J].中华内分泌外科杂志,2012,6(5):330-334.
[20]Santini D,Vincenzi B,Dicuonzo G,et al.Zoledronic acid induces significant and long-lasting modifications of circulating angiogenic factors in cancer patients[J].Clin Cancer Res,2003,9(8):2893-2897.
[21]Vincenzi B,Santini D,Dicuonzo G,et al.Zoledronic acid-related angiogenesis modifications and survival in advanced breast cancer patients[J].J Interferon Cytokine Res,2005,25(3):144-151.
[22]Carmeliet P,Jain RK.Angiogenesis in cancer and other diseases[J].Nature,2000,407(6801):249-257.
[23]Ferretti G,Fabi A,Carlini P,et al.Zoledronic acid and angiogenesis[J].Clin Cancer Res,2007,13(22 Pt 1):6850.
[24]李晓敏.唑来膦酸单药或联合化疗治疗恶性肿瘤骨转移的临床观察[J].中国药物经济学,2014,(z2):191-192.
[25]郁汉旭.唑来膦酸联合放疗与单纯放疗治疗骨转移瘤疗效观察[J].中外医学研究,2015,13(26):49-50.
[26]Gnant M,Mlineritsch B,Stoeger H,et al.Adjuvant endocrine therapy plus zoledronic acid in premenopausal women with early-stage breast cancer:62-month follow-up from the ABCSG-12 randomised trial[J].Lancet Oncol,2011,12(7):631-641.
[27]曹桂侠,程朝辉,周冬梅.唑来膦酸与帕米膦酸二钠治疗恶性肿瘤骨转移性疼痛比较分析[J].肿瘤基础与临床,2013,26(1):59-61.
[28]王永新.唑来膦酸治疗骨转移癌痛的临床效果[J].中国处方药,2015,13(1):58.
[29]李永领,杜向慧.乳腺癌骨转移的综合治疗[J].中国癌症防治杂志,2014,6(2):193-197.
[30]石晶,付凌雨,刘云鹏,等.唑来膦酸和帕米膦酸二钠治疗骨转移癌疼痛疗效比较的 Meta分析[J].中华临床医师杂志,2011,5(17):5051-5056.
[31]李英华,王彦,李曼,等.唑来膦酸、伊班膦酸钠和帕米膦酸二钠治疗非小细胞肺癌骨转移的疗效和安全性比较[J].医学与哲学,2012,33(3B):23-25.
