低级别子宫内膜间质肉瘤8例临床病理分析
2016-12-07李树斌黄彩虹
李树斌 黄彩虹
子宫内膜间质肉瘤(endometrial stromal sarcoma,ESS)是一种激素依赖性的子宫间叶源性肿瘤[1.2],起源于子宫间质细胞或子宫肌层内具有分化潜能的原始间叶细胞,占女性生殖道恶性肿瘤的0.2%,其中约80%为低级别子宫内膜间质肉瘤(low-grade endometrial stromal sarcoma,LGESS)[3],临床上 LGESS 较容易发生漏诊和误诊。现回顾分析2005年10月至2013年12月我院在术前及术中均未能明确诊断的8例LGESS患者的临床资料,探讨其临床病理学特征、诊断、鉴别诊断及预后,以期提高对该肿瘤的认识。
1 资料与方法
1.1 临床资料
收集江苏省扬州市第一人民医院和江苏省宝应县人民医院2005年10月至2013年12月收治的LGESS患者8例,均有完整的临床和病理资料。年龄36~53岁,平均46岁。按FIGO临床分期Ⅰ期6例,Ⅱ期1例,Ⅲ期1例。B超或CT检查示子宫黏膜下、肌壁间占位或下腹部肿块,术前诊断为子宫肌瘤或下腹部肿块。患者均行子宫及双附件切除术,术后经组织病理学检查诊断为LGESS,均行孕激素治疗。
1.2 方法
8例LGESS组织标本均经10%中性福尔马林固定,石蜡包埋,4 μm片厚连续切片,常规HE染色,光镜检查。免疫组化染色采用SP法,DAB显色,所用抗体包括 CD10、SMA、desmin、Inhibin、CD34、LCA、HMB45、EMA、ER、PR等,均购自福州迈新公司,按照说明书常规操作,全部设阴性和阳性对照。以肿瘤细胞的特定部位染色显示为深棕色视为阳性表达,其中CD10、CD34、EMA定位于细胞质或细胞膜为阳性表达,SMA、desmin、Inhibin、HMB45 定位于细胞质为阳性表达,LCA定位于细胞膜为阳性表达,ER、PR定位于细胞核为阳性表达。
2 结果
2.1 眼观
肿瘤局限于子宫内6例,表现为阴道不规则出血,肿瘤呈结节状,其中位于黏膜下2例(浸润子宫肌壁间),肌壁间3例,黏膜下及肌壁间1例。2例位于子宫外,表现为下腹部肿块,其中位于大网膜和盆腔内各1例,分别伴一侧卵巢囊肿和双侧卵巢肿块。肿瘤直径1~6 cm,平均5 cm,肿瘤切面呈灰白色或灰红色,质软,细腻,部分伴出血、坏死。
2.2 镜检
8例均由卵圆形或短梭形细胞构成(图1),7例呈不规则舌状浸润性生长,浸润子宫壁(图2),其中4例有突入淋巴管、血管内生长(图3)。4例中2例可见核分裂,细胞轻度异形,均见薄壁螺旋状生长小血管,周围有同心圆样排列的肿瘤细胞(图4);1例伴平滑肌分化,并见核分裂;1例间质见泡沫细胞巢、玻璃样变性;1例伴性索样分化,未见核分裂。
2.3 免疫表型
8例患者肿瘤细胞CD10均呈弥漫性强阳性表达(图5),PR阳性8例,ER阳性7例。肿瘤局限于子宫内的6例中,SMA、desmin局灶阳性1例,Inhibin局灶阳性1例;8例肿瘤细胞CD34、EMA、LCA、HMB45均阴性。
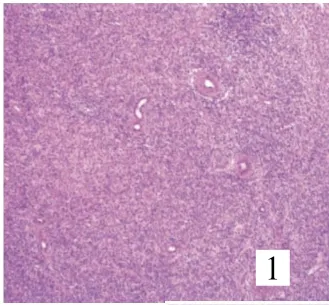
图1 肿瘤由卵圆形或短梭形细胞构成(SP×40)
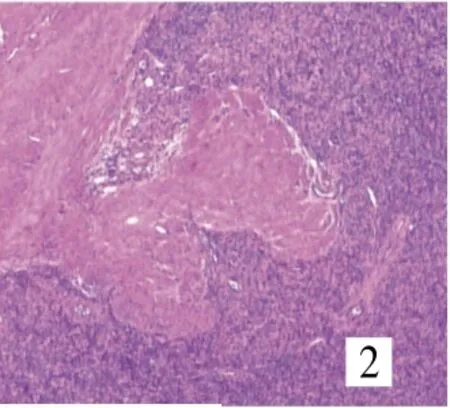
图2 肿瘤细胞浸润性生长(SP×40)
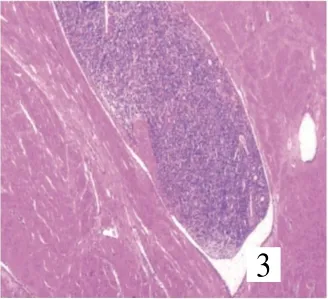
图3 肿瘤细胞浸润脉管(SP×40)
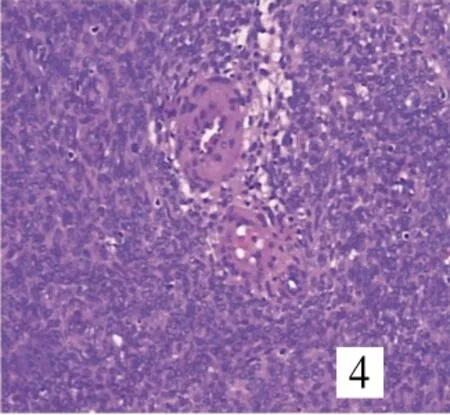
图4 肿瘤细胞围绕小血管呈同心圆样排列(SP×200)
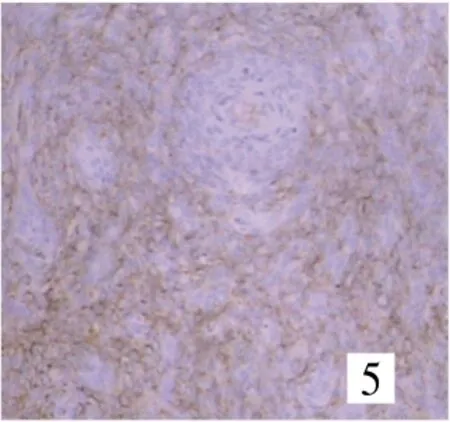
图5 肿瘤细胞表达CD10(SP×200)
2.4 随访
8例均获随访,随访时间1~8年,中位随访时间为37个月。1例5年后复发,再次行手术等治疗后随访2年,仍生存,其余7例随访期间均未复发。
3 讨论
子宫内膜间质肉瘤是女性生殖道少见的恶性肿瘤,占整个女性生殖系统恶性肿瘤的1%~4%[4]。WHO(2014年)子宫体、宫颈肿瘤和滋养细胞疾病组织学分类[5]将子宫内膜间质及相关肿瘤分为子宫内膜间质结节(endometrial stromal nodule,ESN)、LGESS、高级别子宫内膜间质肉瘤(high-grade endometrial stromal sarcoma,HESS)、未分化子宫肉瘤(undifferentiated endometrial sarcoma,UES)和类似于卵巢性索肿瘤的子宫肿瘤(uterine tumors resembling ovarian sex cord tumors,UTROSCT)。文献[3]报道 LGESS 多见于45~50岁中年女性,恶性程度低,易复发。临床上多数LGESS发生于子宫内,常表现为不规则阴道出血,而少部分可发生在子宫外,多数因体检时发现腹部肿块就诊。本组患者年龄36~53岁,平均46岁,与上述文献报道的发病年龄和主要临床表现一致。
3.1 病理学特征
子宫内膜间质肉瘤起源于子宫间质细胞,可向性索样、肌纤维母细胞、平滑肌、横纹肌、纤维性及骨样分化,因此病理形态和免疫表型表达方式多样,正确诊断有一定难度。LGESS的病理诊断依据为肿瘤细胞呈子宫内膜样间质分化,有丰富的螺旋样小动脉,肿瘤细胞围绕其周围呈同心圆样排列,核分裂大多数<10个/10HP,肿瘤边缘不清,呈舌状浸润性生长,浸润脉管并可见瘤栓。本组6例肿瘤局限于子宫内的患者均出现螺旋样小动脉,肿瘤细胞围绕其周围呈同心圆样排列;2例肿瘤位于子宫外的患者亦出现螺旋样小动脉,但肿瘤细胞围绕其周围呈同心圆样排列不明显,螺旋状小动脉与肿瘤细胞之间有粗大的胶原纤维,无浸润脉管或瘤栓。文献[6]报道CD10在LGESS肿瘤细胞内阳性表达率为100%,是诊断LGESS的特异性抗体。临床工作中PR、ER阳性表达提示为LGESS,而PR、ER阴性则提示为HESS,因此提出了以PR、ER阳性区分低级别和高级别子宫内膜间质肉瘤[7,8]。本组肿瘤细胞CD10均呈弥漫性阳性表达,PR均阳性,除子宫外1例ER阴性,其余均为阳性,提示LGESS是一种激素依赖性肿瘤,CD10是较特异的抗体,与上述文献报道一致。此外,当LGESS肿瘤出现平滑肌分化,SMA、desmin可表现为阳性,如出现性索样分化,Inhibin可阳性表达,但肿瘤细胞均不表达 CD34、LCA、HMB45、EMA。本组1例平滑肌分化者SMA、desmin局灶阳性,1例伴性索样分化者Inhibin局灶阳性。
3.2 鉴别诊断
在临床工作中应注意LGESS与以下肿瘤鉴别:⑴子宫内膜间质结节。子宫内膜间质结节是一种良性病变,结节边缘光滑清楚,呈膨胀样生长,无肌层或脉管浸润,局灶性不规则突起罕见,深度≤3 mm,数量<3个,无血管浸润[9,10],在实际工作中诊刮标本取材表浅破碎,区分难度较大。本组1例肿瘤位于黏膜下,术前诊刮时由于仅见短梭形肿瘤细胞,未见明显浸润生长,诊断为子宫内膜间质肿瘤,术后见明显浸润性生长,因此难以鉴别诊断时,建议使用子宫内膜间质肿瘤(ESTS)诊断,以免过度诊断或诊断不足。⑵高级别子宫内膜间质肉瘤。当类似低级别子宫内膜间质肉瘤样的组织中部分区域肿瘤细胞变圆,异形程度明显增加,核分裂>10个/10HP,并见坏死,应归入高级别子宫内膜间质肉瘤。分子遗传学检测可以证实HESS起源于子宫内膜间质[11],其预后较LGESS差,但优于未分化子宫内膜肉瘤。⑶未分化子宫内膜肉瘤。该瘤细胞缺乏子宫内膜样间质细胞分化,细胞异形明显,大多数核分裂≥10个/10HP,可见坏死。⑷富于细胞的平滑肌瘤。平滑肌瘤见有大而厚壁血管,细胞间见有裂隙、呈梭形、束状排列,无浸润性生长及坏死,CD10、SMA、desmin 可出现阳性,有学者[9,12]推荐联合检测h-caldesmon、desmin和OTRs诊断平滑肌肿瘤,并结合临床和病理形态,避免依据单一标志物的染色结果作出诊断。⑸静脉内平滑肌瘤病。该瘤由细长的平滑肌细胞构成,而LGESS由卵圆形的子宫内膜间质细胞组成,静脉内平滑肌瘤病肿瘤沿血管生长,常延伸到阔韧带和子宫血管以及髂静脉,可达右心房,LGESS则呈浸润性生长。⑹血管周上皮样细胞肿瘤(PEComa)。PEComa以透明或嗜酸性细胞为主,表现为边缘呈舌状伸入肌层或血管内生长,HMB45、Melan-A阳性表达,部分平滑肌样分化则CD10呈阳性表达。⑺子宫性索样肿瘤。如以子宫内膜间质成分为主(>50%),仅有局限性索成分,应归入子宫内膜间质肉瘤伴性索分化。若全部或主要成分(>50%)为性索成分,目前大多数学者认可其为UTROSCT[13]。
3.3 治疗与预后
LGESS一般生长缓慢,易复发,但预后较好。目前手术仍是主要的治疗方法,术后常辅以放化疗和激素治疗。Mizuno等[14]报道1/3~1/2的LGESS患者可发生盆腔内复发,复发间隔时间平均为3年。而有报道LGESS术后行孕激素治疗,10年生存率可达90%~100%[3]。本组8例患者手术后均行孕激素治疗,1例术后5年盆腔内复发,再次手术后行放化疗和激素治疗,目前仍生存,其余7例随访情况良好。
综上认为,LGESS是临床上较难正确诊断的肿瘤,无特异性的临床表现,主要由组织病理学确诊,但需免疫组织化学辅助综合分析。肿瘤细胞呈子宫内膜间质样分化、有丰富的螺旋样小血管在其周围呈同心圆样排列、浸润性生长、可见浸润脉管是LGESS主要的诊断依据,CD10、ER、PR是特异性较强的抗体,可作为LGESS鉴别诊断的重要标志物。
[1]惠延平,郭双平,王映梅,等.子宫外子宫内膜间质肉瘤1例病理分析及文献复习[J].第四军医大学学报,2004,25(15):1424-1425.
[2]梁莉,丁彦青.子宫外子宫内膜间质肉瘤2例临床病理观察[J].诊断病理学杂志,2010,17(5):339-342.
[3]汪勤,刘辉,赵彩霞,等.低度恶性子宫内膜间质肉瘤7例临床病理分析[J].临床与实验病理学杂志,2014,30(5):558-560.
[4]史景丽,成宁海,郭丽娜,等.子宫内膜间质肉瘤55例临床病理特点和预后分析[J].中华病理学杂志,2011,40(8):517-522.
[5]马亚琪,王昀,刘爱军.WHO(2014)子宫体、宫颈肿瘤和滋养细胞疾病组织学分类[J].诊断病理学杂志,2014,21(9):596-597.
[6]He L,Li JD,Xiong Y,et al.Clinicopathological and molecular markers associated with prognosis and treatment effectiveness of endomentrial sarcoma:a retrospective study in China[J].Arch Gynecol Obstet,2014,289(2):383-391.
[7]Fukunaga M,Ishihara A,Ushigome S.Extrauterine low-grade endometrial stromal sarcoma:report of three cases[J].Pathol Int,1998,48(4):297-302.
[8]丁彩霞,黄颖楠,张娟,等.子宫外子宫内膜间质肉瘤4例临床病理分析[J].现代肿瘤医学,2013,21(10):2309-2313.
[9]顾芸,张新华,石群立,等.子宫内膜间质肿瘤35例临床病理分析[J].临床与实验病理学杂志,2008,24(2):166-169,173.
[10]Baker P,Oliva E.Endomettrial stromal tumours of the uterus:a practical approach using conventional morphology and ancillary technique[J].J Clin Pathol,2007,60(3):235-243.
[11]沈丹华,陈定宝.解读第4版WHO女性生殖器官肿瘤分类中的变化[J].中华妇产科杂志,2014,49(9):717-720.
[12]Loddenkemper C,Foss HD,Dallenbach FE,et al.Recent advances in the histopathology of stromal tumors of the endometrium[J].Curr Diagn Pathol,2005,11(2):125-132.
[13]都吉雅,郭彦.类似于卵巢性索肿瘤的子宫肿瘤的临床病理观察[J].诊断病理学杂志,2014,21(9):553-556.
[14]Mizuno M,Yatabe Y,Nawa A,et al.Long-term medroxyproges-terone acetate therapy for low-grade endometrial stromal sarcoma[J].Int J Clin Oncol,2012,17(4):348-354.
