伊马替尼联合化疗序贯异基因造血干细胞移植治疗费城染色体阳性急性淋巴细胞白血病疗效的Meta分析
2016-12-07杨玉婷谭晓虹岑洪
杨玉婷 谭晓虹 岑洪
费城染色体阳性的急性淋巴细胞白血病(Philadelphia chromosome+acute lymphoblastic leukemia,Ph+ALL)是一组预后较差的疾病,约占成人ALL的25%,占儿童ALL的3%左右[1]。伊马替尼应用以前,联合化疗后的复发率接近100%,5年持续完全缓解率及总生存率约为8%及11%[2,3],而异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,allo-HSCT)则是有效治疗Ph+ALL的手段,特别是在首次完全缓解状态下进行的allo-HSCT,可使患者3年总生存率提高到30%~40%[4]。但allo-HSCT后的复发率及移植相关死亡率均较高,加之部分患者因年龄大、无合适供者及移植费用高等原因而无法进行allo-HSCT[5]。对伊马替尼诱导治疗联合allo-HSCT,还是只依靠伊马替尼联合化疗仍是一个值得探讨的课题,且国内外未有相关系统评价的报道。因此,本研究采用系统评价方法检索相关文献,并进行Meta分析,旨在为其临床应用提供循证医学证据。
1 资料与方法
1.1 文献纳入与排除标准
1.1.1 研究类型 随机对照试验、临床对照试验、队列研究。文种限中文、英文。
1.1.2 研究对象 Ph+ALL患者。
1.1.3 干预措施 ⑴试验组(移植组):伊马替尼联合化疗序贯allo-HSCT;⑵对照组(非移植组):伊马替尼联合化疗。
1.1.4 观察指标 主要为无瘤生存率(disease free survival,DFS)和总生存率(overall survival,OS),其次为死亡事件。
1.2 检索策略
计算机检索 PubMed、CBM、CNKI、Embase、Cochrane图书馆、Google学术搜索。对中华血液学杂志进行手工检索,并查阅相关学术会议及报刊文献。检索日期为建库至2015年8月。联合主题词与关键词进行检索。中文检索词包括伊马替尼、造血干细胞移植、费城染色体和急性淋巴细胞白血病。英文检索词为“imatinib”“hematopoietic stem cell transplantation”“philadelphia chromosome”“acute lymphoblastic leukemia”。
1.3 文献筛选与质量评价
由两名评价员独立检索和筛选文献、提取相关数据,意见未统一时进行讨论并与第三者协商解决。纳入的队列研究使用纽卡斯尔-渥太华量表(The Newcastle Ottawa Scale,NOS)提供的队列研究质量评价标准[6]进行评定,满分为9分。
1.4 资料提取
使用统一的数据提取表格,两名评价员独立提取资料,若意见不同则通过讨论或由第三方协商解决。提取的信息包括第一作者、发表年份、国家、样本量、年龄、随访时间、干预措施、结局指标及方法学等内容。
1.5 统计学分析
采用Cochrane协作网提供的RevMan 5.2软件进行统计分析。时间-事件变量(无病生存率、总生存率)采用风险比(hazard,ratio,HR)、二分类变量(死亡事件)采用相对危险度(risk ratio,RR)绘制森林图。HR从各研究报道的Kaplan-Meier(K-M)生存曲线上提取[7]。以P<0.05为差异有统计学意义。采用χ2检验对各研究结果进行异质性检验,若P>0.1,I2<50%,可认为多个同类研究不存在明显异质性,使用固定效应模型进行分析。如果P<0.1,I2≥50%,则研究间存在明显异质性,使用随机效应模型计算。根据临床判断,对可能影响结果的重要因素进行亚组分析。为了评价发表偏倚,使用“倒漏斗图”(funnel plot)进行评估,若图形呈对称的倒漏斗状,则不存在偏倚。若存在临床异质性,行亚组分析。此外,根据文章质量进行敏感性分析[8]。
2 结果
2.1 文献检索结果
检索中文、英文共401篇文献,通过阅读文题和摘要进行初筛,剔除重复的记录、不相关、设计不符合、综述类及会议摘要共381篇,剩余20篇供复筛。阅读全文后,排除不符合纳入标准8篇(1篇研究对象不符合,2篇文献数据重复,5篇无可用的结局数据)。最终12 篇[9~20]研究纳入评价,其中英文 8 篇[9~13,16,19,20],中文 4 篇[14,15,17,18]。
2.2 纳入研究的特点
纳入的12篇研究共620例初治Ph+ALL患者,其中移植组344例,非移植组276例。其中10个研
究[9~11,13~19]纳入成年患者,其余 2 个研究[12,20]纳入儿童患者。伊马替尼的剂量为340~600 mg/d。绝大多数患者在完全缓解(CR)期行allo-HSCT,绝大部分供体为全相合供体,少部分为单倍体或其他类型供体。有7 个研究[9,11,12,15,18~20]报道了 DFS 或 OS 的 K-M 生存曲线,10 个研究[9~11,13~18,20]报道了死亡事件。纳入研究的基本特征见表1。
2.3 纳入研究的质量评价
在研究设计类型上,由于检索到的原文有限,纳入的研究均为非随机对照试验,包括1篇[10]临床对照试验(CCTs)、7 篇[11,13~15,17,18,20]回顾性队列研究及 4篇[9,12,16,19]前瞻性队列研究。通过 NOS 评分标准评定,所有研究评分均不低于6分。纳入研究的质量评价见表2。
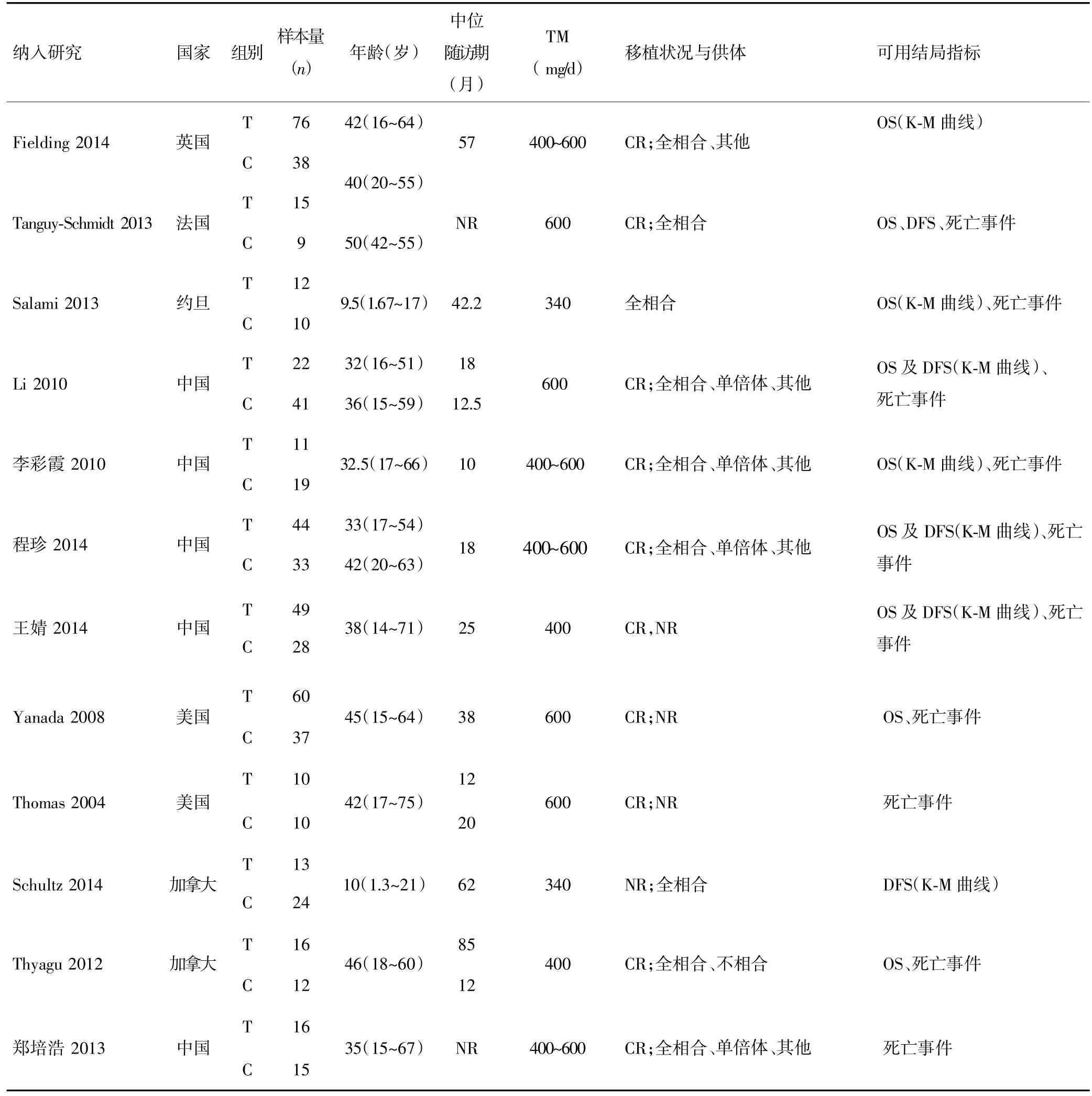
表1 纳入研究的基本特征
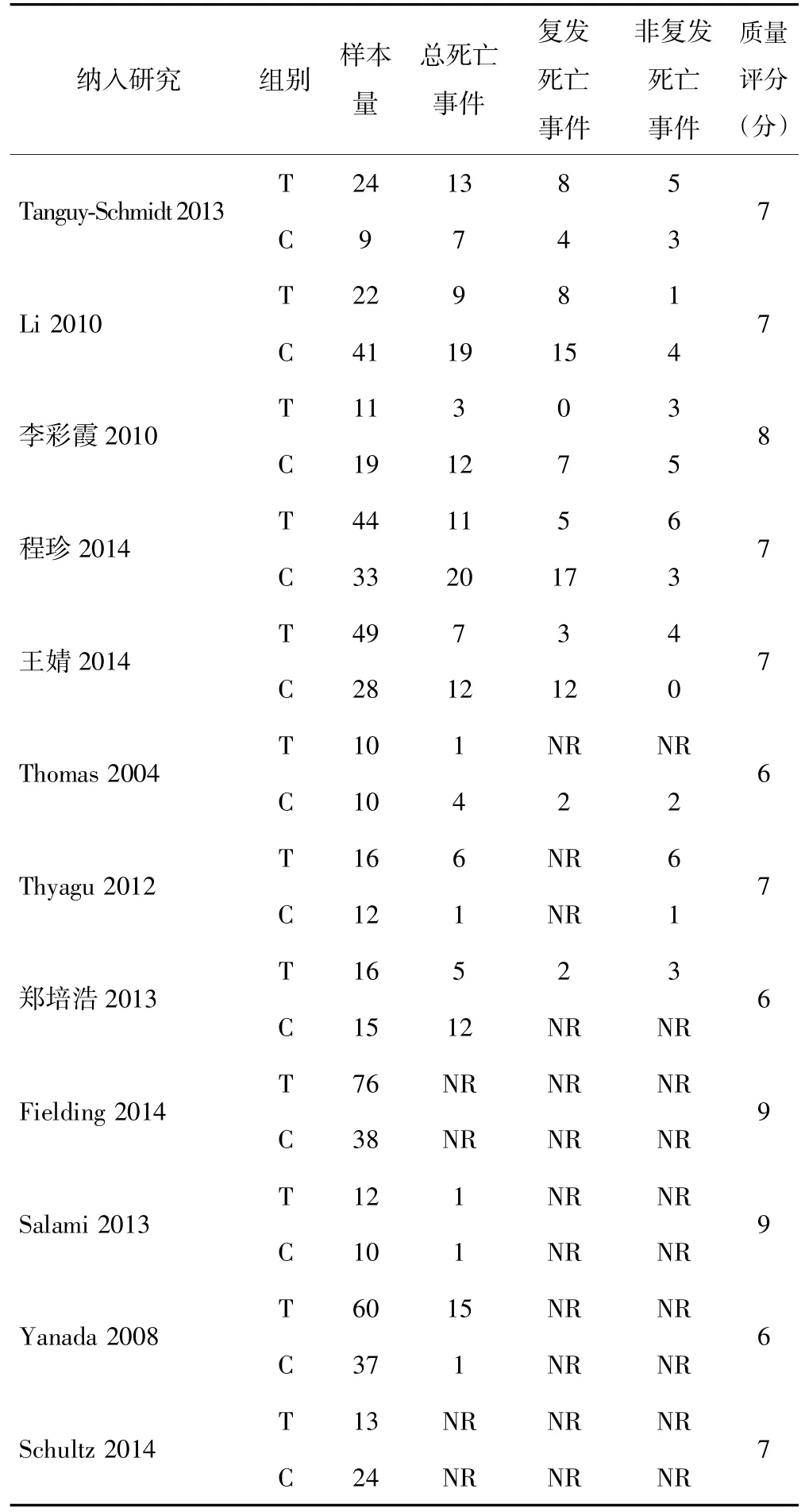
表2 死亡事件及纳入研究的质量评价(n)
2.4 Meta分析结果
2.4.1 无瘤生存率 共6篇文献(310例患者)报道了关于DFS的K-M生存曲线。经异质性检验,各研究间无明显异质性(I2=22%,P=0.27),故选用固定效应模型。结果显示移植组的DFS优于非移植组,差异具有统计学意义(HR=0.48,95%CI:0.31~0.74,P<0.001)。见图1。
2.4.2 总生存率 共7篇文献(407例患者)报道了关于OS的K-M生存曲线。经异质性检验,各研究间无明显异质性(I2=19%,P=0.28),故选用固定效应模型。结果显示移植组的OS优于非移植组,差异具有统计学意义(HR=0.49,95%CI:0.35-0.68,P<0.001)。见图 2。
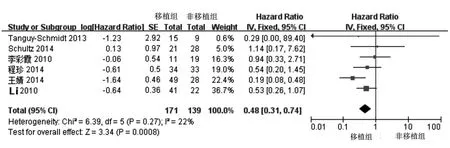
图1 移植组和非移植组Ph+ALL患者无瘤生存率的情况
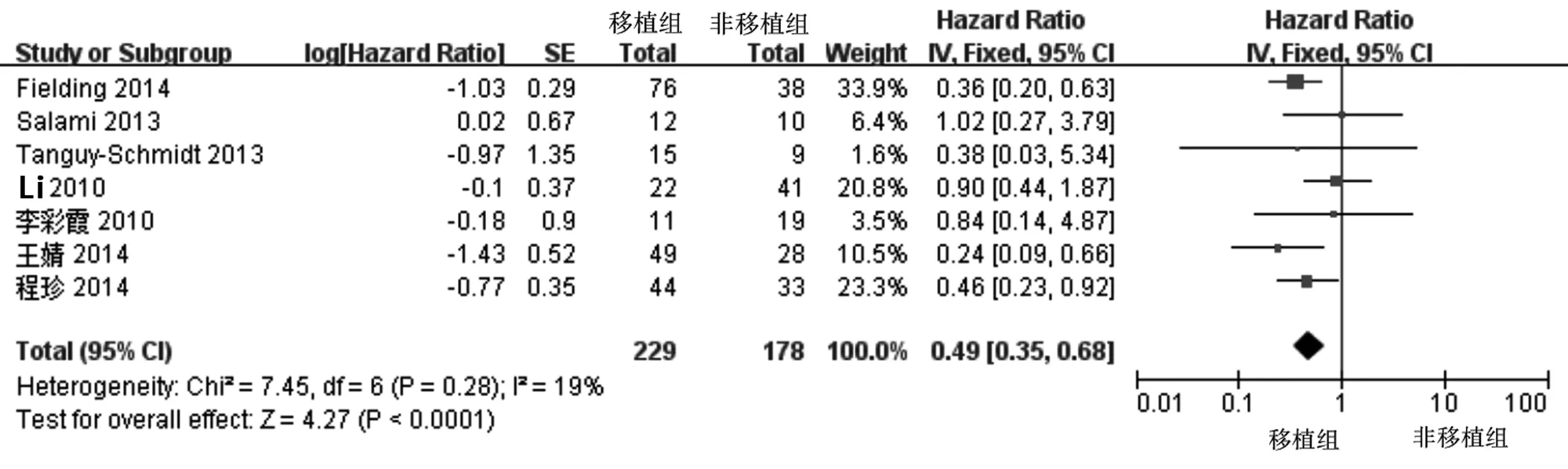
图2 移植组和非移植组Ph+ALL患者总生存率的情况
2.4.3 死亡事件 共10篇文献(478例患者)报道了死亡事件,其中移植组264例患者中71例死亡,非移植组214例患者中89例死亡。经异质性检验,各研究间存在较明显异质性(I2=55%,P=0.02),故选用随机效应模型。结果显示移植组与非移植组发生死亡事件的差异具有统计学意义,移植组少于非移植组(RR=0.62,95%CI:0.39~0.97,P=0.04)(图 3)。根据是否复发,分为复发死亡及非复发死亡两个亚组;根据随访时间长短,分为随访时间<5年及随访时间≥5年两个亚组。其中5个研究报道了复发死亡事件,6个研究报道了非复发死亡事件。结果显示移植组与非移植组发生复发死亡事件的差异具有统计学意义,(RR=0.38,95%CI:0.15~0.92,P=0.03),而发生非复发死亡事件的差异无统计学意义(RR=1.15,95%CI:0.61~2.16,P=0.66);尽管两者差异无统计学意义,但亚组的森林图显示移植组在随访时间<5年(RR=0.73,95%CI:0.45~1.19,P=0.2)及随访时间≥5年(RR=0.57,95%CI:0.26~1.28,P=0.17)的死亡事件少于非移植组。
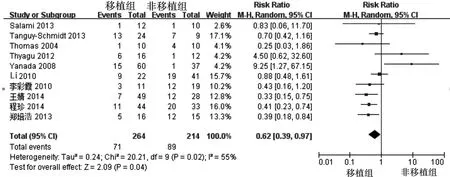
图3 移植组和非移植组Ph+ALL患者总死亡事件的情况
2.4.4 文献发表偏倚 分别对总生存率及死亡事件纳入的研究进行发表偏倚检验,结果总生存率Begg′s检验P=0.851,总死亡事件 Begg′s检验P=0.176,提示均无明显发表偏倚。
2.4.5 敏感性分析 因死亡事件分析结果存在较明显统计学异质性(I2=55%),故对其进行敏感性分析。将纳入的研究依次排除后,发现排除Yanada等[21]的研究后,I2由55%降为31%,总效应值由RR=0.62,95%CI:0.39 ~0.97,P=0.04 变 为RR=0.55,95%CI:0.39~0.78,P<0.001。提示剔除该研究对整体结果无明显影响。
3 讨论
Ph+ALL是ALL中预后不良的类型[22]。费城染色体是由22号染色体上的BcR基因易位到9号染色体的ABL基因而形成,其产生的具有酪氨酸激酶活性的蛋白质是影响ALL预后的关键。伊马替尼是一种高选择性BcR-ABL酪氨酸激酶抑制剂,治疗Ph+ALL可取得较好的血液学及遗传学缓解率[23],根据美国癌症综合网(NCCN)治疗指南及国内专家共识,伊马替尼已被纳入Ph+ALL患者的一线治疗方案[24],但伊马替尼耐药问题也日益凸显,从而减弱了其部分疗效[23]。近年来伊马替尼序贯allo-HSCT治疗明显提高了患者DFS和OS,认为免疫表型、染色体核型及分子遗传学不再是影响Ph+ALL的预后因素[25],主张尽早行allo-HSCT联合伊马替尼治疗[15];但allo-HSCT治疗后复发及移植相关死亡率较高[1],并且受患者年龄、共存疾病、经济情况、医疗条件及有无供体等诸多因素的影响,因此其在临床应用受到较大限制,allo-HSCT和伊马替尼的治疗地位亦受到争议。
本研究共纳入12篇研究,Meta分析结果显示,与非移植组比较,移植组治疗后提高了患者DFS及OS,减少了死亡事件,表明在伊马替尼联合化疗治疗Ph+ALL患者的基础上,序贯allo-HSCT优于无allo-HSCT方案。分析其原因可能为:⑴伊马替尼联合化疗提高了缓解率及延长缓解时间,为allo-HSCT创造了更多机会,同时降低肿瘤负荷,减少移植后复发,因而提高移植成功率[26],而本研究纳入的文献中,很大部分患者可接受全相合供体,且行allo-HSCT时处于CR期;尽管较高的移植相关死亡率会抵消一部分allo-HSCT的生存优势[27],但其整体长期生存率仍高于非移植组;⑵移植组DFS优于非移植组,可转化为生存获益;⑶尽管移植组与非移植组发生的非复发死亡事件无差别,但移植组发生的复发死亡事件较少,总死亡事件发生数亦少于非移植组,亦可转化为长期生存获益;⑷一部分年龄大、具有共存疾病的患者往往不能使用移植方案而被分到非移植组,这些患者较容易发生不良事件,从而影响疾病的预后。
在Oliansky等[28]的研究中,仅仅描述了几篇关于伊马替尼与allo-HSCT疗效比较的研究,由于纳入的文献少,可用数据分散,该综述并没有对此作出明确的结论。此外,两个相关的重要研究(GIMEMA、NCT00327678)正在进行中,我们期待提供更多有效的数据以利临床决策。
本系统评价存在一定局限:⑴关于伊马替与allo-HSCT疗效比较的原始研究较少,检索到的文献有限,纳入的研究无随机对照试验,方法学质量较低,证据级别亦低,其结论可能存在选择、实施或测量偏倚;⑵一些未发表的灰色文献未被检索到,纳入的研究仅为中文或英文,缺乏其他语种的文献,也可能造成偏倚;⑶各研究间化疗方案及疗程、伊马替尼使用的剂量及疗程、移植前的预处理、移植时的疾病状态及供体类型等都存在不同程度的差异,均可对结果造成一定影响,加之纳入研究较少,数据分散,故没有分亚组进一步分析。因此,在今后的研究中应注意:⑴设计前瞻性、多中心、大样本的随机对照试验;⑵增大样本量;⑶延长随访时间,报道更多重要结局;⑷进一步探讨伊马替尼治疗Ph+ALL的最佳剂量及疗程;⑸进一步探讨减少移植后复发及移植相关死亡的治疗方案;⑹进一步探讨第二代酪氨酸抑制剂与异基因移植治疗Ph+ALL的疗效。以上有关方面值得深入研究。
[1]Ottmann OG,Pfeifer H.Management of Philadelphia chromosomepositive acute lymphoblastic leukemia(Ph+ALL)[J].Hematology Am Soc Hematol Educ Program,2009,25(3):371-381.
[2]Faderl S,Jeha S,Kantarjian HM.The biology and therapy of adult acute lymphoblastic leukemia[J].Cancer,2003,98(7):1337-1354.
[3]Wetzler M,Dodge RK,Mrózek K,et al.Prospective karyotype analysis in adult acute lymphoblastic leukemia:the cancer and leukemia Group B experience[J].Blood,1999,93(11):3983-3993.
[4]Mizuta S,Matsuo K,Yagasaki F,et al.Pre-transplant imatinib-based therapy improves the outcome of allogeneic hematopoietic stem cell transplantation for BCR-ABL-positive acute lymphoblastic leukemia[J].Leukemia,2011,25(1):41-47.
[5]Stock W.Current treatment options for adult patients with Philadelphia chromosome-positive acute lymphoblastic leukemia[J].Leuk Lymphoma,2010,51(2):188-198.
[6]曾宪涛,刘慧,陈曦,等.Meta分析系列之四:观察性研究的质量评价工具[J].中国循证心血管医学杂志,2012,4(4):297-299.
[7]Parmar MK,Torri V,Stewart L.Extracting summary statistics to perform meta-analyses of the published literature for survival endpoints[J].Stat Med,1998,17(24):2815-2834.
[8]Zhong JH,Li LQ.Postoperative adjuvant transarterial chemoembolization for participants with hepatocellular carcinoma:a meta-analysis[J].Heptol Res,2010,40(10):943-953.
[9]Tanguy-Schmidt A,Rousselot P,Chalandon Y,et al.Long-term followup of the imatinib GRAAPH-2003 study in newly diagnosed patients with de novo Philadelphia chromosome-positive acute lymphoblastic leukemia:a GRAALL study[J].Biol Blood Marrow Transplant,2013,19(1):150-155.
[10]Thomas DA,Faderl S,Cortes J,et al.Treatment of Philadelphia chromosome-positive acute lymphocytic leukemia with hyper-CVAD and imatinib mesylate[J].Blood,2004,103(12):4396-4407.
[11]Li Y,Zou D,Zhao Y,et al.Clinical characteristics and outcomes of adults with Philadelphia chromosome positive and/or bcrabl positive acute lymphoblastic leukemia:a single center study from China[J].Leuk Lymphoma,2010,51(3):488-496.
[12]Schultz KR,Carroll A,Heerema NA,et al.Long-term follow-up of imatinib in pediatric Philadelphia chromosome-positive acute lymphoblastic leukemia:Children's Oncology Group Study AALL0031[J].Leukemia,2014,28(7):1467-1471.
[13]Thyagu S,Minden MD,Gupta V,et al.Treatment of Philadelphia chromosome-positive acute lymphoblastic leukaemia with imatinib combined with a paediatric-based protocol[J].Br J Haematol,2012,158(4):506-514.
[14]程珍,赵澜,陈广华,等.伊马替尼联合化疗或异基因造血干细胞移植治疗成人Ph染色体阳性急性淋巴细胞白血病的临床研究[J].中华血液学杂志,2014,35(2):114-119.
[15]王婧,黄晓军,江滨,等.伊马替尼联合化疗治疗Ph染色体阳性急性淋巴细胞白血病的分子学疗效与预后因素分析[J].中华血液学杂志,2014,35(2):120-125.
[16]Yanada M,Sugiura I,Takeuchi J,et al.Prospective monitoring of BCR-ABL1 transcript levels in patients with Philadelphia chromosome-positive acute lymphoblastic leukaemia undergoing imatinibcombined chemotherapy[J].Br J Haematol,2008,143(4):503-510.
[17]郑培浩,刘毅.伊马替尼联合化疗治疗成人费城染色体阳性急性淋巴细胞白血病 46 例临床分析[J].临床军医杂志,2013,41(1):37-39.
[18]李彩霞,吴德沛,刘红,等.伊马替尼治疗Ph+急性淋巴细胞白血病的临床研究[J].中华血液学杂志,2010,31(3):181-185.
[19]Fielding AK,Rowe JM,Buck G,et al.UKALLXII/ECOG2993:addition of imatinib to a standard treatment regimen enhances long-term outcomes in Philadelphia positive acute lymphoblastic leukemia[J].Blood,2014,123(6):843-850.
[20]Salami K,Alkayed K,Halalsheh H,et al.Hematopoietic stem cell transplant versus chemotherapy plus tyrosine kinase inhibitor in the treatment of pediatric Philadelphia chromosome-positive acute lymphoblastic leukemia(ALL)[J].Hematol/Oncol Stem Cell Ther,2013,6(1):34-41.
[21]Yanada M,Takeuchi J,Sugiura I,et al.High complete remission rate and promising outcome by combination of imatinib and chemotherapy for newly diagnosed BCR-ABL-positive acute lymphoblastic leukemia:a phase II study by the Japan Adult Leukemia Study Group[J].J Clin Oncol,2006,24(3):460-466.
[22]Dombret H,Gabert J,Boiron JM,et al.Outcome of treatment in adults with Philadelphia chromosome-positive acute lymphoblastic leukemia--results of the prospective multicenter LALA-94 trial[J].Blood,2002,100(7):2357-2366.
[23]朱雨,潘良琴,钱思轩,等.达沙替尼治疗伊马替尼耐药的BCR/ABL阳性白血病的临床研究[J].中国实验血液学杂志,2013,21(3):581-586.
[24]中华医学会血液学分会,中国抗癌协会血液肿瘤专业委员会.中国成人急性淋巴细胞白血病诊断与治疗专家共识[J].中华血液学杂志,2012,33(9):789-792.
[25]Jaso J,Thomas DA,Cunningham K,et al.Prognostic significance of immunophenotypic and karyotypic features of Philadelphia positive B-lymphoblastic leukemia in the era of tyrosine kinase inhibitors[J].Cancer,2011,117(17):4009-4017.
[26]孙运艳,张学美,史明霞,等.Ph+成人急性淋巴细胞白血病治疗进展[J].生物医学工程与临床,2013,17(4):406-410.
[27]Fielding AK,Rowe JM,Richards SM,et al.Prospective outcome data on 267 unselected adult patients with Philadelphia chromosome-positive acute lymphoblastic leukemia confirms superiority of allogeneic transplantation over chemotherapy in the pre-imatinib era:results from the International ALL Trial MRC UKALLXII/ECOG2993[J].Blood,2009,113(19):4489-4496.
[28]Oliansky DM,Larson RA,Weisdorf D,et al.The role of cytotoxic therapy with hematopoietic stem cell transplantation in the treatment of adult acute lymphoblastic leukemia:update of the 2006 evidencebased review[J].Biol Blood Marrow Transplant,2012,18(1):18-36.
