三种双酰胺类杀虫剂制剂对大型溞生长发育和繁殖的影响
2016-12-06林涛游泳林荣华史梦竹李建宇赵建伟陈艺欣傅建炜魏辉
林涛,游泳,林荣华,史梦竹,李建宇,赵建伟,陈艺欣,傅建炜,#,魏辉,*
1.福建省农业科学院植物保护研究所,福州350013
2.农业部农药检定所,北京100125
三种双酰胺类杀虫剂制剂对大型溞生长发育和繁殖的影响
林涛1,游泳1,林荣华2,史梦竹1,李建宇1,赵建伟1,陈艺欣1,傅建炜1,#,魏辉1,*
1.福建省农业科学院植物保护研究所,福州350013
2.农业部农药检定所,北京100125
为探索双酰胺类杀虫剂对大型溞的慢性毒性,本文采用氟虫双酰胺、氯虫苯甲酰胺和溴氰虫酰胺3种双酰胺类杀虫剂制剂,测定其对大型溞生长发育和繁殖的影响,明确其对大型溞的慢性毒性以及大型溞对该类杀虫剂敏感的端点指标。结果表明,氟虫双酰胺、氯虫苯甲酰胺和溴氰虫酰胺3种制剂对大型溞的寿命、体长、蜕皮数、首胎时长、产胎数、单雌产溞数等端点指标具有不同程度的影响。3种杀虫剂显著减少大型溞蜕皮数的最低浓度分别为1.00×10-2mg·L-1、1.00×10-4mg·L-1、1.25× 10-3mg·L-1;显著缩短寿命的最低浓度分别为5.00×10-3mg·L-1、1.00×10-4mg·L-1和1.25×10-3mg·L-1;显著缩短体长的最低浓度分别为5.00×10-3mg·L-1、8.00×10-4mg·L-1和1.00×10-2mg·L-1;显著减少产胎数的最低浓度分别为1.00×10-2mg·L-1、4.00× 10-4mg·L-1和1.00×10-2mg·L-1;显著减少单雌产溞数的最低浓度分别为1.00×10-2mg·L-1、8.00×10-4mg·L-1和5.00×10-3mg·L-1;但是,除溴氰虫酰胺外,其他2种杀虫剂制剂对首胎时长却没有显著影响。端点指标中对氟虫双酰胺的敏感性为寿命和体长>蜕皮数、产胎数和单雌产溞数>首胎时长;对氯虫苯甲酰胺为蜕皮数和寿命>产胎数>体长和单雌产溞数>首胎时长;对溴氰虫酰胺为蜕皮数和寿命>单雌产溞数>体长、首胎时长和产胎数。研究结果说明,3种双酰胺类杀虫剂对大型溞的生长发育和繁殖具有不同程度的抑制作用,寿命是评价该类杀虫剂制剂对大型溞慢性毒性的最敏感端点指标。
双酰胺类;氟虫双酰胺;氯虫苯甲酰胺;溴氰虫酰胺;大型溞;生长发育;繁殖
双酰胺类杀虫剂(diamide insecticides)是一类新型广谱杀虫剂。该类杀虫剂以鱼尼丁受体(ryanodine receptors)为作用靶标,通过激活受体上钙通道引起胞内Ca2+大量释放,导致昆虫因肌肉收缩、麻痹而死亡[1-2]。目前,该类杀虫剂已上市应用的制剂主要有20%氟虫双酰胺水分散粒剂、200 g·L-1氯虫苯甲酰胺悬浮剂和200 g·L-1溴氰虫酰胺悬浮剂等3种。该类杀虫剂制剂不仅能够防治鳞翅目幼虫,同时还能兼防蚜虫类、叶蝉类、飞虱类以及部分鞘翅目和双翅目害虫[2],已被广泛应用于防治水稻和蔬菜害虫[3-4]。然而,随着应用范围的不断扩大,双酰胺类杀虫剂对天敌昆虫[5]、资源昆虫[6]和捕食性螨类[7]的毒性风险逐步暴露。但是,该类杀虫剂对水生生物的慢性毒性却鲜有报道[8-9],尤其是对水生浮游动物慢性毒性的研究尚无报道。因此,研究水体残留的双酰胺类杀虫剂对水生浮游动物生长发育和繁殖的影响,对于该类杀虫剂的安全应用具有重要的意义。
溞类是甲壳纲的枝角类浮游动物,以藻类为食,同时又是鱼类和无脊椎捕食动物的天然饵料,是水生生态系统中物质循环和能量流动的重要环节[10]。而大型溞(Daphnia magna)作为该类群的代表物种,广泛分布于池塘、江河、稻田等水体环境中。由于其体型小、生活史短、繁殖快、对有毒物质敏感和易于培养等特点[11],成为世界各国化学品毒理学研究普遍应用的标准实验动物,被广泛应用于农业、环境、生态、医学等领域的研究[10,12-13]。
本研究以大型溞为对象,采用寿命、体长、蜕皮数、首胎时长、产胎数、产溞数等端点指标测定氟虫双酰胺、氯虫苯甲酰胺和溴氰虫酰胺3种商品制剂对大型溞生长发育和繁殖的影响,明确大型溞对该类杀虫剂敏感的端点指标,为评价该类杀虫剂对大型溞的慢性毒性和指导田间用药提供参考依据。
1 材料与方法(Materials and methods)
1.1 大型溞的来源与培养
溞种最初购自中国科学院武汉水生生物研究所,后在实验室内采用曝气(24 h以上)自来水作为培养基单性保种培养3 y以上,培养基水质硬度控制在140~250mg·L-1之间(以CaCO3计),pH在6.0~8.5之间,溶解氧保持在5.8mg·L-1以上,每周换水3次。保种培养水温为(20±2)℃,光周期L:D为16 h:8 h。每天投喂浓度为5×105个·mL-1的斜生栅藻(Scenedesmus obliquus)藻液5~10 mL。
在试验开始的前6个月,从保种种群中转移出若干母溞单独培养,并由曝气自来水培养逐渐过渡替换为用Elendt M7培养基培养[14],以此作为试验种群。从试验种群中转移30只同步发育的幼溞到1 L烧杯中,每天投喂斜生栅藻(浓度同上),取其在6~24 h内产下的幼溞(第三胎以后的幼溞)供试。试验种群在人工气候箱中培养,温度为(20±1)℃,光周期L:D为16 h:8 h。
1.2 试验药剂
试验选用20%氟虫双酰胺水分散粒剂(flubendiamide WG,日本农药株式会社),200 g·L-1氯虫苯甲酰胺悬浮剂(chlorantraniliprole SC,美国杜邦公司),200 g·L-1溴氰虫酰胺悬浮剂(cyantraniliprole SC,美国杜邦公司)3种制剂,本文中对此3种制剂的叙述如无特别指出,则均分别简称为氟虫双酰胺、氯虫苯甲酰胺和溴氰虫酰胺。各药剂试验药液的储备液直接用Elendt M7培养基溶解配制,再按试验浓度逐级稀释,现配现用。
1.3 试验方法
基于前期急性毒性试验结果[14],每种杀虫剂制剂各设置5个处理浓度,其中氟虫双酰胺为6.25× 10-4mg·L-1、1.25×10-3mg·L-1、2.50×10-3mg·L-1、5. 00×10-3mg·L-1、1.00×10-2mg·L-1;氯虫苯甲酰胺为1.00×10-4mg·L-1、2.00×10-4mg·L-1、4.00×10-4mg·L-1、8.00×10-4mg·L-1、1.60×10-3mg·L-1;溴氰虫酰胺为6.25×10-4mg·L-1、1.25×10-3mg·L-1、2.50×10-3mg·L-1、5.00×10-3mg·L-1、1.00×10-2mg·L-1,并设置一个无药剂空白对照,每个处理浓度设置15个重复。大型溞毒性试验方法采用半静态法[15],并作出部分调整,即在100 mL的烧杯中加入配制好的药液50 mL,以斜生栅藻(浓度为5×105个·mL-1)作为食物,然后转移一只上述6~24 h内的雌性幼溞到烧杯中,每天定时更换1次药液并记录当天试验溞的蜕皮数、产幼溞数、产胎数和死亡情况。在试验开始后的第21天测量试验溞的体长(未到21 d即死亡的个体测量死亡当天溞个体体长),体长指从大型溞溞体头部到尾刺的长度[16]。试验条件温度(20±1)℃,光周期L:D=16 h:8 h,连续培养21 d。
1.4 数据统计和分析
实验数据采用Excel 2007和SPSS 19.0软件进行统计分析,采用单因素方差分析(one-way ANOVA)比较不同杀虫剂暴露浓度中大型溞蜕皮数、首胎时长、平均单雌产幼溞数、产胎数、寿命、体长等端点指标的均值差异,各端点值均为不同处理的所有大型溞个体的平均值。运用生存分析中的Kaplan-Meier分析各浓度组与空白对照组之间大型溞存活时间的差异显著性[17]。
2 结果(Results)
2.1 20%氟虫双酰胺水分散粒剂对大型溞生长发育和繁殖的影响
从表1可以看出,不同浓度的氟虫双酰胺对大型溞的蜕皮数、寿命、体长和产胎数存在显著影响(P<0.05)。随着浓度升高,大型溞蜕皮数、寿命、体长、产胎数和单雌产溞数呈减少(缩短)趋势。试验测试的5个浓度对大型溞首胎时长并没有显著影响,但当浓度达到5.00×10-3mg·L-1时,大型溞的体长显著缩短,低于2.50×10-3mg·L-1则无显著影响;浓度达到1.00×10-2mg·L-1时,大型溞的蜕皮数、产胎数和单雌产溞数均显著减少,寿命显著缩短,低于5.00× 10-3mg·L-1则无显著影响。不同浓度氟虫双酰胺暴露下大型溞的存活时间显著短于对照组(P<0.05),随着浓度升高,其存活率逐渐下降;同时,繁殖时间也没有明显缩短,繁殖率无明显的高峰值,但波动幅度较大,日均后代数量不稳定(图1)。
2.2 200 g·L-1氯虫苯甲酰胺悬浮剂对大型溞生长发育和繁殖的影响
从表2可以看出,不同浓度的氯虫苯甲酰胺对大型溞的蜕皮数、寿命、体长和产胎数存在显著影响(P<0.05)。试验测试的5个浓度对大型溞首胎时长并没有显著影响,但对蜕皮数和寿命却均有显著影响。当浓度达到4.00×10-4mg·L-1时,大型溞的产胎数显著减少,低于2.00×10-4mg·L-1则无显著影响;当浓度达到8.00×10-4mg·L-1时,大型溞的体长显著缩短,单雌产溞数显著减少,低于4.00×10-4mg·L-1则无显著影响。不同浓度氯虫苯甲酰胺暴露下大型溞的存活时间显著短于对照组(P<0.05),随着浓度升高,其存活率逐渐下降;同时,其繁殖率无明显的高峰值,但繁殖时间却逐渐缩短(图1)。
2.3 200 g·L-1溴氰虫酰胺悬浮剂对大型溞生长发育和繁殖的影响
从表3可以看出,不同浓度的溴氰虫酰胺对大型溞的蜕皮数、寿命、体长、首胎时长和单雌产溞数存在显著影响(P<0.05)。当浓度达到1.25× 10-3mg·L-1时,大型溞的蜕皮数显著减少,寿命显著缩短,低于6.25×10-4mg·L-1则无显著影响;当浓度达到5.00×10-3mg·L-1时,大型溞的单雌产溞数显著减少,低于2.50×10-3mg·L-1则无显著影响;当浓度达到1.00×10-2mg·L-1时,大型溞的体长和首胎时长显著缩短,产胎数显著减少,低于5.00×10-3mg·L-1则无显著影响。不同浓度溴氰虫酰胺暴露下大型溞的存活时间显著短于对照组(P<0.05),且随着浓度升高,其存活率逐渐下降;同时,其繁殖率无明显的高峰值,但繁殖时间却逐渐缩短(图1)。
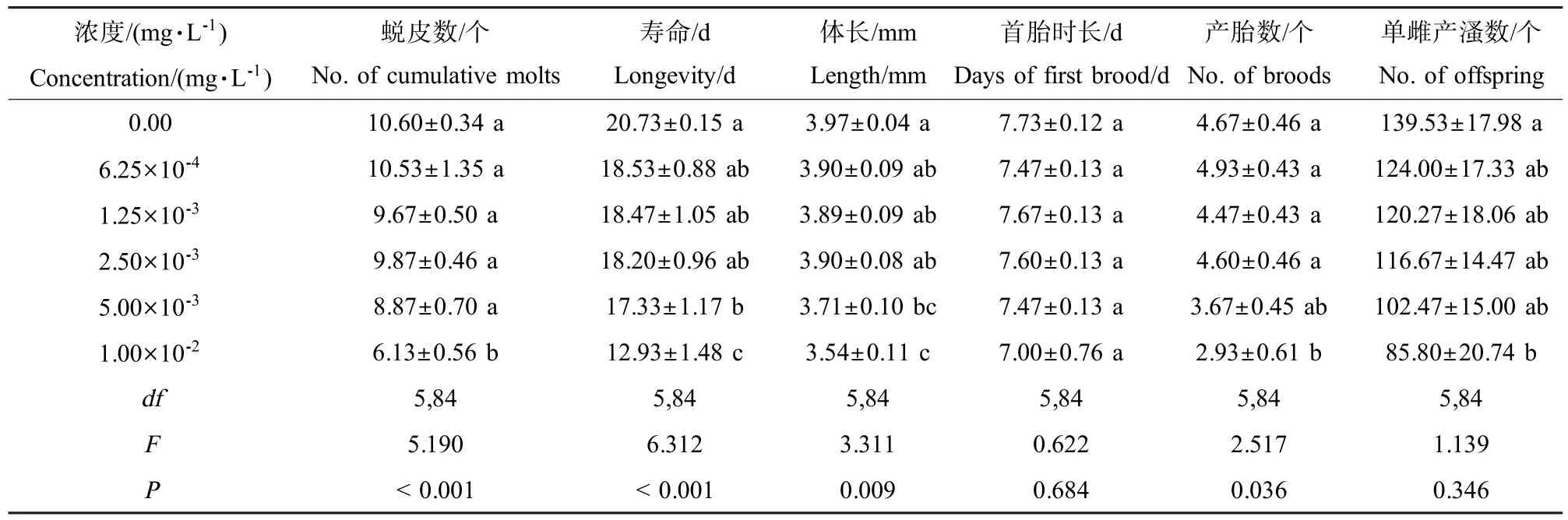
表1 20%氟虫双酰胺水分散粒剂对大型溞生长发育和繁殖的影响Table 1 Development and fecundity ofD.magnaexposed to 20%flubendiamide WG in a 21-day life study

表2 200g·L-1氯虫苯甲酰胺悬浮剂对大型溞生长发育和繁殖的影响Table 2 Development and fecundity ofD.magnaexposed to 200 g·L-1chlorantraniliprole SC in a 21-day life study
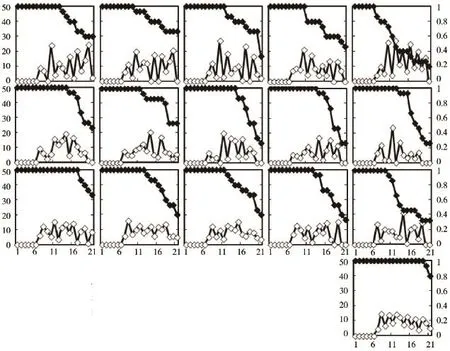
图1 不同浓度杀虫剂制剂暴露条件下大型溞的特定存活率和繁殖率注:第一、二、三、四行分别为20%氟虫双酰胺水分散粒剂、200 g·L-1氯虫苯甲酰胺悬浮剂、200 g·L-1溴氰虫酰胺悬浮剂和空白对照。Fig.1 Age-specific survivorship and fecundity ofD.magnaexposed to the different concentration of insecticide preparationsNote:Different row represent 20%flubendiamide WG,200 g·L-1chlorantraniliprole SC,200 g·L-1cyantraniliprole SC and blank control from top to bottom,respectively.
3 讨论(Discussion)
蜕皮数、体长和产溞数等是目前国际上常用的监测与评价大型溞慢性毒性的主要端点指标。本试验以大型溞的蜕皮数、寿命、体长、首胎时长、产胎数以及单雌产溞数等慢性毒性端点为指标,开展20%氟虫双酰胺水分散粒剂、200 g·L-1氯虫苯甲酰胺悬浮剂、200 g·L-1溴氰虫酰胺悬浮剂等3种双酰胺类杀虫剂制剂对大型溞生长发育和繁殖的影响研究。
研究结果表明,暴露在3种杀虫剂制剂水溶液中的大型溞寿命显著减短。个体寿命是评价杀虫剂对溞类慢性毒性的敏感指标[18-20],也是评价生物种群增长的主要参数之一[21]。寿命缩短能够导致种群内禀增长率的急剧下降,会给种群增长带来副作用甚至产生更大的生态影响[22-23]。但是,就本试验结果却显示,寿命缩短并不必然伴随着大型溞产溞数的减少,在导致寿命减短的几个处理中,大型溞仍然保持正常的产幼溞数(表2、表3)。这可能是由于大型溞通过在短时间内产生更多后代,来弥补由于寿命缩短而导致的不利影响。
大型溞体长也是评价农药慢性毒性的重要指标。Toumi等[24]研究者通过试验发现溴氰菊酯(deltamethrin)对2个不同品系大型溞的体长具有显著影响,并认为体长是慢性毒性试验的最敏感参数指标。类似结论,在Liu等[25]就噻嗪酮(buprofezin)对大型溞慢性毒性的相关研究中也得到证实。本研究的结果显示3种杀虫剂制剂可导致大型溞体长显著缩短。同时,还伴随着单雌产溞数的减少。这与一些研究者的观点一致[26-28]。
在农药慢性暴露试验中,一些学者认为大型溞等溞类的繁殖能力是比寿命更加敏感的评价指标[16,29-30]。大型溞的繁殖能力通常是通过其首胎时长、产胎数和单雌产溞数等端点值来考察[16,28]。本试验的研究结果表明氟虫双酰胺、氯虫苯甲酰胺和溴氰虫酰胺等3种杀虫剂制剂对大型溞首胎时长、产胎数、单雌产溞数具有不同程度的影响。但与寿命和体长2个指标相比,产胎数和单雌产溞数不具敏感优势。尽管首胎时长对敌稗(propanil)、毒死蜱(chlorpyrifos)、溴氰菊酯(deltamethrin)等几种农药的敏感性极高[16,24,30],但在本研究中却表现低敏感度。
双酰胺类杀虫剂为非蜕皮激素类生长调节剂,其主要是通过生物鱼尼丁受体起作用。目前也没有证据表明该类杀虫剂直接干扰蜕皮过程。因此,从本试验结果可以看出大型溞蜕皮次数的减少可能与其寿命缩短有直接关系。由于枝角类浮游动物的蜕皮阶段是对有毒物质的最敏感时期[31],暴露在化学农药环境中的大型溞有可能通过减少蜕皮次数来提高抗逆性。同时,从本研究结果也可以看出大型溞的蜕皮与其繁殖相关,蜕皮次数的减少意味着繁殖能力的下降(氟虫双酰胺制剂处理尤其明显),这与一些研究者的观点相符合[24]。
双酰胺类杀虫剂是对非靶标生物和水生生物安全的一类新型杀虫剂[2,32]。然而,本研究却发现氟虫双酰胺、氯虫苯甲酰胺和溴氰虫酰胺3种杀虫剂制剂在极低的浓度下即可显著影响大型溞的生长发育和繁殖。因此,该类杀虫剂制剂在田间,尤其是在水稻田及农田水源毗邻区应当谨慎使用,其对水体环境生物的毒性影响应当引起人们足够的重视。同时,从本研究的结果也可以看出,大型溞的蜕皮数、寿命和体长等生长发育指标比首胎时长、产胎数和单雌产溞数等繁殖指标更敏感,可以作为水体环境中该类杀虫剂制剂污染程度的指示指标,为评估该类杀虫剂的环境风险和控制水体环境污染提供科学依据。
[1]Ogawa Y.Role of ryanodine receptors[J].Critical reviews in biochemistry and molecular biology,1994,29(4):229-274
[2]Teixeira L,Andaloro J.Diamide insecticides:Global efforts to address insect resistance stewardship challenges [J].Pesticide Biochemistry and Physiology,2013,106(3): 76-78
[3]肖春雷,罗丰,刘勇,等.氯虫苯甲酰胺对小菜蛾的室内毒力测定及防治效果[J].中国蔬菜,2012,1(16):86-89 Xiao C L,Luo F,Liu Y,et al.Laboratory toxicity determination and control effect of chlorantraniliprole on diamondback mothPlutella xylostella(L.)[J].China Vegetables,2012,1(16):86-89(in Chinese)
[4]徐德进,顾中言,徐广春,等.雾滴密度及大小对氯虫苯甲酰胺防治稻纵卷叶螟效果的影响[J].中国农业科学,2012,45(4):666-674 Xu D J,Gu Z Y,Xu G C,et al.Effects of droplet density and droplet size on control efficiency of chlorantraniliprole againstCnaphalocrocis medinalis(Guenée)[J].Scientia Agricultura Sinica,2012,45(4):666-674(in Chinese)
[5]Amarasekare K G,Shearer P W.Comparing effects of insecticides on two green lacewings species,Chrysoperla johnsoniandChrysoperla carnea(Neuroptera:Chrysopidae)[J].Journal of Economic Entomology,2013,106(3): 1126-1133
[6]陈伟国,董瑞华,孙海燕,等.农用杀虫剂氯虫苯甲酰胺对家蚕的毒性研究[J].蚕业科学,2010,36(1):84-90 Chen W G,Dong R H,Sun H Y,et al.An investigation on toxicity of the agricultural pesticide chlorantraniliprole to the silkworm,Bombyx mori[J].Science of Sericulture, 2010,36(1):84-90(in Chinese)
[7]Beers E H,Schmidt R A.Impacts of orchard pesticides onGalendromus occidentalis:Lethal and sublethal effects [J].Crop Protection,2014,56:16-24
[8]Agbohessi P T,Toko I I,Houndji A,et al.Acute toxicity of agricultural pesticides to embryo-larval and juvenile african catfishClarias gariepinus[J].Archives of Environmental Contamination and Toxicology,2013,64(4):692-700
[9]Rodrigues A C M,Gravato C,Quintaneiro C,et al.Life history and biochemical effects of chlorantraniliprole on Chironomus riparius[J].Science of the Total Environment,2015,508:506-513
[10]彭颖,范灿鹏,廖伟,等.2,2’,4,4’-四溴联苯醚对大型溞的毒性效应[J].生态毒理学报,2012,7(1):79-86 Peng Y,Fan C P,Liao W,et al.Toxic effects of 2,2’,4, 4’-tetrabromodiphenyl ether onDaphnia magna[J].Asian Journal of Ecotoxicology,2012,7(1):79-86(in Chinese)
[11]Poynton H C,Varshavsky J R,Chang B,et al.Daphnia magnaecotoxicogenomics provides mechanistic insights into metal toxicity[J].Environmental Science&Technology,2007,41(3):1044-1050
[12]胡方华,宋文华,丁峰,等.三唑酮对大型溞21天慢性毒性效应[J].生态毒理学报,2012,7(2):171-176 Hu F H,Song W H,Ding F,et al.21-d Chronic toxicity of triadimefon toDaphnia magna[J].Asian Journal of Ecotoxicology,2012,7(2):171-176(in Chinese)
[13]余言想,魏华,陶贤继,等.纳米水稳型C6060(n60)促进Zn2+和Cr6+在大型溞体内的吸收、抗氧化性和急性毒性[J].生态毒理学报,2014,9(3):569-577 Yu Y X,Wei H,Tao X J,et al.Aqueous stable fullerene nanocrystals nC60promoted the accumulation,anti-oxidation and acute toxicity of Zn2+and Cr6+onDaphnia magna[J].Asian Journal of Ecotoxicology,2014,9(3):569-577(in Chinese)
[14]林涛,游泳,郑丽祯,等.三种双酰胺类杀虫剂制剂对环境非靶标生物的急性毒性[J].农药学学报,2015,17 (6):757-762 Lin T,You Y,Zheng L Z,et al.Acute toxicity of three diamide insecticide preparations to environmental non-target organisms[J].Chinese Journal of Pesticide Science,2015, 17(6):757-762(in Chinese)
[15]OECD.OECD guidelines for the testing of chemicals No. 211.Daphnia magnareproduction test[R].Paris:OECD, 1998
[16]Villarroel M J,Sancho E,Ferrando M D,et al.Acute, chronic and sublethal effects of the herbicide propanil on Daphnia magna[J].Chemosphere,2003,53(8):857-864
[17]许丹丹,席贻龙,马摇杰,等.Cd2+对角突臂尾轮虫和曲腿龟甲轮虫的急性毒性和生命表统计学参数的影响[J].生态学报,2011,31(17):4874-4880 Xu D D,Xi Y L,Ma Y J,et al.Acute toxicity and effect of Cd2+on life table demography ofBrachionus angularis andKeratella valga[J].Acta Ecologica Sinica,2011,31 (17):4874-4880(in Chinese)
[18]Daniels R E,Allan J D.Life table evaluation of chronic exposure to a pesticide[J].Canadian Journal of Fisheries and Aquatic Sciences,1981,38(5):485-494
[19]Day K,Kaushik N K.An assessment of the chronic toxicity of the synthetic pyrethroid,fenvalerate,toDaphnia galeata mendotae,using life tables[J].Environmental Pollution,1987,44(1):13-26
[20]Ingersoll C G,Winner R W.Effect onDaphnia pulex(De Geer)of daily pulse exposures to copper or cadmium[J]. Environmental Toxicology and Chemistry,1982,1(4): 321-327
[21]Kim H Y,Lee M J,Yu S H,et al.The individual and population effects of tetracycline onDaphnia magnain multigenerational exposure[J].Ecotoxicology,2012,21 (4):993-1002
[22]Stark J D,Banks J E.Population-level effects of pesticides and other toxicants on arthropods[J].Annual Review of Entomology,2003,48(1):505-519
[23]Dodson S I.Effect of Clean and Polluted Groundwater on Reproduction and Development ofDaphnia[M].USA Wisconsin:University of Wisconsin Water Resources Institute,2002:1-16
[24]Toumi H,Boumaiza M,Millet M,et al.Effects of deltamethrin(pyrethroid insecticide)on growth,reproduction, embryonic development and sex differentiation in two strains ofDaphnia magna(Crustacea,Cladocera)[J].Science of the total Environment,2013,458:47-53
[25]Liu Y,Qi S,Zhang W,et al.Acute and chronic toxicity of buprofezin onDaphnia magnaand the recovery evaluation[J].Bulletin of Environmental Contamination and Toxicology,2012,89(5):966-969
[26]Hanazato T.Growth analysis ofDaphniaearly juvenile stages as an alternative method to test the chronic effect of chemicals[J].Chemosphere,1998,36(8):1903-1909
[27]Barata C,Baird D,Soares A.Phenotypic plasticity in Daphnia magnaStraus:Variable maturation instar as an adaptive response to predation pressure[J].Oecologia, 2001,129(2):220-227
[28]Villarroel M J,Ferrando M D,Sancho E,et al.Effects of tetradifon onDaphnia magnaduring chronic exposure and alterations in the toxicity to generations pre-exposed to the pesticide[J].Aquatic Toxicology,2000,49(1-2):39-47
[29]Buhl K J,Hamilton S J,Schmulbach J C.Chronic toxicity of the bromoxynil formulation Buctril®to Daphnia magna exposed continuously and intermittently[J].Archives of Environmental Contamination and Toxicology,1993,25 (2):152-159
[30]Zalizniak L,Nugegoda D.Effect of sublethal concentrations of chlorpyrifos on three successive generations of Daphnia carinata[J].Ecotoxicology and Environmental Safety,2006,64(2):207-214
[31]Hanazato T.Pesticide effects on freshwater zooplankton: An ecological perspective[J].Environmental Pollution, 2001,112(1):1-10
[32]Sattelle D B,Cordova D,Cheek T R.Insect ryanodine receptors:Molecular targets for novel pest control chemicals [J].Invertebrate Neuroscience,2008,8(3):107-119
*共同通讯作者(Co-),E-mail:fjw9238@163.com
Effect of Three Diamide Insecticide Preparations on Development and Reproduction of Daphnia magna Straus
Lin Tao1,You Yong1,Lin Ronghua2,Shi Mengzhu1,Li Jianyu1,Zhao Jianwei1,Chen Yixin1,Fu Jianwei1,#,Wei Hui1,*
1.Institute of Plant Protection,Fujian Academy of Agriculture Sciences,Fuzhou 350013,China
2.Institute for the Control of Agrochemicals,Minstry of Agriculture,Beijing 100125,China
8 December 2015 accepted 5 February 2016
We aim to investigate the chronic toxicity of diamide insecticides toDaphnia magna.The effects of three diamide insecticides(flubendiamide,chlorantraniliprole and cyantraniliprole)on the development and reproduction ofD.magnawere tested.The results suggest that these insecticides have different degrees of influence on the lon-gevity,length,number of cumulative molts,days of first brood,number of broods and number of offspring ofD. magna.The lowest concentrations that could significantly decrease the number of cumulative molts were 1.00×10-2mg·L-1,1.00×10-4mg·L-1and 1.25×10-3mg·L-1for flubendiamide,chlorantraniliprole and cyantraniliprole,respectively.The lowest concentrations for the significantly decreasing the longevity were 5.00×10-3mg·L-1,1.00×10-4mg·L-1and 1.25×10-3mg·L-1,respectively.For the significantly decreased length,the lowest concentrations were 5.00×10-3mg·L-1,8.00×10-4mg·L-1and 1.00×10-2mg·L-1,respectively.Similarly,the lowest concentrations resulting in the decreased number of broods were 1.00×10-2mg·L-1,4.00×10-4mg·L-1and 1.00×10-2mg·L-1,respectively,and the decreased number of offspring were 1.00×10-2mg·L-1,8.00×10-4mg·L-1and 5.00×10-3mg·L-1,respectively.There was no significant reduction in the days of first brood inD.magna(except cyantraniliprole).For flubendiamide,arranged in descending order,the sensitive endpoint was longevity and length,number of cumulative molts and number of broods and number of offspring,days of first brood,respectively;for chlorantraniliprole was number of cumulative molts and longevity,number of broods,length and number of offspring,days of first brood,respectively;for cyantraniliprole was number of cumulative molts and longevity,number of offspring,length and days of first brood and number of broods,respectively.Therefore,different degrees of negative effects were demonstrated for three diamide insecticides on development and reproduction ofD.magna.For those insecticides, longevity was most sensitive endpoint for evaluating chronic toxicity ofD.magna.
diamide;flubendiamide;chlorantraniliprole;cyantraniliprole;Daphnia magna;development;reproduction
2015-12-08 录用日期:2016-02-05
1673-5897(2016)1-306-07
X171.5
A
10.7524/AJE.1673-5897.20151208002
林涛,游泳,林荣华,等.三种双酰胺类杀虫剂制剂对大型溞生长发育和繁殖的影响[J].生态毒理学报,2016,11(1):306-312
Lin T,You Y,Lin R H,et al.Effect of three diamide insecticide preparations on development and reproduction ofDaphnia magnaStraus[J].Asian Journal of Ecotoxicology,2016,11(1):306-312(in Chinese)
国家自然科学基金(31471803);福建省省属公益类科研院所专项(2014R1024-6)
林涛(1982-),男,助理研究员,硕士,研究方向为农药环境毒理研究,E-mail:maludongzuo@163.com
),E-mail:weihui@faas.cn
简介:魏辉(1972-),男,博士,研究员,主要研究方向为农业昆虫与害虫防治。
傅建炜(1974-),男,博士,研究员,主要研究方向为农药学与生物安全。
