环境混合物的联合毒性研究方法
2016-12-06杨蓉李娜饶凯锋马梅王子健
杨蓉,李娜,饶凯锋,马梅,*,王子健
1.北京市南水北调水质监测中心,北京100195
2.中国科学院生态环境研究中心中国科学院饮用水科学与技术重点实验室,北京100085
环境混合物的联合毒性研究方法
杨蓉1,2,李娜2,饶凯锋2,马梅2,*,王子健2
1.北京市南水北调水质监测中心,北京100195
2.中国科学院生态环境研究中心中国科学院饮用水科学与技术重点实验室,北京100085
人类和其他生物通过多重途径暴露于大量的环境污染物中。单一化合物由于其在环境中非常低的浓度使得人们忽视其可能的健康危害,然而,多种化合物在环境中同时存在,就意味着更加复杂的联合作用的可能性。Something from nothing现象引起了科学界对于环境混合物加和作用和潜在协同作用的关注,致使许多研究联合毒性的数学和生物模型的提出和应用。本文综述了这些研究方法,以及未来化学混合物研究和管理面临的挑战。
混合物;联合作用;作用方式;模型预测
人类和其他生物终生暴露在不同来源、不同种类的多种环境污染物中,单一污染物环境暴露在实际环境中并不存在。检测各污染物的环境浓度水平、并评价其毒性和健康风险一直是科学界和大众的关注焦点。传统方法中通常是通过对目标化合物的分析定量测定其环境浓度,并根据其毒性数据判断其潜在的健康影响。虽然仪器和方法学的发展带来了检测限的降低和更多痕量物质的发现,但仪器分析检测到的目标化合物种类有限,可能只占种类繁多的环境污染物中很少一部分,会导致我们忽略了未知污染物的存在和毒性效应。例如,Escher等[1]研究了包括回用水、饮用水、雨水在内的9个环境水样造成的氧化应激反应,指出已知化合物的贡献小于0.1%,而超过99.9%的氧化应激都由未知化合物造成。另一方面,环境污染及其健康影响的调查与评价,其最终目的是保护生态系统和人类健康。从这个角度考虑,污染物浓度本身并没有实质意义,但是其所产生的生物毒性或对健康的干扰效应才是应该受到关注的重点。因此在生态和健康风险评估中,暴露评价和危害评价均是整体研究中的不可或缺的部分。
毒理学研究中的毒性测试则关注整体生物效应,通常是测定某个具体污染物或混合物样品针对具体受试生物和测试终点的毒性表现。在20世纪,绝大多数的毒理学研究和风险评价都停留在单一化合物的水平上[2],因为针对单一物质的毒性研究花费低廉且简单易行。然而,已有大量证据证明混合物的联合毒性并不能简单地通过组分浓度或毒性当量加合来描述,而是表现出相互影响、相互作用,会产生诸如加和、协同或拮抗等联合毒作用。此外,联合毒性还会随着组分浓度水平、浓度比、暴露时间、路径和顺序、以及测试生物的状态发生变化。由此可见,混合物的联合毒性研究是一个挑战性与必要性并存的课题。基于单一物质的毒性研究和管理策略很难用来解决复杂的污染问题,而研究联合效应对进行风险评价、改进环境标准和环境容量、开展预防评价对策都有很强的推动作用和现实意义。
对联合作用的描述及其评价方法的探讨已日益引起研究人员和环境管理人员的重视,提出了许多基于生理学、毒理学和生物统计学的方法模型并加以应用优化。近年来,美国环保署(United States Environmental Protection Agency,USEPA)、毒物与疾病登记署(Agency for Toxic Substances and Disease Registry,ATSDR)、经济合作与发展组织(Organization for Economic Cooperation and Development, OECD)和世界卫生组织(World Health Organization, WHO)等[3-7]一系列具有影响力的环境机构和组织也开始发布混合物毒性研究的准则和标准。本文综述了这一领域的进展和主要成就,包括用来预测联合毒性的数学和生物学模型,以及未来化学混合物研究和管理面临的挑战。
1 联合作用的分类(Classification of combined effects)
Bliss[8]于1939年发表的论文标志着混合污染物联合毒性研究的开始,其中首次提出了联合作用的分类方法:独立作用(independent joint action)、相似作用(similar joint action)和协同作用(synergistic action)。Bliss强调了联合作用分类的关键之处,即一种组分的存在是否干扰混合物中其他组分的效果。由此,联合作用可被分为无相互作用(non-interative,包括独立作用和相似作用)和相互作用(interactive,此处的“协同作用”包含了传统意义上的协同和拮抗)2种。在无相互作用的进一步分类中,也考虑了混合物组分的作用位点和路径是否相同。

表1 Bliss的联合作用分类法Table 1 Classification of combined effects by Bliss
表1说明Bliss仅将协同作用定义为对加和的偏离,但并未对此开展进一步讨论。在此基础上, Plackett和Hewlett[9-10]根据作用方式(mode of action, MoA)的不同,对相互作用做了进一步分类。复杂相似作用(complex similar action)和关联作用(dependent action)两个概念被分别用来描述机理相似和机理不同的混合物组分的相互作用(见表2)。然而,Plackett和Hewlett的分类法仍存在不足之处,它只适用二元混合物,不能用于多组分混合物、尤其是复杂环境样品的分类。因此,Ashford[11]在总结了以上分类法的特性和优缺点后,将各种联合作用基于亚系统、作用位点和混合物组分重新分类,提出了将组分相似性、关联性、一致性等信息同时纳入框架的新方法(见表3)。与前述分类法不同,新引入的部分相似作用(partially similar)和部分关联作用(partially dependent)2个概念更加符合环境样品的真实情况,也为联合作用提供了更加细致的描述。

表2 Plackett和Hewlett的联合作用分类法Table 2 Classification of combined effects by Plackett and Hewlett
在Ashford分类法提出的同一时期,WHO和USEPA也发布了各自推荐的联合作用分类,主要参考了半世纪前Bliss分类法的思路。WHO[12]将联合作用分成独立作用(independent joint action)、加和作用(additive effects)、协同作用(synergistic joint action)和拮抗作用(antagonistic joint action)4类;USEPA[5]则将最后两者合并,分为剂量加和(dose addition)、效应加和(response addition)和相互作用(interaction)3类。30多年来,WHO和USEPA的巨大影响力使其推荐的分类法被普遍采用。但这也带来了以下问题:作为自然界中广泛存在的现象,相互作用的研究不应当仅仅满足于诸如“偏离加和”、“协同(大于加和)”和“拮抗(小于加和)”的现象描述,而应该更加深入到作用方式和机理的探讨。因此,虽然WHO和EPA对本领域中关键概念的推广和标准化作出了很大贡献,但他们的观点并不能代表混合物毒性研究的最新进展。
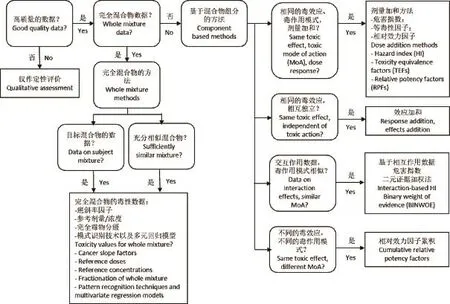
图1 基于数据质量的混合物风险评价Fig.1 Flow chart for evaluating mixtures based on data quality

表3 Ashford的联合作用分类法Table 3 Classification of combined effects by Ashford
2 无相互作用模型(Non-interactive combined effects)
USEPA于1986年发布的化学混合物风险评价指南是混合物毒性研究领域的重要文档。其针对混合物毒性研究提出了3个层次的问题,以指导不同数据质量的混合物进行研究方法的选择[5-6]:(1)是否是高质量数据?(2)是否有完全混合物数据?(3)混合物组分信息是否已知?因此,可以由数据质量的评价开始,评估已有数据并选择合适的风险评价方法,如Teuschler[13]的流程图所示(图1)。完全混合物及充分相似混合物是把混合物看作一个整体加以评价,在混合物组分信息已知的情况下,可以通过对其组分的分析来评价混合物,这更利于联合毒性的分析和预测、以及作用模式机理和相互作用的探讨。在基于组分的预测方法中,大多数研究联合效应的模型都与2个基本概念相关,是由Loewe和Bliss分别提出的浓度加和模型(concentration addition,CA)和效应加和模型(response addition,RA)。在相互作用不存在或组分浓度低到可以忽略相互作用的情况下,浓度加和和效应加和都被USEPA推荐为风险评价的通用方案,方法简便可靠,应用广泛[8,14]。这两者的区别在于混合物每一组分是否具有毒理学相似性。混合物各组分可能具有相同或不同的作用方式,结合相同或不同的作用位点(target of action, ToA),这都会影响对评价方法和预测模型的选择。
浓度加和也被称为剂量加和[5]和简单相似作用[8]。它基于混合物组分共享一个作用方式的假设,认为在混合物各组分结构类似、生理功能和毒理行为相似、只在毒性效力上有所区别、某组分与其他组分无相互作用。因此,在调整各组分的毒性强度后,我们可以将各单一化合物的剂量(或浓度)相加,由此计算联合效应[15]。严格地说,浓度加和只可用于所有组分竞争结合同一分子位点的情况[16],但这一苛刻的条件可以适当放宽至各组分可以引起相同生物响应[17]。浓度加和说明即使各化合物浓度低于其各自无观察效应浓度(no-observed effect concentration,NOEC),也可能会产生显著的联合作用。其可表示为:
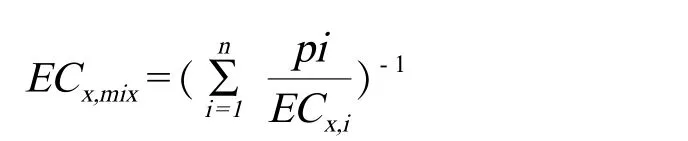
其中,pi表示i化合物浓度在混合物总浓度中的比例,ECx,i表示i化合物产生x%效应时的浓度,比如各化合物的半数效应浓度(half-effective concentration,EC50),ECx,mix表示混合物产生x%效应时的浓度[18]。显然,不论单个化合物的浓度是否低于无观察效应浓度,混合物中每个化合物对总体的毒效应均有贡献。
浓度加和是混合物风险评价中使用最多的方法,它具有简单的数学表达式,方便易用,倾向在某种程度上高估了联合作用,这有利于潜在风险的识别、符合预防原则。并且当复杂混合物的毒性信息不完全已知时,浓度加和可以被用作通用解决方法,因为模型预测和实验观察到的结果总体而言相差不大[19-20]。由这个方法衍生出来的方法众多,包括危害指数法(hazard index,HI)[21-22]、毒性单位法(toxic unit,TU)[23-24]、相对强度因子法(relative potency factor,RPF)[6]、毒性当量因子法(toxicity equivalence factor,TEF)[25]、总体负荷法(total body residue,TBR)[26]等,需要根据毒性机理和毒理学相似性方面的相关信息进行选择[15]。
浓度加和模型及其衍生方法在环境研究和管理中得到广泛的应用。有许多研究者利用浓度加和研究混合物毒性,受试生物包括细菌、酵母、细胞、啮齿类和鱼类,测试终点涵盖生物发光[27]、酶活性[28-29]、细胞增殖[30-31]、卵黄蛋白原水平[32-33]、mRNA 表达[34]、子宫增重[35]等。另外,作为浓度加和的衍生物,标准化合物当量法也被成功应用于描述联合作用。例如,用二噁英的TEF表示混合体系相对于2, 3,7,8-TCDD的芳烃受体结合效应[25,36],用雌激素的EEF表示混合体系相对于雌二醇的雌激素受体结合效应[37],用RPF表示有机磷农药混合物相对于甲胺磷的乙酰胆碱酯酶抑制效应[38],而用BaP-TEF表示化合物的遗传毒物相对于苯并[α]芘的致癌性[39]。
另一方面,效应加和是每个混合物组分效应的加和,也称独立作用[8,40]或简单非相似作用[15]。此时,混合物中的化合物被认为彼此独立地与不同的系统或靶位点发生作用、不影响其他物质的毒性。效应加和通常被描述为:

其中,E(cmix)表示混合物的联合毒效应,E(ci)表示i化合物单独作用时的毒效应。与浓度加和概念中的“不论浓度大小,所有组分均对总毒性有所贡献”不同,效应加和模型认为各化合物的浓度必须在其环境安全水平以上才能对混合物的总毒性有所贡献[41]。当混合物中各化合物具有不同的作用方式、且每个组分的存在不会影响其他化合物毒性时,效应加和对联合毒性有更好的预测能力[42]。
事实上,环境中化合物作用完全相同或完全不同的情况很少发生,浓度加和和效应加和用于实际样品都存在局限性。因此Junghans[43]在更接近实际混合物的探索中提出了整合浓度加和/效应加和于一体的两步预测(two-step prediction,TSP)模型,其表达式如下:

显然,上式为浓度加和和效应加和表达式的结合。作用方式的化合物先各自组成数个集合,分别用浓度加和预测集合内效应;之后,集合间联合作用的再使用效应加和预测。两步预测模型已被应用于污水处理厂出水的评价,被证明可用于评价复杂混合物的效应[44]。
无相互作用模型在实践中得到广泛应用,很长一段时间内几乎被用于混合物毒性描述和预测的通用解决方案。表4总结了使用浓度加和和效应加和进行的部分联合毒性研究,显然,混合物组分的作用方式和最优模型选择具有一定相关性。

表4 浓度加和和效应加和模型在混合物毒理研究中的应用Table 4 Application of CA and RA in mixture toxicity researches
然而,研究者发现现实世界里无相互作用的普适性并不令人满意。例如,在针对雌激素混合物的研究中,采用 MCF-7细胞增殖[53-55]、海龟性别决定[56-57]和小鼠子宫增重[58]作为测试终点,也都发现了协同或拮抗效应。Vijver等[59]综述了2010年之前发表的文献,发现模型预测是无相互作用的只占全部数据的13%。对有机有毒物质,加和模型有较好的预测效果,但不同金属离子之间主要是协同和拮抗作用。由此可知,实际环境中存在的相互作用更加普遍。这就意味着预测相互作用需要有新的方法学突破,应该重点考虑不同的靶点和不同的作用方式之间的交互影响[60]。理论上,这类联合毒性的研究更需要数学模型、生理学、系统毒理学、计算机预测等多方面的支持与合作,目前处于发展阶段。
3 常见的联合毒性实验设计(Common experimental design for combined effects)
浓度加和效应加和模型使用虽广,但其最大的缺点在于它们忽视了组分之间可能的相互作用。相互作用是对加和性(additivity)的偏离的经验性描述,会影响混合物的毒理学应答和整体毒性,一般分为协同和拮抗效应。许多研究者研究了混合物组分之发生的相互作用频率及强度,证明在真实世界里相互作用是普遍存在的[59,61]。当组分的浓度和浓度比发生变化时,可能会有更微妙和复杂的相互作用发生[62]。因此,研究者提出了诸多用于研究联合毒性、分辨加和、协同和拮抗的实验设计方法,在此予以综述。
3.1 等效线图
在特定效应水平对二元混合物进行分析时,等效线图是区分加和效应和相互作用的经典统计方法[14]。在此图上,x轴和y轴分别是组分A和B的毒性单位,用混合物中该组分浓度与其单独作用时特定效应水平下浓度(一般是EC50)的比值表示(Ci/ EC50i)。当混合物两组分之间没有相互作用,实验点会形成一条笔直的“加和线”,如图2所示。如果实验点出现在加和线的上方和下方,即认为有拮抗和协同作用发生。
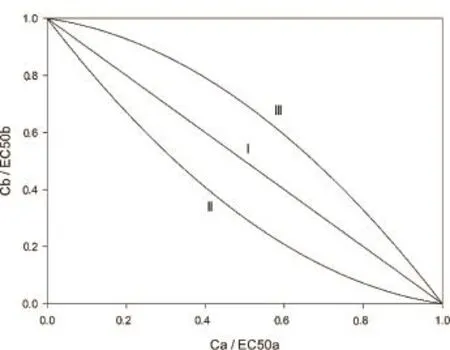
图2 等效线图(I:加和效应;II:协同效应;III:拮抗效应)Fig.2 Isobologram(I:additivity;II:synergism;III:antagonism)
尽管等效线图可以直观地表示联合效应,它也存在很多方面的局限:只可用于二元混合物在某一特定效应水平上的评估,因此需要开展大量工作来精确地测定每一组分的等效应浓度[63]。然而,在试验方法学的发展下,某一效应水平上的毒性数据——如EC50已经不是评估和比较混合物毒性的唯一指标。环境中化合物浓度随空间和时间变化巨大,只研究单一浓度比的传统方法难以反映环境现实,而增加组分和浓度组的数量又会大大提高工作量。此外,实验设计方式和实验产生的误差会很大程度地影响基于等效线设计而得出结论的置信度水平,需要在统计学方法的帮助下得到清晰、可控、数据使用充分的实验设计[64]。
3.2 混合物毒性指数法
混合物毒性指数法是通过公式计算定量判断模型预测值和实际观测值之间关系的方法。针对二元混合物,大多数指数法是由等效线图推导得出的,与其代数等价。例如Finney[65]的K值法,定义K为实验得到的EC50和浓度加和预测到的EC50的比值。从理论角度讲,K=1说明毒物具有加和作用,K<1或K>1说明它们有拮抗或协同作用。但由于实验误差和实验动物状态的波动,在0.4到2.5之间的K值一般被认为表示加和。之后,也有其他研究者推荐了不同的K值加和区间,或者提出了更完善的K值评价系统[66-67]。
其他可行并常用的指数法包括毒性单位、加和指数(additive index,AI)、混合毒性指数(mixture toxicity index,MTI)、相似参数(similarity parameter,λ)等,它们在近年仍被用于联合毒性评价[68-69],其定义式、特性、应用等详细阐述可参见曾鸣等[70]的综述。与等效线图相比,指数法可用于多元化合物的联合毒性预测,并使大量毒性数据最终以一个清晰、简明的数字呈现,从而更受欢迎[71]。但是,指数法具有与等效线图相似的缺点,其仅适用于具有单调剂量-效应曲线、EC50单指标即可用来确定整个作用区域的化合物。若混合物由数种剂量-效应曲线为U型或倒U型的组分构成,其联合毒性将不能用指数法计算。
3.3 析因分析
为避免传统实验设计上的种种局限,研究者开始采用统计学方法研究化学混合物的联合毒性。其中,析因分析是一种判断多组分体系是否存在相互作用的定性方法,它可以同时观察不同因子的作用,分析因子之间的相互作用,提供各化合物各浓度间的数学关系。与等效线图和指数法不同,析因设计能够分析获得的所有数据点,并不要求提供各化合物精确的剂量-效应方程,因此可以提高试验效率,更全面地利用实验数据,减少工作量和实验动物用量,得到高质量的结果[72-73]。采用析因分析研究联合毒性的思路为:(1)获得各组分的单一剂量-效应曲线;(2)选择合适的浓度进行混合物析因设计(2水平2因子是最简单的);(3)通过双因素方差分析并结合均数轮廓图判断混合物组分间有无交互作用。若估计边缘均数轮廓图中曲线互相平行,认为混合物各组分间表现为相加,两条曲线互相远离表示协同,曲线靠近或交叉为拮抗。例如,孙立伟等[33]利用析因分析研究了雌二醇、壬基酚、双酚A所组成的二元混合物的雌激素作用,发现估计边缘均数轮廓图的所有线条基本平行,说明组分间不存在相互作用。这一方法也可以扩展到三元混合物的情况[74-75],以大幅度减少多组分、多组合、多浓度水平下混合物设计和毒性测试的工作量。
4 生物学和生理学模型(Biological and physiological models)
4.1 效应终点与混合物作用靶点和作用方式
在毒理学研究中,决定用什么生物进行暴露、暴露后检测哪些指标,这些方面的考虑和研究何种类化合物或其混合物的毒性同样重要。当生物体暴露在环境样品中,各种化合物通过饮食、呼吸和皮肤进入机体和组织,通过血液、淋巴等组织液运输达到靶位点。通过与相应的生物分子结合干扰正常生理过程。它们依次导致可逆的生理生化改变和不可逆的病理改变,并随之产生病变、疾病和死亡。因此,作为环境混合物的作用对象,生物体是一个过于复杂的系统。化合物在不同机体层面上都可引起效应,有的还能在不同靶位点引起不同的效应,所以评价一个化合物毒性会有很多个测试终点可供选择。
对同样的受试物和同样的测试生物,不同的毒理学终点具有不同的敏感性。例如,针对铜对布氏双尾藻的生长抑制作用,Rijstenbil等[76]发现当所选择的效应终点不同时会获得不同的剂量-效应关系。也就是说,在给定的铜浓度下,亲脂配体、有性繁殖、胞溶现象等效应终点会表现出强度不同的响应。而金小伟等[77]在评价壬基酚的生态风险时,选择存活、生长、生化指标以及繁殖作为测试终点会使得实验的灵敏性逐渐升高,相应使预测无效应浓度(predicted no effect concentration,PNEC)值逐渐降低。因此在毒性研究中测试终点的选择是非常重要的,生物测试方法的开发也正在囊括越来越多的毒理学效应终点。
然而,污染物具有不同的致毒机制和作用方式。单一化合物进入生物体内都会引起不同位点、不同水平的反应,混合物、尤其是作用机制复杂的混合物导致的联合效应将由于ToA和MoA的不同而更难以分析和预测。例如在一个复杂混合物中,有机污染物和重金属离子组分对于生物体的作用靶点可能相差甚大,这大大增加了研究混合物毒性的难度。传统意义上对于化合物急性毒性的分类相对简单,主要是炎症性损伤和反应性损伤;而当涉及慢性毒性或健康效应会让联合毒性研究举步维艰。例如,多氯联苯和对硫磷都是典型有机污染物,但它们的致毒机理分别是抑制免疫系统和抑制胆碱酯酶;而作为重金属,铅的作用位点是神经海马细胞,镉的主要作用位点是骨骼细胞,硒和铊的主要作用位点则分别是胶原蛋白代谢和Na/K-ATP酶。在很多环境样品毒性评价中,实验人员把测试生物暴露在复杂混合物中检测急性毒性。但由于存在众多的致死途径,导致结果复杂和无法解释。例如,一项4种抗生素联合暴露鱼腥藻和绿藻的研究发现联合毒性呈现出协同效应[78],但这一结果只针对此研究所用的混合物,这种结论对预测模型的开发和外推至人类的风险评估帮助有限。因此,为了解释复杂混合物的效应,研究者已经把注意力转到了基于作用机制的研究思路上。此时关注的重点是受体、作用方式和机理,而不是一种或一类化合物对整体动物或细胞的毒性。从这一角度,“改变摄入和排泄过程的化合物”、“抑制某特定酶的化合物”等概念会比“酚类”、“重金属”更易于在联合毒性领域进行分类和开展研究。在Groten等[15]的综述里,“简单混合物”被定义为10个或以下化合物的集合;但在新的框架下,它也许会表示包含了相同作用方式物质的混合物,因为它的组分之间不存在相互作用,讨论起来相对简单。随着角度的变化,很多概念和思考方式都会不同。这个基本概念预示着未来的联合毒性研究将更多侧重于与毒理学研究同步[79]。在本实验室最近发表的2篇文章中,也强调了基于相同作用方式和作用靶点研究联合毒性的重要性[48,80]。
4.2 基于过程的研究框架:对危害指数的修正
近年来,系统毒理学方法越来越多地应用于相互作用的判断和预测中。从生物学过程的角度看,相互作用会在3个层次上发生[62]:一是生物体外的相互作用,排放到环境中的大多数污染物都会与某些环境成分或互相发生作用,以改变暴露水平和最终被生物体吸收的量。例如土壤、沉积物颗粒对可溶性腐殖质的吸附和解吸,药物和酸性物质影响金属的生物可利用性等[81-82]。二是化合物在体内吸收、分配、代谢、排出(aborption-distribution-metabolism-excretion,ADME)过程中的相互作用(毒物代谢动力学)。当组分B改变组分A的摄入和/或消除,解毒或激活作用会发生,引起组分A在靶位点的浓度改变。如丙磺舒可通过降低青霉素的肾脏排泄加强其药效,和锌可通过降低铅的吸收抑制铅中毒[83]。三是靶位点的相互作用(毒物作用动力学)。如果混合物各组分和相同位点竞争或非竞争性结合,组分B的存在将会影响组分A和靶位点的结合,影响其毒性。例如,阿托品可通过结合乙酰胆碱受体位点拮抗有机磷的毒性,他莫昔芬由于可与雌激素竞争结合受体被用于雌激素阳性乳腺癌的治疗。后两个层次在联合效应研究中更受重视,一些毒物代谢动力学和毒物作用动力学的修饰也被用来反映化学组份在体内的浓度变化和相互作用。因此,有研究者使用生理药代动力学模型(physiologically-based pharmacokinetic model,PBPK)和证据加权法(weight of evidence,WOE)对危害指数HI进行修正,使基于浓度加和的HI成为基于相互作用的IbHI(Interaction-based HI),这也是结合相互作用描述联合毒性的方法之一。两者分别对机体内靶位点的暴露浓度和相互作用存在时相应的区别进行修正,从而使危害指数更接近实际情况。
在基于组分信息研究联合毒性时,组分浓度、作用方式和作用强度等信息对开展评价都很关键。在离体毒性测试中,测试生物是细菌、真菌和细胞,因此一般默认暴露浓度即为靶位点浓度。但对于比较高等的生物体,化合物进入体内后要经历复杂的ADME过程,直接用暴露浓度计算联合效应会造成较大误差,很不利于毒性评价和离体试验结果的外推。由于靶位点浓度很难获得,需要用暴露浓度或给药量进行模型推导。PBPK模型就是建立在生理学和解剖学上的一种整体模型,研究化合物在体内如何分配,属于毒物代谢动力学范畴[84]。与经典的房室模型不同,在PBPK模型中,生物体被看作一系列与组织和器官对应的隔室,以血液、淋巴液、胆汁等为传输工具连接[85]。每个隔室里的化合物浓度都被看作时间和暴露量的函数,从而可以计算[86]。它提供了化合物在血液和各个隔室里的浓度-时间关系,反映了物理参数的变化如何影响ADME过程,也表现出高浓度到低浓度、急性毒性到慢性毒性的可外推性[87],在化合物风险评估中有越来越多的应用[88]。有研究报道在高浓度混合物引起中央神经系统毒性时,经PBPK修正的危害指数比基于简单浓度加和的危害指数更大[89]。这说明了在混合物风险评价中考虑多组分的药代动力学相互作用的必要性。PBPK模型是一个分室模型,其对系统预测的置信度水平与分室的复杂程度有关。例如,即使分室到细胞水平,仍然没有解决预测不同污染物进入细胞后与不同生物大分子之间的相互作用问题。
WOE是USEPA推荐的相互作用存下HI的修正方法[6]。它是一种基于经验观察和机理研究的定性判断,可以在给定暴露条件下对相互作用进行分类和整理[40,90]。WOE把多组分化合物拆解成二元组合,通过判断相互作用方向、毒理学作用机制、毒理学意义的重要性和其他修正因子将每个组合的相互作用信息转化为用数字表示的权重,然后对HI进行修正。在一篇有关WOE应用的综述文章里, 380个来自ATSDR文档的二元混合物被按照上述3个方面分组并赋予相应权重[91]。例如,锌和铅的联合作用表现为拮抗,其作用机制清晰,毒理学重要性强,此合物被归入<IA组。另一个例子是TCDD和p, p’-DDE的相互作用,p,p’-DDE的存在对TCDD并无影响,对其作用机制的了解不足,毒理学重要性较弱,因此属于=IIIC组。然而,WOE的应用经常显示出我们对二元混合物机理的了解远远不足。未来,实验数据、专家判断和计算机工具的结合将为WOE在混合物风险评价里的应用提供更好的支持。WOE方法是一个管理学方法,并不需要科学理论的支持。
4.3 动态能量平衡理论
如前所述,化合物进入体内会与多重位点发生作用,导致多种作用方式的影响。致死、生长抑制、干扰繁殖、致畸致癌,每一类效应都包含诸多测试终点可供进行生物测试。因此,测试终点的选择始终是混合物毒性评价的重要问题,诸多测试终点的结果无法统一、难以外推也一直是研究者的思考重点。在此情况下,动态能量平衡(dynamic energy budget, DEB)理论的提出在一定程度上指出了联合毒性研究的新方向。DEB是使用能量作为效应端点的研究方法。生物体从外界物质中获得能量,之后这些能量被用于生长、成熟、繁殖等一系列生物过程。特定的生物对能量如何获得和分配会保持一个特定的模式,但当暴露在有毒化合物中时,此分配过程就会受到干扰、甚至被破坏[92]。DEB把生命周期里的测试终点都综合到能量上,以解释为何混合物毒性能够随时间变化,并在不同测试终点有不同表现[93]。致死、半致死、生长繁殖等任何作用终点都与能量流相关,而任何毒物单独或联合作用都会扰乱能量的分配过程。因此,通过结合与时间相关的实验结果、各种相互作用参数和不同测试终点的效应,我们就能解释混合物组分的特定相互作用。在这个模型中,能量化身为国际通用货币,影响被认为是一个消费过程。
前文中2个无相互作用模型——浓度加和和效应加和都是数学模型,均将生物体看作黑箱,不关注作用方式和作用位点,针对不同的测试终点结果通常被分开解释;PBPK和WOE具有很强的物种特异性,无法克服不同种群和个体间物理、化学、生化和生理参数的差异,导致外推困难。而作为毒物代谢动力学和毒物作用动力学的结合,DEB理论包含了各种与新陈代谢机制有关的参数,这样的综合分析方法在分析毒理学内在机理上是不可缺少的。在一项荧蒽和芘对大型溞不同测试终点的联合毒性研究中利用DEB理论描述了4个维度(荧蒽浓度,芘浓度,时间,响应)和3种测试终点(存活率,体长,繁殖率)的信息,最终证明2种多环芳烃作用于相同靶位点,其混合物的联合毒性表现为加和效应[94]。这是目前可以预测未经测试的化合物和暴露情境下联合毒性的有限选择。
5 展望(Perspective)
联合毒性研究是一个极具挑战性但又有很强的现实意义的课题。从20世纪上半叶至今,科学界在无相互作用模型的应用上收获了许多有价值的数据;而近年来随着对生物体作用位点和作用途径的研究,又发展了一系列基于生物学和生理学的模型来将复杂问题简单化。这些研究可以看作是一个良好的开端,但是尚没有看到能够解决实际问题的希望。
混合物研究的难点在于当环境复合污染体系的组分众多,各组分浓度变化幅度巨大、且作用机理各不相同。同时,由于单一污染物可以作用于不同靶点、或通过靶点间是生物学交叉作用(cross-talk)来影响最终的效应。发展预测能力和外推能力更好的新方法和新模型是未来的研究方向。如前所述,目前的研究能够证明在单一靶点或单一作用方式上的联合毒性基本符合浓度加和原理,并已经广泛应用于诸如二噁英类污染物的环境管理。因此未来的研究工作不仅需要研究复杂体系中各组分的相互作用,更需要了解这种相互作用的毒理学机制,认识混合体系中单个组分的作用方式,及其发挥联合作用的过程机理。已经有很多研究者利用定量活性结构关系(quantitative structure-activity relationship,QSAR)模型预测未经过毒性测试的新型化合物的毒性,以此评价其在混合物中的联合效应类型[95],这也成为联合毒性研究极有潜力的分支之一。可以预期,环境组学、计算毒理学方法与靶向毒性测试技术的联合应用、多学科知识的融合才可能会导致新的突破。
[1]Escher B I,van Daele C,Dutt M,et al.Most oxidative stress response in water samples comes from unknown chemicals:The need for effect-based water quality trigger values[J].Environmental Science&Technology,2013,47 (13):7002-7011
[2]Yang R S H.Introduction to the toxicology of chemical mixtures[M]//Toxicology of Chemical Mixtures.New York:Academic Press,1994:1-10
[3]Agency for Toxic Substances and Disease Registry(ATSDR).Guidance manual for the assessment of joint toxic action of chemical mixtures[R].Atlanta,GA:ASTDR and USDHHS,2004
[4]Organization for Economic Cooperation and Development (OECD).Harmonised integrated classification system for human health and environmental hazards of chemical substances and mixtures[R].Paris:OECD,2001
[5]United States Environmental Protection Agency(USEPA).Guidelines for the health risk assessment of chemical mixtures[R].Washington DC:Risk Assessment Forum, 1986
[6]United States Environmental Protection Agency(USEPA). Supplementary guidance for conducting health risk assessment of chemical mixtures[R].Washington DC:Risk Assessment Forum,2000
[7]World Health Organization(WHO).Assessment of combined exposures to multiple chemicals:Report of a WHO/ IPCS international workshop on aggregate/cumulative risk assessment[R].Washington DC:WHO,2009
[8]Bliss C I.The toxicity of poisons applied jointly[J].Annals of Applied Biology,1939,26(3):585-615
[9]Hewlett P S,Plackett R L.A unified theory for quantal responses to mixtures of drugs:Non-interactive action[J]. Biometrics,1959,15(4):591-610
[10]Plackett R L,Hewlett P S.A comparison of two approaches to the construction of models for quantal responses to mixtures of drugs[J].Biometrics,1967,23(1):27-44
[11]Ashford J R.General models for the joint action of mixtures of drugs[J].Biometrics,1981,37(3):457-474
[12]World Health Organization(WHO).Health effects of combined exposures in the work environment[R].Geneva:WHO,1981
[13]Teuschler L.Deciding which chemical mixtures risk assessment methods work best for what mixtures[J].Toxicology and Applied Pharmacology,2007,223(2):139-147
[14]Loewe S.Die quantitativen probleme der pharmarkologic [J].Ergebnisse der Physiologie,1928,27(1):47-187
[15]Groten J P.Mixtures and interactions[J].Food and Chemical Toxicology,2000,38(S1):S65-S71
[16]Pöch G.Combined Effects of Drugs and Toxic Agents: Modern Evaluation in Theory and Practice[M].Beilin: Springer,1993
[17]Berenbaum M C.What is synergy?[J].Pharmacological Reviews,1989,41(2):93-141
[18]Zhang Y H,Liu S S,Song X Q,et al.Prediction for the mixture toxicity of six organophosphorus pesticides to the luminescent bacterium Q67[J].Ecotoxicology and Environmental Safety,2008,71(3):880-888
[19]Ven Leeuwen C J.Ecotoxicological Effects,in Risk Assessment of Chemicals:An Introduction[M].Dordrecht: Kluwer Academic Publishers,1995:175–237
[20]Berenbaum M C.The expected effect of a combination of agents:The general solution[J].Journal of Theoretical Biology,1985,114(3):413-431
[21]Teuschler L K,Hertzberg R C.Current and future risk assessment guidelines,policy,and methods development for chemical mixtures[J].Toxicology,1995,105(2– 3): 137-144
[22]Evans R M,Scholze M,Kortenkamp A.Examining the feasibility of mixture risk assessment:A case study using a tiered approach with data of 67 pesticides from the Joint FAO/WHO Meeting on Pesticide Residues(JMPR)[J]. Food and Chemical Toxicology,2015,84:260-269
[23]Sprague J B,Ramsay B A.Lethal levels of mixed copper–zinc solutions for juvenile salmon[J].Journal of the Fisheries Research Board of Canada,1965,22(2):425-432
[24]Marking L L,Dawson V K.Method for assessment of toxicity or efficacy of mixtures of chemicals[R].Washington DC:US Fish and Wildlife Service,1975
[25]Van den Berg M,Birnbaum L,Bosveld A T C,et al.Toxic equivalency factors(TEFs)for PCBs,PCDDs,PCDFs for humans and wildlife[J].Environmental Health Perspectives,1998,106(12):775-792
[26]Van Loon W M G M,Verwoerd M E,Wijnker F G,et al. Estimating total body residues and baseline toxicity of complex organic mixtures in effluents and surface waters [J].Environmental Toxicology and Chemistry,1997,16 (7):1358-1365
[27]Fulladosa E,Murat J C,Villaescusa I.Study on the toxicity of binary equitoxic mixtures of metals using the luminescent bacteria as a biological target[J].Chemosphere, 2005,58(5):551-557
[28]Payne J,Rajapakse N,Wilkins M,et al.Prediction and assessment of the effects of mixtures of four xenoestrogens [J].Environmental Health Perspectives,2000,108(10): 983-987
[29]Silva E,Rajapakse N,Kortenkamp A.Something from" nothing"-eight weak estrogenic chemicals combined at concentrations below NOECs produce significant mixture effects[J].Environmental Science&Technology,2002, 36(8):1751-1756
[30]Arcaro K F,Vakharia D D,Yang Y,et al.Lack of synergy by mixtures of weakly estrogenic hydroxylated polychlorinated biphenyls and pesticides[J].Environmental Health Perspectives,1998,106(S4):1041-1046
[31]Payne J,Scholze M,Kortenkamp A.Mixtures of four organochlorines enhance human breast cancer cell proliferation[J].Environmental Health Perspectives,2001,109(4): 391-397
[32]Brian J V,Harris C A,Scholze M,et al.Accurate prediction of the response of freshwater fsh to a mixture of estrogenic chemicals[J].Environmental Health Perspectives,2005,113(6):721-728
[33]Sun L W,Zha J M,Wang Z J.Interactions between estrogenic chemicals in binary mixtures investigated using vitellogenin induction and factorial analysis[J].Chemosphere,2009,75(3):410-415
[34]Ribeiro C,Urbatzka R,Castro L F C,et al.In vitro exposure of Nile tilapia(Oreochromis niloticus)testis to estrogenic endocrine disrupting chemicals:mRNA expression of genes encoding steroidogenic enzymes[J].Toxicology Mechanisms and Methods,2012,22(1):47-53
[35]Ramamoorthy K,Vyhlidal C,Wang F,et al.Additive estrogenic activities of a binary mixture of 2',4',6'-trichloro-and 2',3',4',5'-tetrachloro-4-biphenylol[J].Toxicology and Applied Pharmacology,1997,147(1):93-100
[36]Pohjanvirta R,Tuomisto J.The toxic equivalency principle and its application in dioxin risk assessment[M]//The AH Receptor in Biology and Toxicology.Hoboken:John Wiley&Sons,Inc,2011:317-330
[37]Jarošová B,Bláha L,Giesy J P,et al.What level of estrogenic activity determined by in vitro assays in municipal waste waters can be considered as safe?[J].Environment International,2014,64:98-109
[38]Vuc̆inic'S,Antonijevic'B,Brkic'D.Occupational and environmental aspects of organophosphorus compounds [M]//Basic and Clinical Toxicology of Organophosphorus Compounds.London:Springer,2014:213-244
[39]Jung K H,Yan B,Chillrud S N,et al.Assessment of benzo(a)pyrene-equivalent carcinogenicity and mutagenicity of residential indoor versus outdoor polycyclic aromatic hydrocarbons exposing young children in New York City[J].International Journal of Environmental Research and Public Health,2010,7(5):1889-1900
[40]Mumtaz M M,DeRosa C T.Approaches and challenges in risk assessment of chemical mixtures[M]//Toxicology of Chemical Mixtures.San Diego:Academic Press,1994: 565-598
[41]Faust M,Altenburger R,Backhaus T,et al.Joint algal toxicity of 16 dissimilarly acting chemicals is predictable by the concept of independent action[J].Aquatic Toxicology,2003,63(1):43-63
[42]Backhaus T,Arrhenius A,Blanck H.Toxicity of a mixture of dissimilarly acting substances to natural algal communities:Predictive power and limitations of independent action and concentration addition[J].Environmental Science&Technology,2004,38(23):6363-6370
[43]Junghans M.Studies on combination effects of environmentally relevant toxicants[D].Bremen:University of Bremen,2004:78-106
[44]Ra J S,Lee B C,Chang N I,et al.Estimating the combined toxicity by two-step prediction model on the complicated chemical mixtures from wastewater treatment plant effluents[J].Environmental Toxicology and Chemistry,2006,25(8):2107-2113
[45]Altenburger R,Walter H,Grote M.What contributes to the combined effect of a complex mixture?[J].Environmental Science&Technology,2004,38(23):6353-6362
[46]Chen C Y,Lu C L.An analysis of the combined effects of organic toxicants[J].Science of the Total Environment, 2002,289(1–3):123-132
[47]Fulladosa E,Murat J-C,Villaescusa I.Study on the toxicity of binary equitoxic mixtures of metals using the luminescent bacteriaVibrio fischerias a biological target[J]. Chemosphere,2005,58(5):551-557
[48]Yang R,Li N,Ma M,et al.Combined effects of estrogenic chemicals with the same mode of action using an estrogen receptor binding bioassay[J].Environmental Toxicology and Pharmacology,2014,38(3):829-837
[49]Ermler S,Scholze M,Kortenkamp A.The suitability of concentration addition for predicting the effects of multicomponent mixtures of up to 17 anti-androgens with varied structural features in an in vitro AR antagonist assay [J].Toxicology and Applied Pharmacology,2011,257(2): 189-197
[50]Olmstead A W,LeBlanc G A.Joint action of polycyclic aromatic hydrocarbons:Predictive modeling of sublethal toxicity[J].Aquatic Toxicology,2005,75(3):253-262
[51]Hodges G,Roberts D W,Marshall S J,et al.Defining the toxic mode of action of ester sulphonates using the joint toxicity of mixtures[J].Chemosphere,2006,64(1):17-25
[52]Baylay A J,Spurgeon D J,Svendsen C,et al.A metabolomics based test of independent action and concentration addition using the earthwormLumbricus rubellus[J].Ecotoxicology,2012,21(5):1436-1447
[53]Suzuki T,Ide K,Ishida M.Response of MCF-7 human breast cancer cells to some binary mixtures of oestrogenic compounds in-vitro[J].Journal of Pharmacy and Pharmacology,2001,53(11):1549-1554
[54]Rajapakse N,Silva E,Scholze M,et al.Deviation from additivity with estrogenic mixtures containing 4-nonylphenol and 4-tert-octylphenol detected in the E-SCREEN assay[J].Environmental Science&Technology,2004,38 (23):6343-6352
[55]Silva E,Rajapakse N,Scholze M,et al.Joint effects of heterogeneous estrogenic chemicals in the E-Screen-exploring the applicability of concentration addition[J]. Toxicological Sciences,2011,122(2):383-394
[56]Arnold S F,Bergeron J M,Tran D Q,et al.Synergistic responses of steroidal estrogens in vitro(yeast)and in vivo(turtles)[J].Biochemical and Biophysical Research Communications,1997,235(2):336-342
[57]Bergeron J M,Crews D,McLachlan J A.PCBs as environmental estrogens:Turtle sex determination as a biomarker of environmental contamination[J].Environmental Health Perspectives,1994,102(9):780-781
[58]Tinwell H,Ashby J.Sensitivity of the immature rat uterotrophic assay to mixtures of estrogens[J].Environmental Health Perspectives,2004,112(5):575-582
[59]Vijver M G,Peijnenburg W J G M,Snoo G R D.Toxicological mixture models are based on inadequate assumptions[J].Environmental Science&Technology,2010(44): 4841-4842
[60]Backhaus T,Faust M.Predictive environmental risk assessment of chemical mixtures:A conceptual framework [J].Environmental Science&Technology,2012,46(5): 2564-2573
[61]Cedergreen N,Christensen A M,Kamper A,et al.A review of independent action compared to concentration addition as reference models for mixtures of compounds with different molecular target sites[J].Environmental Toxicology and Chemistry,2008,27(7):1621-1632
[62]Spurgeon D J,Jones O A H,Dorne J-L C M,et al.Systems toxicology approaches for understanding the joint effects of environmental chemical mixtures[J].Science of the Total Environment,2010,408(18):3725-3734
[63]Cassee F R,S u¨hnel J,Groten J P,et al.Toxicology of chemical mixtures[M]//General and Applied Toxicology. London:Macmillan Reference Ltd,1999:303-319
[64]Groten J P,Tajima O,Feron V J,et al.Toxicology of chemical mixtures:International perspective[J].Environmental Health Perspectives,1998,106(S6):1281-1289
[65]Finney D J.Probit Analysis[M].London:Cambridge U-niversity Press,1952
[66]Keplinger M L,Deichmann W B.Acute toxicity of combinations of pesticides[J].Toxicology and Applied Pharmacology,1967,10(3):586-595
[67]Smyth Jr H F,Weil C S,West J S,et al.An exploration of joint toxic action:Twenty-seven industrial chemicals intubated in rats in all possible pairs[J].Toxicology and Applied Pharmacology,1969,14(2):340-347
[68]Li X F,Zhou Q X,Luo Y,et al.Joint action and lethal levels of toluene,ethylbenzene,and xylene on midge (Chironomus plumosus)larvae[J].Environmental Science and Pollution Research,2013,20(2):957-966
[69]Mori I C,Arias-Barreiro C R,Koutsaftis A,et al.Toxicity of tetramethylammonium hydroxide to aquatic organisms and its synergistic action with potassium iodide[J]. Chemosphere,2015,120:299-304
[70]曾鸣,林志芬,尹大强,等.混合污染物联合毒性研究进展[J].环境科学与技术,2009(2):80-86 Zeng M,Lin Z F,Yin D Q,et al.Progress on joint effect of mixture pollutants[J].Environmental Science&Technology,2009(2):80-86(in Chinese)
[71]Altenburger R,Nendza M,Schüürmann G.Mixture toxicity and its modeling by quantitative structure-activity relationships[J].Environmental Toxicology and Chemistry, 2003,22(8):1900-1915
[72]Groten J P,Tajima O,Feron V J,et al.Statistically designed experiments to screen chemical mixtures for possible interactions[J].Environmental Health Perspectives, 1998,106(S6):1361-1365
[73]Greco W R,Bravo G,Parsons J C.The search for synergy:A critical review from a response surface perspective [J].Pharmacological Reviews,1995,47(2):331-385
[74]Charles G D,Gennings C,Zacharewski T R,et al.An approach for assessing estrogen receptor-mediated interactions in mixtures of three chemicals:A pilot study[J]. Toxicological Sciences,2002,68(2):349-360
[75]李小朋,张琛,李娟,等.基于析因设计的多种重金属对发光菌联合毒性研究[J].环境科学与技术,2012,35 (12):169-174 Li X P,Zhang C,Li J,et al.Joint toxicity of multi-heavymetal to photobacterium phosphoreum based on factorial design[J].Environmental Science&Technology,2012,35 (12):169-174(in Chinese)
[76]Rijstenbil J W,Gerringa L J A.Interactions of algal ligands,metal complexation and availability,and cell responses of the diatomDitylum brightwelliiwith a gradual increase in copper[J].Aquatic Toxicology,2002,56(2): 115-131
[77]Jin X W,Wang Y Y,Jin W,et al.Ecological risk of nonylphenol in China surface waters based on reproductive fitness[J].Environmental Science&Technology,2014,48 (2):1256-1262
[78]González-Pleiter M,Gonzalo S,Rodea-Palomares I,et al. Toxicity of five antibiotics and their mixtures towards photosynthetic aquatic organisms:Implications for environmental risk assessment[J].Water Research,2013,47 (6):2050-2064
[79]Altenburger R,Scholz S,Schmitt-Jansen M,et al.Mixture toxicity revisited from a toxicogenomic perspective[J]. Environmental Science&Technology,2012,46(5):2508-2522
[80]Yang R,Li N,Rao K F,et al.Combined action of estrogen receptor agonists and antagonists in two-hybrid recombinant yeast in vitro[J].Ecotoxicology and Environmental Safety,2015,111(1):228-235
[81]章强,辛琦,强丽媛,等铜及其与四环素的联合暴露对斑马鱼胚胎的毒性效应[J].生态毒理学报,2015,10(5): 35-46 Zhang Q,Xin Q,Qiang L Y,et al.Developmental toxicity of Cu and tetracycline on zebrafish embryos(Danio Rerio)[J].Asian Journal of Ecotoxicology,2015,10(5):35-46(in Chinese)
[82]吴寅,吴永贵,马岚,等.水体酸化条件下Cu(II)对斑马鱼胚胎的毒性效应[J].生态毒理学报,2013,8(3):389-394 Wu Y,Wu Y G,Ma L,et al.Toxic effect of Cu(II)on zebrafish embryos under water acidification condition[J]. Asian Journal of Ecotoxicology,2013,8(3):389-394(in Chinese)
[83]United States Department of Health and Human Services (USDHHS).Guidance manual for the assessment of joint toxic action of chemical mixtures(DRAFT)[R].Washington DC:USDHHS,2001
[84]Teorell T.Kinetics of distribution of substances administered to the body.I:The extravascular modes of administration[J].Arch Int Pharmacodyn,1937,57:205-225
[85]Leahy D E.Progress in simulation modelling for pharmacokinetics[J].Current Topics in Medicinal Chemistry, 2003,3(11):1257-1268
[86]Parrott N,Jones H,Paquereau N,et al.Application of full physiological models for pharmaceutical drug candidate selection and extrapolation of pharmacokinetics to man [J].Basic and Clinical Pharmacology and Toxicology, 2005,96(3):193-199
[87]Roy A.Mechanistic modeling of transport and metabolism in physiological systems[D].Washington DC:Rutgers University,1997:1-7
[88]Mumtaz M,Fisher J,Blount B,et al.Application of physiologically based pharmacokinetic models in chemical risk assessment[J].Journal of Toxicology,2012,DOI:10. 1155/2012/904603.
[89]Haddad S,Béliveau M,Tardif R,et al.A PBPK modeling-based approach to account for interactions in the health risk assessment of chemical mixtures[J].Toxicological Sciences,2001,63(1):125-131
[90]Hertzberg R C,Rice G,Teuchler L K.Methods for health risk assessment of combustion mixtures[M]//Hazardous Waste Incineration:Evaluating the Human Health and Environmental Risks.Boca Raton,FL:Lewis Publishers, 1999:105-148
[91]Pohl H R,Mumtaz M M,Scinicariello F,et al.Binary weight-of-evidence evaluations of chemical interactions—15 years of experience[J].Regulatory Toxicology and Pharmacology,2009,54(3):264-271
[92]Nisbet R M,Muller E B,Lika K,et al.From molecules to ecosystems through dynamic energy budget models[J]. Journal of Animal Ecology,2000,69(6):913-926
[93]Jager T,Vandenbrouck T,Baas J,et al.A biology-based approach for mixture toxicity of multiple endpoints over the life cycle[J].Ecotoxicology(London,England),2010, 19(2):351-361
[94]Baas J,Jager T,Kooijman B.A review of DEB theory in assessing toxic effects of mixtures[J].Science of the Total Environment,2010,408(18):3740-3745
[95]Kim J,Kim S.State of the art in the application of QSAR techniques for predicting mixture toxicity in environmental risk assessment[J].SAR and QSAR in Environmental Research,2015,26(1):41-59
Review on Methodology for Environmental Mixture Toxicity Study
Yang Rong1,2,Li Na2,Rao Kaifeng2,Ma Mei2,*,Wang Zijian2
1.Beijing Water Quality Monitoring Center for South-to-North Water Diversion,Beijing 100195,China
2.Key Laboratory of Drinking Water Science and Technology,Research Center for Eco-Environmental Sciences,Chinese Academy of Sciences,Beijing 100085,China
25 November 2015 accepted 8 January 2016
Both human and wild animals are simultaneously exposed to numbers of environmental pollutants,and via multiple exposure pathways.The adverse effect of single chemical could sometimes be ignored due to its low environmental concentration.However the effects of co-existing multiple chemicals could not be negligible because of the so-called“something from nothing”phenomenon.Therefore the joint toxicity of a mixture arouse to be a hot topic,especially on the additive and potential synergistic actions of environmental mixtures.A numbers of mathematical or biological models have been developed and applied to investigate the combined effects of environmental pollutants.In this review paper,widely used and newly emerging models were evaluated on their suitability to the circumstances,and the future challenges in toxicology of chemical mixture research and their applications in environmental management were discussed.
environmental mixture;combined effects;mode of action;model prediction
2015-11-25 录用日期:2016-01-08
1673-5897(2016)1-001-13
X171.5
A
10.7524/AJE.1673-5897.20151125002
杨蓉,李娜,饶凯锋,等.环境混合物的联合毒性研究方法[J].生态毒理学报,2016,11(1):1-13
Yang R,Li N,Rao K F,et al.Review on methodology for environmental mixture toxicity study[J].Asian Journal of Ecotoxicology,2016,11(1):1-13(in Chinese)
自然科学基金重点课题(No.51290283);自然科学基金青年基金(No.21307131);国家高技术研究发展计划项目(No.2014AA06A506)
杨蓉(1987-),女,博士,研究方向为水生态毒理学,E-mail:ygrg1987@gmail.com;
),E-mail:mamei@rcees.ac.cn
简介:马梅(1967—),女,博士,研究员,博士生导师,主要从事水生态毒理学研究。
