类二噁英物质及芳香烃受体(AhR)介导的有害结局路径(AOP)研究进展
2016-12-06魏凤华张俊江夏普张效伟于红霞
魏凤华,张俊江,夏普,张效伟,于红霞
南京大学环境学院污染控制与资源化研究国家重点实验室,南京210023
类二噁英物质及芳香烃受体(AhR)介导的有害结局路径(AOP)研究进展
魏凤华,张俊江,夏普,张效伟*,于红霞
南京大学环境学院污染控制与资源化研究国家重点实验室,南京210023
二噁英及类二噁英物质(dioxin-like compounds,DLCs)是一类高毒性化合物的统称,对其毒理学的研究一直都是备受关注的焦点。已有证据表明,高毒二噁英及DLCs主要通过激活芳香烃受体(aryl hydrocarbon receptor,AhR),进而导致一系列生物毒性。近年来越来越多的新型有机污染物被发现具有类二噁英分子结构并存在潜在生物毒性或活性。与此同时,如何评估二噁英及DLCs对本土生态生物的危害及其风险也受到更多关注。本文综述了近几年发现的新型二噁英物质、二噁英及DLCs的AhR致毒机制、相应的有害结局路径(adverse outcome pathway,AOP)及AOP在指导探索新型物质及物种敏感性方面上的新观点和发现,同时也展望了二噁英及DLCs在生态毒理及风险评估领域的未来研究方向。
类二噁英物质;多溴联苯醚;多氯代联苯硫醚;新型污染物;芳香烃受体;致毒机制;物种敏感性分布
二噁英及类二噁英物质(dioxin-like compounds, DLCs)通常被认为是一类具有高毒性的物质,能引起人和野生动物的生殖及发育毒性、免疫毒性、肝毒性及致癌、体重减少、胸腺萎缩、皮肤病变等[1-6]。二噁英及DLCs的致毒机理主要是通过激活芳香烃受体(aryl hydrocarbon receptor,AhR)通路来进行调控的,AhR被配体激活后进入细胞核与AhR核转位因子(aryl hydrocarbon receptor nuclear translocator, ARNT)形成二聚体后特异性地识别结合到二噁英响应元件(dioxin response element,DRE)上,诱导下游基因的表达,从而产生相关毒性[7]。尽管一些不能激活AhR的DLCs也可能导致神经毒性和免疫毒性效应,但是这一般需要很高的暴露浓度,因此在实际的化学品管理中重要性不高[8-9]。
近年来越来越多的新型有机污染物具有类二噁英的分子结构并存在潜在的生物毒性[10-13]。当今新型有机污染物的种类和数量逐年急剧增加,其生态危害和环境风险具有很高的不确定性[14]。其中一个重要的科学问题是这些物质中是否会有类似二噁英的高毒物质。然而对这些物质开展传统的动物测试毫无现实性。如何通过分子致毒机制和高通量测试技术来识别新型有毒污染物并预测其生态危害已成为当前国际上生态毒理学研究的热点。
如何评估二噁英及DLCs对本土生物的危害及其生态风险也受到更多关注。以往对二噁英及DLCs毒理学的研究主要是通过模式生物来开展的,而证据显示野生动物对二噁英及DLCs的毒性反应表现出显著的差异[15-18]。从环境管理的角度,保护生态系统健康首先是保护敏感性的生态物种,近年来越来越多的研究开始关注于二噁英及DLCs对野生生物的毒性敏感性差异的机制[15-16,19-20]。
随着对二噁英及DLCs分子毒理学的深入研究,其致毒机制和模式逐渐清晰。这些研究的积累勾画出二噁英及DLCs通过激活AhR诱导毒性的有害结局路径(adverse outcome pathway,AOP)。此AOP作为连接分子启动事件和有害结局之间的框架[21],可为研究新型化合物的毒性及物种间敏感性提供一定指导。
1 二噁英及新型二噁英物质(Dioxins and emerging dioxin-like pollutants)
二噁英及DLCs主要包括多氯二苯并对二噁英(polychlorinated dibenzo-p-dioxins,PCDDs)、多氯二苯并呋喃(polychlorinated dibenzo-furans,PCDFs)、多氯联苯(polychorinated biphenyls,PCBs)和多环芳烃(polycyclic aromatic hydrocarbons,PAHs)等持久性有机污染物,分别有75种、135种、208种及200余种异构体[13]。由于当今新型有机污染物的种类和数量每年急速增长,并随着相关检测技术的发展,越来越多的化学物质被发现具有二噁英活性。最近,通过H4IIE-luc报告基因法[22]和鸟的AhR1-LRG报告基因法[23]发现了3种重要的新型二噁英物质,即甲氧基化多溴联苯醚(methoxylated polybrominated diphenyl ethers,MeO-PBDEs)、羟基化多溴联苯醚(hydroxylated polybrominated diphenyl ethers,OH-PBDEs)[12]和多氯代联苯硫醚(polychlorinated diphenyl sulfides,PCDPSs)[13]。
1.1 MeO-/OH-PBDEs
MeO-PBDEs和OH-PBDEs作为最近被发现的具有二噁英类活性的化合物,是多溴联苯醚(polybrominated diphenyl ethers,PBDEs)的甲氧基化和羟基化衍生物。它们也是一种新型的环境有机类污染物,近年来越来越受到社会各界的广泛关注[12]。PBDEs作为常见的添加型溴代阻燃剂,在环境中被大量检出[24-29]。因PBDEs与二噁英类化合物结构极为相似,大量的研究探索其是否为新型二噁英物质,但结果显示这类化合物并无二噁英类活性,即使表现的微弱效应也是由其他杂质造成的[30-33]。
而后来研究发现PBDEs的衍生物MeO-PBDEs和OH-PBDEs具有二噁英类活性,并且发现它们的二噁英活性对不同鸟类具有敏感性差异。Su等[12]利用报告基因法将34种PBDEs衍生物(15种MeOPBDEs和19种OH-PBDEs)暴露于H4IIE-luc细胞,首次发现了PBDEs衍生物能够诱导显著的AhR活性,结果显示:34种测试物质有19种表现出二噁英活性,其中5-C1-6-HO-BDE-47的相对毒性效力(relative potency,ReP)最大,与八氯代二苯并二噁英(OCDD)和八氯代二苯并呋喃(OCDF)的毒性当量因子(TEF)相当;并且发现OH-官能团和MeO-官能团相比,可以诱导更大的AhR活性,这和其他文献报道的MeO-和OH-官能团的加入会大大加强化合物的AhR效应的结果相一致[34]。可见OH-和MeO-官能团的加入使得PBDEs具有了极强的二噁英活性。张睿[35]用鸟的 AhR1-LRG报告基因法对 19种MeO-/OH-PBDEs二噁英活性的鸟类种间敏感性进行了研究,结果表明:1)不同鸟对同一MeO-/OH-PBDEs的敏感性不同;2)部分MeO-/OH-PBDEs二噁英毒性的鸟类种间敏感性排序与典型二噁英化合物也不一致;3)基于H4IIE-luc试验推导的MeO-/OH-PBDEs的毒性效力比鸟类毒理试验得到的小1~4个数量级,这与典型二噁英化合物的情况一致。
1.2 PCDPSs
PCDPSs作为一种新型二噁英活性化合物,其结构与多氯联苯醚和多溴联苯醚极其相似,共有209种同素异构体。PCDPSs两个苯环之间由硫原子连接,化学通式为C12H10-xSClx(x=1~10)。其可在冶炼厂的灰渣、垃圾焚烧炉的烟道废气、纸浆废水、长江下游水和表层底泥中被检出[36-38]。
通过研究发现部分PCDPSs具有二噁英活性,并且发现PCDPSs的二噁英活性规律与PCDD/Fs、PCBs相似。夏洁[13]使用H4IIE-luc受体报告基因法,对19种PCDPSs的毒性进行研究,发现15种PCDPSs具有二噁英类活性,8种的二噁英活性最显著,ReP值为5.1×10-8~3.2×10-5,AhR受体活性最高的PCDPSs的ReP值(ReP=10-5)比四氯二苯并-p-二噁英(TCDD)的ReP值(ReP=l)低105倍;且除了2,4,4 ',5-TrisCDPS和2,2',3,3',4,5,6-HeptaCDPS的ReP值与WHO公布的单临位 PCBs相当外,其他的PCDPSs的 ReP值均比 PCBs低;另外,19种PCDPSs的二噁英活性规律与PCDD/Fs、PCBs相似,低于四氯取代的PCDD/Fs、PCBs均不会激活芳香烃受体活性,这可能与AhR-LBD域氨基酸残基通过疏水作用所形成的口袋有关。Zhang等[39]使用鸟类AhR1-LRG试验对18种PCDPSs的二噁英活性进行分析,证实了它们能够诱导二噁英类活性,且具有很大的种间敏感性差异。并发现PCDPSs对鸡、环颈雉和日本鹌鹑的毒性效力均随着氯代水平的提高呈现上升趋势。部分PCDPSs类二噁英毒性的鸟类种间敏感性排序与典型二噁英的情况不同,这可能与鸟类AhR1-LBD域氨基酸序列的差异及配体化合物结构的差异有关。
2 二噁英及DLCs的AhR相关毒性机制(AhR toxic mechanism of dioxins and DLCs)
1976年,Poland等[40]首次发现了TCDD的毒性主要是由于其可与AhR特异性地结合。其后大量研究表明,具有高毒性的二噁英及DLCs的作用主要是通过激活 AhR,进而引起各种相关毒性[41-43]。并且二噁英及DLCs在不同物种间和物种内的毒性存在着敏感性差异。由于AhR经过长期的复制和多样化,产生了各种差异,虽然同一物种的AhR结构特性有着广泛的保守性,但结构上细微的差异会导致功能上巨大的不同[44]。
2.1 AhR简介
AhR属于碱性螺旋-环-螺旋(basic helix loop helix,bHLH)PER-ARNT-SIM同源域(PER-ARNT-SIM, PAS)蛋白超家族[45]。AhR是一个依赖配体激活的转录因子,主要由DNA结合域(DNA-binding domain,DBD)、配体结合域(ligand binding domain, LBD)和反式激活域(transactivation domain,TAD)组成[46]。
AhR在无脊椎动物中并没有结合二噁英及DLCs的能力,但在脊椎动物中能够结合二噁英类物质,并且AhR基因经过长期的复制和多样化,导致产生了至少3个AhR基因家族—AhR1、AhR2和芳香烃受体抑制因子(AhRR)[47-48]。AhR1最先在C57BL/6小鼠的肝中被发现,后来发现在所有的脊椎动物中都含有AhR1并具均有转录活性[49]。和哺乳动物(包括人类)只有AhR1不同[50],其他脊椎动物不只有AhR1,还有AhR2,只是在不同物种中两者的表达活性不同。鸟的AhR1和AhR2虽然都具有转录活性,但AhR2转录活性低,即AhR1在鸟中占主导[51]。而对于鱼来说,二噁英通过AhR介导的毒代动力学更复杂。鱼至少有3个AhR(AhR1、AhR2和AhR3),并且每个 AhR又都包括多个亚型[52]。AhR1、AhR2最初在鳉鱼中被确认[44,53],大多数硬骨鱼类中,AhR2显示是活化型,而AhR1不能被二噁英类化合物结合和激活[54]。后来发现AhR1的亚型AhR1B邻近AhR2,并且在斑马鱼胚胎中可表达,而这与二噁英类化合物无关,即AhR1B在斑马鱼的胚胎发育中起着重要的生理作用[43]。另外AhR3的作用至今还没有确认,仅仅知道在一些软骨鱼类中可以表达[47]。AhRR是AhR作用的抑制因子,AhRR本身不结合AhR受体,但AhRR和AhR在bHLH和PAS-A域有着高度的序列一致性[48,55-56]。AhRR有些功能与AhR类似,在卤代和非卤代芳香烃化合物激活AhR1或者AhR2后,其表达可被诱导,与AhR竞争可用的ARNT结合位点,形成没有转录活性的AhRR/ARNT二聚体,并可以结合DRE来抑制DRE启动子[48,57]。另外鳉鱼的 AhRR可以抑制AhR1和AhR2的反式激活作用[48]。AhRR功能在鱼类和哺乳动物的进一步表征,可有助于理解在暴露于芳香烃化合物后,引起物种间及细胞类型差异的机制。
2.2 AhR经典作用机制
AhR活性的毒性机制研究由来已久,其毒性调控过程主要包括4个步骤:胞浆复合物形成、AhR转运、AhR异源二聚化及CYP1A的诱导表达[43]。但由于AhR基因经过长期的复制和多样化,导致其在不同物种中的形态和功能产生一定差异,再加上AhR的作用通路与其他通路交叉的多样和混杂性,试图描述清楚 AhR的机制比较困难[41]。但根据AhR结构特性的广泛保守性,仍存在着一个经典的核受体机制,具体如下:
正常情况下存在于细胞质中的AhR处于不活跃状态,因为AhR与热休克蛋白(Hsp90)、前列腺素E合成酶3(prostaglandin esynthase,p23)单聚体及乙型肝炎病毒X蛋白2(hepatitis B virus X-associated protein2,XAP2)形成多蛋白复合体[58-60],参与屏蔽核定位信号。当外源性配体进入细胞后,与AhR结合。接着进入细胞核,AhR从Hsp90复合体上解离下来,再与 ARNT形成异质二聚体[59-61]。而由于Hsp90复合体的解离使得AhR的DNA结合位点暴露出来,此DNA结合位点可特异性地识别结合DNA上的DRE,从而AhR/ARNT异质二聚体结合在DRE上并启动下游靶基因,如编码CYP1A1、醌还原酶的基因表达[43,62],由此诱导相应的生物毒性。
3 AhR的有害结局路径(Adverse outcome pathway of AhR)
随着对AhR的分子生物学机制和二噁英及DLCs的致毒模式的深入研究,通过对这些研究数据进行整合勾画出二噁英及DLCs通过激活AhR受体诱导毒性的AOP,它是连接分子启动事件、细胞、器官、组织、个体和最终有害结局之间的框架[21]。这种AOP框架能为预测新型污染物和物质的种间敏感性差异提供基础,进而为生态毒理学的预测方法和生态风险评估的更广泛使用提供保障。

图1 AhR介导的有害结局路径示意图Fig.1 Adverse outcome pathway(AOP)mediated by AhR
AOP是一个概念性的框架,通过整合现有的不同生物组织水平的生态毒理信息,描述了直接分子启动事件和有害结局直接的联系,从而使得评估结果更加有效[21]。即AOP描述了从一个分子启动事件开始,经过对细胞、器官、组织和个体产生的一系列效应,最终在群落水平上导致一个有害结局的过程。分子启动事件(MIE)是在开始有害结局路径时,化学物和机体产生生化作用的一个主锚位。而关键事件(KE)是连接MIE和有害结局之间的多个层次生物组织上的有因果关系或者某种相关关系的事件,这些数据的获得可能来自体外、体内试验或计算模拟系统。
如图1所示,AhR-AOP框架可帮助把二噁英及DLCs通过AhR介导的分子效应和在细胞、器官、个体或者群体水平上观察到的有害结局联系起来。即二噁英及DLCs首先激活AhR这一分子启动事件,导致AhR/ARNT的二聚及相关I相和II相代谢酶的诱导,接着引起细胞、器官、个体上的一连串效应,最终对整个种群产生影响。
二噁英及DLCs能够激活AhR,并同时激活相关代谢酶,引起各种毒性[63]。直接和间接的证据表明二噁英的AOP的分子启动事件就是激活AhR,尽管这个事件还没有被完全确定[21],但有研究发现TCDD的毒性通过AhR启动的直接证据是小鼠被敲除AhR后,对TCDD诱导的毒性具有抵抗力[64],并且对斑马鱼胚胎注射抑制AhR转运蛋白的吗啉代寡核苷酸后,减少和延迟了TCDD的毒性[65]。
二噁英及DLCs在启动AhR关键分子事件后,最关键的一条通路是能诱导持续的AhR/ARNT二聚,从而导致细胞形态发育期间的ARNT和原来的结合对象分离,最终干扰依赖 ARNT的细胞功能[66-67]。比如,HIF-1α作为ARNT的二聚对象,在供氧不足时,与ARNT能形成一个转录因子复合体,来结合DNA上的缺氧反应增强子,激活相关基因的表达,如激活与血管生成有关的血管内皮生长因子,而二噁英及DLCs通过干扰ARNT和HIF-1α的二聚,从而改变心血管的发育和相关功能[68-71]。
二噁英及DLCs还和转录辅助因子作用,改变大量基因的转录,包括增加细胞色素基因(CYP1A)的转录[72]。鸡的CYP1A有2个亚型:CYP1A4和CYP1A5[73]。其中CYP1A4具有芳香烃酶(aromatic enzyme,AE)和脱乙基酶(ethoxy-resorufin-o-deethylase,EROD)的催化特异性。而CYP1A5主要是负责内源性脂肪酸花生四烯酸代谢和特异性催化尿卟啉原的氧化。尿卟啉原氧化会带来羧酸盐卟啉的积累,其对肝脏、肾脏、骨骼和血液等都会带来影响,最终导致尿卟啉症。花生四烯酸能够产生大量活性氧,诱导氧化应激,使得氧化系统和抗氧化系统失衡,导致组织损伤。
AhR的激活还能导致II相代谢酶的诱导,如谷胱苷肽硫转移酶(glutathione S-transferases,GSTs)和半乳糖基转移酶(uridine diphosphate-galactosyl transfer-ase,UDP-GT)。因羟基化多氯联苯(OH-PCBs)与甲状腺激素(T4)比,和甲状腺素运载蛋白(TTR)的亲和力更大,能与T4竞争结合TTR,故PCBs可取代T4,导致 T4代谢和排泄,从而使 T4的含量降低[72,74-75]。同时,PCBs可能会加速新陈代谢和在没有AhR介导下,与一些载体作用(如维生素结合蛋白和TTR),导致维生素A的降低[76-77]。而T4和类维生素A的减少会直接导致器官、个体发育的异常。
二噁英及DLCs的的毒性效应在个体上表现为引起发育异常[78]、胚胎致死[79]、增加不孕症及改变父母行为[80]等,进而降低繁殖率[81],引起种群下降[82]。Kim等[83]研究了TCDD、PCB77和PCB126对日本青鳉胚胎发育毒性,发现心血管发育和功能异常,并且引起幼鱼颅面畸形,心包及卵黄囊水肿并抑制鱼鳔的形成,并且孵化后3 d的半数致死浓度(LC50)分别是8.1 pg·mL-1、0.25 ng·mL-1和0.6μg·mL-1。黄莉等[84]研究了TCDD暴露对小鼠胚胎毒性的影响,发现其可造成着床前胚胎丢失并导致雌性生殖器官的多种生殖激素的紊乱。并且20世纪60年代,人们发现美国的一个水紹人工养殖农场里,水紹不孕,种群下降,研究发现喂食水貂的饲料里含有TCDD和PCBs[85]。Giesy等[86]研究了二噁英类物质对北美五大湖区域鸟的繁殖率的影响,发现秃鹰和污染相对较轻地区的鹰比,繁殖率要低,并且随后在此地区发现了小鹰的畸形[87]。Henny等[88]对北美鱼鹰的数量从历史和现代的角度进行了综述,发现在20世纪50到70年内期间,DDT及PCDD/Fs、PCB等环境持久性有机污染物极大降低了鱼鹰的数量,而由于禁止和减少了此类化合物的生产和使用,目前鱼鹰的数量趋于稳定。二噁英及DLCs对哺乳动物的影响也很严重。大量调查发现世界各大海洋哺乳动物体内,如鲸、海豚、海豹等的体内PCBs浓度比较高,都面临着种群减少的风险[89]。
虽然从20世纪70年代末,全世界范围内开始对二噁英及DLCs的生产和使用进行明令禁止,但由于其具有环境持久性、亲脂性及高度的生物蓄积性,生态危害仍持续存在。并且在中国,PCDD/Fs的污染仍较为严重,并主要存在于沉积物中,其他介质中则相对较少。张烃等[90]对中国苏南25个城市群河流沉积物样品中的二噁英类物质进行了调查, 96%和88%的样点总毒性当量浓度(TEQs)分别超过加拿大和美国环境保护局(EPA)沉积物质量指导值,表明苏南城市群沉积物二噁英及DLCs具有一定生态风险。夏洁[13]对长江和太湖流域环境介质中二噁英类活性进行筛查,发现水样在浓度设置范围内(浓缩50倍)均无二噁英活性,而所有沉积物釆样点均表现出显著的二噁英活性,且高于美国沉积物的二噁英类物质的风险阈值(30 pg·g-1,干重),表明太湖和长江沉积物具有一定的生态和健康风险。Zhang等[91]对中国珠江三角地区的土壤进行二噁英类物质调查发现,62个样品中有27.4%的样品超过了加拿大的背景浓度。
基于AhR介导的AOP的构建为研究新型化合物的作用模式、生态毒性预测及物种间敏感性研究提供了指导性的框架。面对种类和数量急剧增长的各种新型化学物质,探索其中是否存在新AhR配体及物种敏感性是二噁英及DLCs毒理学研究的重要方向之一。而AOP正好为此提供了支撑,可以实现从作用机制到最终生态毒性的反推。我们可以设想:根据新型化合物的关键作用模式,即分子启动事件,和现有已知化合物的AOP模式的进行比对,并辅以相应的细胞、器官、个体及种群水平上的比较,从而能为识别此新型化合物和推断相应的物种敏感性提供可能。进而也许无需传统的生态毒理学实验即可进一步推断此新型化合物可能导致的最终结局效应,最终可为实现此类化合物的生态毒性预测和风险评估提供一定指导。
然而要预测一个化合物是否能够诱导类二噁英毒性,存在以下几种假设:
(1)分子启动事件:化合物能够结合和激活AhR;
(2)需要有显著的效能;
(3)分子启动事件激活是高度专一的,且是最敏感的内源性分子事件;
(4)由于AhR蛋白(序列和构象)基因多样性,生态物种间的对二噁英的毒性敏感性是不同的。
4 AhR-AOP相关的检测方法(Testing method of AhR-AOP)
要实现上述假设,必须有相应的检测方法来支撑。主要包括生物检测方法和化学分析方法两大类。生物检测方法又包括报告基因法和酶活力诱导法(ethoxyresorufin-O-deethylase,EROD)、免疫法等。
目前基于细胞的的体外实验生物测试方法,能够为测试新型二噁英物质和物种敏感性提供有效的技术支持。而传统上是通过大量的活体模式动物实验发现的生态毒性类型和大小来判断其是否为类二噁英物质,这种做法不仅违背动物保护理论,工作量巨大[35],而且对当今数量巨大并一直在增加的新型化合物来说,也是不现实的。这种利用体外实验的动物替代性试验技术,高效价廉,很好地减少了对活体动物长期测试的需要[40]。EROD法作为一种体外实验生物方法,是基于二噁英与AhR结合活化后,经过一系列过程,通过测定激活7-乙氧基-异吩恶唑酮-脱乙基(7-ethoxyresorufin-O-deethylase,EROD)酶的活性,来了解二噁英激活AhR的能力。而由于EROD酶不能由肝细胞内源表达,故其表达量与二噁英的暴露量成存在定量关系。报告基因法是近年来根据AhR受体作用模式发展起来的体外细胞测试法(如H4IIE-luc报告基因法和鸟的AhR1-LRG报告基因法),与EROD法比,灵敏度更高,检测周期更短,更适合大量样品的筛选和半定量测定[92],能为快速发现这些新型二噁英物质提供有效的技术支撑,故目前得到了更广泛的应用。报告基因法是应用基因重组技术,把哺乳动物细胞的细胞色素P450基因(CYP1A1)和萤火虫荧光酶合成,作为报告基因重组到真核细胞内,当二噁英及DLCs进入细胞和AhR结合后,经过一系列过程激活下游的荧光合成酶基因表达[22]。该测定系统合成的荧光素酶表达量及荧光强度与加入的二噁英及DLCs的量成正比,最终测定结果以ReP表示。鸟的AhR1-LRG报告基因法已经在鸡、环颈雉、日本鹌鹑、鸬鹚、黑足信天翁和游隼中应用,并表现出显著的敏感性差异。报告基因法与高通量测试技术结合,为快速探索环境介质中大量存在的潜在二噁英活性物质提供了更加有效的支撑[12,93]。报告基因法还可以和化学方法联合,构成用于识别关键致毒物的技术,即基于毒性测试的污染物鉴别技术(effect directed analysis,EDA)[94]。Shi等[95]和Hu等[96]用EDA的方法分别对长江水源水和中国东部不同地区的自来水厂出水、自来水、煮沸的自来水进行了筛查分析,首先用生物测试方法进行了生物活性测试,对高活性的样品再进行进一步的分级分离,最后用化学仪器定量检测,最终识别出有机氯农药、邻苯二甲酸二丁酯、邻苯二甲酸二异辛酯、双酚A、壬基酚、辛基酚等关键致毒物。细胞水平的相关指标,如T4的检测可使用放射免疫法(RIA)和酶联免疫法(ELISA)。传统上,广泛使用RIA研究锯齿动物的内分泌和毒性,而目前,ELISA已经成为锯齿动物研究常用的方法,对其分析测定则采用高效液相色谱(HLPC)和质谱(MS)[97]。氧化应激的测定主要通过检测活性氧(ROS)、还原型谷胱甘肽(GSH)、脂质过氧化、过氧化物等指标,ROS主要是用荧光进行检测,不过目前出现了基于发光进行检测的技术。GSH水平可由HLPC、毛细管电泳(CE)检测。另外通过荧光或吸收光检测技术可检测脂质过氧化反应。
5 AhR-AOP的物种敏感性(Species sensitivity of AhR-AOP)
由上述可知,AOP反映的是关键分子启动事件及随后产生的细胞、器官、组织、个体和种群水平上效应的框架,可为化合物的物种敏感性差异研究提供指导,进而据此或许可进行跨物种外推的生态风险评估。二噁英及DLCs化合物对大多数脊椎动物具有高毒性,但是不管在物种内还是物种间敏感性上存在很大的不同[51,98-101]。主要是由于在长期的进化过程中,生物体的遗传变异产生了多种AhR的变形体,虽然脊椎动物的AhR结构特性有着广泛的保守性,但结构上细微的差异会导致功能上巨大的不同[42],即导致了对二噁英及DLCs的生化和毒性效应的敏感性差异[50,102]。而这种差异是由AhR配体结合区域的氨基酸序列和构象的不同导致的。另外不同配体化合物由于不同的分子结构,导致其和AhR的结合力也不同,进而产生不同的物种敏感性。
5.1 敏感性差异
已有大量研究表明,TCDD、PCB77和PCB126等其他二噁英类物质对鸟类的毒效应存在种间敏感性差异[103-106]。对于TCDD来说,发现鸡在鸟类中最敏感,日本鹌鹑的敏感性比鸡低1 000倍[103]。而对于哺乳动物,大鼠对TCDD的敏感性比鸡高1个数量级左右[93,107]。而TCDD对人类AhR的亲和力通常比大多数标准的实验室啮齿类动物低,研究发现,人类细胞的CYP1A1诱导的剂量效应曲线在这些啮齿类动物的右侧,大约10倍左右[104,108]。由TCDD引起的鲑鱼和斑马鱼早期阶段致死率敏感性相差40倍[109]。
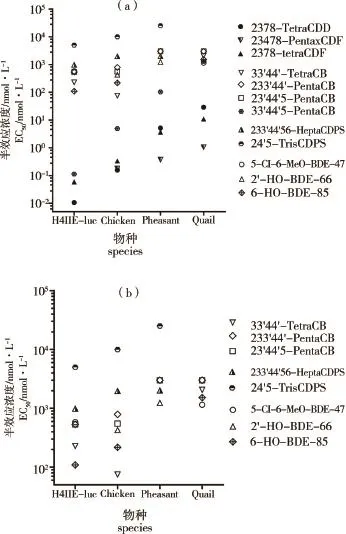
图2 二噁英及DLCs对各个物种的EC50值注:1.数据来自不同文献[35,39,23,110],2.图2-b是图2-a的部分物质数据图。Fig.2 EC50value of dioxins and DLCs to different speciesNote:1.Dates are from different references[35,39,23,110], 2.Fig.2-b is a part of Fig.2-a.
图2 是二噁英及DLCs对大鼠和3种鸟类(鸡、环颈雉、日本鹌鹑)的通过报告基因法得到的半效应浓度(EC50)比较图。显示:
(1)对各个物种间敏感性比较,发现对大多数物质来说,4种物种的敏感性具有一定的差异,浓度相差1~2个数量级左右,特别是对TCDD来说,在4个物种的EC50值相差一个数量级左右。对于大多数物质,3种鸟类中,鸡最敏感,环颈雉次之,日本鹌鹑最弱,分别相差一个数量级左右。而大鼠比鸡的敏感性又高0~1个数量级左右。
(2)对于单个物种,不同二噁英及DLCs的物种敏感性也存在差异。除对 2,3,3',4,4',5,6-Hepta-CDPS、2,3,3',4,4'-PentaCB和2,3',4,4',5-PentaCB物种敏感性在一个数量级内,相差不大外,其他物质的敏感性差别最大可达一个多数量级。
(3)TCDD、2,3,4,7,8-PentaCDF和2,3,7,8-TetraCDF的毒性最强,2,4',5-TrisCDPS的毒性最弱。
通过图2我们可推想,对于某未知新型化合物,若通过报告基因法进行毒性测试,得到的EC50值在某个区间内,我们或许可以通过此EC50的所落区间范围来判断其所属物质类型,实现物质的半定性判断,对化学分析方法起到辅助补充作用。另外,对某已知其结构的化合物,通过其结构上与其他化合物结构的类似性,可以推断此化合物的相应二噁英毒性。并且可以据此进一步对此物质的敏感性和毒性进行跨物种外推。而要实现上述设想,最重要的前提是进行更多化合物和更多物种的二噁英类毒性测试,图中的物质数量太少,判断结果存在很大不确定性。只有建立大量物质和大量物种的毒性数据库,才能为更好的物质毒性识别和判断提供可靠的数据支撑。
5.2 敏感性差异原因
不同的二噁英及DLCs在不同物种间存在很大敏感性差异,导致这种差异的主要原因有两点:(1)化学物质由于其分子结构不同,导致其在同一物种的活性不同;(2)不同物种由于其AhR蛋白序列和构象差异,导致同一化学物质在不同物种中的活性不同。而后者是敏感性差异研究的主要关注点。
对于生态系统,鸟类、哺乳动物及鱼类通常作为主要的研究对象,对于鸟和哺乳动物的敏感性差异机制已经比较清楚,而对于鱼类,由于基因经过长期的进化和多样化,产生了多种AhR变异体,故其敏感性机制比较复杂,目前还不是很清楚。
5.2.1 鸟类
对于鸟类来说,AhR1配体LBD区域的氨基酸序列的差异是引起二噁英及DLCs效应产生鸟类种间敏感性差异的原因[103-106]。
为了进一步说明氨基酸差异在物种敏感性上所起的重要作用,研究发现,鸟AhR1的LBD域的异亮氨酸324(Ile324)位点和丝氨酸380(Ser380)位点的差异决定着二噁英及DLCs诱导的鸟种间敏感性不同[16,106,110-111]。Karchner等[111]研究发现鸡对二噁英类物质的敏感性明显大于燕鸥(约250倍),为评估鸡和欧燕的AhR1-LBD域的3个氨基酸残基(鸡的丙氨酸Ala 257、异亮氨酸Ile324和丝氨酸Ser380,分别对应于欧燕的苏氨酸Thr258、缬氨酸Val325和丙氨酸Ala381)对AhR特性的贡献,通过嵌合AhR蛋白和定点诱变,把欧燕AhR的每个相应的残基变为相对应的鸡的残基,来检测其结合TCDD的能力和反式激活荧光报告基因的能力,结果显示:野生型的欧燕结合TCDD的能力是鸡的20%,欧燕AhR诱变型Thr258Ala(258位点的Thr诱变为Ala)结合TCDD的能力和野生型的相似,而欧燕的诱变型Val325Ile和Ala381Ser结合TCDD的能力趋于鸡;并且反式激活荧光报告基因的能力的结果显示, Thr258Ala诱变型不能激活荧光素酶的转录表达,而诱变型Val325Ile和Ala381Ser能够激活其转录表达,所以鸡的Ile324和Ser380两个氨基酸位点决定此2种鸟对二噁英及DLCs的敏感性差异。Head等[106]为了进一步证明这2个关键氨基酸差异在鸟敏感性上所起的关键作用,在Karchner研究的基础上,选取了更多的鸟类(12种)进行研究,进一步显示了AhR1-LBD的Ile324和Ser380两个关键氨基酸位点能够预测更多鸟的敏感性差异。随后Farmahin等[18]和 Manning等[110]对 86种鸟类对二噁英及DLCs的敏感性和AhR1-LBD域的氨基酸位点进行分析,并从256、257、297、324、337和380六个氨基酸位点中,又一次确认了氨基酸位点 Ile324和Ser380能够影响86种鸟AhR1表达的敏感性。并据此将鸟类分为三大类:高敏感型(Ⅰ型,Ile324_ Ser380)、中敏感型(Ⅱ型,Ile324_Ala380)和低敏感型(Ⅲ型,Val324_Ala380),各个敏感型的代表物种分别为鸡、环形雉、日本鹌鹑。张睿[35]采用Farmahin[23]建立的鸟类AhR1-LRG实验对MeO-/OH-PBDEs鸟类特异的类二噁英毒性及其类二噁英毒性的鸟类种间敏感性差异进行了研究,结果表明,同一MeO-/OHPBDEs对不同鸟类的二噁英毒性存在差异;且由分子动力模拟可知,鸟类AhR1的380和324氨基酸点位会影响4号螺旋的运动和构象的变化,进而影响AhR1的激活,从而导致MeO-/OH-PBDEs在鸟类间的二噁英活性敏感性差异;且Ile324Val诱变型和Ser380Ala诱变型分别增加了鸡AhR1-LBD的空腔体积[111],故二噁英及DLCs的敏感性差异可能与AhR蛋白空腔体积大小有关,另外残基侧链上羟基的氢键等也可能影响二噁英及DLCs的敏感性差异。Farmahin等[18]也研究发现,日本鹌鹑AhR1的氨基酸324位点从Val到Ile(Val324Ile)的诱变可以提高AhR的荧光素酶活性(约12倍)。通过对日本鹌鹑AhR1的氨基酸380位点从Ala到Ser的诱变可以分别提高TCDD和PeCDF的敏感性约25和3.5倍。并同时会导致AhR空腔体积的减少,引起残基侧链上羟基的氢键和双氧桥或配体的氯原子进行相互作用,这些变化可能使得配体-受体的相互作用更稳定[18],从而导致二噁英及DLCs的种间敏感性产生差异。
5.2.2 哺乳动物
研究发现人类的AhR-LBD的苯丙氨酸318 (Phe318)位点和缬氨酸381(Val381)位点在二噁英的敏感性差异上起着关键作用。Goryo等[112]研究了人的AhR的5个氨基酸在敏感性差异上可能起到的作用,发现这些氨基酸通过诱变方法改变为Ala后,通过检测它们的反激活效应发现Phe318Ala完全丢失了活性,而其他点位的活性仅稍微被损坏。并对 318邻近位点进行诱变发现 Ile319Ala和His320Ala诱变型(小鼠的319位点和鸟的324位点是对等的)的活性也完全丧失,显示这两个氨基酸也在配体结合上起着重要作用[112-113]。Ema等[114]发现了人类AhR的381位点(和小鼠AhR的375位点对等)在配体结合上的重要性,由381位点的Val到天门冬氨酸(Asp)的诱变完全丧失了人类AhR的配体结合活性。故二噁英及DLCs对人类敏感性差异的原因是 AhR-LBD的2个氨基酸位点 Phe318和Val381的不同。
5.2.3 鱼类
和鸟类和哺乳动物不同的是,在长期的进化和演变中,鱼类的AhR产生了更多变异体,所以对鱼类来说,二噁英的种间敏感性和AhR氨基酸序列的类似关系还没有确定[52]。斑马鱼是已知的最不敏感的鱼类,和已知的最敏感的鱼类虹鳟鱼比,斑马鱼的胚胎对TCDD的敏感性低40倍[109,115]。在鸟类中, AhR配体结合域的关键氨基酸残基能预测二噁英类化合物的物种敏感性,但不清楚是否类似的预测关系存在于鱼类中[106]。因为虽然二噁英效应在鱼类中也是通过AhR介导,但对于鱼类来说动力学更复杂。鱼至少有3个AhR(AhR1、AhR2和AhR3),并且每个AhR又都包括多个亚型[52]。在大西洋鲑鱼中,共有6种不同的AhR亚型被发现,包括2个AhR1s(α、β)和4个AhR2s(α、β、γ、ζ)[116]。目前主要推测脊椎动物,如一些鱼,包括大马哈鱼,经历了古老基因复制,并且经历了二次复制,从而导致了鱼类的多种AhR分支和多种AhR亚型[117]。且基因复制后的完整冗余功能是不稳定的,随着时间推移会导致复制的基因的失活或功能差异[118]。另外鱼类间的AhR序列和鸟相比,保守性更低,保守性的缺乏使得识别结合配体的关键氨基酸更加困难[52]。
AhR表达的自动调节和AhR蛋白的稳定性已经被证实和鱼类的敏感性有关。然而,目前还不清楚AhR2的上调是否对物种间的AhR激动剂的效应差异存在影响[119]。Wirgin等[120]推测了AhR蛋白构象的不同是大西洋小鳕对二噁英及DLCs产生种间敏感性差异的决定因素。但研究中没有发现大西洋小鳕的LBD氨基酸序列的不同和配体结合的亲和力有关,然而,LBD以外的氨基酸的检测显示影响蛋白的稳定性,因此导致亲和力的降低。
另外关于AhRR、ARNT和Hsp蛋白的表达和功能在决定鱼类对二噁英及DLCs的敏感性差异方面的信息还不完善[120-121]。而鱼类钟间还有AhR动力学的其他未知差异,致使得鱼种间对二噁英及DLCs敏感性差异的原因更加复杂。
6 展望(Prospect)
(1)虽然目前对二噁英及DLCs的毒理学的研究由来已久,包括一个经典的核受体机制。但由于在物种漫长的进化过程中,AhR经过了各种变异,虽然AhR结构特性有着广泛的保守性,但是将其具体致毒机制试图描述清楚还比较困难,并且二噁英及DLCs的各种毒性数据还不齐全,故基于此建立的AOP还需要进一步完善,从而为更好的风险评估提供有效的支持。
(2)二噁英及DLCs在不同的物种间存在显著的敏感性差异,找到最敏感性物种是生态毒理的一个重要任务,而要在我国进行二噁英及DLCs对环境污染物的生态评估,必须加强本土物种的研究,建立基于本土物种的二噁英及DLCs毒性数据,从而为风险评价及基准和标准的制定提供更加有效的数据支持。
(3)本文介绍了最近几年所发现的环境中的新型二噁英物质。而目前环境中的污染物数量巨大,并且一小部分物质具有相关的毒性数据,而大部分物质的毒性数据非常缺乏。故应该进一步开展新型物质的毒性筛查工作,探索新型二噁英物质。
(4)环境中有大量的有机污染具有潜在二噁英类毒性和生态风险。基于物种特异性的报告基因技术,不仅可以用于检测复合暴露条件下有机污染物的二噁英类物质的TEQs,并以EDA方法来鉴别关键有毒物质;此外,采用本土敏感性物种的报告基因法的检测策略,还可以预测二噁英类毒性物质的生态风险。
[1]Burleson G R,Lebrec H,Yang Y G,et al.Effect of 2,3, 7,8-tetrachlorodibenzo-p-dioxin(TCDD)on influenza virus host resistance in mice[J].Toxicological Sciences, 1996,29(1):40-47
[2]Safe S.Polychlorinated biphenyls(PCBs),dibenzo-pdioxins(PCDDs),dibenzofurans(PCDFs),and related compounds:Environmental and mechanistic considerations which support the development of toxic equivalency factors(TEFs)[J].CRC Critical Reviews in Toxicology, 1990,21(1):51-88
[3]杨永滨,郑明辉,刘征涛.二恶英类毒理学研究新进展[J].生态毒理学报,2006,1(2):105-115 Yang Y B,Zheng M H,Liu Z T.Researching advancement of the dioxins toxicology[J].Asian Journal of Ecotoxicology,2006,1(2):105-115(in Chinese)
[4]Moura-Alves P,Faé K,Houthuys E,et al.AhR sensing of bacterial pigments regulates antibacterial defence[J].Nature,2014,512(7515):387-392
[5]许振成,许虹,张素坤,等.2,3,7,8-四氯二苯并对二噁英对大鼠卵巢颗粒细胞雌二醇和孕酮分泌的影响[J].生态毒理学报,2009,4(1):131-135 Xu Z C,Xu H,Zhang S K,et al.Effects of 2,3,7,8-tetrachlorodibenzo-p-dioxin on estradiol and progesterone secretion of ovarian granulosa cells in rats in vitro[J].A-sian Journal of Ecotoxicology,2009,4(1):131-135(in Chinese)
[6]Kennedy G D,Nukaya M,Moran S M,et al.Liver tumor promotion by 2,3,7,8-tetrachlorodibenzo-p-dioxin is dependent on the aryl hydrocarbon receptor and TNF/IL-1 receptors[J].Toxicological Sciences,2014,140(1):135-143
[7]Mandavia C.TCDD-induced activation of aryl hydrocarbon receptor regulates the skin stem cell population[J]. Medical Hypotheses,2015,84(3):204-208
[8]Connor K T,Harris M A,Edwards M R,et al.AH receptor agonist activity in human blood measured with a cellbased bioassay:Evidence for naturally occurring AH receptor ligands in vivo[J].Journal of Exposure Science and Environmental Epidemiology,2008,18(4):369-380
[9]de Waard P W J,Peijnenburg A A C M,Baykus H,et al. A human intervention study with foods containing natural Ah-receptor agonists does not significantly show AhR-mediated effects as measured in blood cells and urine[J]. Chemico-Biological Interactions,2008,176(1):19-29
[10]Bittner M,Hilscherová K,Giesy J P.In vitro assessment of AhR-mediated activities of TCDD in mixture with humic substances[J].Chemosphere,2009,76(11):1505-1508
[11]Bittner M,Macikova P,Giesy J P,et al.Enhancement of AhR-mediated activity of selected pollutants and their mixtures after interaction with dissolved organic matter [J].Environment International,2011,37(5):960-964
[12]Su G,Xia J,Liu H,et al.Dioxin-like potency of HO-and MeO-analogues of PBDEs’the potential risk through consumption of fish from Eastern China[J].Environmental Science&Technology,2012,46(19):10781-10788
[13]夏洁.二恶英类污染物的高通量生物检测技术研究及其在在环境监测中的应用[D].南京:南京大学,2013: 21-31 Xia J.Development of a high throughput bio-analytical method of dioxin-like compounds and its application in environmental monitoring[D].Nanjing:Nanjing University,2013:21-31(in Chinese)
[14]Gavrilescu M,Demnerová K,Aamand J,et al.Emerging pollutants in the environment:Present and future challenges in biomonitoring,ecological risks and bioremediation [J].New Biotechnology,2015,32(1):147-156
[15]Shoots J,Fraccalvieri D,Franks D G,et al.An aryl hydrocarbon receptor from the salamanderAmbystoma mexicanumexhibits low sensitivity to 2,3,7,8-tetrachlorodibenzo-p-dioxin[J].Environmental Science&Technology,2015,49(11):6993–7001
[16]Doering J A,Farmahin R,Wiseman S,et al.Functionality of aryl hydrocarbon receptors(AhR1 and AhR2)of white sturgeon(Acipenser transmontanus)and implications for the risk assessment of dioxin-like compounds[J].Environmental Science&Technology,2014,48(14):8219-8226
[17]Doering J A,Wiseman S,Beitel S C,et al.Identification and expression of aryl hydrocarbon receptors(AhR1 and AhR2)provide insight in an evolutionary context regarding sensitivity of white sturgeon(Acipenser transmontanus)to dioxin-like compounds[J].Aquatic Toxicology, 2014,150:27-35
[18]Farmahin R,Manning G,Crump D,et al.Amino acid sequence of the ligand binding domain of the aryl hydrocarbon receptor 1(AHR1)predicts sensitivity of wild birds to effects of dioxin-like compounds[J].Toxicological Sciences,2013,131(1):139-152
[19]Doering J A,Farmahin R,Wiseman S,et al.Differences inactivation of aryl hydrocarbon receptors of white sturgeon relative to lake sturgeon are predicted by identities of key amino acids in the ligand binding domain[J].Environmental Science&Technology,2015,49(7):4681-4689
[20]Hirano M,Hwang J H,Park H J,et al.Insilico analysis of the interaction of avian aryl hydrocarbon receptors and dioxins to decipher isoform-,ligand-,and species-specific activations[J].Environmental Science&Technology, 2015,49(6):3795-3804
[21]Ankley G T,Bennett R S,Erickson R J,et al.Adverse outcome pathways:A conceptual framework to support ecotoxicology research and risk assessment[J].Environmental Toxicology and Chemistry,2010,29(3):730-741
[22]张诺,孙韶华,王明泉,等.荧光素酶表达基因法(CALUX)用于二噁英检测的研究进展[J].生态毒理学报,2014,9(3):391-397 Zhang N,Sun S H,Wang M Q,et al.Research progress of dioxins'detection using chemical-luciferase gene expression(CALUX)[J].Asian Journal of Ecotoxicology, 2014,9(3):391-397(in Chinese)
[23]Farmahin R,Wu D,Crump D,et al.Sequence and in vitro function of chicken,ring-necked pheasant,and Japanese quail AHR1 predict in vivo sensitivity to dioxins[J].Environmental Science&Technology,2012,46(5):2967-2975
[24]Sinkkonen S,Rantalainen A L,Paasivirta J,et al.Polybrominated methoxy diphenyl ethers(MeO-PBDEs)in fish and guillemot of Baltic,Atlantic and Arctic environments[J].Chemosphere,2004,56(8):767-775
[25]Haglund P S,Zook D R,Buser H R,et al.Identification and quantification of polybrominated diphenyl ethers and methoxy-polybrominated diphenyl ethers in Baltic biota [J].Environmental Science&Technology,1997,31(11): 3281-3287
[26]Verreault J,Gabrielsen G W,Chu S,et al.Flame retardants and methoxylated and hydroxylated polybrominated diphenyl ethers in two Norwegian Arctic top predators: Glaucous gulls and polar bears[J].Environmental Science &Technology,2005,39(16):6021-6028
[27]Olsson A,Ceder K,Bergman Å,et al.Nestling blood of the white-tailed sea eagle(Haliaeetus albicilla)as an indicator of territorial exposure to organohalogen compounds-An evaluation[J].Environmental Science&Technology, 2000,34(13):2733-2740
[28]Jaspers V L B,Sonne C,Soler-Rodriguez F,et al.Persistent organic pollutants and methoxylated polybrominated diphenyl ethers in different tissues of white-tailed eagles (Haliaeetus albicilla)from West Greenland[J].Environmental Pollution,2013,175:137-146
[29]Nordlöf U,Helander B,Bignert A,et al.Levels of brominated flame retardants and methoxylated polybrominated diphenyl ethers in eggs of white-tailed sea eagles breeding in different regions of Sweden[J].Science of the Total Environment,2010,409(1):238-246
[30]Kuiper R V,Murk A J,Leonards P E G,et al.In vivo and in vitro Ah-receptor activation by commercial and fractionated pentabromodiphenylether using zebrafish(Danio rerio)and the DR-CALUX assay[J].Aquatic Toxicology, 2006,79(4):366-375
[31]Luthe G,Jacobus J A,Robertson L W.Receptor interactions by polybrominated diphenyl ethers versus polychlorinated biphenyls:A theoretical structure– activity assessment[J].Environmental Toxicology and Pharmacology,2008,25(2):202-210
[32]Peters A K,Sanderson J T,Bergman A,et al.Antagonism of TCDD-induced ethoxyresorufin-o-deethylation activity by polybrominated diphenyl ethers(PBDEs)in primary cynomolgus monkey(Macaca fascicularis)hepatocytes [J].Toxicology Letters,2006,164(2):123-132
[33]Peters A K,Van Londen K,Bergman A,et al.Effects of polybrominated diphenyl ethers on basal and TCDD-induced ethoxyresorufin activity and cytochrome P450-1A1 expression in MCF-7,HepG2,and H4IIE cells[J].Toxicological Sciences,2004,82(2):488-496
[34]Cantón R F,Sanderson J T,Letcher R J,et al.Inhibition and induction of aromatase(CYP19)activity by brominated flame retardants in H295R human adrenocortical carcinoma cells[J].Toxicological Sciences,2005,88(2):447-455
[35]张睿.类二噁英有机污染物毒性的鸟类种间敏感性差异研究[D].南京:南京大学,2014:120-149 Zhang R.The sensitivity difference of avian species to the toxicity of dioxin-like organic pollutants[D].Nanjing: Nanjing University,2014:120-149(in Chinese)
[36]Sinkkonen S,Vattulainen A,Aittola J P,et al.Metal reclamation produces sulphur analogues of toxic dioxins and furans[J].Chemosphere,1994,28(7):1279-1288
[37]Sinkkonen S,Kolehmalnen E,Laihia K,et al.Polychlorinated diphenyl sulfides:Preparation of model compounds, chromatography,mass spectrometry,NMR,and environmental analysis[J].Environmental Science&Technology, 1993,27(7):1319-1326
[38]Schwarzbauer J,Littke R,Weigelt V.Identification of specific organic contaminants for estimating the contributionof the Elbe river to the pollution of the German Bight[J]. Organic Geochemistry,2000,31(12):1713-1731
[39]Zhang R,Zhang X,Zhang J,et al.Activation of avian aryl hydrocarbon receptor and inter-species sensitivity variations by polychlorinated diphenylsulfides[J].Environmental Science&Technology,2014,48(18):10948-10956
[40]Poland A,Glover E,Kende A S.Stereospecific,high affinity binding of 2,3,7,8-tetrachlorodibenzo-p-dioxin by hepatic cytosol.Evidence that the binding species is receptor for induction of aryl hydrocarbon hydroxylase[J]. Journal of Biological Chemistry,1976,251(16):4936-4946
[41]Denison M S,Soshilov A A,He G,et al.Exactly the same but different:Promiscuity and diversity in the molecular mechanisms of action of the aryl hydrocarbon (dioxin)receptor[J].Toxicological Sciences,2011,124 (1):1-22
[42]Schmidt J V,Bradfield C A.Ah receptor signaling pathways[J].Annual Review of Cell and Developmental Biology,1996,12(1):55-89
[43]周海龙,张林宝,廖春阳,等.持久性有机污染物对水生动物芳香烃受体通道的毒理机制及其早期监测(英文)[J].生态毒理学报,2010,5(1):9-17 Zhou H L,Zhang L B,Liao C Y,et al.Advances on toxicological mechanism of AHR pathway and early biomonitoring of persistent organic pollutants(POPs)in aquatic animals[J].Asian Journal of Ecotoxicology,2010,5(1): 9-17
[44]Hahn M E,Karchner S I,Shapiro M A,et al.Molecular evolution of two vertebrate aryl hydrocarbon(dioxin)receptors(AHR1 and AHR2)and the PAS family[J].Proceedings of the National Academy of Sciences,1997,94 (25):13743-13748
[45]Furness S G B,Whelan F.The pleiotropy of dioxin toxicity—Xenobiotic misappropriation of the aryl hydrocarbon receptor's alternative physiological roles[J].Pharmacology&Therapeutics,2009,124(3):336-353
[46]Okey A B.An aryl hydrocarbon receptor odyssey to the shores of toxicology:the Deichmann Lecture,International Congress of Toxicology-XI[J].Toxicological Sciences, 2007,98(1):5-38
[47]Hahn M E.Aryl hydrocarbon receptors:Diversity and evolution[J].Chemico-biological Interactions,2002,141 (1):131-160
[48]Karchner S I,Franks D G,Powell W H,et al.Regulatory interactions among three members of the vertebrate aryl hydrocarbon receptor family:AHR repressor,AHR1,and AHR2[J].Journal of Biological Chemistry,2002,277(9): 6949-6959
[49]庞朋沙,过倩萍,伍会健.细胞内AhR信号转导通路的机制研究[J].现代生物医学进展,2010(13):2567-2570 Pang P S,Guo Q P,Wu H J.Biological role of AhR signaling pathway[J].Progress in Modern Biomedicine, 2010(13):2567-2570(in Chinese)
[50]Harper P A,Wong J M Y,Lam M S M,et al.Polymorphisms in the human AH receptor[J].Chemico-biological Interactions,2002,141(1):161-187
[51]Yasui T,Kim E Y,Iwata H,et al.Functional characterization and evolutionary history of two aryl hydrocarbon receptor isoforms(AhR1 and AhR2)from avian species[J]. Toxicological Sciences,2007,99(1):101-117
[52]Doering J A,Giesy J P,Wiseman S,et al.Predicting the sensitivity of fishes to dioxin-like compounds:Possible role of the aryl hydrocarbon receptor(AhR)ligand binding domain[J].Environmental Science and Pollution Research,2013,20(3):1219-1224
[53]Karchner S I,Powell W H,Hahn M E.Identification and functional characterization of two highly divergent aryl hydrocarbon receptors(AHR1 and AHR2)in the teleost Fundulus heteroclitusevidence for a novel subfamily of ligand-binding basichelix loop helix-Per-ARNT-Sim (bHLH-PAS)factors[J].Journal of Biological Chemistry, 1999,274(47):33814-33824
[54]Andreasen E A,Hahn M E,Heideman W,et al.The zebrafish(Danio rerio)aryl hydrocarbon receptor type 1 is a novel vertebrate receptor[J].Molecular Pharmacology, 2002,62(2):234-249
[55]Dolwick K M,Swanson H I,Bradfield C A.In vitro analysis of Ah receptor domains involved in ligand-activated DNA recognition[J].Proceedings of the National Academy of Sciences,1993,90(18):8566-8570
[56]Fukunaga B N,Probst M R,Reisz-Porszasz S,et al.Identification of functional domains of the aryl hydrocarbon receptor[J].Journal of Biological Chemistry,1995,270 (49):29270-29278
[57]Mimura J,Ema M,Sogawa K,et al.Identification of a novel mechanism of regulation of Ah(dioxin)receptor function[J].Genes&Development,1999,13(1):20-25
[58]Pollenz R S.The mechanism of AH receptor protein down-regulation(degradation)and its impact on AH receptor-mediated gene regulation[J].Chemico-biological Interactions,2002,141(1):41-61
[59]Hankinson O.The aryl hydrocarbon receptor complex[J]. Annual Review of Pharmacology and Toxicology,1995, 35(1):307-340
[60]Fujii-Kuriyama Y,Kawajiri K.Molecular mechanisms ofthe physiological functions of the aryl hydrocarbon(dioxin)receptor,a multifunctional regulator that senses and responds to environmental stimuli[J].Proceedings of the Japan Academy.Series B,Physical and Biological Sciences,2010,86(1):40-53
[61]Henklová P,Vrzal R,Ulrichová J,et al.Role of mitogenactivated protein kinases in aryl hydrocarbon receptor signaling[J].Chemico-biological Interactions,2008,172(2): 93-104
[62]Pavek P,Dvorak Z.Xenobiotic-induced transcriptional regulation of xenobiotic metabolizing enzymes of the cytochrome P450 superfamily in human extrahepatic tissues [J].Current Drug Metabolism,2008,9(2):129-143
[63]Poland A,Knutson J C.2,3,7,8-Tetrachlorodibenzo-thorndioxin and related halogenated aromatic hydrocarbons: Examination of the mechanism of toxicity[J].Annual Review of Pharmacology and Toxicology,1982,22(1):517-554
[64]Fernandez-Salguero P M,Hilbert D M,Rudikoff S,et al. Aryl-hydrocarbon receptor-deficient mice are resistant to 2,3,7,8-tetrachlorodibenzo-p-dioxin-induced toxicity[J]. Toxicology and Applied Pharmacology,1996,140(1): 173-179
[65]Prasch A L,Teraoka H,Carney S A,et al.Aryl hydrocarbon receptor 2 mediates 2,3,7,8-tetrachlorodibenzo-pdioxin developmental toxicity in zebrafish[J].Toxicological Sciences,2003,76(1):138-150
[66]Heid S E,Walker M K,Swanson H I.Correlation of cardiotoxicity mediated by halogenated aromatic hydrocarbons to aryl hydrocarbon receptor activation[J].Toxicological Sciences,2001,61(1):187-196
[67]Walker M K,Pollenz R S,Smith S M.Expression of the aryl hydrocarbon receptor(AhR)and AhR nuclear translocator during chick cardiogenesis is consistent with 2,3,7, 8-tetrachlorodibenzo-p-dioxin-induced heart defects[J]. Toxicology and Applied Pharmacology,1997,143(2): 407-419
[68]Jiang B H,Rue E,Wang G L,et al.Dimerization,DNA binding,and transactivation properties of hypoxia-inducible factor 1[J].Journal of Biological Chemistry,1996, 271(30):17771-17778
[69]Goldberg M A,Schneider T J.Similarities between the oxygen-sensing mechanisms regulating the expression of vascular endothelial growth factor and erythropoietin[J]. Journal of Biological Chemistry,1994,269(6):4355-4359
[70]Forsythe J A,Jiang B H,Iyer N V,et al.Activation of vascular endothelial growth factor gene transcription by hypoxia-inducible factor 1[J].Molecular and Cellular Biology,1996,16(9):4604-4613
[71]Maxwell P H,Dachs G U,Gleadle J M,et al.Hypoxiainducible factor-1 modulates gene expression in solid tumors and influences both angiogenesis and tumor growth[J].Proceedings of the National Academy of Sciences,1997,94(15):8104-8109
[72]Mimura J,Fujii-Kuriyama Y.Functional role of AhR in the expression of toxic effects by TCDD[J].Biochimica et Biophysica Acta(BBA)-General Subjects,2003,1619 (3):263-268
[73]Gilday D,Gannon M,Yutzey K,et al.Molecular cloning and expression of two novel avian cytochrome P450 1A enzymes induced by 2,3,7,8-tetrachlorodibenzo-p-dioxin [J].Journal of Biological Chemistry,1996,271(51): 33054-33059
[74]Ucán-Marín F,Arukwe A,Mortensen A,et al.Recombinant transthyretin purification and competitive binding with organohalogen compounds in two gull species(Larus argentatusandLarus hyperboreus)[J].Toxicological Sciences,2009,107(2):440-450
[75]McNabb F M,Fox G A.Avian thyroid development in chemically contaminated environments:Is there evidence of alterations in thyroid function and development?[J].E-volution&Development,2003,5(1):76-82
[76]Murvoll K M,Skaare J U,Anderssen E,et al.Exposure and effects of persistent organic pollutants in European shag(Phalacrocorax aristotelis)hatchlings from the coast of Norway[J].Environmental Toxicology and Chemistry, 2006,25(1):190-198
[77]Thackaberry E A,Gabaldon D M,Walker M K,et al.Aryl hydrocarbon receptor null mice develop cardiac hypertrophy and increased hypoxia-inducible factor-1α in the absence of cardiac hypoxia[J].Cardiovascular Toxicology,2002,2(4):263-273
[78]Gilbertson M,Kubiak T,Ludwig J,et al.Great lakes embryo mortality, edema, and deformities syndrome (GLEMEDS)in colonial fish‐eating birds:Similarity to chick‐edema disease[J].Journal of Toxicology and Environmental Health,Part A Current Issues,1991,33(4): 455-520
[79]Handel C M,Van Hemert C.Environmental contaminants and chromosomal damage associated with beak deformities in a resident North American passerine[J].Environmental Toxicology and Chemistry,2015,34(2):314-327
[80]Fernie K J,Smits J E,Bortolotti G R,et al.Reproduction success of American kestrels exposed to dietary polychlorinated biphenyls[J].Environmental Toxicology and Chemistry,2001,20(4):776-781
[81]Kubiak T J,Harris H J,Smith L M,et al.Microcontaminants and reproductive impairment of the Forster's tern on Green Bay,Lake Michigan-1983[J].Archives of Environmental Contamination and Toxicology,1989,18(5): 706-727
[82]Peakall D B,Fox G A.Toxicological investigations of pollutant-related effects in Great Lakes gulls[J].Environmental Health Perspectives,1987,71:187-193
[83]Kim Y,Cooper K R.Toxicity of 2,3,7,8-tetrachlorodibenzo-p-dioxin(TCDD)and polychlorinated biphenyls (PCBs)in the embryos and newly hatched larvae of the Japanese medaka(Oryzias latipes)[J].Chemosphere, 1999,39(3):527-538
[84]黄莉,黄韧,冯媛瑜,等.2,3,7,8-四氯苯并二噁英(TCDD)短期染毒可造成着床前胚胎丢失并伴随雌性生殖器官中毒物相关蛋白的诱导表达[J].生态毒理学报, 2010,5(3):334-342 Huang L,Huang R,Feng Y Y,et al.Shorttime exposure of TCDD causing loss of implantation failure of embryos and its associated with induced expression of relevant proteins[J].Asian Journal of Ecotoxicology,2010,5(3): 334-342(in Chinese)
[85]Stone R.Environmental estrogens stir debate[J].Science, 1994,265(5170):308-310
[86]Giesy J P,Ludwig J P,Tillitt D E.Dioxins,Dibenzofurans, PCBs and Colonial,Fish-Eating Water Birds[M]//Dioxins and Health.USA:Springer,1994:249-307
[87]Giesy J P,Ludwig J P,Tillitt D E.Deformities in birds of the Great Lakes region[J].Environmental Science& Technology,1994,28(3):128A-135A
[88]Henny C J,Grove R A,Kaiser J L,et al.North American osprey populations and contaminants:Historic and contemporary perspectives[J].Journal of Toxicology and Environmental Health,Part B,2010,13(7-8):579-603
[89]Bowerman W W,Best D A,Grubb T G,et al.Assessment of environmental endocrine disruptors in bald eagles of the Great Lakes[J].Chemosphere,2000,41(10):1569-1574
[90]张烃,陈社军,李楠,等.苏南城市群河流表层沉积物中二噁英和共平面多氯联苯的浓度水平、来源和生态风险[J].环境化学,2014,33(9):1445-1455 Zhang T,Chen S J,Li N,et al.Occurrence,sources and ecological risks of PCDD/Fs and dl-PCBs in surface sediments from rivers in city cluster in South Jiangsu Province,China[J].Environmental Chemistry,2014,33(9): 1445-1455(in Chinese)
[91]Zhang S,Peng P,Huang W,et al.PCDD/PCDF pollution in soils and sediments from the Pearl River Delta of China[J].Chemosphere,2009,75(9):1186-1195
[92]Qiu X,Bigsby R M,Hites R A.Hydroxylated metabolites of polybrominated diphenyl ethers in human blood samples from the United States[J].Environmental Health Perspectives,2009,117(1):93-98
[93]Xia J,Su G Y,Zhang X W,et al.Dioxin-like activity in sediments from Tai Lake,China determined by use of the H4IIE-luc bioassay and quantification of individual AhR agonists[J].Environmental Science and Pollution Research,2014,21(2):1480-1488
[94]Brack W.Effect-directed analysis:A promising tool for the identification of organic toxicants in complex mixtures?[J].Analytical and Bioanalytical Chemistry,2003, 377(3):397-407
[95]Shi W,Wang X,Hu G,et al.Bioanalytical and instrumental analysis of thyroid hormone disrupting compounds in water sources along the Yangtze River[J].Environmental Pollution,2011,159(2):441-448
[96]Hu X,Shi W,Wei S,et al.Occurrence and potential causes of androgenic activities in source and drinking water in China[J].Environmental Science&Technology,2013, 47(18):10591-10600
[97]DeVito M,Biegel L,Brouwer A,et al.Screening methods for thyroid hormone disruptors[J].Environmental Health Perspectives,1999,107(5):407-415
[98]USEPA.Critical review and assessment of published research on dioxins and related compounds in avian wildlife-field studies.External review draft[R].Cincinnati, OH:National Center for Environmental Assessment,Office of Research and Development,2001
[99]USEPA.Dose-response assessment from published research of the toxicity of 2,3,7,8-tetrachlorodibenzo-pdioxin and related compounds to aquatic wildlife–laboratory studies.EPA/600/R-02/095.2002.[R].Cincinnati, OH:National Center for Environmental Assessment,Office of Research and Development,2000
[100]Karchner S I,Kennedy S W,Trudeau S,et al.Towards molecular understanding of species differences in dioxin sensitivity:Initial characterization of Ah receptor cDNAs in birds and an amphibian[J].Marine Environmental Research,2000,50(1):51-56
[101]Sand S,Fletcher N,von Rosen D,et al.Quantitative and statistical analysis of differences in sensitivity between Long–Evans and Han/Wistar rats following long-term exposure to 2,3,7,8-tetrachlorodibenzo-p-dioxin[J].Regulatory Toxicology and Pharmacology,2010,57(2):136-145
[102]Thomas R S,Penn S G,Holden K,et al.Sequence varia-tion and phylogenetic history of the mouse Ahr gene[J]. Pharmacogenetics and Genomics,2002,12(2):151-163
[103]Hoffman D J,Melancon M J,Klein P N,et al.Comparative developmental toxicity of planar polychlorinated biphenyl congeners in chickens,American kestrels,and common terns[J].Environmental Toxicology and Chemistry,1998,17(4):747-757
[104]Powell D C,Aulerich R J,Meadows J C,et al.Effects of 3,3′,4,4′,5-pentachlorobiphenyl(PCB 126)and 2,3,7,8-tetrachlorodibenzo-p-dioxin(TCDD)injected into the yolks of chicken(Gallus domesticus)eggs prior to incubation [J].Archives of Environmental Contamination and Toxicology,1996,31(3):404-409
[105] Brunström B,Andersson L.Toxicity and 7-ethoxyresorufin O-deethylase-inducing potency of coplanar polychlorinated biphenyls(PCBs)in chick embryos [J].Archives of Toxicology,1988,62(4):263-266
[106]Head J A,Hahn M E,Kennedy S W.Key amino acids in the aryl hydrocarbon receptor predict dioxin sensitivity in avian species[J].Environmental Science&Technology,2008,42(19):7535-7541
[107]Zhang R,Manning G E,Farmahin R,et al.Relative potencies of aroclor mixtures derived from avian in vitro bioassays:Comparisons with calculated toxic equivalents [J].Environmental Science&Technology,2013,47(15): 8852-8861
[108]Zeiger M,Haag R,Höckel J,et al.Inducing effects of dioxin-like polychlorinated biphenyls on CYP1A in the human hepatoblastoma cell line HepG2,the rat hepatoma cell line H4IIE,and rat primary hepatocytes:Comparison of relative potencies[J].Toxicological Sciences,2001,63 (1):65-73
[109]Elonen G E,Spehar R L,Holcombe G W,et al.Comparative toxicity of 2,3,7,8‐ tetrachlorodibenzo‐ p‐dioxin to seven freshwater fish species during early life‐stage development[J].Environmental Toxicology and Chemistry,1998,17(3):472-483
[110]Manning G E,Farmahin R,Crump D,et al.A luciferase reporter gene assay and aryl hydrocarbon receptor 1 genotype predict the LD50 of polychlorinated biphenyls in avian species[J].Toxicology and Applied Pharmacology, 2012,263(3):390-401
[111]Karchner S I,Franks D G,Kennedy S W,et al.The molecular basis for differential dioxin sensitivity in birds: Role of the aryl hydrocarbon receptor[J].Proceedings of the National Academy of Sciences of the United States of America,2006,103(16):6252-6257
[112]Goryo K,Suzuki A,Del Carpio C A,et al.Identification of amino acid residues in the Ah receptor involved in ligand binding[J].Biochemical and Biophysical Research Communications,2007,354(2):396-402
[113]Pandini A,Denison M S,Song Y,et al.Structural and functional characterization of the aryl hydrocarbon receptor ligand binding domain by homology modeling and mutational analysis[J].Biochemistry,2007,46(3):696-708
[114]Ema M,Ohe N,Suzuki M,et al.Dioxin binding activities of polymorphic forms of mouse and human arylhydrocarbon receptors[J].Journal of Biological Chemistry,1994,269(44):27337-27343
[115]Walker M K,Spitsbergen J M,Olson J R,et al.2,3,7,8-Tetrachlorodibenzo-p-dioxin(TCDD)toxicity during early life stage development of lake trout(Salvelinus namaycush)[J].Canadian Journal of Fisheries and Aquatic Sciences,1991,48(5):875-883
[116]Hansson M C,Hahn M E.Functional properties of the four Atlantic salmon(Salmo salar)aryl hydrocarbon receptor type 2(AHR2)isoforms[J].Aquatic Toxicology, 2008,86(2):121-130
[117]Hahn M E.Dioxin toxicology and the aryl hydrocarbon receptor:Insights from fish and other non-traditional models[J].Marine Biotechnology,2001,3(1):S224-S238
[118]Abnet C C,Tanguay R L,Hahn M E,et al.Two forms of aryl hydrocarbon receptor type 2 in rainbow trout(Oncorhynchus mykiss)evidence for differential expression and enhancer specificity[J].Journal of Biological Chemistry,1999,274(21):15159-15166
[119]Doering J A,Wiseman S,Beitel S C,et al.Tissue specificity of aryl hydrocarbon receptor(AhR)mediated responses and relative sensitivity of white sturgeon(Acipenser transmontanus)to an AhR agonist[J].Aquatic Toxicology,2012,114:125-133
[120]Wirgin I,Roy N K,Loftus M,et al.Mechanistic basis of resistance to PCBs in Atlantic tomcod from the Hudson River[J].Science,2011,331(6022):1322-1325
[121]Wang L,Liang X F,Zhang W B,et al.Amnesic shellfish poisoning toxin stimulates the transcription of CYP1A possibly through AHR and ARNT in the liver of red sea breamPagrus major[J].Marine Pollution Bulletin,2009, 58(11):1643-1648
Research Progress on Dioxin-like Compounds and AhR-Mediated Adverse Outcome Pathway(AOP)
Wei Fenghua,Zhang Junjiang,Xia Pu,Zhang Xiaowei*,Yu Hongxia
State Key Laboratory of Pollution Control and Resource Reuse,School of the Environment,Nanjing University,Nanjing 210023,China
12 April 2015 accepted 6 July 2015
Dioxins and DLCs(dioxin-like compounds,DLCs)are normally considered as a class of highly toxic compounds and their toxicological mechanisms have been extensively studied in the past decades.It is well accepted that all highly toxic dioxins and DLCs exert their toxic and biological interference effects through the binding and activation of Aryl hydrocarbon receptor(AhR).Recently increasing evidences showed that many emerging environmental pollutants had similar structure as dioxins and could potentially induce high toxicity.There is widely regulatory concern that how to efficiently and effectively evaluate the hazard and ecological risk to local species by this large amount of untested chemicals.Here this paper reviewed 1)discovery of emerging dioxin-like pollutants, 2)recent development on the understanding of AhR related toxicological mechanism,3)development of AhR-mediated adverse outcome pathway(AOP),4)development of predictive method to assess the AhR mediated toxicity in local species.A perspective was provided on future research direction in the ecotoxicological and risk assessment of dioxins and DLCs.
DLCs;emerging pollutants;PBDEs;PCDPSs;AhR;toxicological mechanism;species sensitivity distribution
2015-04-12 录用日期:2015-07-06
1673-5897(2016)1-037-15
X171.5
A
10.7524/AJE.1673-5897.20150412001
魏凤华,张俊江,夏普,等.类二噁英物质及芳香烃受体(AhR)介导的有害结局路径(AOP)研究进展[J].生态毒理学报,2016,11(1):37-51
Wei F H,Zhang J J,Xia P,et al.Research progress on dioxin-like compounds and AhR-mediated adverse outcome pathway(AOP)[J].Asian Journal of Ecotoxicology,2016,11(1):37-51(in Chinese)
国家重大“水专项”(2012ZX07506);环保公益性行业科研专项经费项目(201209016);高校博士学科点专项科研基金(20120091110034)
魏凤华(1986-),女,硕士,研究方向为生态毒理及风险评价研究,E-mail:fenghua0722@163.com;
),E-mail:zhangxw@nju.edu.cn
简介:张效伟(1978—),男,动物学和环境毒理学博士、教授、博士生导师,主要从事生态毒理学和健康风险评估方面的研究,发表英文SCI论文80多篇,包括以一作或通讯作者在环境领域高影响刊物Environmental Science& Technology和Toxicological Science等上发表论文20多篇。
