维药异常黑胆质成熟剂对胰岛素抵抗大鼠的影响
2016-12-06阿迪力阿不都肉苏力帕力万夏依丁哈力克卡依沙尔DenisDubrovin
阿迪力· 阿不都肉苏力, 帕力万, 夏依丁· 哈力克, 卡依沙尔, Denis Dubrovin
(1新疆医科大学维吾尔医学院, 乌鲁木齐 830011; 2新疆医科大学第一附属医院内分泌科, 乌鲁木齐 830054;3圣彼得堡巴甫洛夫国立医科大学, 俄罗斯 197000
·维医维药·
维药异常黑胆质成熟剂对胰岛素抵抗大鼠的影响
阿迪力· 阿不都肉苏力1, 帕力万2, 夏依丁· 哈力克1, 卡依沙尔1, Denis Dubrovin3
(1新疆医科大学维吾尔医学院, 乌鲁木齐 830011;2新疆医科大学第一附属医院内分泌科, 乌鲁木齐 830054;3圣彼得堡巴甫洛夫国立医科大学, 俄罗斯 197000
目的 探讨不同剂量的异常黑胆质成熟剂 ( ASM)对胰岛素抵抗( IR)SD大鼠的影响,研究ASM对胰岛素抵抗的预防和治疗作用。方法 选用雄性SD 大鼠80只,体质量(200±20)g,随机分为对照组、预防组(高、中、低剂量)、胰岛素抵抗组(模型建立后再分为模型组、治疗高、中、低剂量组,每组10只。预防组以高脂饲料饲养,同时不同剂量的ASM灌胃。治疗组模型建立后给予不同剂量的ASM分别灌胃。第十周检测血脂四项、空腹葡萄糖、空腹胰岛素水平、胰岛素敏感指数(ISI)、胰岛素抵抗指数(HOMA-IR), 结果与对照组和模型组比较,探讨模型是否建立和药物的预防作用。治疗组用ASM干预21 d后检测血脂四项、空腹葡萄糖、空腹胰岛素水平、胰岛素敏感指数(ISI)、胰岛素抵抗指数(HOMA-IR),口服糖耐量(OGTT),结果与对照组和模型组比较,探讨不同剂量的ASM 对胰岛素抵抗的治疗作用。结果 (1)全程干预ASM后,预防3个不同剂量(PH、PM、PL)组的FBG均小于模型组和对照组,FINs值也小于模型组(P<0.05~0.01),HOMA-IR值同样下降(P<0.01)。胰岛素抵抗模型建立后用AMS干预21 d,TH、TM和TL组的FINS值均小于模型组和对照组,TH组和TL组与模型组比较,FINs值差异有统计学意义(P<0.05)。与模型组比较,TH、TM和TL组中HOMA-IR值明显下降(P<0.05),ISI值明显升高(P<0.05)。(2)预防3个不同剂量(PH、PM、PL)组的HDL-C、LDL-C、TG值与模型组比较差异均有统计学意义(P<0.05~0.01),药物浓度越高越接近对照组。治疗3个不同剂量组的LDL和TG值小于模型组,TL组的TG值与模型组比较差异有统计学意义(P<0.01)。(3)治疗3个不同剂量组30 min的血糖水平高于模型组和对照组(P<0.05),恢复正常水平比模型组快并接近于对照组。结论 ASM对大鼠胰岛素抵抗的产生有预防和治疗作用,能够改善胰岛素抵抗的病理状态和糖耐量受损状况,也有较好的调节血脂作用。
胰岛素抵抗(IR); 异常黑胆质成熟剂(ASM) ; 血脂
胰岛素在胰岛素敏感组织(如骨骼肌、脂肪和心脏)中诱导葡萄糖的摄取而降低血糖,胰岛素也通过抑制肝脏、肾脏、小肠中葡萄糖的输出而控制血糖。在机体胰岛素作用的靶器官对胰岛素的敏感性减弱或丧失时会发生胰岛素抵抗 (insulin resistance, IR)[1]。目前普遍认为糖尿病、高血压、心血管疾病既是各自独立又有内在联系的一组疾病,其内在联系是胰岛素抵抗及其所致的糖、脂代谢紊乱。现代医学认为胰岛素抵抗是上述疾病滋生的“共同土壤”,即共同危险因素。在我国随着糖尿病、高血压、心血管疾病的发病率增高, IR成为国内外医疗界研究的热点。
目前,改善胰岛素抵抗的主要药物有二甲双胍、阿卡波糖、噻唑烷二酮类药物及血管紧张抑制剂等。虽然这些药物临床应用广泛,但长期服用均有不同程度的毒副作用。因此,寻找一种安全有效的新药成为急需解决的问题。
异常黑胆质成熟剂(ASM)是维吾尔医复方制剂,由牛舌草、红枣、小茴香、破布木、地锦草、甘草等 10味药材组成,含有生物碱、酚、有机酸及氨基酸、皂苷黄酮、糖、香豆素或内酯等多种有效化学成分[2]。长期以来,在传统维吾尔医学中一直被用于多种疾病的治疗,如消化道癌症、糖尿病、心血管疾病和慢性哮喘等[3]。本课题组前期实验结果表明异常黑胆质成熟剂对肝癌和糖尿病有一定的疗效[4-5]。
本实验在已有的研究基础之上,通过模拟人类胰岛素抵抗发病机制,复制胰岛素抵抗模型,研究不同剂量异常黑胆质成熟剂对胰岛素抵抗大鼠空腹血糖、空腹胰岛素、糖耐量、血脂的影响,探讨异常黑胆质成熟剂对胰岛素抵抗的预防和改善作用及作用机制,为临床上广泛应用异常黑胆质成熟剂治疗代谢综合征提供理论依据。
1 材料与方法
1.1 实验动物及材料 无特定病原体(Specefic pathogen Free,SPF),雄性Sprague-Dawley大鼠 80只,购自新疆医科大学实验动物中心[许可证号:SCXK(新)2011-0004],体质量(200±20)g,普通词料及笼内垫料购自新疆医科大学实验动物中心。实验动物房内温度控制在(24±2)℃,湿度40%~70%,给予12/12 h的光暗周期,以新疆医科大学实验动物中心制定的实验动物管理制度对实验大鼠进行饲养与管理。胰岛素放射免疫分析药盒由北京北方生物技术研究所生产(生产批号:150820),利用中佳GC-2016γ放射免疫计数器测定胰岛素的浓度。使用艾科精益血糖仪(one call plus)和艾科精益血糖试剂条[爱康生物技术(杭州)有限公司]检测血糖。高脂饲料由猪油18%、白砂糖7%、胆固醇3%、胆酸盐0.5%、生鸡蛋7%及常规饲料64.5%配制而成(由新疆医科大学实验动物中心按配方的要求制备),常规饲料由新疆医科大学实验动物中心提供。
1.2 方法 清洁级,雄性SD大鼠80只,分笼,适应性喂养1 w后,随机领取40只大鼠分为对照组(C组)、预防高剂量组(PH组)、预防中剂量组(PM组)及预防低剂量组(PL组),每组10只。 另40只大鼠(胰岛素抵抗组)以高脂饲料饲养10 w,复制IR大鼠模型。模型建立后按照胰岛素抵抗指数(HOMA-IR)再次随机分为模型组(M组)、治疗高剂量组(TH组)、治疗中剂量组(TM组)及治疗低剂量组(TL组),每组10只。全组给予灭菌水,每天更换1次,1 w换新笼子和垫料1次。C组大鼠正常饲养,2 mL生理盐水灌胃,作为安慰剂。预防组(PH、PM、PL)以高脂饲料饲养同时按体质量(6、3、1.5 g/kg)ASM灌胃,共10 w。 M组灌胃生理盐水2 mL/d , 其他治疗组(TH、TM、TL)按体质量(6、3、1.5 g/kg)ASM灌胃,共21 d。第10周全实验组动物禁食不禁水12 h,无菌剪刀断尾测血糖,随后乙醚麻醉大鼠,从眼睛静脉丛取血1 mL测量空腹胰岛素及血清胆固醇(CHOL)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)、甘油三酯(TG),计算HOMA-IR值和胰岛素敏感性指数(ISI),作为胰岛素抵抗模型的确定指标以及ASM的预防作用的评价指标。模型建立后治疗组ASM干预21 d,检测血脂4项、HOMA-IR、ISI、糖耐量(OGTT),与模型组比较ASM对IR的治疗作用。整个实验过程中,仔细观察并记录大鼠的生活状态如排泄物的改变、活动情况、毛色变化等,每周记录1次大鼠体质量变化。
1.3 评价指标 (1)空腹糖耐量试验(oral glucose tolerance test, OGTT):末次给药后禁食不禁水12 h,用消毒的手术剪剪断大鼠尾端1~2 mm处,将血滴在艾科精益血糖试剂的检测处,记录艾科精益血糖仪显示的血糖浓度值作为0点的血糖值,接着用50%葡萄糖(2 g/kg体质量)灌胃,检测30、60、90和120 min的血糖浓度值,并计算各组OGTT曲线下面积(AUC)。(2)空腹血糖(fasting blood glucose, FBG)、空腹胰岛素(Fasting serum Insulin, FINS)和血脂4项:全部实验组大鼠禁食不禁水12 h,用艾科精益血糖仪检测空腹血糖浓度(FBG)。用10%水合氯醛麻醉(3 mL/kg体质量)空腹注射,从腹主动脉采血,低速离心机3 600 r/min,离心15 min,分离血清,在新疆医科大学第一附属医院核医学科按胰岛素放射免疫分析盒说明书操作,再用γ免疫计数器检测空腹胰岛素(FINS)浓度值,测得FBG及FINS,按胰岛素抵抗指数公式HOMA-IR=FBG×FINS/22.5和胰岛素敏感指数[6]ISI= Ln[1÷(FPG×FINs)]计算HOMA-IR和ISI,血脂4项在新疆医科大学第一附属医院科技楼检测。
2 结果
2.1 预防组和治疗组FBG、FINs、HOMA-IR 和ISI 的比较 模型组与对照组FBG、FINs、HOMAI-IR、ISI值差异均有统计学意义(P<0.01),说明模型建立成功。全程干预ASM后,PH、PM、PL组的FBG均小于模型组和对照组,FINs值也小于模型组(P<0.05~0.01),HOMA-IR值同样下降(P<0.01),接近对照组,ISI值升高(P<0.05~0.01),接近对照组。胰岛素抵抗模型建立后用AMS干预21 d,TH、TM和TL组的FINS值均小于模型组和对照组,TH组和TL组与模型组比较,FINs值差异有统计学意义(P<0.05)。与模型组比较,TH、TM和TL组中HOMA-IR值明显下降(P<0.05),ISI值明显升高(P<0.05),见表1。
2.2 预防组和治疗组CHOL、HDL、LDL和TG的比较 模型组HDL-C、LDL-C、TG、CHOL水平与对照组比较差异均有统计学意义(P<0.01),说明在模型组大鼠上发生脂代谢紊乱,支撑胰岛素抵抗模型的形成。PH、PM、PL组的HDL-C、LDL-C、TG值与模型组比较差异均有统计学意义(P<0.05~0.01),药物浓度越高越接近对照组。TH、TM、TL组LDL和TG值小于模型组,但LDL值差异无统计学意义,TL组的TG值与模型组比较差异有统计学意义(P<0.01),TH和TM组TG值虽然有下降趋势,但差异无统计学意义。TH组和TM组CHOL水平与模型组相比有下降趋势,但差异无统计学意义,见表2。

表1 预防组和治疗组FBG、FINs、HOMA-IR和 ISI的比较(±s)
注:与对照组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05,△△P<0.01。

表2 预防组和治疗组CHOL、HDL、LDL和TG的比较(±s)
注:与对照组比较,*P<0.05,**P<0.01; 与模型组比较,△P<0.05,△△P<0.01。
2.3 治疗组药物干预21 d的糖耐量试验(OGTT)及曲线下面积(AUC)的变化 葡萄糖灌胃后,模型组大鼠的OGTT曲线异常升高,于给糖后至60 min直线上升达峰值(7.67±1.59)mmol/L,总体血糖水平也较高,与对照组和治疗高剂量组比较差异有统计学意义(P<0.05),治疗高剂量组整体血糖水平稍高于对照组,而较模型组明显减少(P<0.05),治疗中剂量和低剂量组90、120 min的血糖水平较模型组明显降低(P<0.05),整体血糖值彼此接近。TH、TM、TL组30 min的血糖水平高于模型组和对照组(P<0.05),恢复正常水平比模型组快并接近于对照组,此点的斜率表明,TH、TM、TL组的斜率小于模型组和对照组,模型组和对照组的斜率接近。30 min的斜率分别为:KC=0.073、KM=0.070、KTH=0.013、KTM=0.006、KTL=0.003(图1)。模型组曲线下面积(1 789.55±95.14)mmol/L·min明显高于对照组(1 331.35±78.55)mmol/L·min和治疗高剂量组(1 433.18±89.24)mmol/L·min,治疗中剂量和治疗低剂量组AUC小于模型组,但差别不大(图2)。
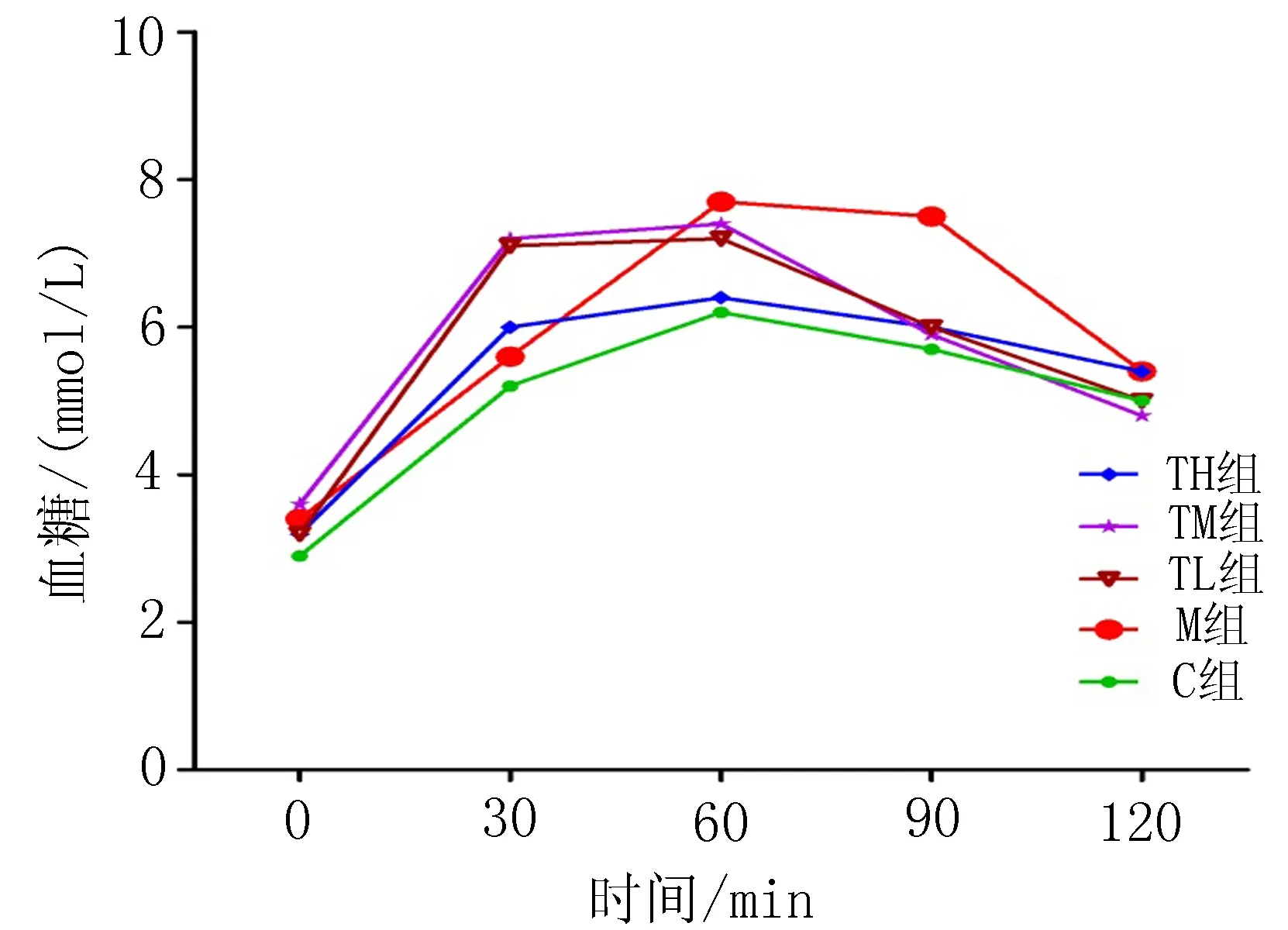

图1 ASM对OGTT的影响曲线图 图2 OGTT曲线下面积变化
3 讨论
维吾尔医药是中华民族传统医学重要组成部分,具有丰富的临床实践和独特的理论内涵。维吾尔药异常黑胆质成熟剂是在维吾尔医学理论的指导下由十几种草药组成的复方药。既往的研究表明ASM对肝癌、糖尿病、哮喘等疾病有一定的疗效[4-5]。虽然肝癌、糖尿病、抑郁症等多种疾病与IR有密切关系,但是ASM与IR的关系未见报道。因此本实验通过建立IR动物模型后,用ASM进行干预从而研究ASM与IR的联系。随着IR研究的深入,动物模型的建立方法也比较成熟了。由于建立方法的不同胰岛素抵抗模型可分为遗传性模型、基因改造模型和诱发模型。遗传性模型和基因改造模型常用于研究胰岛素抵抗的发生机制,但该类模型造价昂贵,分子技术和实验条件要求较高,来源有限。诱发模型根据诱导物质的不同又可分为食物诱导模型、药物诱导模型和食物加药物混合诱导模型,广泛应用于药效学和药理学研究[7-8]。本实验研究ASM对IR的作用,因此选择了人类胰岛素抵抗发病机制近似的高脂饮食诱导模型方法。根据国内外研究,在脂肪组织、肝、肌肉、心脏和血管过量脂质的蓄积导致胰岛素抵抗[9-10],当啮齿动物和人类组织被长时间脂质浸泡时胰岛素刺激葡萄糖转运活动降低,引起骨骼肌胰岛素抵抗,是因为蓄积的脂质使胰岛素信号减弱[11-13],另外,高胰岛素血症可引起胰岛素抵抗,而且其与氧化应激和线粒体功能失调有密切的关系[14-15]。本实验使用的高脂饲料由猪油18%、白砂糖7%、胆固醇3%、胆酸盐0.5%、生鸡蛋7%、64.5%的常规饲料配制而成[16]。实验第10周模型组的FINS、HOMA-IR、ISI、TC、TG、LDL-C的检测值与对照组比较差异均有统计学意义,且ISI、HOMA-IR值与IR金标准正糖钳夹实验的M值有高度相关性,相关系数为0.78[17]。根据上述数据确定模型建立成功。
本研究结果显示,预防3个不同剂量组空腹血糖小于模型组和对照组,可能长时间AMS的干预增强组织对胰岛素的敏感性。治疗3个不同剂量组OGTT实验显示,胰岛素抵抗模型组整体血糖高于对照组和3个治疗剂量组,治疗高剂量组很接近对照组,而且30 min的值接近峰点值,斜率比模型组小,说明30 min的血糖变化比模型组和对照组慢,可以推断ASM促进大鼠的糖代谢速率,加强胰岛素敏感性。模型组AUC大于治疗组和对照组,且治疗高剂量组与对照组一致,治疗中剂量和低剂量组与模型组差别不大。由此可以看出,ASM在治疗高剂量组的糖代谢调节作用比较理想,此结果与买吾拉尼江等[5]的研究结果一致。预防3个不同剂量组和治疗3个剂量组的FINS值都低于模型组,治疗组的甚至低于对照组,显示ASM对胰岛素敏感组织的胰岛素利用率上调作用。胰岛素抵抗指数、敏感指数与模型组比较差异有统计学意义,说明ASM对胰岛素抵抗有理想的预防和治疗作用。
本研究结果显示,预防3个不同剂量和对照组的HDL均明显小于模型组,模型组的LDL、TG大于对照组和预防不同剂量组,预防不同剂量组的LDL、TG 值接近对照组。CHOL的变化不明显,但是在3个不同剂量预防组中有下降趋势。 治疗3个不同剂量组的LDL、TG 小于模型组,接近对照组,CHOL无明显变化。 根据实验,在模型对照组中出现明显的高LDL和TG 的情况,表明模型动物出现脂代谢紊乱[18]。给药后LDL和TG 接近对照组,而且预防3个不同剂量组药物作用比治疗不同3个剂量组更明显,但是HDL和CHOL的影响不明显,表明ASM对脂代谢有明显的调节作用。
综上所述,长时间饮用高能量的食物很容易引起脂、糖谢代紊乱,诱发胰岛素抵抗,甚至导致糖尿病、心血管疾病。维吾尔药异常黑胆质成熟剂对脂代谢紊乱、胰岛素抵抗有良好的调节和治疗作用。在维吾尔医学中异常黑胆质成熟剂长期应用于治疗糖尿病、哮喘等难治疾病,其机制可能是通过调节血脂、增加组织对胰岛素的敏感性、提高胰岛素的利用率而改善糖耐量受损和胰岛素抵抗,从而对代谢综合征发挥预防和治疗作用。
[1] Ye J. Mechanisms of insulin resistance in obesity[J]. Front Med, 2013, 7(1):14-24.
[2] 哈木拉提·吾甫尔,阿不都热依木·玉苏甫. 维吾尔医异常黑胆质新论[M]. 乌鲁木齐:新疆科学技术出版社, 2005:11-12.
[3] Upur H, Yusup A, Umar A, et al. Uighur traditional medicine syndrome of abnormal Savda in men is associated with oxidative stress, which can be improved by Munziq and Mushil of Abnormal Savda[J].Therapie,2004,59(4):483-484.
[4] 哈木拉提·吾甫尔,买合木提·米吉提,斯坎德尔·白克力,等. 维药异常黑胆质成熟剂对异常黑胆质型肝癌模型作用机制的血清代谢组学研究[J]. 科技导报, 2015, 33(2):1-5.
[5] 买吾拉尼江·依孜布拉,巴吐尔·买买提明,娜祖克·库尔班塔依,等.基于HMR代谢组学方法研究异常黑胆质性 2型糖尿病大鼠的作用机制[J].新疆医科大学学报, 2013, 36(4):411-418.
[6] 李光伟. 胰岛素抵抗评估及其临床应用[J].中华老年多器官疾病杂志, 2003,1(3):11-12.
[7] 刘微,李冀. 胰岛素抵抗动物模型的研究进展[J].中医药信息.2008, 25(6):9-11.
[8] 马海港,张汝学,贾正平. 胰岛素抵抗动物模型的研究进展[J]. 国际内分泌代谢杂志,2008,28(1):33 -36.
[9] Amuel VT, Petersen KF, Shulman GI. Lipid-induced insulin resistance:unravelling the mechanism[J]. Lancet,2010,375(9733):2267-2277.
[10] Samuel VT, Shulman GI. Mechanisms for insulin resistance:common threads and missing links[J]. Cell,2012,148(5):852-871.[11] Cline GW, Petersen KF, Krssak M. Impaired glucose transport as a cause of decreased insulin-stimulated muscle glycogen synthesis in type 2 diabetes[J]. N Engl J Med,1999,341(4):240-246.
[12] Griffin ME, Marcucci MJ, Cline GW. Free fatty acid-induced insulin resistance is associated with activation of protein kinase C theta and alterations in the insulin signaling cascade[J]. Diabetes,1999,48(6):1270-1274.
[13] Roden M, Price TB, Perseghin G. Mechanism of free fatty acid-induced insulin resistance in humans[J]. Clin Invest,1996,97(12):2859-2865.
[14] Guo S. Insulin signaling, resistance, and the metabolic syndrome:insights from mouse models to disease mechanisms[J].J Endocrinol, 2014, 220(2):T1-T23.
[15] Liu HY, Cao SY, Hong T. Insulin is a stronger inducer of insulin resistance than hyperglycemia in mice with type 1 diabetes mellitus (T1DM)[J]. Biol Chem,2009, 284(40) :27090-27100.
[16] 刘丽萍,吴晶,王建青,等. 高脂喂养法建立大鼠胰岛素抵抗模型[J].安徽医药,2009,13(13):1171-1173.
[17] 李光伟. 胰岛素敏感性评估及其在临床研究中的应用[J]. 中华内分泌代谢杂志,2003,16(3):198-200.
[18] 赵玲,杜娟,徐勉,等. 2型糖尿病合并非酒精性脂肪性肝病与胰岛素抵抗及血脂代谢紊乱的关系[J].中华内分泌代谢杂志, 2012,28(1):16-20.
(本文编辑 王艳)
The effect of Abnormal Savda Muziq on insulin resistant rat model
Adili Abudurousuli1, Paliwan2, Xayiding Halike1, Kayishaer1, Denis Dubrovin3
(1CollegeofUyghurMedicine,XinjiangMedicalUniversity,Urumqi830011,China;2DepartmentofEndocrinology,theFirstAffiliateHospital,XinjiangMedicalUniversity,Urumqi830054,China;3PavlovStateMedicalUniversity,SaintPetersburg197000,Russia)
Objective To study the therapeutic and preventive effect of Abnormal Savda Muziq (ASM) on insulin resistant (IR) rat model. Methods 80 male SD rats (180±20 g) were randomly divided into control group, IR model group and ASM preventive groups (low dose, middle dose, high dose), and ASM treatment groups (low dose, middle dose, high dose) respectively. Except the control group, other rats were fed with high fat diet to establish IR model. And the preventive group were fed with high fat diet plus orally administrated with low, middle, high dose of ASM respectively, 10 weeks later testing results of blood lipid level, fasting blood glucose (FBG), fasting insulin (FIN), insulin sensitivity index (ISI), HOMA-IR was compared with IR model group and control group to investigate if the animal model established or not and evaluate the preventive role of ASM on metabolic syndrome; after the IR model was established, the treatment groups rats were orally administrated different doses of ASM for three weeks. Three weeks later, all the same indexes of the above were measured and compared with model and control group to investigate the therapeutic effect of ASM on insulin resistant. Results (1) After ASM intervention, the FBGs of the 3 doses of preventive groups were less than that in the model group and the control group, and the FINs values of them were less than that in the model group (P<0.05), additionally, the HOMA-IR value decreased (P<0.01). After 21 d intervention of ASM on established insulin resistance model rats, the FINS values of the 3 doses of treatment groups were less than that in the model group and the control group, and there was significant difference between high dose group and low dose group (P<0.05). Compared with the model group, the HOMA-IR values of the 3 doses of treatment groups decreased significantly (P<0.05), while the ISI values of them were significantly increased (P<0.05). (2) Compared with the model group, the values of TG, LDL-C and HDL-C of the 3 doses of preventive groups showed significant differences (P<0.05), and the higher of the concentration, the closer of the values to the control group. The values of TG and LDL in the 3 doses of treatment groups were less than that in the model group, and the TG value of low dose group was statistically significant difference compared with the model group (P<0.01). (3) The blood glucose levels of 30 min in the treatment groups were higher than that in the model group and the control group (P<0.05), but the time to recovery back to the normal level of them were higher than that of the model group and the model group, which were close to that in the control group. Conclusion ASM has a certain role of regulating lipid level. Initially it was confirmed that ASM has the preventive effect on insulin resistance and the pathological state of impaired glucose tolerance.
Insulin resistance; Abnormal Savda Muziq; Blood lipid
国际合作项目(87E2A0313397)
阿迪力·阿不都肉苏力(1988-),男(维吾尔族),在读硕士,研究方向:新疆重大疾病的中维西医干预,E-mail:782721717@qq.com。
作者简介:帕力万(1988-),男(维吾尔族),博士,研究方向:肠道菌群与胰岛素抵抗E-mail:palvan@me.com。
R29
A
1009-5551(2016)12-1601-06
10.3969/j.issn.1009-5551.2016.12.029
2016-06-07]
