高良姜素对宫颈癌SiHa细胞凋亡及基因表达的影响
2016-12-06古扎力努尔买提沙木塔力甫艾买提艾尔肯肉孜比拉力努尔满古力肉孜
古扎力努尔买提沙, 木塔力甫·艾买提, 艾尔肯·肉孜比拉力, 努尔满古力·肉孜,
阿布力孜·阿布杜拉1, 2
·民族肿瘤学·
高良姜素对宫颈癌SiHa细胞凋亡及基因表达的影响
古扎力努尔买提沙1, 木塔力甫·艾买提1, 艾尔肯·肉孜比拉力2, 努尔满古力·肉孜3,
阿布力孜·阿布杜拉1, 2
(1新疆地方病分子生物学重点实验室,2新疆医科大学基础医学院生物化学教研室, 乌鲁木齐 830011,
3新疆维吾尔自治区人民医院妇科, 乌鲁木齐 830000)
目的 探讨高良姜素(Galangin)对宫颈癌SiHa细胞增殖、凋亡及基因表达的影响。方法 从高良姜(Alpinia officinarum Hance) 中提取分离高良姜素,(1) 采用四甲基偶氮唑盐 (MTT) 比色法,检测空白对照组、不同浓度高良姜素干预组、顺铂 (Cisplatin) 组SiHa细胞在24、48、72 h内的细胞存活率、用荧光倒置显微镜观察对细胞形态的影响。 (2) 采用流式细胞检测法检测高良姜素在24 h内对Siha细胞凋亡的影响。 (3) 采用荧光定量PCR的方法, 分析半胱氨酸的天冬氨酸蛋白水解酶3(Caspase 3)和CDK4等基因在高良姜素干预前、后的表达水平。 结果 以高良姜素干预宫颈癌SiHa细胞后,与空白对照组比较,细胞存活率明显下降并呈剂量和时间依赖性;早期凋亡率明显上升,并呈剂量依赖性;细胞凋亡因子Caspase 3上调表达(P<0.05),呈剂量依赖性,而高良姜素干预前、后细胞周期蛋白激酶CDK4的表达调控无统计学意义(P>0.05)。 结论 高良姜素能抑制宫颈癌Siha细胞增殖,促进细胞凋亡,其作用机理可能通过提高细胞凋亡执行因子的活性诱导细胞凋亡,从而表现出抗肿瘤活性,但对细胞周期的影响需要进一步研究。
高良姜素; 宫颈癌Siha细胞; 细胞凋亡; 基因表达
宫颈癌是常见的妇科恶性肿瘤,仅次于乳腺癌[1-2]。新疆是我国宫颈癌高发区之一,在南疆地区维吾尔族妇女宫颈癌患病率和死亡率很高。SiHa细胞株是宫颈癌细胞株研究中应用最广泛的癌细胞。本课题组前期研究中,从高良姜提取高良姜总黄酮,并干预宫颈癌SiHa细胞,发现高良姜总黄酮 (TFs) 能诱导SiHa细胞凋亡,影响细胞凋亡相关基因和肿瘤干细胞标记物表达水平[3-4]。然而,高良姜总黄酮包括高良姜素、槲皮素、 槲皮素-3-甲醚、 山奈酚、山奈酚-4-甲醚、二氢高良姜醇和儿茶精等多种黄酮类化合物[5], 其抑制作用是上述黄酮类化合物共同发挥作用的结果,各有效成分的抗肿瘤活性和机理待进一步研究。
高良姜素(Galangin, 3,5,7-三羟基黄酮)作为一种黄酮类化合物,可从姜科山姜属植物高良姜的根茎、植物的地上部分中提取分离得到。现代药理学研究表明,高良姜素在抗诱变、抗畸变、抗肿瘤、抗氧化和清除自由基、调解代谢酶活性等方面发挥独特的化学防护作用[6-8]。近年来,高良姜素的抗肿瘤活性越来越受到关注,有研究发现高良姜素对CRT阳性细胞[9]、乳腺癌细胞株(Hs578T、U937[10-11]、人食管鳞癌细胞株(KYSE-510)[6]、肝细胞株[12-13]、TRAIL诱导的前列腺癌细胞[14]、HL-60[15]、人头颈部鳞状细胞癌 (HNSCC)[16]、胃癌细胞 (SNU-484)[17]、结肠癌细胞(HCT-15、HT-29)[18]、肾癌细胞 (Caki-1、786-0)[19]等肿瘤细胞均有诱导凋亡作用,而尚未有文献报道高良姜素对宫颈癌细胞凋亡的影响及机制相关的研究。
本研究首先从高良姜的根部提取高良姜总黄酮,再通过聚丙烯酰胺色谱柱分离方法,从总黄酮中分离高良姜素,进而对宫颈癌SiHa细胞进行药物干预,采用MTT和流式细胞检测技术,检测细胞存活率和细胞凋亡,评价高良姜素的抗宫颈癌SiHa 细胞活性。其次,采用RT-PCR法检测不同浓度高良姜素处理后的细胞中关于细胞凋亡基因半胱氨酸的天冬氨酸蛋白水解酶3(Caspase 3)和CDK4表达水平的变化,探讨高良姜素影响宫颈癌SiHa细胞增殖、凋亡和基因表达调控的分子机制,为宫颈癌的临床治疗提供新的药物靶点。
1 材料与方法
1.1 主要试剂与仪器 DMEM培养基、胎牛血清(FBS),双抗(青霉素和链霉素)和胰蛋白酶、四甲基偶氮唑盐(MTT),二甲基亚砜(DMSO)和Annexin V-FITC等试剂均购自Gibco公司;Trizol试剂(DP405 北京天根生物公司),顺铂(大连美仑),氯仿(上海生工),异丙醇、乙醇(上海生工),聚酰胺(新疆恒博鑫业),cDNA 合成试剂盒(Fermentas),SYBR Green1试剂盒(TAKARA);宫颈癌SiHa细胞由新疆地方病分子生物学实验室提供。旋转蒸发仪(Heidolph, 德国),CO2孵育箱(HeraCell-150, Thermo Fishers公司),生物安全柜(Thermo KS-18, Thermo Fishers公司),酶标仪(Beckmann Coulters 公司),流式细胞仪(LSRⅡ, BD Biosciences公司),光学显微镜(BA210, Motic公司),定量PCR 仪(Bio-Rad, 美国),核酸-蛋白快速测定仪。
1.2 高良姜素的制备 将前期研究中按照常规化学提取方法[20]提取的粗提物(高良姜总黄酮)用60 mL 95%乙醇溶解,慢慢注入到已活化的聚酰胺色谱柱,再用500 mL 95% 乙醇饱和,过夜;次日分别用3倍柱体积的水及20%、40%、50%、60% 的乙醇溶液洗脱;合并50% 和60% 的乙醇洗脱液,减压浓缩成淡黄色混悬液,放置4℃ 冰箱,静止分层;弃除上层,过滤下层,滤纸上的残渣用无水乙醇收集到表面皿上,静止自然挥发,得黄色粉末状固体,即高良姜素。用DMSO溶解高良姜素,配置浓度为80 mg/mL的母液。
1.3 SiHa细胞的培养 在常规的细胞培养条件下,使用含10%胎牛血清、100 μg/mL链霉素的DMEM全培养基培养细胞。当细胞融合度达80%时,用胰蛋白酶 (0.25%) 消化方法收集细胞,用于MTT、流式细胞检测等后续实验的传代和接种。
1.4 细胞形态学观察和MTT检测 按 6×103个细胞/孔密度, 将宫颈癌 SiHa 细胞接种在96孔细胞培养板上,培养。24 h后,将96孔板细胞设为空白对照组、不同浓度高良姜素干预组、顺铂组3组,每个组6个复孔。配置空白对照组培养液(200 μL DMEM培养液加入1 μL DMSO,即DMSO浓度为0.5%);配置高良姜素150、125、100、75、50、25 μg/mL组干预溶液:将80 mg/mL的母液以DMSO逐步稀释至30、25、20、15、10、5 mg/mL的高良姜素溶液,再按照200 μL DMEM培养液加入1 μL药物的比例,将不同浓度高良姜素溶液加入到DMEM培养液中,配置干预浓度为150、125、100、75、50、25 μg/mL的细胞培养液;配置顺铂100、50、25 μg/mL组溶液:将25 mg/mL 顺铂母液以DMSO逐步稀释至20、10、5 mg/mL浓度,再用DMEM培养液稀释至100、50、25 μg/mL浓度,并按24、48、72 h 时间梯度对宫颈癌 SiHa 细胞进行药物干预。药物干预结束后,在24、48、72 h时,使用光学显微镜观察细胞形态变化。 继而加入5 mg/mL MTT 溶液10 μL,孵育4 h后,弃去培养基,以 150 μL DMSO 溶解,在酶标仪上 570 nm 处读取吸光度并按以下公式计算细胞存活率:细胞存活率=(OD实验组-OD空白对照组)/ OD空白对照组×100%。
1.5 细胞凋亡检测 在6 孔培养板上按1×105个细胞/孔密度培养细胞并进行药物干预;24 h后收集细胞 (约3×104个细胞),依次加入400 μL细胞凋亡检测试剂盒提供的结合缓冲液 (1×binding buffer)、5 μL Annexin V-FITC和10 μL PI,在室温下避光反应15 min,在流式细胞仪上检测细胞凋亡率。
1.6 RT-PCR检测细胞凋亡相关基因mRNA表达水平 以25 μg/mL和100 μg/mL高良姜素干预细胞24 h后,收集细胞,用Trizol试剂提取总RNA,利用核酸-蛋白快速测定仪测定所提取RNA浓度和纯度,用1% 琼脂糖凝胶电泳对RNA进行质量检测。随后抽取1 μg总RNA利用逆转录试剂盒并按说明书合成cDNA;再以cDNA为模板, 并以β-actin为内参照,相应基因上下游引物(表1) 及SYBR对cDNA进行扩增。RT-PCR反应条件为:DNA变性 95℃ 3 min, 合成40个循环 (95℃ 10 s,55℃~62.6℃ 30 s)。

表1 基因引物序列
2 结果
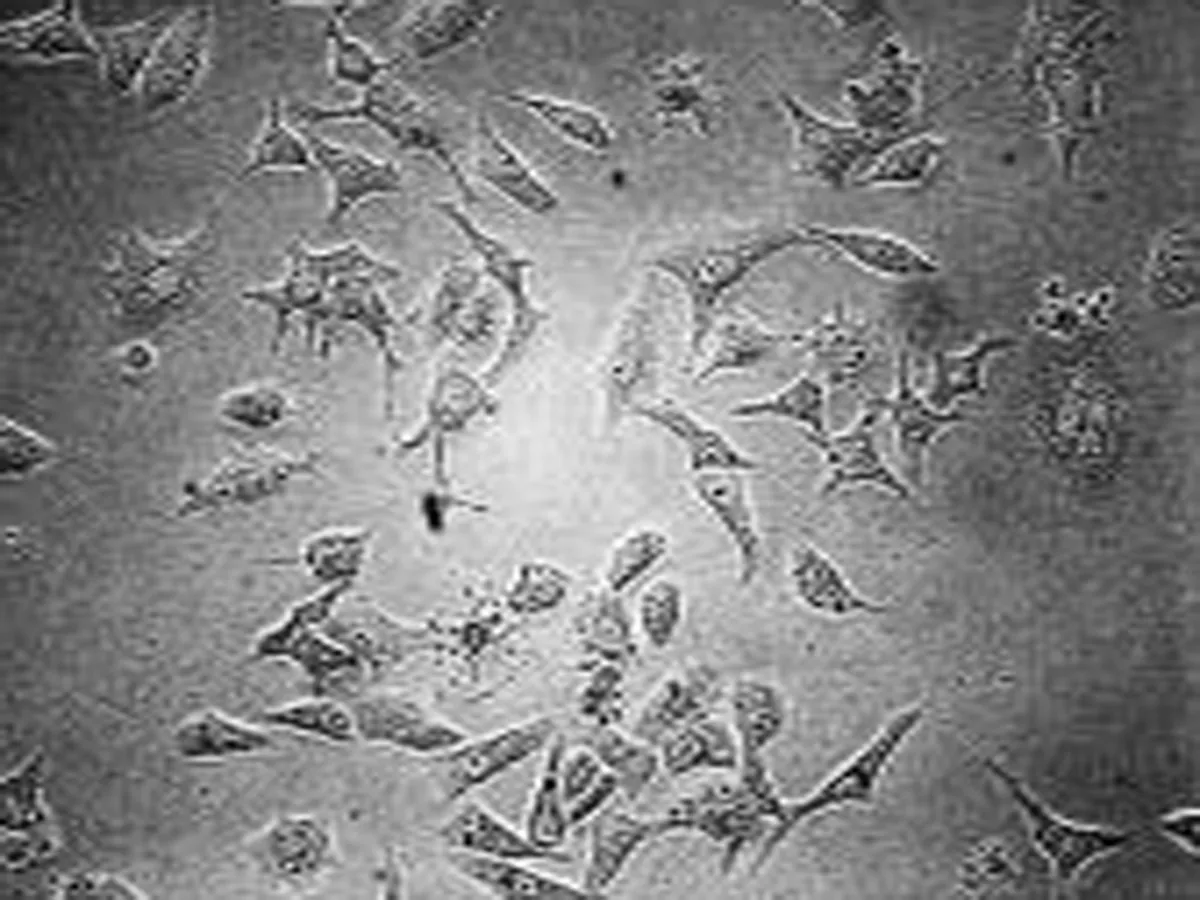
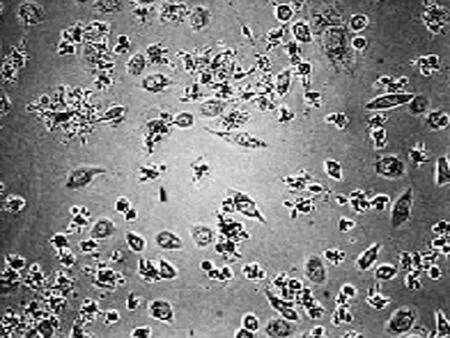
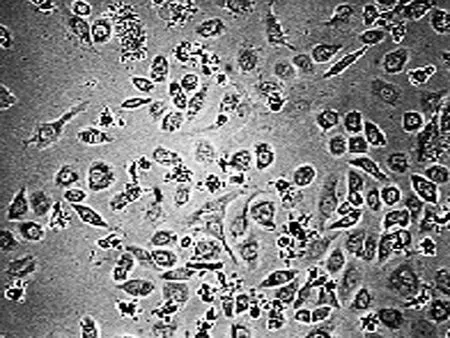
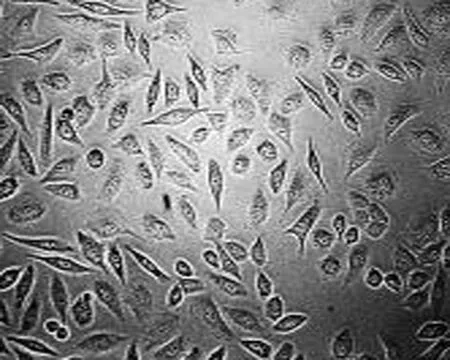
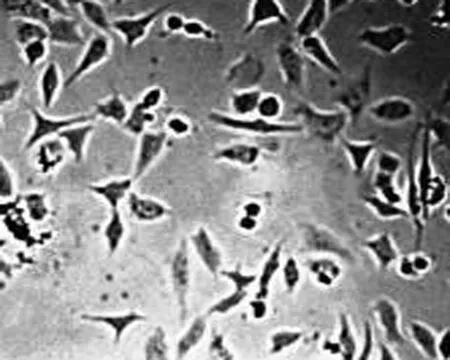
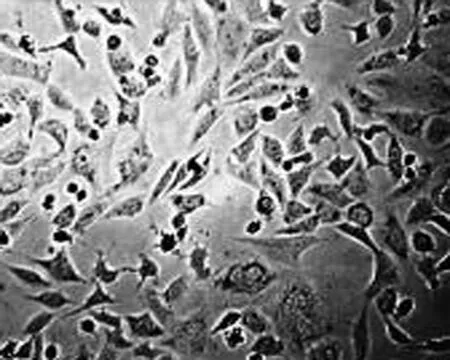
2.1 高良姜素对SiHa细胞形态的影响 在24 h,与空白对照组相比,随着高良姜素和顺铂浓度的增加,细胞数量明显减少,细胞胞体缩小,皱缩或碎裂,培养液中有较多的细胞碎片,悬浮细胞增多(图1、2);在观察不同时间段细胞状态时,发现药物干预后细胞增殖比正常细胞增殖缓慢(图 3)。
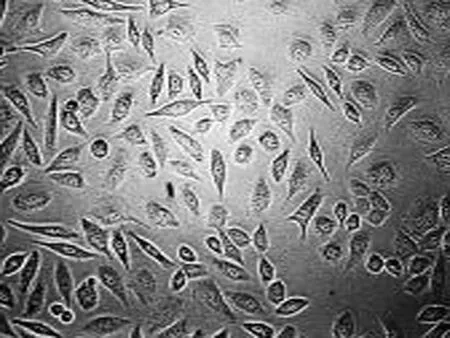
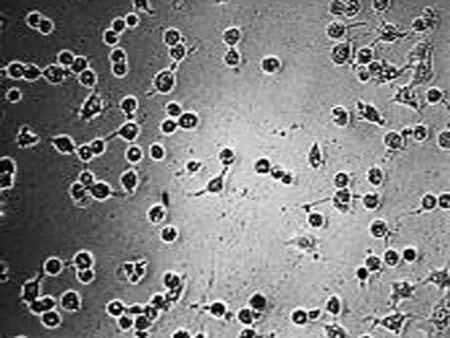
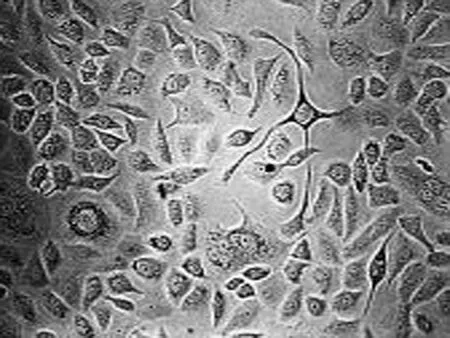
空白对照组 高良姜素125 μg/mL组 高良姜素75 μg/mL组 高良姜素25 μg/mL组
图1 高良姜素影响SiHa细胞形态的浓度依赖效应(24 h, ×200)
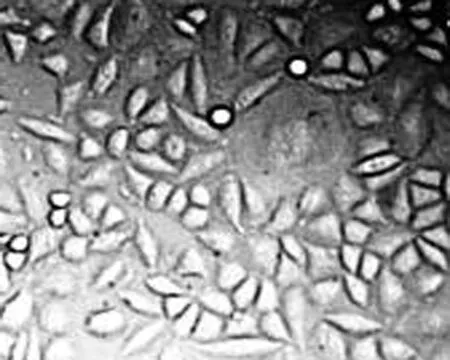
2.2 高良姜素干预对SiHa宫颈癌细胞存活率的影响 与空白对照组比较,随着药物剂量增加和干预时间延长,SiHa细胞增殖活力(存活率)均梯度性下降,差异有统计学意义(P<0.05),呈剂量和时间依赖性;与顺铂组(Cisplatin, DDP)相比较,其效应基本相似(表2)。
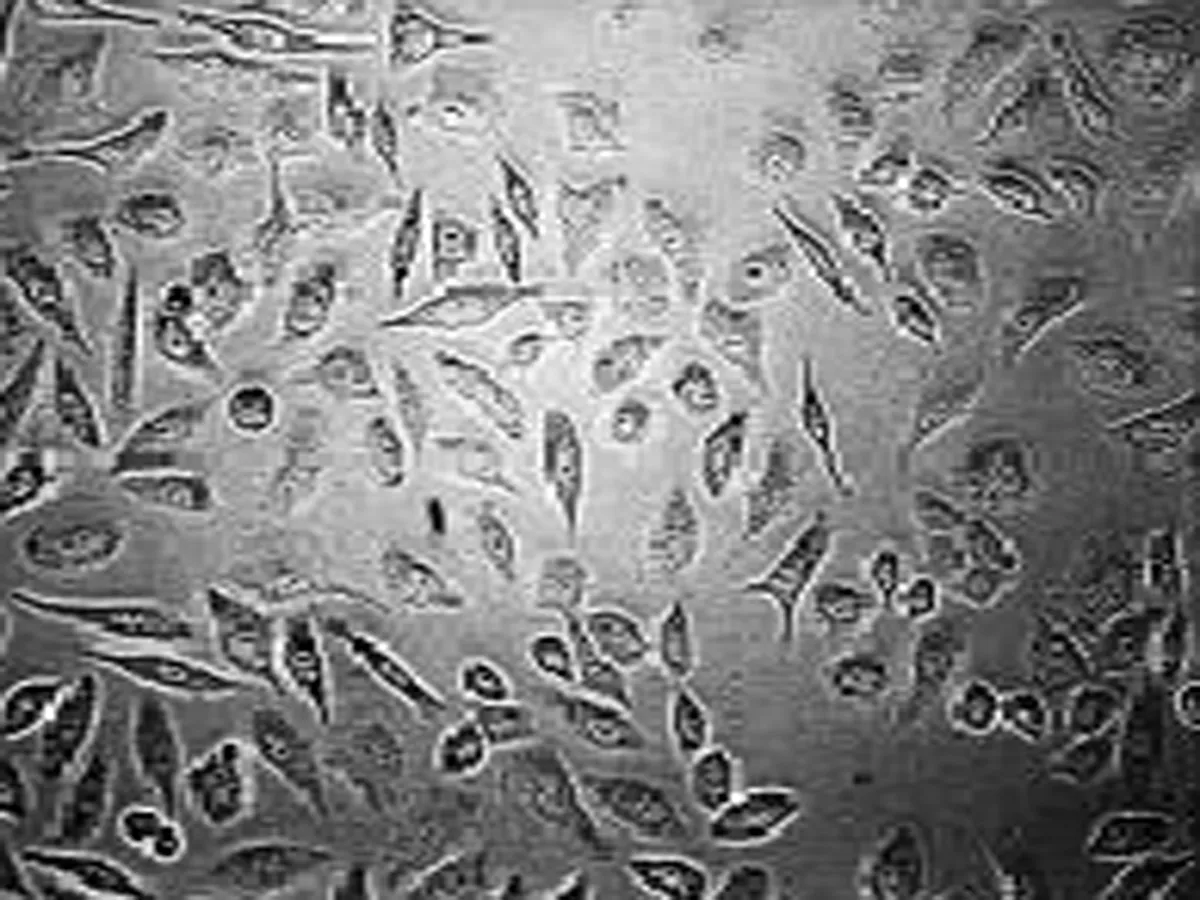

空白对照组 顺铂100 μg/mL组 顺铂50 μg/mL组 顺铂25 μg/mL组
图2 顺铂影响SiHa细胞形态的浓度依赖效应(24 h, ×200)
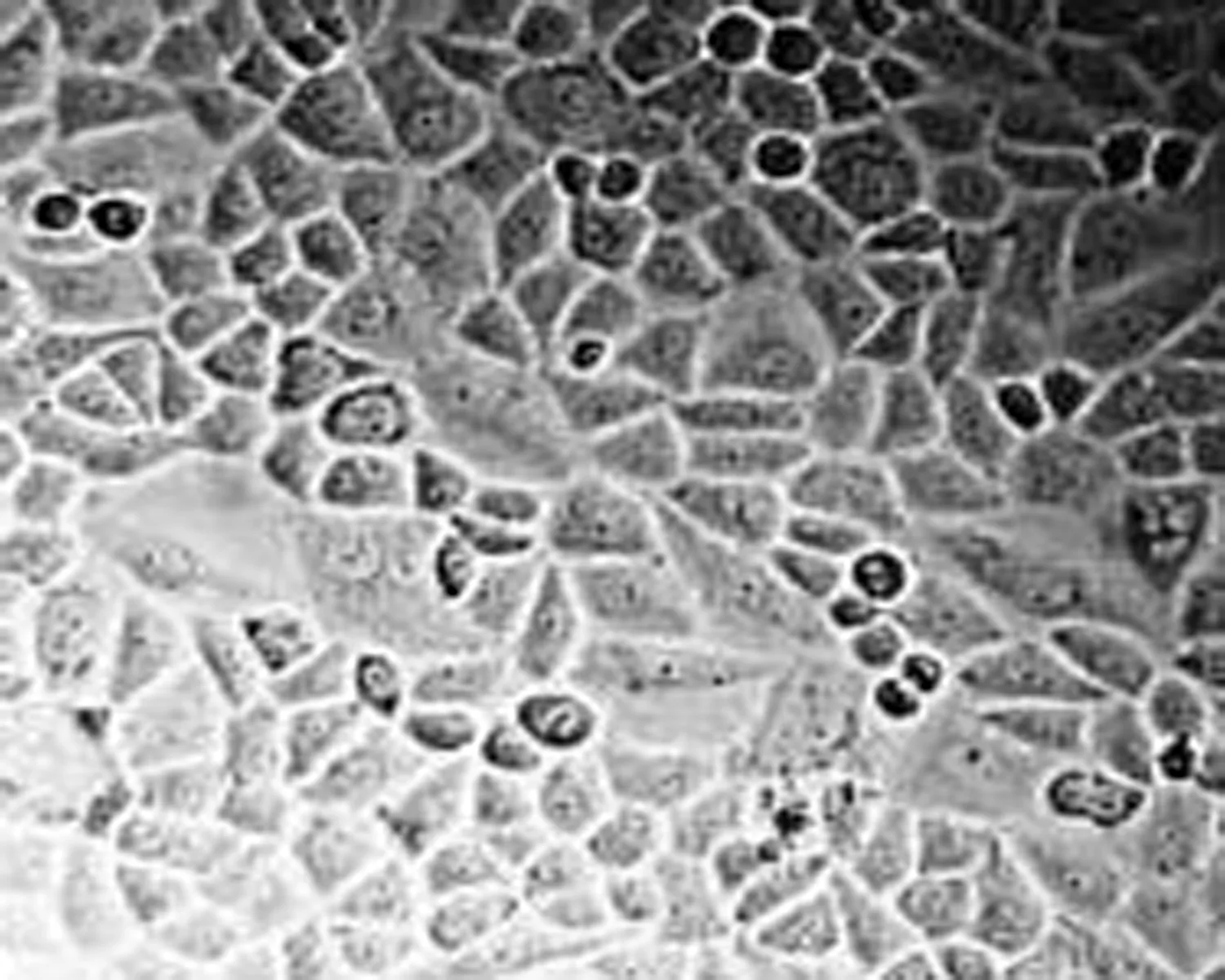
空白对照组 (24 h) 空白对照组 (48 h) 空白对照组 (72 h)
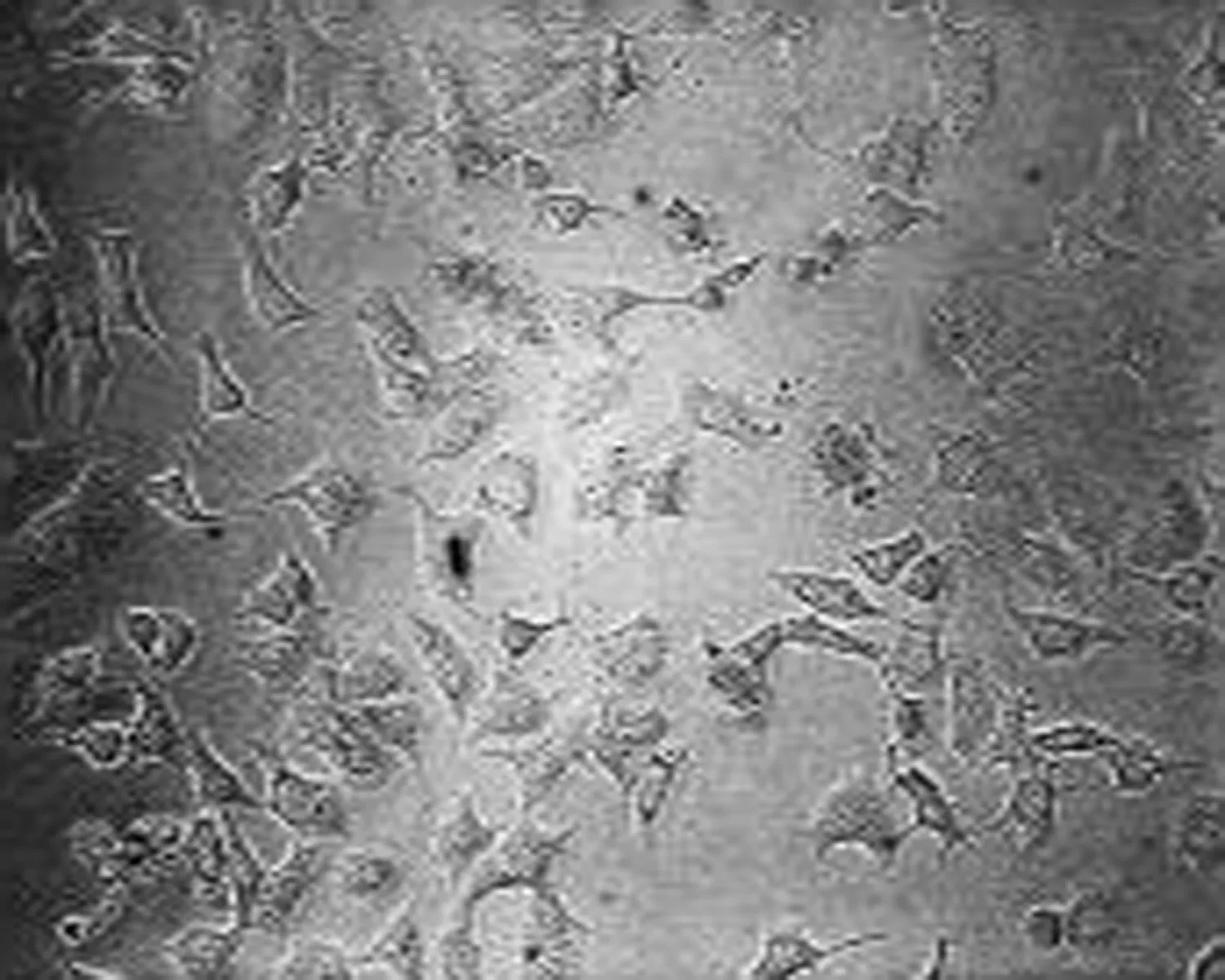
高良姜素50 μg/mL 组 (24 h) 高良姜素50 μg/mL 组 (48 h) 高良姜素50 μg/mL 组 (72 h)
图3 高良姜素(50 μg/mL)影响SiHa细胞形态的时间依赖效应(×200)

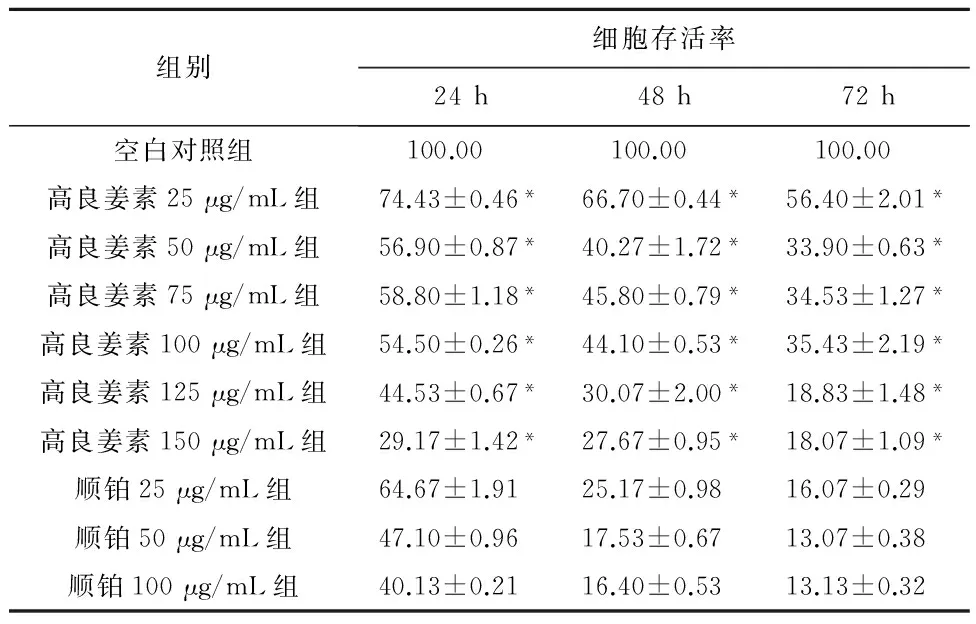
组别细胞存活率24h48h72h空白对照组 100.00 100.00 100.00高良姜素25μg/mL组74.43±0.46*66.70±0.44*56.40±2.01*高良姜素50μg/mL组56.90±0.87*40.27±1.72*33.90±0.63*高良姜素75μg/mL组58.80±1.18*45.80±0.79*34.53±1.27*高良姜素100μg/mL组54.50±0.26*44.10±0.53*35.43±2.19*高良姜素125μg/mL组44.53±0.67*30.07±2.00*18.83±1.48*高良姜素150μg/mL组29.17±1.42*27.67±0.95*18.07±1.09*顺铂25μg/mL组64.67±1.9125.17±0.9816.07±0.29顺铂50μg/mL组47.10±0.9617.53±0.6713.07±0.38顺铂100μg/mL组40.13±0.2116.40±0.5313.13±0.32
注: 与空白对照组比较,*P<0.05。
2.3 高良姜素对SiHa宫颈癌细胞凋亡的影响 在空白对照组,SiHa细胞自然发生的早期和晚期凋亡指数分别为5.6% 和0.4%,以25、100 μg/mL 高良姜素干预24 h后,早期凋亡率分别为21.3%和87.7%,晚期凋亡率分别为0.7% 和8.5%;与空白对照组比较,早期凋亡率明显上升,呈剂量依赖性。以25 μg/mL 顺铂干预24 h后发生的早期凋亡和晚期凋亡率分别为56.7% 和11.1 %(图4)。
2.4 高良姜素干预对细胞凋亡相关基因表达水平的影响 与空白对照组比较,25 μg/mL和100 μg/mL的高良姜素干预24 h 后,SiHa细胞内Caspase 3基因的 mRNA表达水平上调,差异有统计学意义(P<0.05)。 高良姜素100 μg/mL组Caspase 3的表达水平高于高良姜素25 μg/mL组,差异有统计学意义(P<0.05)。高良姜素干预后CDK4的表达水平上调,与空白对照组比较,差异无统计学意义(P>0.05),高良姜素25 μg/mL组及100 μg/mL 组CDK4 mRNA表达水平差异无统计学意义(P>0.05)(表 3)。
3 讨论
宫颈癌的发病机制主要与病毒感染[21]、癌基因与抑癌基因、细胞周期调节、端粒与端粒酶等有关。其中,人乳头状瘤病毒(HPV)的单一或多重持续感染现已被公认为是宫颈癌发生、发展的关键因素[22]。 95% 以上的宫颈癌是由高危型HPV 引起的,其中 HPV16与宫颈鳞状细胞癌的发生密切相关,HPV18 则与宫颈腺癌相关[23]。近年来研究发现黄酮类化合物在治疗肿瘤、心血管疾病、糖尿病、炎症、细菌、病毒感染(抗HIV病毒等)等多方面具有药理作用,而上述作用归因于其特有的化学结构,即黄酮结构中一定数目的羟基(2~4个)、C环2、3位的双键、2位的 β环定位、3位和6位的羟基、β环上邻位的羟基是发挥抗肿瘤活性的结构效应元件。诸多研究表明,黄酮类化合物主要是通过阻滞癌细胞增殖、诱导癌细胞凋亡、抑制蛋白激酶活性、抑制信号转导途径等机制发挥抗癌效应[24]。本研究中使用的高良姜素是从中药高良姜的根部提取纯化的单体黄酮类化合物,其分子结构中C环2、3位的有2个双键,2位的 β环定位、3位有羟基(即β环上邻位的羟基),符合上述黄酮类化合物发挥抗肿瘤作用的结构特点。本课题组在前期研究中,通过细胞水平研究, 发现高良姜总黄酮能够抑制肿瘤细胞增殖, 诱导细胞凋亡[3]。本研究在此基础上,进一步对高良姜总黄酮中高良姜素(单体)的抗癌活性进行研究。本课组前期研究报道了以25~150 μg/mL浓度的高良姜总黄酮干预SiHa细胞后,其细胞存活率分别为86.26%、80.05%、60.29%、59.51%[3]。本研究中,在25~150 μg/mL浓度范围的高良姜素干预后的细胞存活率均明显低于高良姜总黄酮干预后的细胞细胞存活率。MTT和细胞凋亡结果显示,高良姜素抑制宫颈癌Siha细胞增殖,降低细胞存活率,促进细胞凋亡,呈剂量和时间依赖性。因此,根据实验结果和上述结构分析可推测,高良姜素具有抗宫颈癌活性。

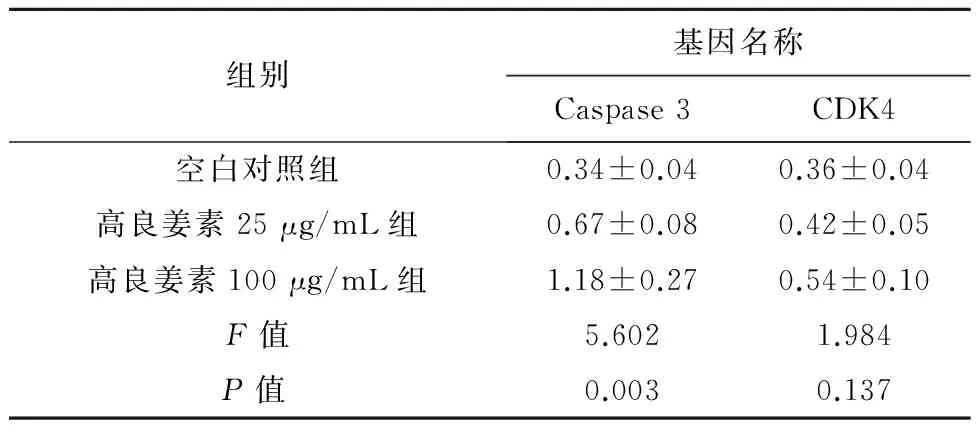
组别基因名称Caspase3CDK4空白对照组0.34±0.040.36±0.04高良姜素25μg/mL组0.67±0.080.42±0.05高良姜素100μg/mL组1.18±0.270.54±0.10F值5.6021.984P值0.0030.137
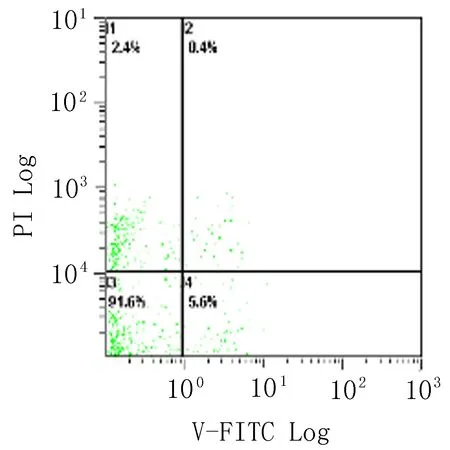

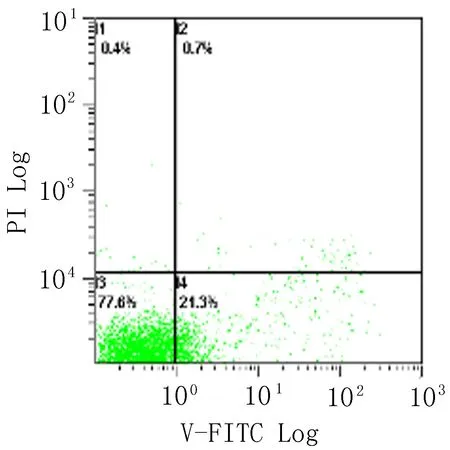
空白对照组 高良姜素100 μg/mL组 高良姜素25 μg/mL组 顺铂25 μg/mL组
图4 不同浓度高良姜素对SiHa细胞凋亡的影响(24 h)
Caspase是半胱氨酸依赖性细胞死亡蛋白酶,是一大类凋亡调节基因。Caspase 3是凋亡执行因子,其能够直接降解胞内的结构蛋白和功能蛋白而引起凋亡[25]。CDK 4 (cyclin D dependent kinase 4) 是一种细胞周期蛋白激酶,在p16 (INK4A)-CDK4/6-cyclin D1-pR-Rb-E2F信号转导通路中可与cyclin D1形成复合体, 抑制 pRB 活性,促进肿瘤细胞增殖、分化[26]。本研究采用RT-PCR方法,进一步研究高良姜素促进癌细胞凋亡的分子机制,研究结果显示,高良姜素通过提高凋亡执行因子Caspase 3的转录水平、促进细胞内结构蛋白的降解,实现凋亡作用。因此,高良姜素可能是高良姜总黄酮中发挥主要作用的有效成分,这对基于高良姜素的抗肿瘤新药研发有重要意义。
本研究中发现药物干预后CDK4基因的转录水平没有明显变化,而在前期研究中,吾尼且木·吐拉克等[4]发现高良姜总黄酮干预宫颈癌Siha细胞使CDK4基因下调表达,说明高良姜总黄酮中可能有另外一种单体黄酮类药物影响其表达水平,这部分内容需要进一步研究。另外,在以往研究中报道,干细胞标记物是胚胎干细胞阶段的转录因子,在多种肿瘤干细胞中过度表达,可能与肿瘤组织的形成、侵袭转移关系密切[27-29]。在今后的研究中进一步探讨良姜素与宫颈癌干细胞信号转导网络的相互作用机制,是新一代抗宫颈癌药物研发的重要切入点。
[1] Munagala R, Dona MG, Rai SN, et al. Significance of multples HPV infection incervical canser patients and its impact on treatment response[J]. Int Joncol, 2009, 34(1):263-271.
[2] Monsonego J. HPV infections and cervical cancer prevention priorities and new directions[J]. Gynecol Oncol, 2005, 96(3):830-839.
[3] 塞米热·艾尼瓦尔热,木塔力甫·艾买提,古扎力努尔·买提沙地克,等.高良姜总黄酮对宫颈癌Siha细胞增殖和凋亡的影响[J]. 新疆医科大学学报,2015,38(8):958-962.
[4] 吾尼且木·吐拉克,塞米热·艾尼瓦尔热,古扎力努尔买提沙,等. 高良姜总黄酮对宫颈癌细胞生长和肿瘤干细胞标记物表达水平的影响及意义[J].医学分子生物学杂志,2016,13(2):78-83.
[5] Leyla PK, Lhami G, Ahmet CG, et al. LC-MS/MS analysis, antioxidant and anticholinergic properties of galanga(Alpinia officinarum Hance) rhizomes[J]. Indust Crop Pro, 2015, 74(15):712-721.
[6] Wang ZJ, Zhang Q, Zhao XH, et al. Suppressive effect of galangin on human esophageal squamous cell carcinoma cell line KYSE-510[J]. Chin J Biochem Mol Biol, 2009, 25(6):563-569.
[7] 许云霞,赵新淮. 高良姜素对人胃癌SGC-7901细胞增殖、周期循环和凋亡的体外影响[J].中国药学杂志,2013,48(15):1274-1278.
[8] Dong Y, Huang HH, Zhao MM, et al. Mechanisms underlying the xanthine oxidase inhibitory effects of dietary flavonoids galangin and pinobanksin[J]. J Funct Foods, 2016, 24:26-36.
[9] Gwak J, Oh J, Cho M, et al. Galangin suppresses the proliferation of β-acten in response transcription-positive cancer cells by promoting adenomatous polyposis coli/Axin/glycogen synthase kinase-3β-independent β-catenin degradation[J]. Mol Pharmacol, 2011, 79(6):1014-1022.
[10] Murray TJ, Yang X, Sherr DH, et al. Growth of a human mammary tumor cell line is blocked by galangin, a naturally occurring bioflavonoid, and is accompanied by down-regulation of cyclins D3, E, and A[J]. Breast Cancer Res, 2006, 8(2):1-12.
[11] Kim JD, Liu L, Guo W, et al. Chemical structure of flavonols in relation to modulation of angiogenesis and immune-endothelial cell adhesion[J]. J Nutr Biochem, 2006, 17(3):165-176.
[12] Zhang HT, Luo H, Wu J, et al. Galangin induces apoptosis of hepatocellular carcinoma cells via the mitochondrial pathway[J]. World J Gastroenterol, 2010, 16(27):3377-3384.
[13] 罗辉,马超,汪亚君,等. 高良姜素诱导肝癌BEL-7402细胞凋亡的研究[J].中药材,2008,31(8):1204-1207.
[14] Szliszka E, Czuba ZP, Bronikowska J, et al. Ethanolic extract of propolis augments TRAIL-induced apoptotic death in prostate cancer cells[J]. Evid Based Complement Alternat Med, 2011,2011:535172.
[15] Bestwick CS, Milne L. Influence of galangin on HL-60 cell proliferation and survival[J]. Cancer Lett, 2006, 243(1):80-89.
[16] Zhu LP , Luo QQ , Bi JJ, et al. Galangin inhibits growth of human head and neck squamous carcinoma cells invitro and invivo[J].Chem Biol Interact, 2014,224:149-157.
[17] Deuk AK,Young KJ, Myeong JN, et al. Galangin induces apoptosis in gastric cancer cells via regulation of ubiquitin carboxy-terminal hydrolaseisozymeL1and glutathioneS-transferase P[J]. Food Chem Toxicol, 2012, 50(3-4):684-688.
[18] Tae KH, Mi EK, Ju HY, et al. Galangin induces human colon cancer cell death via the mitochondrial dysfunction and caspase-dependent pathway[J]. Exp Biol Med, 2013, 238(9):1047-1054.
[19] Cao JY, Wang HN, Xu AM, et al. Galangin inhibits cell invasion by suppressing the epithelial-mesenchymal transition and inducing apoptosis in renal cell carcinoma[J]. Mol Med Reports, 2016, 13(5):4238-4244.
[20] 董乃维,刘凤芝,甘春丽,等. 高良姜素提取工艺改进研究[J]. 哈尔滨医科大学学报,2006,40(2):168-169.
[21] Oliveira A, Dilqado C, Verdasca N, et al. Biomarkers of cervical carsinogenesis associated with genital human papillomavirus infection[J]. Acta Med Port, 2013,26(2):139-144.
[22] Kovacsk, Varnai AD, Bollmann M, et al. Prevalence and genotyped distribution of multple human papillomavirus infection in the uteren cervix:a 75 year long itudenal study in a routin cytology based screening population in west germany[J]. J Med Virul, 2008, 80(10):1814-1823.
[23] Bulk S, Berkhof J, Bulkmana NW, et al. Preferencial risk of HPV 16 for squamous cell carsinoma and of HPV 18 adeno carsinoma of the sirvix compared to women with normal cytology in the Netherlans[J]. Br J Cancer, 2006, 94(1):171-175.
[24] Kandaswami C, Lee LT, Lee PP, et al. The antitumor activities of flavonoids[J]. In Vivo, 2005, 19(5):895-909.
[25] Balal K, Hojjatollah NC, Nasrin S, et al. Ultrasensitive caspase-3 activity detection using an electrochemical biosensor engineered by gold nanoparticle functionalized MCM-41:Its application during stem cell differentiation[J]. Sens Actuators B Chemical,2016,231:561-575.
[26] Liu HQ, Wang YH, Wang LL, et al. P16INK4A and survivin:Diagnostic and prognostic markers in cervical intraepithelial neoplasia and cervical squamous cell carcinoma[J]. Exp Mol Pathol, 2015, 99(1):44-49.
[27] Christiana H, Konstantina C, Natalia P et al. Common stemness regulators of embryonic and cancer stem cells[J]. World J Stem Cells, 2015, 7(9):1150-1184.
[28] Samir KP, Moonmoon D, Aditi P et al. Molecular marks for epigenetic identification of developmental and cancer stem cells[J]. Clin Epigenetics, 2011, 2(1):27-53.
[29] Lesley AM, Francesco C, Farrarl WL, et al. Epigenetic gene regulation in stem cells and correlation to cancer[J]. Differentiation, 2009, 78(1):1-17.
(本文编辑:杨晨晨)
The effects of Galangin against human cervical cancer apoptosis and gene expression levels in vitro
Guzhalinuermaitisha1, Mutalifu Aimaiti1, Aierken Rouzibilali2, Nuermanguli Rouzi3, Abulizi Abudula1, 2
(1KeyLaboratoryofMolecularBiologyandEndemicDiseases;2DepartmentofBiochemistry,CollegeofBasicMedicine,XinjiangMedicalUniversity,Urumqi830011,China;3DepartmentofGynecology,People′sHospitalofXinjiangUyghurAutonomousRegion,Urumqi830000,China)
Objective To investigate effects of galangin isolated from Alpinia officinarum Hance on growth and apoptosis and related gene expressions in SiHa cervical carcinoma cells. Methods (1) Changes in cell viability after treatment of SiHa cervical carcinoma cells with different dose of galangin and Cisplatin at 24 h, 48 h and 72 h were measured by methylthiazolyl tetrazolium (MTT) and Changes in cell morphology were documented by inverted opticmicroscopy. (2) The 24 h apoptopic rate of SiHa cervical carcinoma cells induced by galangin were detected by FCM. (3) The expression of Caspase 3 and CDK 4 were analyzed by fluorescent quantitative PCR. Results After the treatment of SiHa cervical carcinoma cells with galangin, cell viability decreased significantly in a dose-and time-dependent manner. The early stage apoptosis rate increased than that in control with a dose-dependent manner. The expression of Caspase 3 in SiHa cervical carcinoma cells were significantly increased (P<0.05), while the expression of CDK 4 was no significant difference than that in control (P>0.05). Conclusion Galangin can inhibit proliferation and induce apoptosis of SiHa cervical carcinoma cells. However, its effect on the cell cycle arrest still remains to be further investigation.
Galangin; SiHa cervical carcinoma cells; Cell apoptosis; Gene expression
国家自然科学基金(81360321)
古扎力努尔买提沙(1983-),女(维吾尔族),在读博士,助理研究员,研究方向:宫颈癌发病机制及早期预警。
阿布力孜·阿布杜拉,男(维吾尔族),博士,教授,博士生导师,研究方向:分子生物学, E-mail: abulizi_a@126.com。
R737.33
A
1009-5551(2016)12-1595-06
10.3969/j.issn.1009-5551.2016.12.028
2016-07-05]
