130例乳腺癌术后胸壁复发患者预后相关因素分析
2016-12-06吴晖史静琤欧阳取长谢宁田璨刘妮曾化桂
吴晖,史静琤,欧阳取长,谢宁,田璨,刘妮,曾化桂
(1.中南大学湘雅公共卫生学院流行病与卫生统计学系,湖南 长沙 410078;2.湖南省肿瘤医院,湖南 长沙 410013)
130例乳腺癌术后胸壁复发患者预后相关因素分析
吴晖1,史静琤1,欧阳取长2,谢宁2,田璨2,刘妮2,曾化桂2
(1.中南大学湘雅公共卫生学院流行病与卫生统计学系,湖南 长沙 410078;2.湖南省肿瘤医院,湖南 长沙 410013)
目的通过回顾性分析早期乳腺癌术后胸壁复发患者的病例资料,探讨早期乳腺癌患者术后胸壁复发的相关因素。方法选取2008~2009年该院收治的共130例早期乳腺癌术后胸壁复发患者的临床、病理及预后资料,分析其临床特点、胸壁复发时间,Kaplan-Meier法、雌激素受体法计算患者无瘤生存率,COX模型行多因素分析。结果3、5年无瘤生存率分别为58.4%和33.7%,3、5年总体生存率为91.4%和83.9%,中位发病年龄为45岁,中位复发时间为25个月,中位生存时间为56个月。预后相关因素的COX分析显示,肿瘤分期、肿瘤细胞分化程度、淋巴结转移、C雌激素受体B-2表达、雌激素受体、孕激素受体及Ki-67表达是影响患者5年总体生存率的因素(P=0.006、0.015、0.008、0.005、0.024、0.019和0.028)。结论肿瘤分期晚、肿瘤细胞分化程度低、存在淋巴结转移、C雌激素受体B-2阳性表达、雌激素受体和孕激素受体低表达及Ki-67高表达是影响患者5年总体生存率的相关因素,对存在上述危险因素的患者,应根据患者情况选择个体化治疗方案,改善患者预后。
乳腺癌;胸壁复发;预后;因素分析
目前,乳腺癌成为女性最常见的恶性肿瘤之一,其发病年龄逐渐趋于年轻化,已经严重威胁着女性的身心健康。随着我国普查工作的开展,乳腺癌的早期筛查得到广泛的开展,然而其死亡率仍较高,而术后的局部复发也是其重要因素。研究表明,早期乳腺癌术后胸壁复发占乳腺癌局部复发的50%以上[1],因此如何及早发现和有效预防乳腺癌患者术后出现胸壁复发,是提高早期乳腺癌患者术后生存率的关键。本研究收集本院2008~2009年早期乳腺癌胸壁复发患者的临床资料,旨在分析早期乳腺癌改良根治术后胸壁复发的影响因素,以便于临床预防策略的有效实施及治疗计划的合理选择,从而进一步改善该类患者的预后。
1 资料与方法
1.1一般资料
选取2008年1月-2009年12月本院收治的130例早期乳腺癌术后仅出现胸壁复发患者为研究对象,均通过病理确诊。全部病例为女性;年龄26~72岁,平均(47.1±15.9)岁,中位发病年龄43岁;未绝经73例,绝经57例;一级亲属患乳腺癌者47例,未患乳腺癌者83例;肿瘤≤2 cm(T1)45例,2~5 cm(T2)61例,>5 cm(T3)24例;原发肿瘤TNM分期(AJCC分期标准)中Ⅰ期42例,Ⅱ期60例,Ⅲ期28例;单纯癌14例,浸润性导管癌98例,浸润性小叶癌8例,髓样癌3例,导管内乳头状癌2例,黏液腺癌5例;高分化35例,中分化52例,低分化43例;腋窝淋巴结(有癌转移为阳性,无转移为阴性)者阴性者28例,阳性者102例;雌激素受体(estrogen receptors,ER)阳性者(+)96例,ER阴性者(-)34例;孕激素受体(progesterone receptor,PR)阳性者(+)91例,PR阴性(-)39例;人类表皮生长因子受体2(human epidermal growth factor receptor 2,CerbB-2)阳性41例,CerbB-2阴性89例;肿瘤细胞增殖抗原(Ki-67)阳性82例,Ki-67阴性48例。所有患者原发肿瘤均行常规乳腺癌改良根治术,术后行化学治疗(化疗)117例,放射治疗(放疗)95例,内分泌治疗106例,靶向治疗41例。
1.2随访及评价指标
本研究通过门诊复查、电话、信件或网络调研等方式对入组后的早期乳腺癌术后仅出现胸壁复发患者进行随访,随访日期选自患者接受乳腺癌改良根治术后开始,截至时间为2014年12月或者患者死亡、失访日期。统计指标包括:年龄、月经及生育情况,一级家属患乳腺癌情况,肿瘤分期及大小,淋巴结转移情况,病理类型,ER、PR、CerbB-2和Ki-67是否阳性。无瘤生存期定义为早期乳腺癌患者经过根治性治疗后到肿瘤出现复发转移或其他原因导致死亡的时间,总生存期是指从早期乳腺癌手术后第1天开始到因各种原因死亡或末次随访的时间。
1.3统计学方法
采用SPSS 17.0统计软件进行数据分析,组间比较用χ2检验,Kaplan-Meier法计算患者无瘤生存率及总生存率,对生存率进行单因素分析,对无瘤生存期进行COX回归模型(Backward Wald)多因素分析,对患者年龄、绝经情况、家族史、肿瘤分期、肿瘤大小、肿瘤细胞分化程度、病理类型、ER、PR、CerbB-2及Ki-67表达、淋巴结阳性、是否化疗、放疗、内分泌治疗、靶向治疗等因素进行COX风险回归分析,P<0.05为差异有统计学意义。
2 结果
2.1随访情况
截至时间为2014年12月31日,共得到随访数据126例,失访4例,随访率为96.9%,中位随访时间为45个月(7~84个月)。至随访结束,本组病例中41例患者死亡,生存85例,死亡率为31.5%。
2.2总体生存情况
Kaplan-Meier生存分析结果显示,随访期间共有41例患者死亡,生存85例,生存率65.4%,最长随访84个月。全组患者1、3及5年无瘤生存率分别为91.5%、58.4%和33.7%,中位无瘤生存时间为25个月。全组患者1、3及5年总生存率分别为99.2%、91.4%和83.9%,中位生存时间为56个月。见图1、2。
2.3转移率及复发率
随访期间,区域淋巴结转移102例,占92.9%。中位无瘤生存期为25个月,中位总生存期为56个月。全组Ⅰ期、Ⅱ期、Ⅲ期复发转移率分别为75.0%、81.7%和95.2%,差异有统计学意义(P<0.05)。
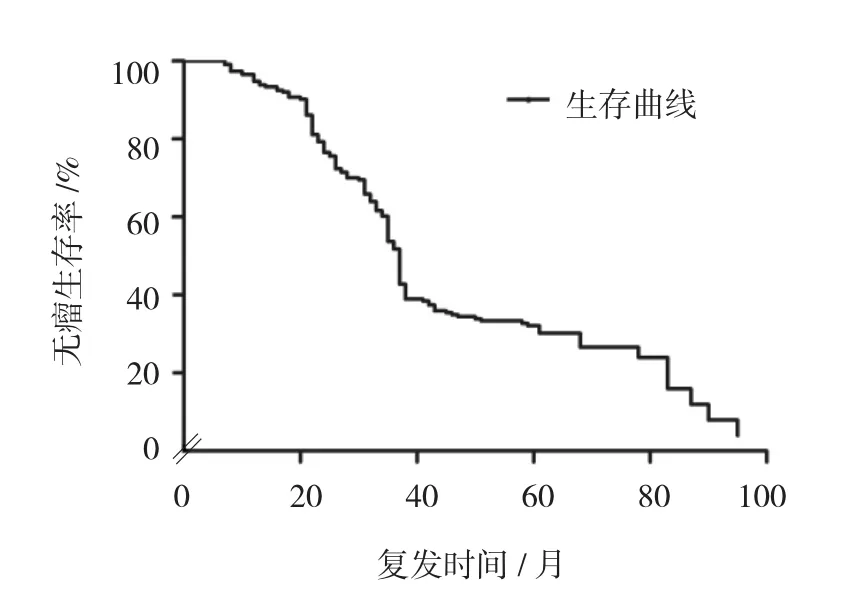
图1 无瘤生存率曲线图
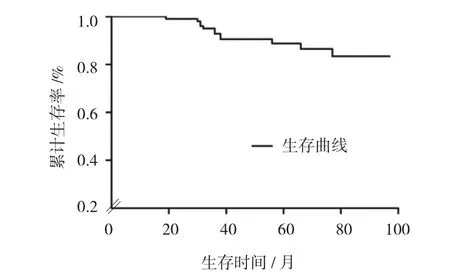
图2 生存率曲线图
2.4早期乳腺癌术后胸壁复发患者无瘤生存率相关因素的COX多因素分析
结果显示,早期乳腺癌胸壁复发患者5年无瘤生存率与患者年龄、绝经情况、一级亲属患乳腺癌情况、肿瘤大小及是否放化疗、内分泌治疗及靶向治疗无相关(P>0.05),而与肿瘤分期、肿瘤细胞分化程度、淋巴结转移,CerB-2、ER、PR及Ki-67表达相关(P<0.05)。见附表。
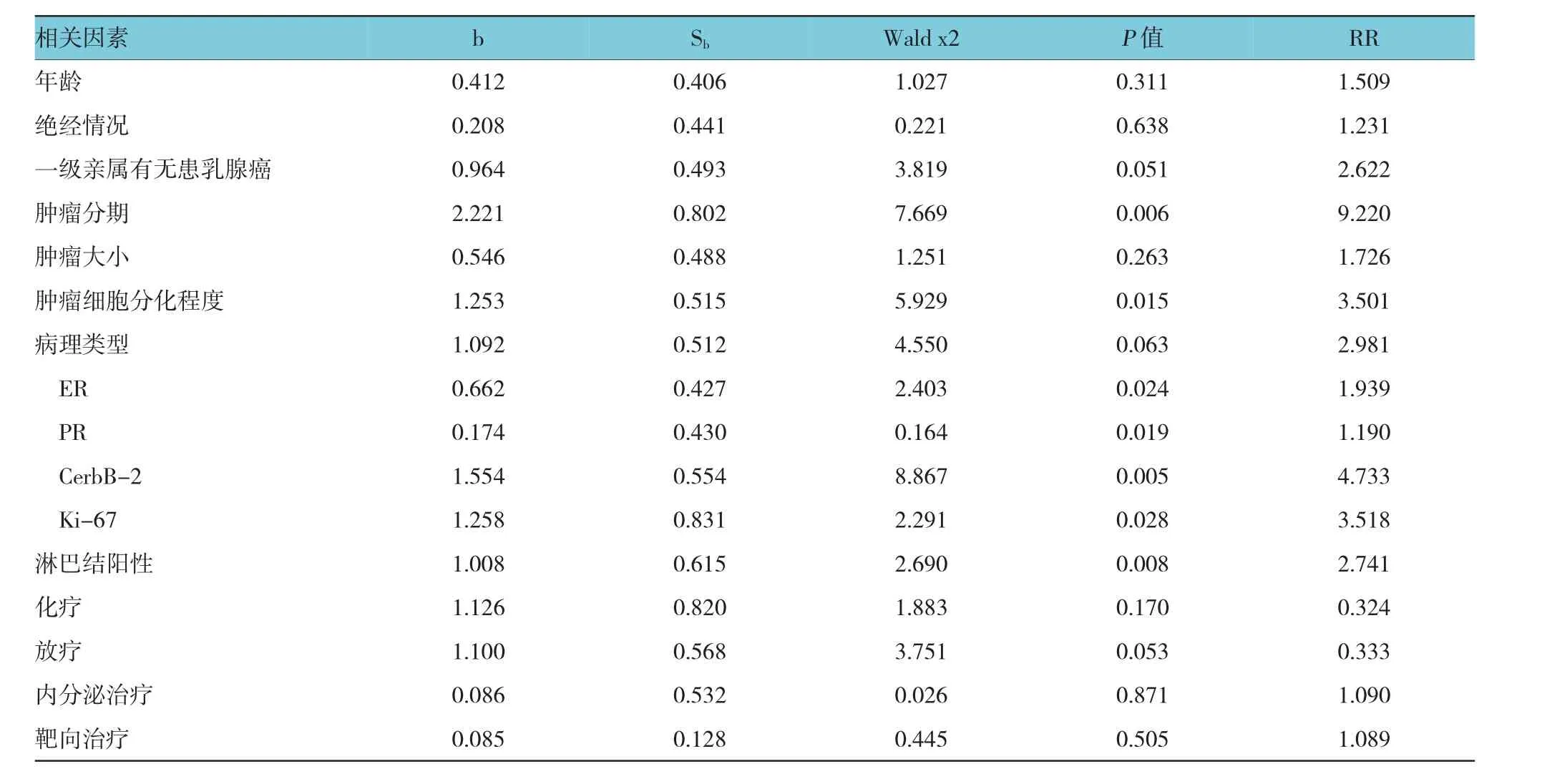
附表早期乳腺癌术后胸壁复发患者生存率相关因素的COX多因素分析
3 讨论
乳腺癌术后局部复发是指手术治疗后出现胸壁和/或区域淋巴结复发,复发率高达10%~30%,其中胸壁复发所占比例最高,是影响乳腺癌患者术后生存率的重要因素[1]。胸壁复发多发生在术后2年内,局部复发后约60.8%~80.0%出现远处转移,以肺、骨及肝脏转移多见,最后多远处转移而死亡[2]。目前研究表明,影响乳腺癌患者生存及预后的因素主要包括两类:第一类是临床病理因素,其中包括患者发病年龄、月经初潮及绝经情况、淋巴结转移情况、激素表达情况、肿瘤大小及分化程度等;另一类是治疗相关因素。乳腺癌是全身性疾病,其病变部位不仅仅局限于乳腺组织,因此在治疗过程中需要采用合理规范的综合性治疗[3]。
乳腺癌是一种全身性疾病,胸壁复发是乳腺癌可能出现远处转移的征象。乳腺癌胸壁复发患者生物学行为和预后有显著的不同,其生存率有很大差异。本组病例中显示,患者出现胸壁复发的时间最长达到96个月,而最短只有5个月。生存时间最短的也只有20个月。
有文献表明,青年患者乳腺癌较中老年乳腺癌具有更高的组织学分级和临床分期,淋巴结转移率也更高并且转移淋巴结数目更多,肿瘤的恶性程度及侵袭性更强,预后相对更差[4-5]。而也有研究认为发病年龄并不是乳腺癌的相关预后因素。本次研究发现,年龄与早期乳腺癌术后胸壁复发患者预后无相关。同时,患者的绝经情况、一级亲属患乳腺癌情况也与该类患者预后无明显相关。
临床分期对肿瘤的生存期起着重要提示作用,其在判断乳腺癌预后方面也起着重要作用[6]。同时,原发肿瘤的大小也被认为与乳腺癌出现胸壁复发及转移、生存率有着密切联系,被认为是乳腺癌患者预后的独立影响因素。原发灶的增大将导致浸润范围扩大,潜在的微小病灶增多,使得术后胸壁复发机会增多。本次研究单因素分析发现,临床分期与早期乳腺癌术后胸壁复发预后相关,而肿瘤大小与术后胸壁复发呈现正相关,而与预后无相关,可能与临床病例数不足有关。乳腺癌的病理类型、组织学分级和区域淋巴结转移情况等临床病理特征也是反映乳腺癌恶性程度的直接指标,也决定其临床进展和预后。本次研究笔者发现肿瘤细胞分化程度及淋巴结阳性均与早期乳腺癌胸壁复发预后有关。
乳腺癌患者肿瘤相关基因的表达异常是其存在一系列肿瘤异质性的基础,而相关基因的表达在乳腺癌的预后中起到提示作用[6-7]。ER是一个由激素结合蛋白分子成的二聚体,而PR是雌激素作用的最终产物。研究表明,ER、PR与患者的生存率呈正相关,是乳腺癌最重要的预后影响因素之一[8-9]。CerbB-2能从蛋白质水平上调肿瘤细胞趋化因子受体CXCR4的表达,后者则进一步介导肿瘤的转移[10]。在人类乳腺癌组织中CerB-2和CXCR4的表达呈正相关,而且CXCR4的高水平表达往往预示着癌症患者预后不良,生存率低下[11-12]。Ki-67是反映肿瘤细胞增殖的指标,其数值越高,肿瘤的恶性程度越高,发生复发转移的概率也越大,预后相对越差[13]。本研究中Ki-67是乳腺癌预后的独立影响因素。
乳腺癌术后辅助放疗和化疗可延长术后无瘤生存期,辅助放疗明显降低局部复发率,因此乳腺癌综合治疗对降低胸壁复发具有重要作用[14]。在乳腺癌的治疗过程中,不仅要手术局部治疗彻底,而且需要重视术前、术后的综合治疗,包括手术前后的化疗、放疗和其他治疗[14-15]。放疗是乳腺癌术后胸壁复发的重要治疗手段,包括局部小野照射和全胸壁照射[16-17]。目前,乳腺癌诊疗指南推荐的标准化治疗是在手术根治的基础上,配合术后辅助放化疗、内分泌治疗及靶向生物免疫治疗,并结合患者实际情况再给予相应调整,从而改善患者生存率。本次研究中早期乳腺癌术后胸壁复发患者由于均于术后采取规范的术后辅助放化疗、内分泌及靶向治疗,因此并未发现放化疗与该类患者预后有相关性。
总之,本次研究结果显示,肿瘤分期晚、肿瘤细胞分化程度低、存在淋巴结转移、CerbB-2阳性表达、ER和PR低表达、Ki-67高表达是影响患者5年总体生存率的相关因素,对存在上述危险因素的患者,应根据患者情况选择个体化治疗方案,改善患者预后。
[1]SERSA G,CUFER T,PAULIN S M,et al.Electrochemotherapy of chest wall breast cancer recurrence[J].Cancer Treat Rev, 2012,38(5):379-386.
[2]黄哲宙,陈万青,吴春晓.中国女性乳腺癌的发病和死亡现况——全国32个肿瘤登记点2003-2007年资料分析报告[J].肿瘤,2012, 32(6):435-439.
[3]YOUK J H,JUNG I,KIM E K,et al.US follow-up protocol in concordant benign result after US-guided 14-gauge core needle breast biopsy[J].Breast Cancer Res Tr,2012,132(3):1089-1097.
[4]ANDERS C K,DEAL A M,MILLER C R,et al.The prognostic contribution of clinical breast cancer subtype,age,and race among patients with breast cancer brain metastases[J].Cancer, 2011,117(8):1602-1611.
[5]JONES L W,COURNEYA K S,MACKEY J R,et al.Cardiopulmonary function and age-related decline across the breast cancer survivorship continuum[J].J Clin Oncol,2012,30(20):2530-2537.
[6]STEPHENS P J,TARPEY P S,DAVIES H,et al.The landscape of cancer genes and mutational processes in breast cancer[J]. Nature,2012,486(7403):400-404.
[7]BAKER J B,BRYANT J L,PAIK S,et al.Molecular indicators of breast cancer prognosis and prediction of treatment response[M]. Google Patents,2009.
[8]BAUER K R,BROWN M,CRESS R D,et al.Descriptive analy sis of estrogen receptor(ER)-negative,progesterone receptor(PR) -negative,and HER2-negative invasive breast cancer,the so-called triple-negative phenotype[J].Cancer,2007,109(9):1721-1728.
[9]LIEDTKE C,MAZOUNI C,HESS K R,et al.Response to neoadjuvant therapy and long-term survival in patients with triplenegative breast cancer[J].J Clin Oncol,2008,26(8):1275-1281.
[10]SLAMON D,EIERMANN W,ROBERT N,et al.Adjuvant trastuzumab in HER2-positive breast cancer[J].New Engl J Med,2011,365(14):1273-1283.
[11]ZHANG M,LIU H X,TENG X D,et al.The differences in CXCR4 protein expression are significant for the five molecular subtypes of breast cancer[J].Ultrastruct Pathol,2012,36(6): 381-386.
[12]OK S,KIM S M,KIM C,et al.Emodin inhibits invasion and migration of prostate and lung cancer cells by downregulating the expression of chemokine receptor CXCR4[J].Immunopharm Immunot,2012,34(5):768-778.
[13]MOHAMMED Z,MCMILLAN D,ELSBERGER B,et al.Comparison of visual and automated assessment of Ki-67 proliferative activity and their impact on outcome in primary operable invasive ductal breast cancer[J].Brit J Cancer,2012,106(2): 383-388.
[14]GROUP EBCTC.Effect of radiotherapy after breast-conserving surgery on 10-year recurrence and 15-year breast cancer death: meta-analysis of individual patient data for 10 801 women in 17 randomised trials[J].Lancet,2011,378(9804):1707-1716.
[15]CURIGLIANO G,BAGNARDI V,BERTOLINI F,et al.Antiangiogenic therapy in recurrent breast cancer with lymphangitic spread to the chest wall:A randomized phaseⅡtrial of bevacizumabwithsequentialorconcurrentoralvinorelbineand capecitabine[J].Breast,2015,24(3):263-271.
[16]SHEN M C,MASSARWEH N N,LARI S A,et al.Clinical courseofbreastcancerpatientswithisolatedsternaland full-thickness chest wall recurrences treated with and without radical surgery[J].Ann Surg Oncol,2013,20(13):4153-4160.
[17]SETHI R,PARK C,FOWBLE B,et al.Postmastectomy radiotherapy in patients with breast cancer[J].Lancet,2014,384(9957): 1844-1845.
(申海菊 编辑)
Analysis of prognostic factors in 130 breast cancer patients with chest wall recurrence after mastectomy
Hui Wu1,Jing-cheng Shi1,Qu-chang Ouyang2,Ning Xie2,Can Tian2,Ni Liu2,Hua-gui Zeng2
(1.Department of Epidemiology and Medical Statistics,Xiangya School of Public Health, Central South University,Changsha,Hunan 410078,China;2.Hunan Cancer Hospital, Changsha,Hunan 410013,China)
Objective To retrospectively analyze the data of the cases of early-stage breast cancer with chest wall recurrence after mastectomy,and to analyze the factors correlated to their prognosis.Methods The clinical,pathological and prognostic data of 130 cases with chest wall recurrence after mastectomy for earlystage breast cancer from 2008 to 2009 in this hospital were analyzed and the clinical features were observed during follow-up.The disease-free survival rate was analyzed by Kaplan-Meier method and the multivariate analysis was executed by COX model.Results The 3-and 5-year disease-free survival rates of these patients were 58.4%and 33.7%,respectively.The 3-and 5-year overall survival rates of these patients were 91.4% and 83.9%,respectively.Median age was 45 years.The median recurrence time was 25 months and the median survival time was 56 months.COX regression analysis showed that tumor stage,tumor differentiation, lymph node metastasis,the expressions of CerbB-2,ER,PR and Ki-67 were the factors that affected the overall 5-year survival rate of the patients with chest wall recurrence after mastectomy for early-stage breast cancer(P=0.006,0.015,0.008,0.005,0.024,0.019 and 0.028 respectively).Conclusions In the early breast cancer patients with chest wall recurrence after mastectomy,late tumor stage,poor differentiation,lymph node metastasis,positive CerbB-2 expression,high expression of Ki-67,and low expressions of ER and PR are thefactors affecting the overall 5-year survival rate.Thus for the patients with such risk factors,individualized treatment programs should be chosen according to the actual situation to improve prognosis.
breast cancer;chest wall recurrence;prognosis;factor analysis
R737.9
B
10.3969/j.issn.1005-8982.2016.21.028
1005-8982(2016)21-0131-05
2015-11-17
史静琤,E-mail:jingzhengs@126.com;Tel:13574817298
