鸭疫里默氏杆菌假定溶血素相关蛋白基因Riean_0415的原核表达及溶血活性检测
2016-12-01孙冰清崔俊生陶敏捷丁云竹薛亚飞刘光清胡青海
姜 盼,孙冰清,崔俊生,陶敏捷,丁云竹,薛亚飞,刘光清,胡青海
(中国农业科学院上海兽医研究所,上海200241)
·研究论文·
鸭疫里默氏杆菌假定溶血素相关蛋白基因Riean_0415的原核表达及溶血活性检测
姜 盼,孙冰清,崔俊生,陶敏捷,丁云竹,薛亚飞,刘光清,胡青海
(中国农业科学院上海兽医研究所,上海200241)
为了分析鸭疫里氏杆菌(Riemerella anatipestifer,RA)假定的含CBS结构域的溶血素相关蛋白(hypothetical hemolysinrelated protein,HRP)的功能,本研究根据血清10型鸭疫里氏杆菌HXb2株Riean_0415基因的核苷酸序列,设计了1对特异性引物,采用PCR扩增了Riean_0415基因,并进行了序列测定与分析。然后将Riean_0415基因克隆到原核表达载体pET-43.1a,再用亲和层析纯化获得诱导表达的重组蛋白rHRP。溶血活性检测结果表明表达的重组蛋白rHRP具有裂解鸭红细胞的活性。本研究结果为进一步研究rHRP蛋白的功能和鸭疫里默氏杆菌的溶血机制等奠定了基础。
鸭疫里默氏杆菌;溶血素相关蛋白;原核表达;溶血活性检测
鸭疫里氏杆菌病是鸭疫里氏杆菌感染家鸭、鹅、火鸡及其他家禽和野禽引起的一种接触性传染病,又称为鸭传染性浆膜炎,是当前危害全世界养鸭业的一种主要疾病。病鸭死亡率高、消瘦、胴体品质下降、疾病治疗等给养鸭业造成巨大经济损失[1]。
目前对鸭疫里默氏杆菌(Riemerella anatipestifer,RA)的毒力相关基因还知之甚少,已经确定的毒力基因只有OmpA[2]、TbdR1[3]和SIP[4]等少数几个。有研究表明溶血素是细菌致病的重要毒力因子,在细菌致病过程中起着不容忽视的作用[5]。本实验室测定了鸭疫里默氏杆菌HXb2株的全基因组序列(未发表),解析后发现其基因组中有假定的溶血素基因hrp。本研究对HXb2株假定的溶血素基因Riean_0415进行了克隆、原核表达和溶血活性分析,为进一步研究其生物学功能奠定了基础。
1 材料和方法
1.1 菌株和血清 鸭疫里默氏杆菌HXb2株(血清10型)由本实验室分离、鉴定并保存;E.coli DH5a 及BL21(DE3)感受态细胞购自天根生化科技(北京)有限公司。
1.2 载体、酶及主要试剂 本研究中用到的限制性内切酶均购自TaKaRa公司;Expand High Fedility PCR system 购自Roche公司;原核表达载体pET-43.1a (+)购自Novagen公司;pGEM-T easy载体、T4 DNA ligase购自Promega公司。
1.3 推测的溶血素相关蛋白基因Riean_0415的克隆和鉴定 根据鸭疫里氏杆菌血清10型HXb2 Riean_0415基因的序列,用Primer Premier 5.0软件设计了一对引物。上游引物P1:5'-ATCTGCAGATGGATCCCGA CAGTATAGTCAAAAT-3';下游引物P2:5'-TACT CGAGTTAGTTAGCATTAGTACCTTCCCCCGA-3'。引物由英潍捷基(上海)贸易有限公司合成。
以提取的血清10型鸭疫里氏杆菌HXb2株基因组DNA为模板,用PCR扩增Riean_0415基因的ORF。PCR反应条件:94℃预变性5 min;94℃变性40 s,52℃退火40 s,72℃延伸2 min;30个循环;72℃延伸10 min。PCR产物连接pGEM-T easy载体后转化DH5α感受态细胞,筛选、鉴定得到阳性重组质粒命名为T-hrp。测序由上海华津生物技术有限公司完成,用DNAStar7.01软件进行序列分析。
1.4 假定溶血素相关基因Riean_0415重组表达质粒的构建 用Bam HΙ和XhoΙ双酶切T-hrp, 回收目的片段,与经同样酶切处理的pET-43.1a(+)原核表达载体连接,构建得到重组的表达质粒,命名为pET43.1a-hrp。
1.5 重组蛋白的诱导表达及纯化 将pET43.1a-hrp重组质粒转化至E.coli BL21(DE3)感受态细胞,筛选阳性重组菌,37℃、200 r/min培养3 h,至OD600值约为0.6时,以终浓度为1 mmol/L的IPTG于37℃、150 r/min诱导表达6 h,收集诱导后的菌体并超声破碎,离心后分别收集上清液和沉淀,通过SDS-PAGE分析表达的重组蛋白的可溶性。重组蛋白的纯化按照Novagen His-bind纯化试剂盒说明书进行。
1.6 重组蛋白HRP的溶血活性检测 先配制含终浓度为5%鸭血液的胰酶大豆琼脂固体培养基(TSA),用 PBS溶液将重组的HRP蛋白稀释至不同浓度(0.60、0.30、0.15 mg/mL)。用打孔器在培养基上打孔后,吸取10 μL蛋白溶液滴至孔内,放置到37℃、5% CO2培养24~36 h,观察是否出现溶血圈。
2 结果
2.1 溶血素基因的克隆与序列测定 用PCR方法从鸭疫里氏杆菌HXb2株中扩增到了大小约1.3 kb的片段(图1),克隆至T载体后测序。结果表明扩增片段大小为1353 bp,与我们已测定的HXb2株Riean_0415基因ORF序列一致,共编码451个氨基酸。BLAST分析表明其编码的蛋白含有TlyC (溶血素或相关蛋白,且含CBS结构域,COG1253)、DUF21(pfam01595)、CBS_pair_CorC_HlyC_ assoc(cd04590)、CorC_HlyC(pfam03471和smart01091)和PRK11573等结构域(图2),提示此蛋白可能与鸭疫里默氏杆菌的溶血及镁离子和钴离子的转运相关。

图1 鸭疫里默氏杆菌HXb2株Riean_0415基因的PCR 扩增Fig.1 Amplifi cation of Riean_0415 gene by PCR from R.anatipestifer strain HXb2
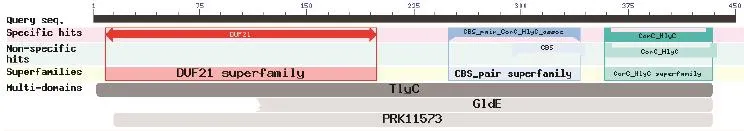
图2 鸭疫里默氏杆菌HRP蛋白的结构域分析Fig.2 The conserved domains on the hemolysin-related protein of R.anatipestifer
2.2 重组表达质粒鉴定 重组质粒pET43.1a-hrp经Bam HΙ和SphΙ双酶切,得到7200 bp左右的载体条带和1300 bp左右的目的条带(图3)。

图3 重组质粒pET43.1a-hrp的酶切鉴定Fig.3 Identifi cation of recombinant plasmid pET43.1a-hrp
2.3 Riean_0415基因的原核表达 收集重组大肠杆菌BL21(DE3)/pET43.1a-hrp诱导表达后进行SDSPAGE电泳,结果表明在 50 kDa左右有一条明显的表达带(图4A)。表达的蛋白rHRP主要存在于裂解细菌的上清液中,说明重组的rHRP在大肠杆菌中以可溶性表达为主。以His抗体为检测一抗进行Western blot,结果显示纯化得到是HRP-His融合蛋白,且大小与预期一致。
2.4 表达的重组蛋白溶血活性检测 由图5可见,在鸭血平板上,0.6 mg/mL的重组rHRP蛋白可引起明显的鸭红细胞裂解,0.3 mg/mL的重组rHRP蛋白也可引起鸭红细胞裂解,而0.15 mg/mL的重组rHRP蛋白未引起明显的鸭红细胞裂解。另一种重组蛋白Riean_0661、PBS和His对照孔周围未出现溶血圈。

图4 原核表达重组蛋白rHRP的SDS-PAGE (A) 和Western blot检测Fig.4 Detection of rHRP expression by SDS-PAGE(A) and Western blot(B)

图5 重组蛋白rHRP溶血活性检测Fig.5 Hemolytic activity assay of recombinant protein rHRP
3 讨论
溶血素在细菌中普遍存在,几乎所有大肠杆菌O157菌株中均存在溶血素[6],多数致病性葡萄球菌也能产生溶血素。对于很多病原细菌来说,溶血素是重要的毒力因子,是一种可以使靶细胞膜形成孔道的蛋白毒素。研究表明,金黄色葡萄球菌的Hla蛋白属于穿孔毒素家族,在细胞表面形成七聚体破坏细胞膜结构,能够快速裂解宿主红细胞[7]。金黄色葡萄球菌的α-溶血素、大肠杆菌溶血素和肺炎链球菌的溶血素突变株在动物实验中毒力明显降低[8],可能与其破坏宿主微生物入侵相关的成孔毒素相关[9]。Gaillard等[10]通过构建转座子突变株表明溶血素李斯特氏菌的一个重要毒力因子。
至今鸭疫里氏杆菌溶血素相关研究还未见报道。鸭疫里氏杆菌血清10型HXb2株是目前已知的对雏鸭致病性最强的鸭疫里默氏杆菌。本研究通过假定溶血素基因Riean_0415的原核表达和溶血活性分析后发现,重组rHRP蛋白具有裂解鸭红细胞的活性。但该蛋白与鸭疫里氏杆菌的致病性之间的关系还有待于进一步研究。由于铁离子是大多数细菌生长繁殖所必需的,参与到很多重要的生物学过程,而且红细胞中含有丰富的铁离子,因此我们推测,在宿主(如鸭)和鸭疫里默氏杆菌相互作用的过程中,鸭疫里默氏杆菌通过裂解宿主(鸭)的红细胞来释放铁。同时,鸭疫里默氏杆菌的获铁系统可通过多种途径来获得铁,以满足其在鸭体内迅速增殖所需要的铁离子。前期本实验室的研究也表明鸭疫里默氏杆菌的SIP(铁载体相关作用蛋白)、TonB依赖受体[11]等都与铁离子的转运相关,且为鸭疫里默氏杆菌的重要的毒力因子。另外,本研究中制备的重组rHRP蛋白具有溶血活性,这一方面提示rHRP蛋白为鸭疫里默氏杆菌的一种溶血素,另一方面也为进一步研究rHRP蛋白的功能和鸭疫里默氏杆菌的溶血机制等奠定了基础。
[1] 程安春, 汪铭书, 汪开毓, 等.现代禽病诊断和防治全书[M].成都: 四川大学出版社, 1997: 181-186.
[2] Hu Q, Han X, Zhou X, et al.OmpA is a virulence factor of Riemerella anatipestifer[J].Vet Microbiol, 2011, 150(3): 278-283.
[3] Lu F, Miao S, Tu J, et al.The role of TonB-dependent receptor TbdR1 in Riemerella anatipestifer in iron acquisition and virulence[J].Vet Microbiol, 2013, 167(3): 713-718.
[4] Tu J, Lu F, Miao S, et al.The siderophore-interacting protein is involved in iron acquisition and virulence of Riemerella anatipestifer strain CH3[J].Vet Microbiol, 2014, 168(2): 395-402.
[5] Braun V, Focareta T.Pore-forming bacterial protein hemolysins (cytolysins)[J].Crit Rev Microbiol, 1991, 18(2): 115-158.
[6] Schmidt H, Beutin L, Karch H.Molecular analysis of the plasmid-encoded hemolysin of Escherichia coli O157: H7 strain EDL 933[J].Infect Immun, 1995, 63(3): 1055-1061.
[7] 李迪, 高亚萍, 靳鹏, 等.金黄色葡萄球菌 α-溶血素的表达, 纯化及中和性抗体的制备[J].军事医学, 2014, 38(11): 871-874
[8] Kennedy A D, Bubeck Wardenburg J, Gardner D J, et al.Targeting of alpha-hemolysin by active or passive immunization decreases severity of USA300 skin infection in a mouse model[J].J Infect Dis, 2010, 202(7): 1050-1058.
[9] Bhakdi S, Bayley H, Valeva A, et al.Staphylococcal alpha-toxin, streptolysin-O, and Escherichia coli hemolysin: prototypes of pore-forming bacterial cytolysins[J].Arch Microbiol, 1996, 165(2): 73-79.
[10] Portnoy D A, Jacks P S, Hinrichs D J.Role of hemolysin for the intracellular growth of Listeria monocytogenes[J].J Exp Med, 1988, 167(4): 1459-1471.
[11] Hu Q, Ding C, Tu J, et al.Immunoproteomics analysis of whole cell bacterial proteins of Riemerella anatipestifer[J].Vet Microbiol, 2012,157 (3): 428-438.
PROKARYOTIC EXPRESSION AND DETECTION OF HEMOLYTIC ACTIVITYOF HYPOTHETICAL HEMOLYSIN-RELATED PROTEIN RIEAN_0415 GENE OF RIEMERELLA ANATIPESTIFER
JIANG Pan, SUN Bing-qing, CUI Jun-sheng, TAO Min-jie, DING Yun-zhu, XUE Ya-fei, LIU Guang-qing, HU Qing-hai
(Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China)
To investigate the biological function of hypothetical hemolysin-related protein (HRP) of Riemerella anatipestifer, the Riean_0415 gene was prokaryotically expressed and hemolytic activity of the recombinant protein was evaluated.The Riean_0415 gene was amplifi ed from serotype 10 strain HXb2 in PCR and cloned into Promega T easy vector.Then, DNA fragments were ligated to the prokaryotic expression vector pET-43.1a.The expression of recombinant protein HRP was induced with IPTG and purifi ed with affi nity chromatograph.In red cell lysis test, the recombinant protein HRP had the ability to lyse duck erythrocytes.The result of this study will benefi t to further study on biological functions of HRP protein and hemolysis mechanism of Riemerella anatipestifer.
Riemerella anatipestifer; hemolysin-related protein; prokaryotic expression; hemolytic activity assay
S852.612
A
1674-6422(2016)02-0031-04
2016-01-19
国家自然科学基金(31272590、31472224)
姜盼,男,硕士研究生,预防兽医学专业
胡青海,E-mail:huqinghai@caas.cn
