猪繁殖与呼吸综合征病毒JX14T2毒株的分离与鉴定
2016-12-01杨德强张文超姜一峰虞凌雪李丽薇黄勤峰童光志周艳君
王 鑫,杨德强,张文超,姜一峰,虞凌雪,杨 莘,高 飞,李丽薇,黄勤峰,童光志,周艳君
(中国农业科学院上海兽医研究所,上海200241)
猪繁殖与呼吸综合征病毒JX14T2毒株的分离与鉴定
王 鑫,杨德强,张文超,姜一峰,虞凌雪,杨 莘,高 飞,李丽薇,黄勤峰,童光志,周艳君
(中国农业科学院上海兽医研究所,上海200241)
江西省某猪场育肥猪群出现高热、呼吸困难和死亡等症状,为确定疫病病原,本实验室从发病猪场随机采取20份病死猪血样和组织,用RT-PCR的方法进行病原检测。结果显示,19份临床样品呈现猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)阳性。随后对病死猪肺组织进行病毒分离,结果显示分离的第1代病毒感染后48 h即可出现典型的致细胞病变效应(cytopathic effect,CPE),对传至第5代的病毒进行RT-PCR检测和间接免疫荧光鉴定,结果证实我们分离获得的病毒为PRRSV,命名为JX14T2。将JX14T2 P5代次的病毒与高致病性PRRSV强、弱毒代表株进行生长特性比较分析,结果显示,JX14T2在Marc-145细胞上形成的细胞病变、病毒噬斑形态以及病毒增殖动态均与HP-PRRSV毒株相似。对JX14T2进行全长基因测序和序列比较分析,结果表明JX14T2基因组全长14 960 bp,属于北美型毒株,其NSP2除存在的1+29个氨基酸的缺失而外,在598~717 aa还存在120个氨基酸的缺失,与HP-PRRSV亲缘关系较近。本研究结果为掌握PRRSV流行情况以及致病机制提供了科学依据。
猪繁殖与呼吸综合征病毒;JX14T2;分离;鉴定
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)引起妊娠母猪繁殖障碍和仔猪的呼吸系统疾病为特征的传染病[1]。1987年,PRRS首发于美国,随后遍布全球。PRRSV的基因型主要分为欧洲型和美洲型,在我国主要流行美洲型。PRRSV基因组长度为15 kb左右,具有5'和3'非编码区,有至少10个开放阅读框(open reading frame,ORF):ORF1a、ORF1b、ORF2~ORF7。ORF1a和ORF1b编码病毒复制酶,可分为1~12个非结构蛋白(non-structural protein,NSP),ORF2~ORF7编码病毒结构蛋白[2]。其中,NSP2为非结构蛋白中具有多功能的病毒RNA复制相关蛋白,也是各毒株之间变异较大基因编码区。2006年我国爆发高致病性PRRSV(HP-PRRSV),该毒株与经典的VR-2332株和CH-1a株相比,除了NSP2基因存在大量的核苷酸点突变而外,最具特征的是NSP2还存在1+29个氨基酸缺失[3,4]。尽管已有研究表明新出现的1+29个氨基酸缺失与HP-PRRSV的致病性增强无关[5],但是NSP2基因高频率变异的潜在意义仍然值得引人深思。目前针对PRRSV疫情的防控主要通过疫苗免疫。随着一系列HP-PRRSV传代致弱的弱毒苗的广泛使用,HP-PRRS的疫情已得到有效控制[6],但是PRRSV的地方性流行和散发所带来的危害仍不容忽视。近期江西省某猪场育肥猪群出现高热、呼吸困难和死亡等临床症状,本研究采集了病死猪的病料样本,对其进行病原检测和病毒分离,以确定此次疫情的病因,为该猪场有效控制疫情提供依据。
1 材料和方法
1.1 病毒、细胞和样品来源 PRRSV强毒HuN4株、传代致弱的HuN4-F112株和Marc-145细胞均由本研究室保存,病料样品采集自江西省某发病猪场。
1.2 主要试剂 RNA提取试剂盒为QIAGEN公司产品;cDNA合成试剂盒为Fermentas公司产品;pMD18-T 载体、LA Taq DNA 聚合酶购自TaKaRa公司;PRRSV 特异性N和M蛋白单抗由本实验室制备并保存[7,8];FITC标记的羊抗鼠二抗购自Inc公司。
1.3 样品核酸提取及RT-PCR检测 按照RNeasy Mini Kit说明书提取样品的总RNA,再根据cDNA合成试剂盒Revert Aid First Strand cDNA Synthesis Kit说明书进行反转录,用实验室已有的PRRSV、猪瘟病毒(Classical swine fever virus,CSFV)、日本脑炎病毒(Japanese encephalitis virus,JEV)、伪狂犬病毒(Pseudorabies virus,PRV)和猪细小病毒(Porcine parvovirus,PPV)特异性鉴定引物进行PCR鉴定[4]。
1.4 病毒的分离 取检测为阳性的肺脏组织研磨,10 800×g 离心5 min,样品经0.22 μm微孔滤膜过滤获取病毒感染液,吸取500 μL感染单层Marc-145细胞,37℃、5%的CO2细胞培养箱中孵育1 h,随后弃去感染液,加入含有2% FBS的DMEM培养液继续培养,观察细胞病变(cytopathic effect,CPE)。出现80%CPE时,收取病毒液,并传代至P5代,冻存于-80℃备用。
1.5 分离病毒的鉴定 提取分离病毒细胞上清RNA,方法同上。用鉴定检测引物对分离病毒进行扩增,将回收纯化的PCR产物克隆在pMD18-T 载体,测序。同时将分离PRRSV毒株感染Marc-145细胞,48 h后冰甲醇固定细胞,分别用针对PRRSV N蛋白和M蛋白的特异性单抗进行间接免疫荧光(indirect immunofluorescence assay,IFA)检测,荧光显微镜下观察结果。
1.6 分离毒株病变特性比较 将新分离的PRRSV JX14T2 P5代病毒与高致病性PRRSV强毒HuN4和弱毒HuN4-F112分别以0.01 MOI的剂量感染Marc-145细胞,分别在感染后36、60 h观察CPE。
1.7 病毒生长曲线的绘制 采用多步法将新分离的PRRSV JX14T2 P5代病毒与PRRSV强毒HuN4和弱毒HuN4-F112分别以0.01 MOI的剂量感染Marc-145细胞,分别于感染后12、24、36、48、72 h收取细胞上清液,测定TCID50,绘制其生长曲线。
1.8 病毒全长基因扩增及序列分析 提取JX14T2 P5代病毒的基因组,利用文献[4]报道的方法对其全长基因进行分段扩增,将回收纯化的PCR产物克隆在pMD18-T 载体后进行测序和拼接,对获得的JX14T2 P5全长基因利用软件Lasergene,MEGA 6 进行序列比较分析。
2 结果
2.1 样品的检测 对采集的20份临床样品用特异引物进行RT-PCR检测,结果显示其中19份呈现PRRSV阳性,扩增条带大小与HP-PRRSV HuN4阳性对照一致(图1),而样品中CSFV、JEV、PRV、PPV等检测均呈阴性(图略)。

图1 20份临床样品PRRSV RT-PCR检测结果Fig.1 Detection of PRRSV in 20 samples by RT-PCR
2.2 病毒的分离 将临床样品处理后,接种Marc-145单层细胞,结果显示接种后48 h后可观察到明显CPE,感染的细胞出现聚集成簇、隆起,随着感染时间的延长伴有少量细胞脱落(图略)。感染后72 h收获分离的病毒,并将其命名为JX14T2。
2.3 分离病毒的RT-PCR及IFA鉴定 将分离获得的JX14T2毒株在Marc-145细胞上连续传至 P5代,提取JX14T2 P5代病毒的RNA,进行PRRSV特异性RTPCR检测,结果显示其扩增条带大小与HP-PRRSV HuN4阳性对照相似(图略)。进一步利用抗PRRSV N蛋白和M蛋白特异性单抗对JX14T2感染后的Marc-145细胞进行IFA,荧光显微镜观察结果显示,JX14T2感染后的Marc-145细胞胞浆中均呈现特异性荧光,证实我们所分离得到的JX14T2毒株为PRRSV毒株(图2)。

图2 JX14T2株感染Marc-145细胞的IFA鉴定Fig.2 Detection of JX14T2 strain in Marc-145 cell by IFA
2.4 PRRSV JX14T2株生长特性比较 新分离获得的PRRSV JX14T2株感染Marc-145细胞所引起的CPE较为集中、聚集,同强毒HuN4株感染所引起的CPE相似,而弱毒HuN4-F112株形成的CPE较为弥散,呈网状(图3)。JX14T2感染Marc-145细胞所形成的噬斑形态也与HuN4株形成的病毒噬斑形态相近,而HuN-F112株形成的噬斑形态则较大而弥散(图4)。
2.5 JX14T2株在Marc-145细胞上的增殖动态比较 以相同剂量(0.01MOI)感染Marc-145细胞,比较JX14T2株与HuN4株和HuN4-F112株在Marc-145细胞上的增殖动态。结果显示,在感染48 h前3株病毒增殖幅度较大,其中HuN4-F112增殖滴度最高,HuN4增殖滴度最低,而JX14T2株增殖滴度居于二者之间,且与HuN4株在Marc-145细胞上的增殖动态趋势相近(图5)。
2.6 JX14T2株基因序列分析 对JX14T2株进行全长基因测序和拼接,结果显示,JX14T2株全基因长度为14 960 bp(不包含polyA),序列比较分析显示以HuN4株为代表的HP-PRRSV变异株全长基因为15 320 bp。JX14T2株在NSP2区域除了具有1+29个氨基酸的缺失外,相对于HuN4类毒株,其下游在598~717 aa的位置还存在120 aa的连续缺失(图6)。将JX14T2株与14株国内外PRRSV代表性毒株的全基因序列进行多序列比对进化树分析,结果显示,JX14T2株属于II型PRRSV株,且与HPPRRSV处于同一分支(图7),与原株型VR-2332的同源性为89.4%,与HuN4株的同源性为98.9%,与CH-1a的同源性为94.9%(图8)。

图3 PRRSV JX14T2与HuN4株、HuN4-F112株感染Marc-145细胞CPE比较Fig.3 Cytopathic effect of Marc-145 cell infected with PRRSV JX14T2, HuN4 and HuN4-F112 strains
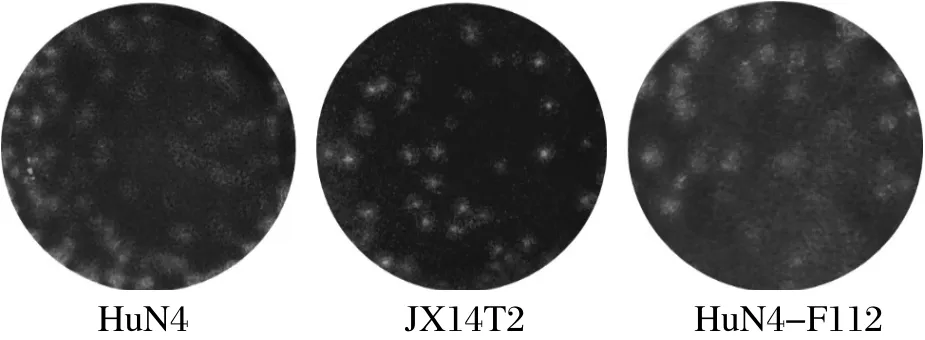
图4 PRRSV JX14T2与HuN4株、HuN4-F112株蚀斑形态比较Fig.4 The plaque morphology of different PRRSV strains
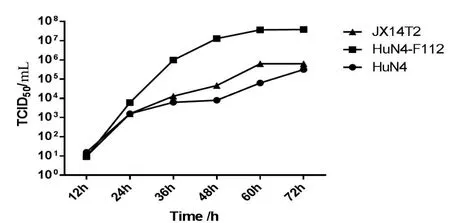
图5 PRRSV JX14T2与HuN4株、HuN4-F112株增殖动态比较Fig.5 Growth curve of different PRRSV strains in Mac-145 cell
3 讨论
我国目前流行PRRSV的主要为北美型PRRSV毒株[9,10],在临床上针对该病的预防手段主要是依赖于疫苗免疫,目前国内用于防控PRRS的疫苗除了商品化的灭活疫苗而外,还有由经典毒株和高致病性毒株弱化而来的两类商品化的活疫苗,每类活疫苗株又包含不同来源毒株。PRRS疫苗种类较多,对预防PRRS的发生发挥了重要作用,但是由于诸多疫苗的交叉和普遍使用,又增加了对PRRSV防控难度,如在疫苗免疫压力下易造成PRRSV毒株的变异[4,11],弱毒疫苗株可能会出现毒力返强,野毒株和疫苗株在猪群中共存,可能会出现新型重组的PRRSV等。目前国内外已有相关新的PRRSV毒株出现的研究报道,如2006年我国暴发的HP-PRRSV的NSP2基因存在1+29 aa的缺失[3,4]。2008年美国分离获得了1株新的HP-PRRSV命名为NADC30毒株,该毒株的特征是分别在NSP2蛋白的322~432 aa、483 aa 和504~522 aa区域存在111、1、19 aa缺失[12]。2013年在我国河南省某猪场,从疑似PRRSV症状的发病猪群病料中分离得到PRRSV毒株Henan-A10,该毒株在GP2蛋白的247~256 aa存在10 aa的缺失[13]。在对2013~2014年PRRSV毒株流行调查分析中发现,我国也存在NADC30样毒株,此前报道该毒株主要流行于美洲,我国并未发现该毒株的存在,并推测其是由CH-1a与NADC30 的NSP2基因发生重组的演化而来的毒株[14]。由此可见,在自然条件下PRRSV还在不断地进行变异,因此及时监测PRRSV在自然感染条件下的流行和进化趋势对于科学预防和控制该病是必要的。本研究采集的临床样品来自江西省某猪场中发生高热、呼吸困难和死亡等临床症状的育肥猪群,该猪场在发病之前一直使用经典PRRSV弱毒疫苗株进行免疫预防接种,未使用过HP-PRRSV弱毒疫苗。检测结果显示19份临床样品均呈现HPPRRSV阳性,从肺脏组织样品中分离得到的PRRSV毒株JX14T2,NSP2基因除了存在1+29 aa缺失以外,还存在120 aa的缺失,遗传演化分析证实该毒株与HP-PRRSV毒株亲缘关系较近。此外,对新分离的JX14T2毒株进行生物学特性分析的结果显示,该毒株在Marc-145细胞形成的CPE、噬斑形态及增殖动态均与HP-PRRSV强毒株HuN4相似,我们推测新分离的PRRSV JX14T2株属于自然感染的HP-PRRSV类毒株,但该毒株对动物的致病性如何尚不明确,还需要进一步开展研究。

图6 JX14T2毒株NSP2基因氨基酸缺失区域比较Fig.6 The amino sequence comparison of NSP2 coding region between JX14T2 strain and reference strains
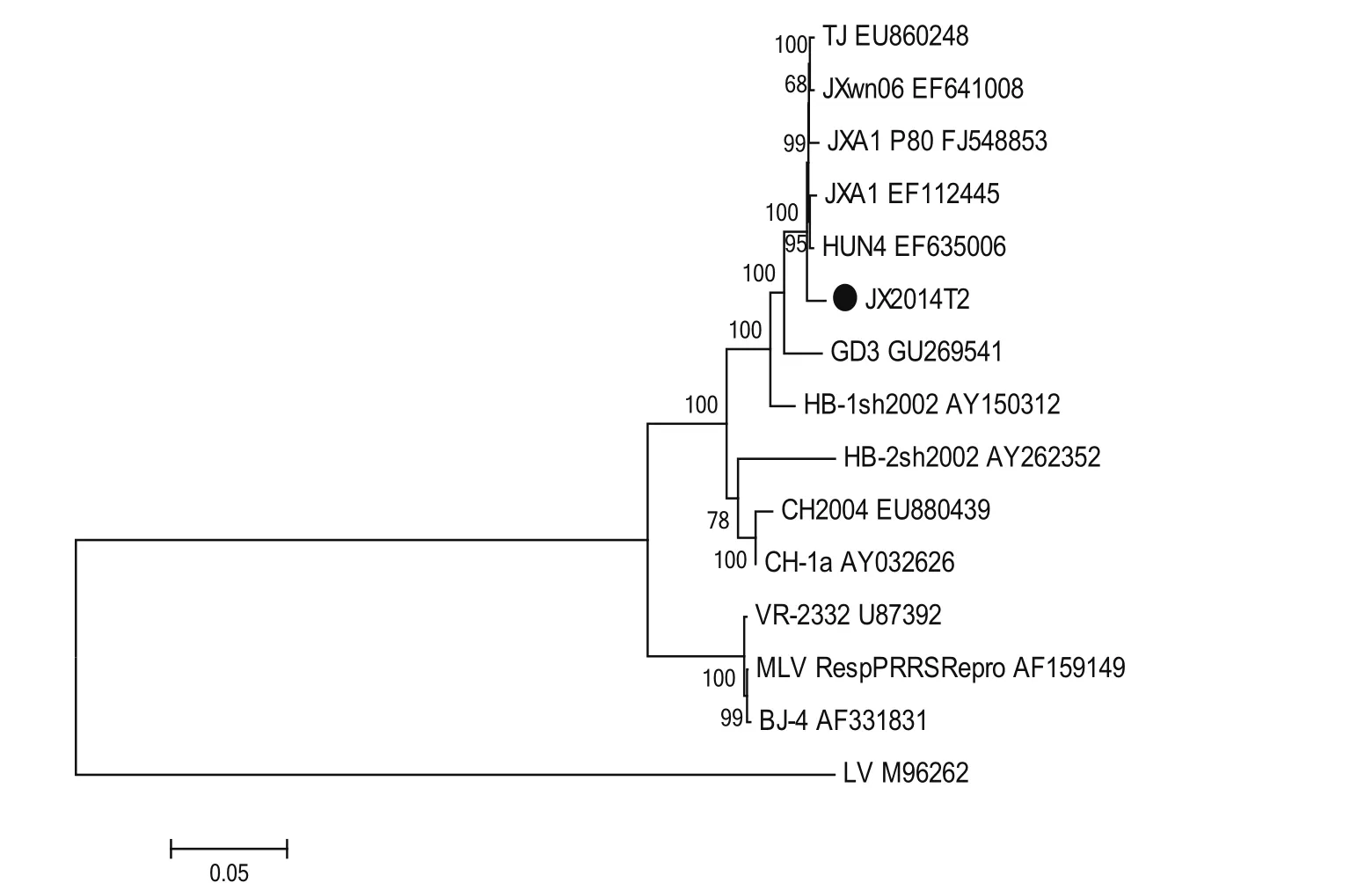
图7 PRRSV JX14T2株系统进化树分析Fig.7 Phylogenetic tree of JX14T2 strain
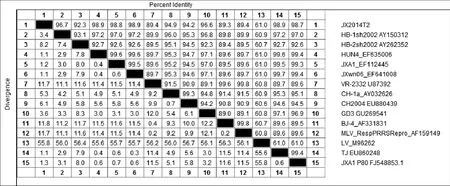
图8 PRRSV毒株间同源性分析Fig.8 Homology analysis between different PRRSV strains
[1] Dea S, Bilodeau R, Sauvageau R, et al.Outbreaks in Quebec pig farms of respiratory and reproductive problems associated with encephalomyocarditis virus[J].J Vet Diagn Invest, 1991, 3(4): 275-282.
[2] Dea S, Gagnon C A, Mardassi H, et al.Current knowledge on the structural proteins of porcine reproductive and respiratory syndrome (PRRS) virus: comparison of the North American and European isolates[J].Arch Virol, 145(4): 659-688.
[3] Tong G Z, Zhou Y J, Hao X F, et al.Highly pathogenic porcine reproductive and respiratory syndrome, China [J].Emerg Infect Dis, 2007, 13 (9): 1434-1436.
[4] Zhou Y J, Hao X F, Tian Z J, et al.Highly virulent porcine reproductive and respiratory syndrome virus emerged in China[J].Transbound Emerg Dis, 2008, 55(3-4): 152-164.
[5] Zhou L, Zhang J, Zeng J, et al.The 30-amino-acid deletion in the Nsp2 of highly pathogenic porcine reproductive and respiratory syndrome virus emerging in China is not related to its virulence[J].J Virol, 2009, 83: 5156-5167.
[6] Tian Z J, An T Q, Zhou Y J, et al.An attenuated live vaccine based on highly pathogenic porcine reproducti ve and respiratory syndrome virus (HP-PRRSV) protects piglets against HP-PRRS[J].Vet Microbiol, 2009, 138 (1-2): 34-40.
[7] Zhou Y J, An T Q, Liu J X, et al.Identification of a conserved epitope cluster in N protein of porcine reproductive and respiratory syndrome virus[J].Viral Immunol, 2006, 19(3): 383-390.
[8] 周艳君, 田志军, 刘金霞, 等.猪繁殖与呼吸综合征病毒M蛋白抗原表位的鉴定[J].中国预防兽医学报, 2009, 31(4): 251-255。
[9] Zhou Y J, Yu H, Tian Z J, et al.Genetic diversity of the ORF5 gene of porcine reproductive and respiratory syndrome virus isolates in China from 2006 to 2008[J].Virus Res, 2009, 144(1-2): 136-144.
[10] Zhou L, Yang H.Porcine reproductive and respiratory syndrome in China[J].Virus Res, 2010, 154(1-2): 31-37.
[11] Leng X1, Li Z, Xia M, et al.Mutations in the genome of the highly pathogenic porcine reproductive and respiratory syndrome virus potentially related to attenuation[J].Vet Microbiol, 2012, 157(1-2): 50-60.
[12] Brockmeier S L, Loving C L, Vorwald A C, et al.Genomic sequence and virulence comparison of four Type 2porcine reproductive and respiratory syndrome virus strains[J].Virus Res, 2012, 169(1): 212-221.
[13] Chen J Z, Peng J M, Bai Y, et al.Characterization of two novel porcine reproductive and respiratory syndrome virus isolates with deletions in the GP2 gene[J].Vet Microbiol, 2015, 176(3-4): 344-351.
[14] Zhao K, Ye C, Chang X B, et al.Importation and Recombination are responsible for the latest emergence of highly pathogenic porcine reproductive and respiratory syndrome virus in China[J].J Virol, 2015.89(20): 10712-10716.
CHARACTERIZATION OF A NEW HIGHLY PATHOGENIC JX14T2 STRAIN OF PORCINE REPRODUCTIVE AND RESPIRATORY SYNDROME VIRUS
WANG Xin, YAMG De-qiang, ZHANG Wen-chao, JIANG Yi-feng, YU Ling-xue,YANG Shen, GAO Fei, LI Li-wei, HUANG Qin-feng, TONG Guang-zhi, ZHOU Yan-jun
(Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China)
To investigate the etiological agent causing high fever, dyspnea and death of fattening pigs on a pig farm in Jiangxi province, a total of 20 blood and tissue samples were collected from dead pigs and examined in RT-PCR.As a result, 19 out of 20 samples were positive for Porcine reproductive and respiratory syndrome virus (PRRSV).Then, one lung sample that was positive in RT-PCR was inoculated to Marc-145.The typical PRRSV-induced cytopathic effect (CPE) developed after 48 hours of inoculation.The viruses at the fi fth passage were demonstrated to be PRRSV in RT-PCR and IFA.Therefore, the isolate was confi rmed to be PRRSV designate as strain JX14T2.In addition, the strain JX14T2 showed similar characters to the highly pathogenic strains in formation of CPE and plague and growth curve in Marc-145.The sequence analysis of the strain JX14T2 showed that its complete genome was 14 960 bp and belonged toNorth American genotype.A continuous deletion of 120 aa between residues 598-717 was identifi ed in NSP2 protein, in which the 1+29 aa deletion existed that was typically found in HP-PRRSV.The characterization of the strain JX14T2 added new information for further understanding of epidemiology of PRRSV.
Porcine reproductive and respiratory syndrome virus; JX14T2; isolation; identifi cation
S852.659.6
A
1674-6422(2016)02-0001-07
2016-02-02
973 计划(2014CB542702);国家科技支撑计划课题(2015BAD12B01-1);国家生猪现代产业技术体系项目(CARS-36);国家自然科学基金(31302098、31300140、31502072);上海市闵行区人才发展专项资金
王鑫,男,硕士研究生,预防兽医学专业
周艳君,E-mail:yjzhou@shvri.ac.cn
