4株鹅源鸭疫里默氏杆菌生物学特性分析
2020-10-17杨永胜薛亚飞徐欣欣杜晓莉MDNazrul宫艳杉胡青海
杨永胜,陈 研,薛亚飞,徐欣欣,王 西,杜晓莉, MD Nazrul,宫艳杉,胡青海
(中国农业科学院上海兽医研究所,上海 200241)
鸭疫里默氏杆菌感染(Riemerella anatipestifer infection,RA)是鸭、鹅以及火鸡等禽类的一种接触性传染病[1],其病死率可高达90%以上,病鸭消瘦、胴体品质下降、疾病治疗等给养鸭业造成巨大经济损失[2],是目前危害全世界养鸭业的一种主要的疾病。
自郭玉璞等[3]1982年首次报道北京鸭发生血清1型鸭疫里默氏杆菌感染、胡青海等[4]1997年首次在国内发病鸭群分离鉴定到非血清1型鸭疫里默氏杆菌(后来鉴定为2型)以来,目前国内鉴定的鸭疫里默氏杆菌血清型至少有13个[5],鹅感染鸭疫里默氏杆菌的病例也时有报道[6-10]。近几年来,随着鸭疫里默氏杆菌病油乳剂灭活疫苗在鸭群中的推广使用,鸭群因发生鸭疫里默氏杆菌引起大规模死亡的病例已很少见到,但目前相继在江苏、安徽和四川等地鹅群见到发生鸭疫里默氏杆菌病的病例,逐渐使鹅发生鸭疫里默氏杆菌感染的问题突显出来。早在1904年,Riemer[11]就报道了鹅发生的一种鹅渗出性败血症,这是最早报道的鸭疫里默氏杆菌感染鹅病例,所以鹅发生鸭疫里默氏杆菌感染并不奇怪,我们关注的是江苏、安徽和四川等地饲养鹅一直就比较多,为什么以前鹅发生本病的病例没有现在这样突出,是因为以前鸭群发生的病例较多,使人们更多地去关注鸭群发生本病,还是因为这些地区鸭和鹅饲养量都很大,使一些原先感染鸭的鸭疫里默氏杆菌适应鹅后,对鹅的致病性增强?或者鹅发生鸭疫里默氏杆菌病是否与菌株特性有关?这些鹅源鸭疫里默氏杆菌分离株对鸭的致病性怎样?等等。本研究将从菌株的溶血特性、生物被膜形成能力、对雏鸭的致病性及对一些药物的敏感性等对鹅源鸭疫里氏杆菌的生物学特性进行研究。
1 材料与方法
1.1 材料不同血清型兔抗鸭疫里默氏杆菌阳性血清由本实验室制备;药敏纸片购自杭州微生物试剂有限公司。
1.2 鹅源鸭疫里默氏杆菌的鉴定将从四川省不同发病鹅群分离到的4株疑似鸭疫里默氏杆菌克隆纯化后,用双重PCR对鸭疫里默氏杆菌16S rRNA和dnaB基因的进行鉴定[12],以鸭疫里默氏杆菌CH3株和大肠杆菌DH5α作为阳性和阴性对照。鉴定到的4株鹅源鸭疫里默氏杆菌分别命名为SC-11、SC-12、SC-13和SC-17。
1.3 血清型鉴定参照文献[13]方法,用玻片凝集法对4株鸭疫里默氏杆菌的血清型进行鉴定。以鸭源鸭疫里默氏杆菌CH3株作为阳性对照、以无菌PBS溶液作为空白对照。结果判定:菌液与血清混合后3 min内出现颗粒状凝集者判为阳性,不出现颗粒状凝集者判为阴性,只出现轻微凝集的判为可疑。
1.4 溶血实验分别取4株鹅源鸭疫里默氏杆菌在TSB中培养至对数期(D600=1.0左右)的菌液,离心后用PBS洗涤2次,再用同等体积PBS重悬。在含4%鸭血的血平板上打孔后,加入10 μL菌液,置于37℃、5%CO2培养箱内培养24 h。观察并记录溶血现象。
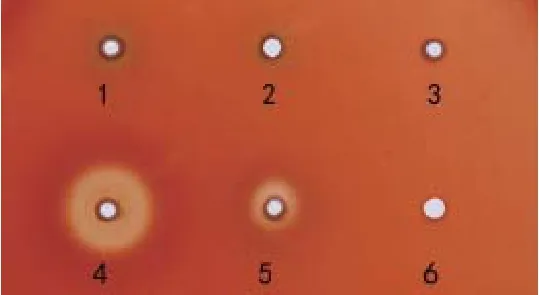
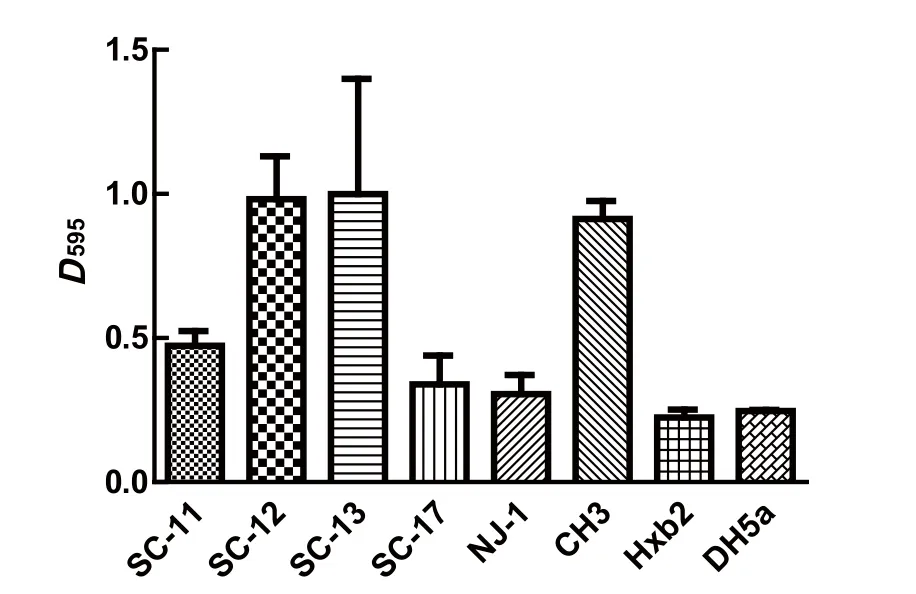
1.5 生物被膜形成的测定将4株鹅源鸭疫里默氏杆菌、已知的鸭疫里默氏杆菌强生物被膜形成菌株CH3株和不形成生物被膜菌株NJ-1和HXb2株[14],以及大肠杆菌DH5α的新鲜菌液(D600=1.0左右)用TSB作1∶200稀释后,加入U型底96孔板中,每孔200 μL,每株菌设立3个重复孔,置于37℃、5%CO2恒温培养箱中分别静置培养。在培养24 h时用结晶紫染色法[14]检测其生物被膜形成情况。最后每孔加入200 μL 75%乙醇充分溶解后,用BioTek酶标仪检测各孔D595值。生物被膜形成能力的判定标准[14]:D595≥1.00为强生物被膜形成菌株;0.31 1.6 药敏试验采用药敏纸片扩散法检测了20种抗菌药物的敏感性,包括青霉素类、头孢菌素类、氨基糖苷类、四环素类、大环内酯类、糖肽类、磺胺类、喹诺酮类、酰胺醇类以及其他类。取新鲜培养的菌液均匀涂布到TSA平板,药敏片贴到平板后置37℃、5% CO2培养箱培养20 h,观察并记录抑菌圈直径。 1.7 对雏鸭的致病性试验将新鲜培养的各株鹅源鸭疫里默氏杆菌菌液分别在TSA平板上划线,37℃、5% CO2培养箱内培养24 h后,用无菌PBS洗下并洗涤2次,最后用PBS重悬并调整菌数至6×109CFU/mL。每株细菌接种6日龄樱桃谷鸭12只,每只经腿部肌肉注射500 μL,观察并记录每株细菌接种后雏鸭的发病和死亡情况。 2.1 血清型鉴定玻片凝集实验的结果表明:SC-11、SC-12株和阳性对照CH3株均能与兔抗血清1型阳性血清发生片状凝集,与其他血清型的阳性血清不发生凝集,鉴定为血清型1型;SC-13和SC-17株与1、2、6、10、14、15型阳性血清均未出现凝集,未能确定血清型。阴性对照大肠杆菌DH5α不与以上任一血清型的阳性血清发生凝集。 2.2 4株鹅源RA的溶血实验血平板置37℃培养24 h后,再4℃过夜。溶血结果如图1所示,4株鹅源鸭疫里默氏杆菌在鸭血平板上均有溶血现象,其中SC-13和SC-17株在鸭血平板上出现明显的溶血圈,以SC-13株的溶血能力最强,SC-17的溶血能力次之;而SC-11和SC-12株的溶血能力较弱。阴性对照JY-1株(另文报道)和PBS加样孔周围均未出现溶血圈。 图1 溶血实验结果Fig. 1 Results of hemolytic activity of 4 RA strains 2.3 RA生物被膜形成实验采用结晶紫染色法测定这4株鹅源RA和3株鸭源RA(CH3、NJ-1以及Hxb2)菌株以及大肠杆菌DH5α静置培养24 h时的生物被膜形成能力,见图2。结果表明:鹅源RA分离株SC-12和SC-13株的生物被膜形成能力与已知的强生物被膜形成株CH3株相近;鹅源分离株SC-11、SC-17株和鸭源分离株NJ-1、HXb2株以及大肠杆菌DH5α的生物被膜形成能力较弱。 图2 不同鸭疫里默氏杆菌菌株生物被膜形成能力Fig.2 The capacity of different R.anatipestifer strains to form biofilms, examined 2.4 药物实验结果4株鹅源鸭疫里默氏杆菌的药物敏感性检测结果如表1。结果表明:4株鹅源RA均对头孢类抗生素敏感,对多粘菌素,诺氟沙星耐药,对另外14种抗生素表现不同程度的耐药性。SC-11和SC-12对红霉素、氧氟沙星、氨 西林敏感,而SC-13和 SC-17株对这三种抗生素完全耐受。值得注意的是,本实验室自1997年来分离到的鸭疫里默氏杆菌分离株均对卡那霉素完全耐受,但本研究中鹅源鸭疫里默氏杆菌分离株SC-11和SC-17株对卡那霉素敏感,且SC-17株对卡那霉素高度敏感。 2.5 对雏鸭的致病性实验记录攻毒后10 d内各组雏鸭的死亡情况。结果显示:SC-11、SC-13、SC-17株攻毒的雏鸭100%(12/12)死亡;SC-12株攻毒鸭死亡41.7%(5/12)。表明这4株鹅源鸭疫里默氏杆菌分离株中有3株对雏鸭有较强的致病性。 近几年来从各地鹅群发生鸭疫里默氏杆菌感染的病例有增多的现象,为了分析其原因,我们对4株鹅源四川分离株的血清型、溶血能力、生物被膜形成能力、对药物敏感性以及对雏鸭的致病性等生物学特性进行了研究,以期分析这几株鹅源鸭疫里默氏杆菌是否来自鸭源流行株。 表1 4株鹅源鸭疫里默氏杆菌药敏试验结果Table 1 Susceptibility of four isolates from goose to antibiotics 目前世界范围内已确认的鸭疫里默氏杆菌血清型至少有21个,我国鸭源鸭疫里默氏杆菌分离株鉴定的血清型有10多个,其中1、2、6、10为优势血清型。本研究4株鹅源分离株的血清型至少有2种,前期已报道的国内鹅源鸭疫里默氏杆菌分离株的血清型主要有血清1、2、11、15型等[6-10]。不同发病鹅群分离到的鸭疫里默氏杆菌血清型可能不同,与鸭源鸭疫里默氏杆菌分离株的血清型有着相似的复杂性,呈现区域性的特点。 细菌的溶血活性可能与其在感染宿主体内的获铁相关,一些细菌的溶血活性与其致病性相关。本研究中4株鹅源鸭疫里默氏杆菌在血平板上均具有溶血活性,但溶血性弱的SC-11和SC-12株对雏鸭的致病性也较强,提示其溶血能力强弱与致病性强弱无直接相关性。 生物被膜是细菌在水相环境中为了黏附于生物或非生物表面分泌出的多糖基质、纤维蛋白、脂质蛋白等,将自体包被于这种不均一的混合基质中而形成的大量细菌聚集膜样物[15-16],与细菌感染宿主的能力,以及致病性密切相关。本实验室前期的研究表明一些鸭疫里默氏杆菌能形成生物被膜,鸭疫里默氏杆菌在一些鸭场持续存在,可能与生物被膜中的鸭疫里默氏杆菌能在鸭场垫料等存活时间长有关[14]。本研究中4株鹅源鸭疫里默氏杆菌分离株都能形成生物被膜,且其中2株的生物被膜形成能力较强。鹅源鸭疫里默氏杆菌是否通过形成生物被膜而在养鹅场持续存在有待进一步验证。 随着抗生素在一些鸭场的广泛使用,鸭疫里默氏杆菌耐药性的问题越来越受到人们的重视。 程安春等[17]对1993-1996年在四川各地发病鸭分离鉴定的25株鸭疫里默氏杆菌进行了药敏试验测定,结果表明25个分离株对环丙沙星、氨 青霉素、羧 青霉素、先锋霉素、洁霉素、土霉素、四环素高度敏感;对庆大霉素、新霉素、链霉素、卡那霉素、红霉素耐药;胡青海等[4]测定了1995-1996年间在江苏省和安徽省等地发病鸭分离鉴定的10株鸭疫里默氏杆菌对药物的敏感性,结果表明这些菌株对羧 青霉素、氨 青霉素、氧呱嗪青霉素、头孢唑啉均高敏(10/10);对妥布霉素均耐药;9/10菌株对红霉素高敏;只有1株(1/10)对卡那霉素敏感。作者1998-2017年间分离的100余株鸭源鸭疫里默氏杆菌分离株均对卡那霉素耐受(未发表资料),由于最早分离的那株卡那霉素敏感菌株已丢失,无法进一步确认,有时我们甚至怀疑鸭疫里默氏杆菌对卡那霉素是不是天然耐受的,且鸭疫里默氏杆菌中的卡那霉素抗性基因也可能是某种持家基因。本研究鉴定到有2株鹅源鸭疫里默氏杆菌分离株对卡那霉素敏感,这是本实验室近20年来首次鉴定到对卡那霉素敏感(其中1株高敏)的鸭疫里默氏杆菌,这推翻我们之前的推测,也提示这2株鸭疫里默氏杆菌可能与我们前面分离的鸭源鸭疫里默氏杆菌不是同一来源,这2株对卡那霉素敏感的鹅源鸭疫里默氏杆菌是从哪里来的,尚需进一步跟踪分析。4株鹅源鸭疫里默氏杆菌对雏鸭的致病性实验结果提示,这些菌株对鹅和鸭都是致病性的,在理论上存在自然感染过程中鸭源鸭疫里默氏杆菌传播鹅、鹅源鸭疫里默氏杆菌传播鸭的可能,但也需要进一步跟踪分析。2 结果
3 讨论