欧洲禽源H1N1亚型猪流感病毒抗体间接ELISA检测方法的建立
2016-12-01阮宝阳宫晓倩刘晓敏李泽君童光志
阮宝阳,王 林,宫晓倩,刘晓敏,张 鹏,汪 琪,李泽君,童光志,于 海
(1.中国农业科学院上海兽医研究所,上海 200241;2.山东农业大学动物科技学院,泰安 271000)
·研究论文·
欧洲禽源H1N1亚型猪流感病毒抗体间接ELISA检测方法的建立
阮宝阳1,2,王 林2,宫晓倩1,刘晓敏1,张 鹏1,2,汪 琪1,李泽君1,童光志1,于 海1
(1.中国农业科学院上海兽医研究所,上海 200241;2.山东农业大学动物科技学院,泰安 271000)
本研究利用原核表达并纯化的重组蛋白pCold TF-HA1作为包被抗原,建立欧洲禽源H1N1亚型猪流感病毒抗体的间接ELISA检测方法。通过反应条件的优化,确定了间接ELISA最佳工作条件:抗原最佳包被浓度为800 ng/孔,血清稀释度为1:200,封闭时间为1 h,一抗血清最佳作用时间为2 h,酶标二抗最佳稀释度为1:40 000,二抗最佳作用时间为1 h,TMB显色时间为7 min。阴/阳性血清的判断结果分别为OD450≤0.255和OD450≥0.292,介于两者之间为可疑。符合性试验结果显示,建立的间接ELISA方法与血凝抑制(haemagglutination inhibition,HI)检测的阳性率分别为53.27%和49.53%,两者总复合率达96.27%。特异性试验结果显示,该方法与古典H1N1亚型和H3N2亚型猪流感阳性血清无交叉反应。通过重复性试验表明,同一批制备的重组蛋白包被96孔酶标板,检测OD450值的批内变异系数为1.97%~7.85%,批间变异系数为1.94%~6.93%。总之,本研究建立的禽源H1N1亚型猪流感病毒抗体间接ELISA方法,具有敏感性较高、特异性强、重复性好的特点,为猪流感抗体检测提供了一种准确、快捷、简便、有效的技术手段,可用于禽源H1N1亚型猪流感抗体检测和流行病学调查。
欧洲禽源H1N1猪流感病毒;重组蛋白;间接ELISA;特异性
猪流感病毒(Swine influenza virus,SIV)是一种高接触性、高传染性的病毒,可引起猪高热、咳嗽、呼吸困难,同时易继发其他病毒和细菌性疾病混合感染,如猪繁殖与呼吸综合征、传染性胸膜肺炎、猪链球菌等[1],对我国养猪业发展产生严重危害。研究表明,猪呼吸道上皮细胞中同时存在禽流感病毒受体和人流感病毒受体[2],因此存在人流感病毒和禽流感病毒感染猪的可能性。自1974年全球首次报道SIV感染人并造成伤亡以来,SIV感染人的事件在世界范围内均有报道[3-5],更为重要的是,1957年、1968年和2009年3次世界性流感大流行均与猪流感病毒有关[6-8]。
目前已发现和鉴定的SIV包括H1N1、H1N2、H1N7、H3N2、H3N6、H4N6、H5N1和H9N2等多种血清亚型,我国流行的主要是H1N1、H1N2和H3N2[9,10]。H1N1亚型SIV主要包括欧洲禽源H1N1亚型和北美古典H1N1亚型两种。在我国南方地区商品化成年猪群中,欧洲禽源H1N1亚型SIV近些年来出现明显增长趋势,已逐渐成为主要流行的H1亚型之一[10,11]。因此,对禽源H1N1亚型SIV抗体和抗病原的检测,可为监控SIV的流行提供有效的技术支持,在防控禽流感和人流感中提供积极的辅助作用。
1 材料与方法
1.1 主要毒株和试剂 欧洲禽源H1N1亚型猪流感A/ Swine/Shanghai/1/2014(H1N1)病毒;Anti-Pig IgG-Peroxidase antibody 购自Sigma公司;猪血清样品;碳酸盐包被液;5%的BSA;TMB显色液;2 mol/L硫酸等;BCA测蛋白浓度试剂盒购自碧云天公司;旋窝震荡器;96孔酶标板;酶标仪购自基因生物有限公司。
1.2 方法
1.2.1 抗原的制备与纯化 原核表达出欧洲禽源H1N1亚型猪流感病毒HA1可溶性重组蛋白(简称pCold TF-HA1),超声破碎菌液,将收集的上清液按照His-Tag融合蛋白纯化操作手册进行重组蛋白的纯化,对纯化后重组蛋白进行抗原性分析[12]。
1.2.2 间接ELISA反应程序 包将抗原通过碳酸盐缓冲液(pH=9.4)稀释,包被96孔酶标板,100 μL/孔,置湿盒,4℃过夜;弃去包被液,加入PBST缓冲液(pH=7.4)并放入水平摇床上室温洗涤3次,5 min/次;加入5%脱脂乳(BSA),100 μL/孔,置湿盒,37℃封闭1 h,甩干并同上洗涤;血清样品用5% BSA稀释加至酶标板,100 μL/孔,置湿盒,37℃孵育1 h,甩干,同上洗涤;用5% BSA稀释将HRP标记的兔抗猪二抗稀释至工作浓度,100 μL/孔,置湿盒,37℃孵育1 h,甩干,同上洗涤。每孔加入TMB显色液,50 μL/孔,避光显色;加入2 mol/L H2SO4,50 μL/孔,终止反应;用酶标仪测定各孔OD450值。
1.2.3 最佳抗原量与血清稀释度的确定 根据方阵测定法,将重组蛋白抗原每孔以100、200、400、800、1000 ng稀释包被酶标板,将阳性血清用5%BSA以50、100、200、400倍稀释酶标板,进行ELISA检测,酶标仪测定OD450值。取OD450值近似1.0,P/N值最大时抗原量和血清稀释度,即为最佳抗原包被浓度和最佳一抗猪血清稀释度。
1.2.4 封闭液最佳作用时间的确定 以最佳的抗原量包被酶标板,4℃过夜。弃去包被液PBST洗涤3次,5 min/次。以5%BSA作为封闭液在37℃孵育,作用时间分别为0.5、1、1.5 h。同上PBST洗涤,以最佳血清稀释度加入一抗37℃孵育2 h。同上PBST洗涤,用5%BSA以1:40 000倍稀释二抗,37℃孵育1 h。同上PBST洗涤,加入50 μL/孔TMB避光显色5 min,加入2 mmol/L H2SO4,50μL/孔,终止反应。每个反应做4个重复,取OD450值近似1.0,P/N值最大时封闭液作用时间,即为封闭最佳时间。
1.2.5 血清最佳反应时间的确定 以最佳抗原量包被酶标板,4℃过夜,PBST洗涤3次,5 min/次,以最佳反应时间37℃封闭。同上PBST洗涤,以最佳血清稀释度加入酶标板中,在37℃分别孵育0.5、1、1.5、2 h。同上PBST洗涤,加入二抗37℃作用1 h。同上PBST洗涤,加入50 μL/孔TMB避光显色5 min,加入2 mmol/L H2SO4,50 μL/孔,终止反应。每个反应做4个重复,取OD450值近似1.0,P/N值最大血清反应时间,即为血清最佳反应时间。
1.2.6 二抗最佳反应时间的确定 以最佳抗原量包被酶标板,4℃过夜,PBST洗涤3次,5 min/次,以最佳反应时间37℃封闭。同上PBST洗涤,以最佳血清稀释度加入酶标板中,在37℃以最佳反应时间孵育一抗血清。同上洗涤,40 000倍稀释二抗加入酶标板中,在37℃分别孵育0.5、1、1.5、2 h。同上PBST洗涤,加入50 μL/孔TMB避光显色5 min,加入2 mmol/L H2SO4,50 μL/孔,终止反应。每个反应做4个重复,取OD450值近似1.0,P/N值最大时二抗反应时间,即为最佳二抗反应时间。
1.2.7 TMB最佳显色时间的确定 以最佳抗原量包被酶标板,4℃过夜,PBST洗涤3次,5 min/次,以最佳反应时间37℃封闭。同上PBST洗涤,以最佳血清稀释度加入酶标板中,在37℃以最佳作用时间孵育。同上洗涤,40 000倍稀释二抗加入酶标板中,在37℃以最佳反应时间孵育二抗。同上洗涤,加入50 μL/孔TMB避光显色3、5、7min。2 mmol/ L H2SO4,50 μL/孔,终止反应。每个反应做4个重复,取OD450值近似1.0,P/N值最大时显色时间,即为TMB最佳显色时间。
1.2.8 阴/阳性标准对照的确定 选取21份SIV阴性的猪血清样品,通过已确立的最佳间接ELISA反应体系进行OD450值测定。
1.2.9 符合性试验 采用确立的间接ELISA检测最佳反应条件和血凝抑制(hemagglutination inhibition, HI)试验两种方法,检测107份在猪场采集并实验室保存的临床猪血清,比较两者阳性率和符合率。
1.2.10 特异性实验 按照上述已确立的最佳反应条件建立的间接ELISA检测方法,进行特异性检测。选取古典H1N1亚型猪流感病毒和H3N2亚型猪流感病毒的阳性血清作为比较,同时设立标准阳性和阴性猪血清对照,比较各组间特异性差异。
1.2.11 重复性实验
1.2.11.1 批内重复性试验 分别取SIV阳性血清和阴性血清在同一批制备的重组蛋白包被酶标板、同一批试验,同一条件,同一时间,按照上述确立的间接ELISA最佳反应体系进行OD450值的测定,每份血清重复4孔,最后用统计学方法统计试验数据,分析批内重复效果。
1.2.11.2 批间重复性试验 用同一批制备的重组蛋白包被酶标板,按照已确立的最佳ELISA反应体系,在4个不同时间进行OD450值测定,每份血清重复4孔,最后用统计学方法统计试验数据,分析批间重复效果。
2 结果
2.1 最佳抗原量与血清稀释度的确定 采用方阵滴定法确定血清最佳稀释度和抗原包被量,结果显示,血清用5%BSA以1:200倍稀释,抗原包被量800 ng/孔,4℃过夜,此时P/N值最大,且阳性血清OD450值接近1.0(表1)。
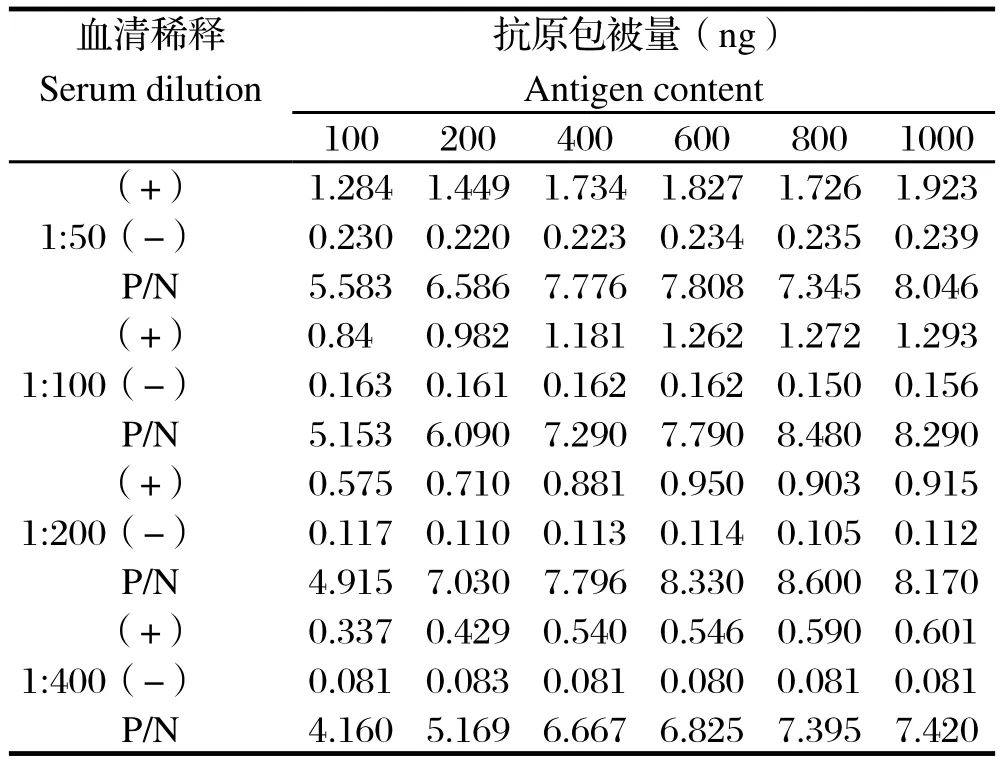
表1 血清最佳稀释度和抗原最佳包被量结果Table1 Determination of optimal serum dilution and antigen content
2.2 封闭液最佳作用时间的确定 以最佳抗原量800 ng/孔包被96孔酶标板,4℃过夜,血清1:200倍稀释,用5%BSA作为封闭液,37℃封闭,测得OD450值见表2。结果显示,封闭1 h时效果最佳,此时P/N值最大,且阳性血清OD450值接近1.0。
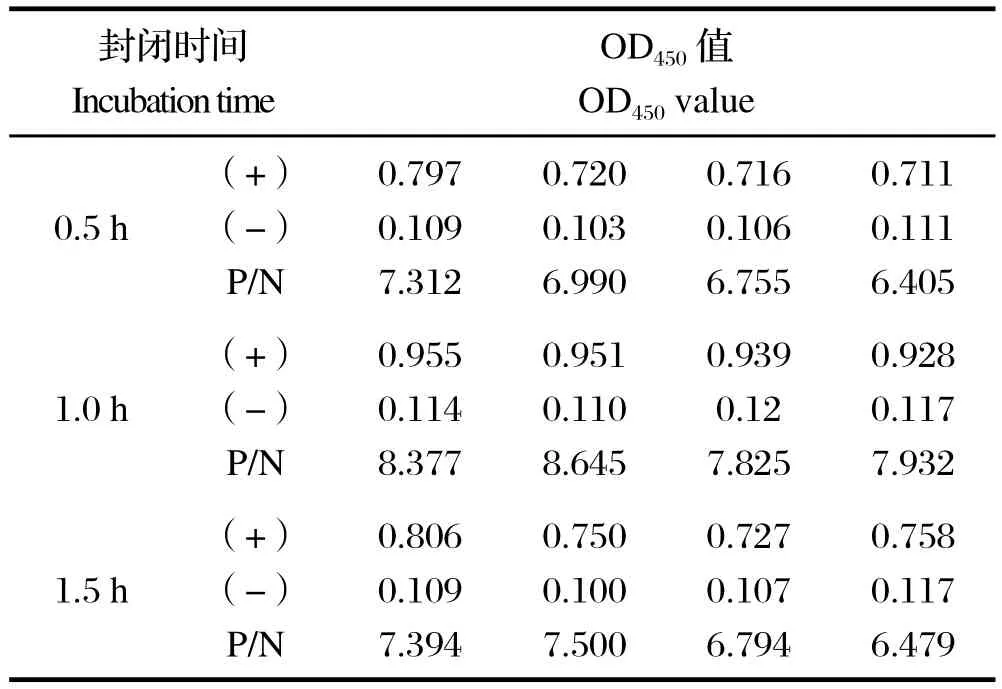
表2 最佳封闭时间的确定Table2 Determination of the optimal incubation time of blocking solution
2.3 血清最佳反应时间的确定 采用最佳抗原量800 ng/孔包被酶标板,血清200倍稀释,用5%BSA在37℃封闭 1 h,测得的OD450值见表3。结果分析得出,血清37℃孵育2 h时,阳性值接近1.0,且P/N值最大,因此血清37℃孵育2 h为最佳反应时间。

表3 血清最佳反应时间的选择Table3 Determination of optimal serum incubation time
2.4 二抗最佳反应时间的确定 以抗原量800 ng/孔包被酶标板,4℃过夜,血清200倍稀释,用5%BSA于37℃封闭1 h,血清37℃孵育2 h,测得的OD450值见表4。结果分析可知,酶标二抗37℃孵育1.0 h时,此时阳性值最接近1.0,且P/N值最大。
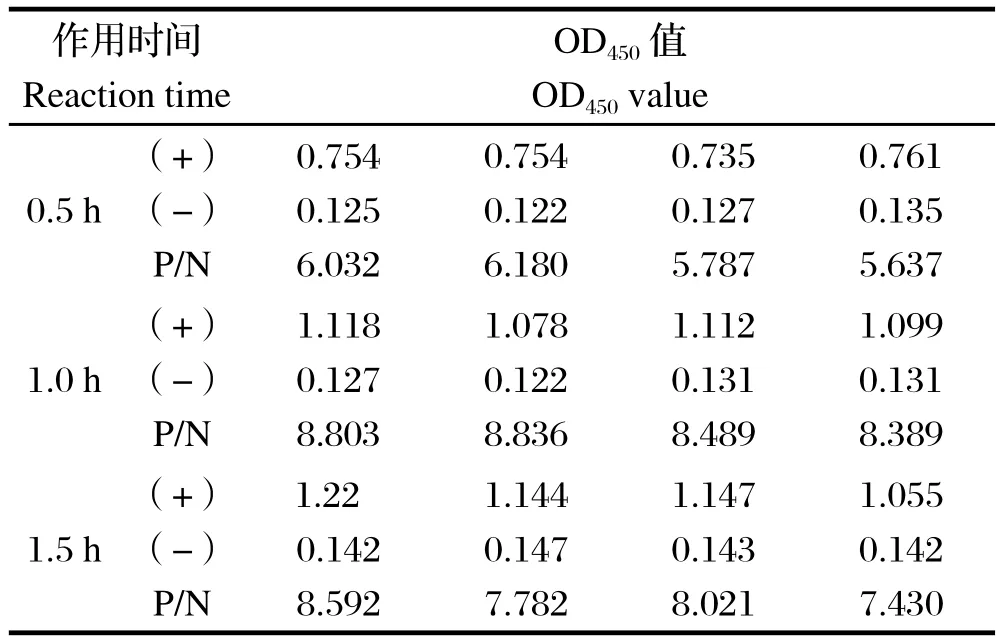
表4 二抗最佳反应时间的选择Table4 Determination of optimal incubation time of HRP-IgG
2.5 TMB最佳显色时间的确定 以抗原量800 ng/孔包被酶标板,4℃过夜,血清200倍稀释,5%BSA在37℃封闭1 h,血清37℃孵育2 h,测得的OD450值见表5。TMB室温显色时间7 min时,此时P/N值为最大,阳性值也较接近1.0。
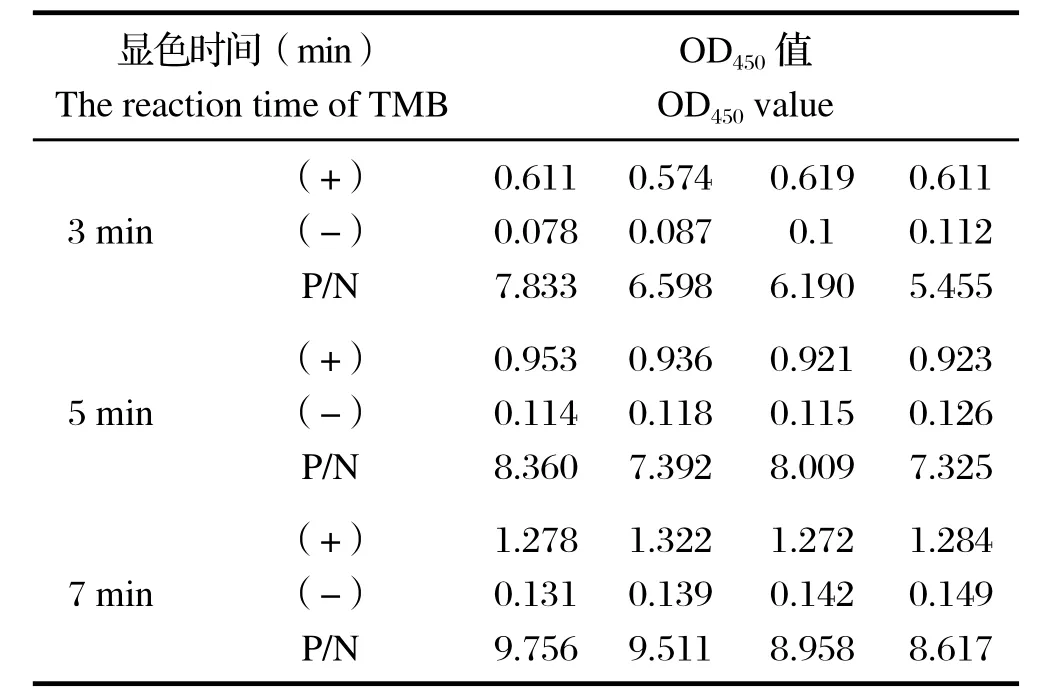
表5 TMB显色最佳时间的选择Table5 Determination of optimal reaction time of TMB
2.6 阴/阳性标准对照的确定 用已确立的间接ELISA反应体系对21份血清样品(HI检测为SIV阴性)进行检测,结果见表6。对上述数据进行统计学分析,运用Microsoft Excel 软件中AVERAGE(平均函数)和STDEVP(标准差函数)计算出平均值(x)及标准差(s)。得到平均值x=0.180571,s=0.037262,根据置信区间上限x+3s≈0.292,作为阳性血清判定下限;置信区间下限x+2s≈0.255,定位可疑界限。因此,间接ELISA的判定标准OD450≥0.292时判定为阳性,OD450≤0.255时判定为阴性,介于两者之间的样品判定为可疑。
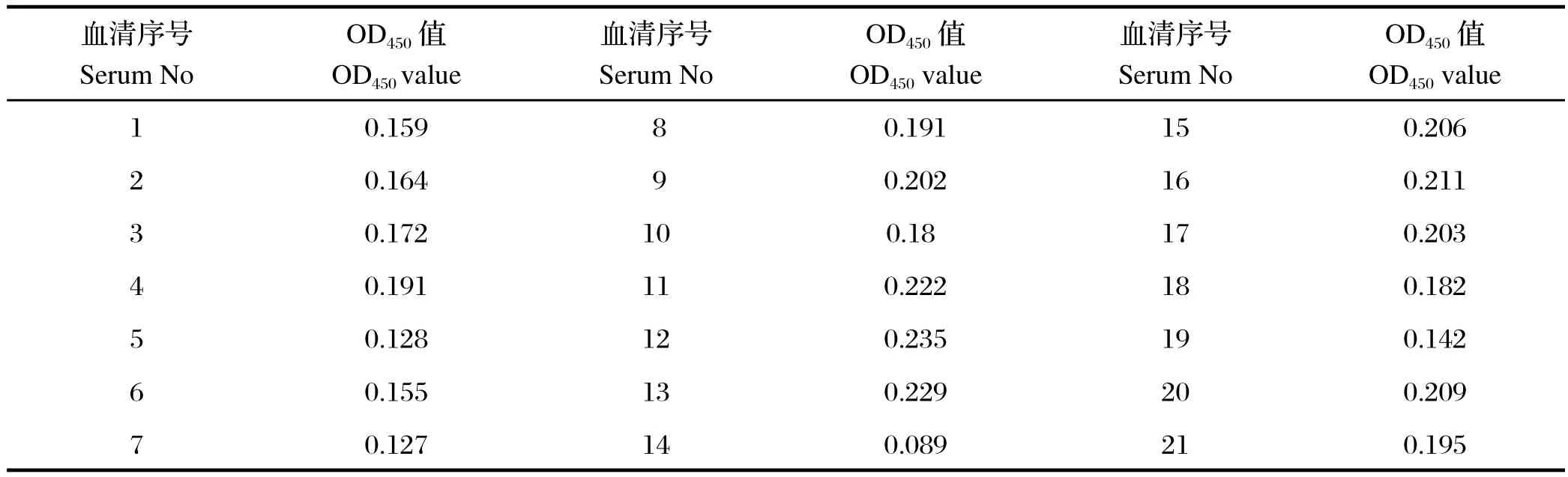
表6 阴/阳性标准对照的确定Table6 Determination of positive or negative of standard control
2.7 符合性试验 选取的107份临床样品,检测结果如表7所示,其中53/107×100%=49.53%为HI试验检测样品的阳性率,而57/107×100%=53.27%为间接ELISA的阳性率,以103/107×100%=96.27%作为HI 和ELISA检测方法的复合率。说明间接ELISA检测结果与HI试验结果有较高的复合率,同时间接ELISA检测的阳性率高于HI试验结果,说明其具有更高的灵敏性。

表7 符合性试验Table7 The result of conformance test
2.8 特异性试验 用确立的间接ELISA反应体系进行特异性试验,结果如表8所示。表明建立的间接ELISA检测方法与猪流感病毒其他亚型无交叉反应,具有较好的特异性。

表8 特异性试验结果Table8 Identifi cation of specifi city for indirect ELISA
2.9 重复性试验
2.9.1 批内重复性试验 用同一批制备的重组蛋白包被酶标板,同一条件,同一时间中,依照已建立的间接ELISA最佳反应体系检测OD450值,结果见表9所示。统计并分析上述表检测数据结果,可以看出变异系数均小于10%,为1.97%~7.85%,表明在同一批试验中同一样品变异程度较小,重复性较好。
2.9.2 批间重复性试验 用同一批制备的重组蛋白抗原包被酶标板,按照建立的间接ELISA最佳反应体系在4个不同时间点检测OD450值,结果见表10所示。结果显示在不同时间点进行间接ELISA检测,变异系数为1.94%~6.93%,小于10%,表明同一批试验中同一样品变异程度较小,重复性较好。
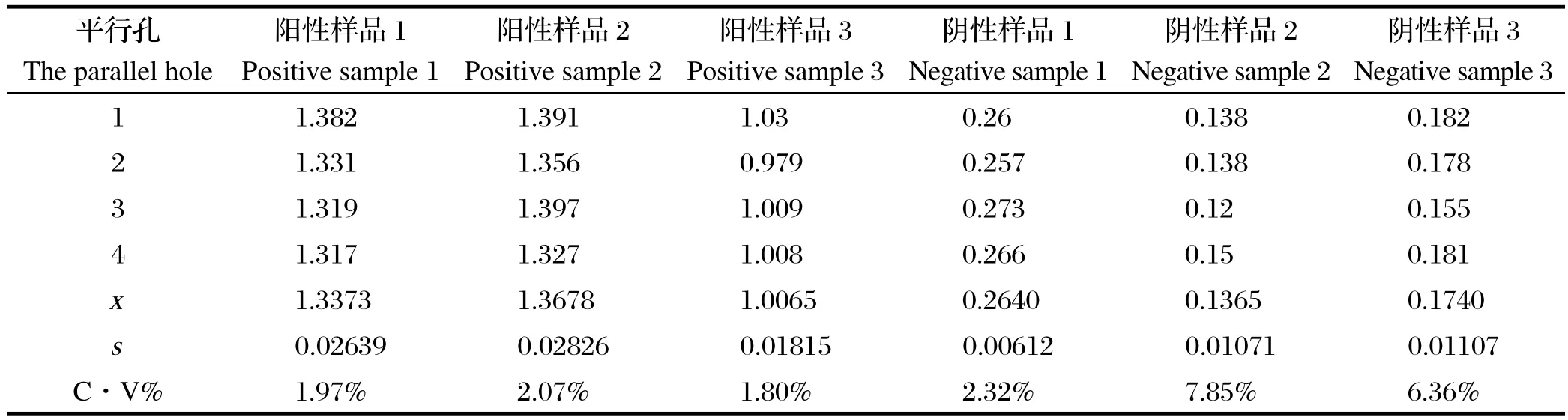
表9 批内重复性试验Table9 Repeatability test in bath
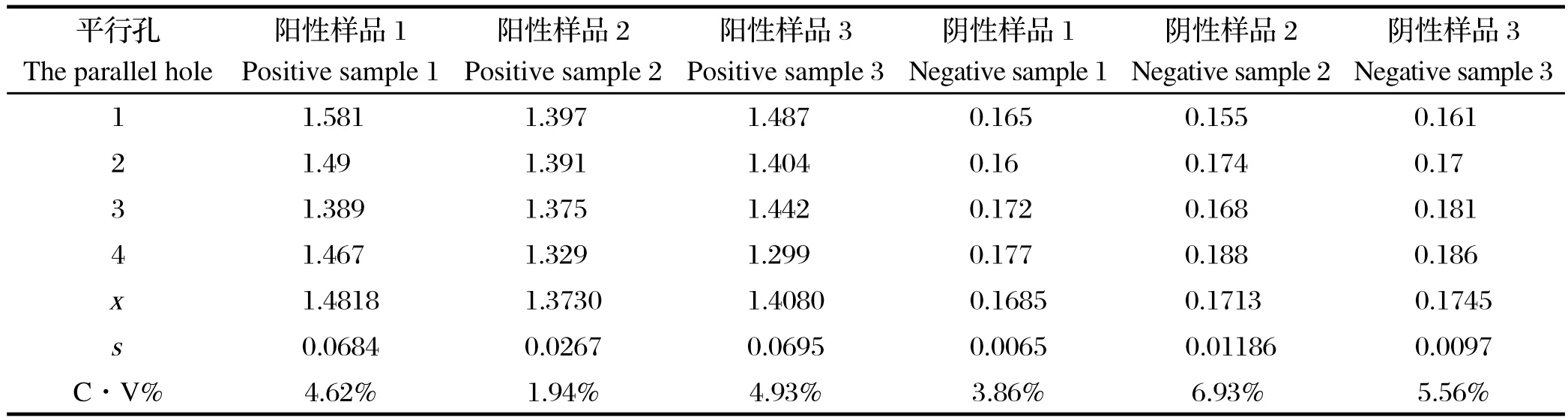
表10 批间重复性试验结果Table1 0 Repeatability test between bath
3 讨论
目前国内外用于诊断猪流感病毒抗体常用的是血清学方法,常见的有血凝抑制试验(HI)、中和试验(seraneutralization,SN)、补体结合试验和ELISA检测等。HI也是检测流感病毒感染最常见的血清学诊断方法,具有操作简单、耗时短、方便等优点,但是哺乳动物血清中存在非特异性血凝因子,容易出现假阳性结果,因此血清需要进行特别处理,且使用哺乳动物红细胞检测效果要比鸡红细胞更好,同时红细胞需要现配现用。SN具有很好的敏感性和特异性,但是由于其耗时且操作过程较复杂,同时其抗体与吸附的抗原需要高度匹配,这无疑给检测过程带来挑战,因此SN在临床疾病诊断中没有得到广泛的应用。补体结合试验具有敏感性高和适应性广的优点,但是操作过程较复杂且要求高,反应的各个因子量必须有恰当比例,否则会影响结果判定。ELISA具有较高的敏感性和特异性,可以检测特异性的抗原或者抗体,容易建立良好的检测系统,结果容易分析,因此适合于大规模样品的血清学调查[13]。
HA蛋白是介导病毒与细胞表面结合的主要成分,是流感最重要的保护性抗原,而HA1是重要的病毒受体结合位点和抗原决定簇区域。本研究利用HA1作为流感病毒最主要抗原蛋白这一特性[14],将欧洲禽源H1N1亚型SIV A/Swine/Shanghai/1/2014 (SH1)HA1基因克隆至原核表达载体pCold TF上,原核表达出重组可溶性蛋白[12],纯化并包被96孔酶标板中,通过确立最佳的ELISA反应体系最终建立间接ELISA检测方法。符合性试验结果表明,建立的间接ELISA检测方法与血凝抑制(HI)检测结果有较高的符合率。特异性检测结果显示,建立的间接ELISA方法检测结果与猪流感病毒其他亚型病毒无明显交叉反应,具有较好的特异性。从批间重复性试验和批内重复性试验检测结果可以看出,其批间和批内重复性的变异系数均小于10%,具有较好的重复性。因此,本研究基于HA1蛋白建立的间接ELISA方法,对于欧洲禽源H1N1亚型SIV抗体水平的检测和临床诊断具有重要的应用价值,利于猪群中H1N1亚型SIV的生物安全预警、有效防控和流行病学调查。
[1] Gutiérrez-Martín C B, Rodríguez-Delgado O, Alvare z-Nistal D, et al.Simultaneous serological evidence of Actinobacillus pleuropneumoniae,PRRS, Aujeszky's disease and influenza viruses in Spanish finishing pigs[J].Res Vet Sci, 2006, 68(1): 9-13.
[2] Castrucci M R, DonatelliΙ, Sidoli L, et al.Genetic reassortment between avian and human influenza A viruses in Italian pigs[J].Virology, 1993, 193(1): 503-506.
[3] Myers K P, Olsen C W, Gray G C.Cases of swine influenza in human: a review of the literature [J].Clin Infect Dis, 2007, 44(8): 1084-1088.
[4] Class E C, Kawaoka Y, Webster R G, et al.Infection of children with avian-human reassortant influenza virus from pigs in Europen[J].Virology, 1994, 204(1): 453-457.
[5] Case Count: Detected U.S.Human infection with H3N2v by State since August 2011[2012-10-12].http://www.cdc.gov/flu/swine flu/h3n2v-case-count.html.
[6] 杜宁, 杨霄星, 杨磊, 等.1957年亚洲流感(H2N2)病原学概述[J].病毒学报, 2009, 25(增刊): 12-16.
[7] 杜宁, 杨霄星, 蓝雨, 等.1968年香港流感(H3N2)病原学概述[J].病毒学报, 2009, 25(增刊): 17-20.
[8] 杜宁, 王大燕, 舒跃龙.2009新甲型H1N1流感病毒病毒学概述[J].病毒学报, 2009, 25(增刊): 479-484.
[9] 廖明, 叶贺佳, 张文炎.猪流感疫苗的研究进展和应用前景[J].猪业科学, 2007, (10): 30-31.
[10] Vijaykrishna D, Smith G J, Pybus O G, et al.Long-term evolution and transmission dynamics of swine influenza A virus[J].Nature, 2011, 473 (7348): 519-522.
[11] Yang H, Chen Y, Qiao C, et al.Prevalence, genetics, and transmissibility in ferrets of Eurasian avian-like H1N1 swine influenza viruses [J].Proc Natl Acad Sci U S A, 2016, 113(2): 392-397.
[12] 阮宝阳, 宫晓倩, 汪秀会, 等.禽源H1N1亚型猪流感病毒HA1基因原核表达及鉴定[J].中国动物传染病学报, 2015, 23(4): 14-18.
[13] 刘佳, 柳敏, 顾兵, 等.甲型H1N1流感病毒实验室检测方法研究进展[J].临床检验杂志, 2001, 29 (3): 214-215.
[14] 杨帅, 朱闻婓, 舒跃龙.猪流感病毒概述[J].病毒学报, 2013, (3): 330-335.
DEVELOPMENT OF AN INDIRECT ELISA FOR DETECTION OF ANTIBODIES TO EUROPEAN AVIAN-LIKE H1N1 SUBTYPE SWINE INFLUENZA VIRUS
RUAN Bao-yang1,2, WANG Lin2, GONG Xiao-qian1, LIU Xiao-min1, ZHANG Peng1,2, WANG Qi1, LI Ze-jun1, TONG Guang-zhi1, YU Hai1
(1.Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China; 2.College of Veterinary Medicine, Shandong Agricultural University, Taian 271000, China)
In the present study, an indirect ELISA method was developed to detect antibodies to European avian-like H1N1 subtype Swine infl uenza virus (SIV) using prokaryotic expressed and purifi ed recombinant protein pCold TF-HA1 as the coating antigen.The reaction conditions were optimized, e.g.coating antigen at 800 ng, serum dilution at 1:200, 5% skim milk as the blocking solution, 1.0 h for closed time, 2.0 h for serum reaction time, HRP antibody dilution at 1:40 000, 1.0 h for labeled antibody reaction time and 7 min for reaction time of TM.Criteria for determining the negative, positive and suspect results of serum samples were OD450nm≤ 0.255,OD450nm≥ 0.292 and 0.255-0.292, respectively.The conformance testing showed the high agreement (96.27%) between the indirect ELISA method and hemagglutination inhibition (HI) test as their individual positive rates were 53.27% and 49.53%.The specifi c test results demonstrated that the established ELISA method had no cross reaction with positive serum samples of H1N1 and H3N2 subtypes SIV.The coeffi cient of variation was 1.97%-7.85% between ELISA plates coated with the same batch of recombinant protein and 1.94%-6.93% between batches of recombinant proteins.In conclusion, the indirect ELISA method developed in the present study had high sensitivity, specifi city and repeatability and thus could be used as an accurate, fast, convenient and effective technique for detection of antibodies to H1N1 subtype SIV and epidemiological surveillance.
European avian-like H1N1 subtype; Swine infl uenza virus (SIV); recombinant protein; indirect ELISA
S852.659.5
A
1674-6422(2016)02-0013-07
2016-04-09
国家青年自然科学基金(31201916);上海市自然科学基金青年项目(12ZR1453500);中央级公益性科研院所基本科研业务费项目(2015JB07);中国农业科学院创新工程科研团队“动物流感病毒病原生态学”项目
阮宝阳,男,硕士研究生,临床兽医学专业
童光志,E-mail:gztong@shvri.ac.cn;于海,E-mail:haiyu@shvri.ac.cn
